Синтез, свойства и биологическая активность продуктов взаимодействия 1,2,4-триазолов с тииранами 14. 04. 02 фармацевтическая химия, фармакогнозия
| Вид материала | Автореферат |
- Синтез, свойства, биологическая активность n-гетериламидов α-оксокислот и продуктов, 367.21kb.
- Синтез, свойства и биологическая активность енаминоамидов ацилпировиноградных кислот, 439.81kb.
- Синтез, химические свойства и биологическая активность 1,4-дизамещенных 5-арил-3-гидрокси-3-пирролин-2-онов, 667.95kb.
- Синтез соединений на основе химических превращений производных α- оксокарбоновых кислот, 643.93kb.
- Синтез и биологическая активность карбо- и гетероциклов на основе тетрацианоэтилена, 673.64kb.
- Синтез и свойства новых производных 2 (1,2,4 триазолил 5 тио)уксусных кислот 15. 00., 240.9kb.
- Синтез, свойства и биологическая активность производных 2-хлорникотинонитрилов, 264.36kb.
- Примерная программа рекомендуется для направления подготовки (специальности) 111801, 717.4kb.
- Программа курса «Аналитическая химия» специальность «Фармация», 92.69kb.
- Тематический план лекций по дисциплине «Фармацевтическая химия», 32.57kb.
На правах рукописи
КЛЕН Елена Эдмундовна
СИНТЕЗ, СВОЙСТВА И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ ПРОДУКТОВ ВЗАИМОДЕЙСТВИЯ 1,2,4-ТРИАЗОЛОВ С ТИИРАНАМИ
14.04.02 – фармацевтическая химия, фармакогнозия
Автореферат
диссертации на соискание ученой степени
доктора фармацевтических наук
Москва – 2010
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Башкирский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
Научный консультант: доктор фармацевтических наук, профессор
Халиуллин Феркат Адельзянович.
Официальные оппоненты: доктор химических наук, чл.-корр. РАН
Дюмаев Кирилл Михайлович
доктор фармацевтических наук, профессор
Боковикова Татьяна Николаевна
доктор фармацевтических наук, профессор
Прокофьева Вера Ивановна
Ведущая организация: Государственное образовательное учреждение высшего профессионального образования «Пермская государственная фармацевтическая академия Федерального агентства по здравоохранению и социальному развитию»
Защита состоится «__» _________ 2010г. в 1400 часов на заседании диссертационного совета Д 006.070.01 при Всероссийском научно-исследовательском институте лекарственных и ароматических растений (ВИЛАР) РАСХН (117216, г. Москва, ул. Грина, 7) по адресу: 123056, г. Москва, ул. Красина, 2.
С диссертацией можно ознакомиться в библиотеке ВИЛАР по адресу 117216, г. Москва, ул. Грина, 7.
Автореферат разослан «___» __________ 2010г.
Ученый секретарь
д
 иссертационного совета
иссертационного совета Д 006. 070. 01,
доктор фармацевтических наук Алла Ивановна Громакова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Создание новых лекарственных средств является одной из приоритетных задач государственной политики РФ в области развития фармпромышленности, сформулированной в «Стратегии развития фармацевтической промышленности на период до 2020».
Анализ литературных данных за последние 15 лет показывает, что большие синтетические возможности в получении новых эффективных лекарственных средств представляют производные 1,2,4-триазола. Ряд производных 1,2,4-триазола используется в медицинской практике в качестве лекарственных препаратов для лечения грибковых инфекций (флуконазол, итраконазол, терконазол), вирусных инфекций (рибавирин, Maraviroc), психических расстройств (тразодон, нефазодон, альпразолам, триазолам, Brotizolam), рака груди (летрозол, анастрозол), заболеваний сердечно-сосудистой системы (тиотриазолин, кардиотрил, Trapidil). Известны производные 1,2,4-триазола, проявляющие антибактериальную, аналептическую, местноанестезирующую, анальгезирующую, противовоспалительную, жаропонижающую, антигипертензивную, гепатопротекторную, кардиопротекторную, антиоксидантную, антиагрегантную и другие виды активности.
Перспективным направлением поиска биологически активных 1,2,4-триазолов является исследование их реакций с новыми реагентами, приводящими к образованию неизвестных рядов соединений. Примером такого типа реагентов являются тиираны, химия которых отличается разнообразием протекающих процессов. При взаимодействии 1,2,4-триазолов с тииранами возможно образование продуктов раскрытия тииранового цикла, производных тиирана и тиетана, а также продуктов их дальнейших превращений. Из-за существования 1,2,4-триазолов в виде трех таутомерных форм исследование их реакций с тииранами представляет интерес, как с точки зрения органической химии, так и с точки зрения синтеза новых рядов биологически активных соединений.
Таким образом, систематическое исследование реакций 1,2,4-триазолов с тииранами, разработка на этой основе оригинальных методов синтеза новых классов потенциально биологически активных соединений, а также изучение их химических и биологических свойств является актуальной проблемой.
Диссертационная работа выполнена в соответствии с планом научно-исследовательских работ ГОУ ВПО «Башкирский государственный медицинский университет Росздрава» по проблеме «Изыскание и изучение новых лекарственных средств». Номер государственной регистрации 01200702369.
Цель и задачи исследования. Разработка путей синтеза новых классов биологически активных соединений на основе систематических исследований реакций 1,2,4-триазолов с тииранами, установление закономерностей «структура - активность» в ряду синтезированных соединений, а также создание на их основе высокоэффективных биологически активных веществ.
Для реализации поставленной цели решались следующие задачи:
- Исследование реакций производных 1,2,4-триазола с «модельным» тиираном. Определение направлений алкилирования триазольного цикла тииранами.
- Исследование реакций производных 1,2,4-триазола с монофункциональными тииранами. Разработка методов синтеза производных 5,6-дигидротиазоло[3,2-b]-1,2,4-триазола.
- Исследование реакций производных 1,2,4-триазола с 2-хлорметилтиираном. Определение направлений алкилирования триазольного цикла и условий протекания тииран-тиетановой перегруппировки.
- Разработка методов синтеза производных N-(тииран-2-ил)метил-, N-(тиетан-3-ил)-, N-(1-оксотиетан-3-ил)- и N-(1,1-диоксотиетан-3-ил)-1,2,4-триазолов и 5,6-дигидротиазоло[3,2-b]-1,2,4-триазола и исследование их химических свойств.
- Разработка методов диоксотиетанилирования гетероциклов и синтеза 3-замещенных тиетан-1,1-диоксидов.
- Установление строения, изучение физико-химических свойств и спектральных характеристик впервые синтезированных производных 1,2,4-триазола и тиетан-1,1-диоксида.
- Проведение фармакологического скрининга впервые синтезированных соединений и анализ зависимости «структура – активность».
- Синтез высокоэффективных биологически активных веществ, разработка технологического процесса их производства и соответствующей нормативной документации.
- Разработка органических реактивов для применения в синтезе новых биологически активных производных 1,2,4-триазола и тиетан-1,1-диоксида.
Научная новизна. Впервые проведены систематические исследования реакций 1,2,4-триазолов с тииранами. Установлены некоторые закономерности, определяющие направление реакций и структуру конечных продуктов. Реакции 1,2,4-триазолов с тииранами идут по положениям N1 и N2 триазольного цикла с образованием региоизомерных продуктов, соотношение которых зависит от характера заместителей в положениях С3 и С5 триазольного цикла. Для 3-алкокси- и 3-арилокси-5-бром-1,2,4-триазолов реакция преимущественно протекает по положению N2 триазольного цикла, а для 3-аминозамещенных 5-бром-1,2,4-триазолов - по положению N1 триазольного цикла.
Установлено, что при взаимодействии 3,5-дибром-1,2,4-триазола с монофункциональными тииранами образуются 5-замещенные 2-бром-5,6-дигидротиазоло[3,2-b]-1,2,4-триазолы.
Впервые исследованы реакции 3,5-дизамещенных 1,2,4-триазолов с 2-хлорметилтиираном. Определены закономерности реакций, структура полученных соединений. Реакции 1,2,4-триазолов с 2-хлорметилтиираном идут по положениям N1, N2 и N4 триазольного цикла с образованием региоизомерных продуктов, структура которых зависит от природы применяемого растворителя, соотношения реагентов и характера заместителей в положениях С3 и С5 триазольного цикла. В апротонном растворителе – ацетоне - образуются региоизомерные 3,5-дизамещенные 1-(тииран-2-илметил)-1,2,4-триазолы и 2,3/5/-тризамещенные 5-(1,2,4-триазол-1-илметил)-5,6-дигидротиазоло[3,2-b]-1,2,4-триазолы. В водной среде протекает тииран-тиетановая перегруппировка, в результате которой образуются региоизомерные N-(тиетан-3-ил)-1,2,4-триазолы. В случае 1,2,4-триазола, 3-арилокси- и 3-аминозамещенных 5-бром-1,2,4-триазолов алкилирование протекает по N1 и N2 положениям триазольного цикла, в случае 3,5-дибром-1,2,4-триазола и 3-алкокси-5-бром-1,2,4-триазолов - по N1, N2 и N4 положениям.
Показано, что в результате реакций 3,5-дибром-1-(тииран-2-илметил)-1,2,4-триазола с нуклеофильными реагентами образуются неизвестные ранее 5-замещенные 2-бром-5,6-дигидротиазоло[3,2-b]-1,2,4-триазолы. Предложен механизм взаимодействия тиирана на основе триазола с нуклеофилами, который включает первоначальное образование тиолят-анионов и последующую гетероциклизацию в дигидротиазолотриазолы.
Исследована реакционная способность 5-замещенных 3-бром-1-(тиетан-3-ил)-1,2,4-триазолов в реакциях окисления. Установлено, что в результате окисления 1-(тиетан-3-ил)-1,2,4-триазолов в среде ледяной уксусной кислоты пероксидом водорода в зависимости от избытка реагента и температуры проведения реакции образуются 1-(1-оксотиетан-3-ил)- или 1-(1,1-диоксотиетан-3-ил)-1,2,4-триазолы.
Установлено, что направление взаимодействия 5-замещенных 3-бром-1-(тиетан-3-ил)-, 3-бром-1-(1-оксотиетан-3-ил)- и 3-бром-1-(1,1-диоксотиетан-3-ил)-1,2,4-триазолов с нуклеофилами зависит от степени окисления атома серы тиетанового цикла и природы нуклеофила. Показано, что 3,5-дибром-1-(тиетан-3-ил)-1,2,4-триазол реагирует с алкоголятами, фенолятами, тиолятами щелочных металлов, аминами и гидразингидратом по атому брома в положении С5 триазольного цикла с образованием соответствующих производных. Взаимодействие 3,5-дибром-1-(1-оксотиетан-3-ил)-1,2,4-триазола с аминами, гидразингидратом и тиогликолевой кислотой также приводит к нуклеофильному замещению атома брома в положении С5 триазольного цикла.
Показано, что при взаимодействии 3,5-дибром-1-(1,1-диоксотиетан-3-ил)-1,2,4-триазола с алкоголятами, фенолятами, тиолятами щелочных металлов и натриевыми солями азолов протекает элиминирование тиетан-1,1-диоксидного цикла, и образуются 3-замещенные тиетан-1,1-диоксиды и 3,5-дибром-1,2,4-триазол. Предложен механизм данной реакции, включающий элиминирование тиет-1,1-диоксида и последующее присоединение нуклеофила. В случае взаимодействия с 2,4-дихлорфенолом, тиогликолевой кислотой, аминами и гидразингидратом протекает только нуклеофильное замещение атома брома по положению С5.
Показана возможность использования реакций 5-замещенных 3-бром-1-(1,1-диоксотиетан-3-ил)-1,2,4-триазолов с этилатом натрия для получения NH-незамещенных 5-бром-1,2,4-триазолов, содержащих в положении С3 различные заместители, а реакций 5-аминозамещенных 3-бром-(1,1-диоксотиетан-3-ил)-1,2,4-триазолов с трет-бутилатом натрия – для получения 3-аминозамещенных 5-бром-(1,1-диоксотиетан-3-ил)-1,2,4-триазолов.
Показана возможность использования метода ЯМР 1Н-спектроскопии для определения положения заместителей в триазольном цикле региоизомерных 3,5-дизамещенных N-(тиетан-3-ил)-1,2,4-триазолов, и установлена зависимость величины химического сдвига протонов от положения тиетанового цикла.
Выявлены некоторые закономерности взаимосвязи «структура – активность» в ряду синтезированных соединений. С помощью компьютерного анализа определен решающий набор признаков для антидепрессивной активности.
Новизна исследований подтверждена 2 патентами на изобретение № 2339632, № 2373929.
Практическая значимость. Разработаны методы синтеза новых рядов биологически активных производных 1,2,4-триазола и тиетан-1,1-диоксида: 3,5-дизамещенных 1-(тииран-2-илметил)-1,2,4-триазолов; 5-замещенных 2-бром-5,6-дигидротиазоло[3,2-b]-1,2,4-триазолов; 2,3/5/-тризамещенных 5-(1,2,4-триазол-1-илметил)-5,6-дигидротиазоло[3,2-b]-1,2,4-триазолов; 5-замещенных 3-бром-1-(тиетан-3-ил)-1,2,4-триазолов; 3-замещенных 5-бром-1-(тиетан-3-ил)-1,2,4-триазолов; 3-замещенных 5-бром-4-(тиетан-3-ил)-1,2,4-триазолов; 5-замещенных 3-бром-1-(1-оксотиетан-3-ил)-1,2,4-триазолов; 5-замещенных 3-бром-1-(1,1-диоксотиетан-3-ил)-1,2,4-триазолов; 3-замещенных 5-бром-1-(1,1-диоксотиетан-3-ил)-1,2,4-триазолов; 3-замещенных 5-бром-1,2,4-1Н-1,2,4-триазолов и 3-замещенных тиетан-1,1-диоксидов.
Предложен новый, оригинальный способ аннелирования дигидротиазольного цикла к триазолам, содержащим легко уходящие группы, основанный на взаимодействии последних с монофункциональными тииранами.
В качестве реагента для диоксотиетанилирования гетероциклов и синтеза 3-замещенных тиетан-1,1-диоксидов предложен 3,5-дибром-(1,1-диоксотиетан-3-ил)-1,2,4-триазол. Предложенный реагент апробирован на примере получения 1-(1,1-диоксотиетан-3-ил)-1,2,4-триазолов, 1-(1,1-диоксотиетан-3-ил)бензимидазолов, 1-(1,1-диоксотиетан-3-ил)имидазолов и 7-(1,1-диоксотиетан-3-ил)ксантинов и др.
Для NH-группы гетероциклов предложена новая защитная группа - тиетановый цикл, который легко вводится реакциями алкилирования гетероциклов 2-хлорметилтиираном. Удаление тиетановой защитной группы проводят после ее окисления пероксидом водорода в уксуснокислой среде до тиетан-1,1-диоксидной действием алкоголята натрия. Предложенный вариант защиты реализован на примере получения 3-замещенных 5-бром-1Н-1,2,4-триазолов.
Из 280 неописанных ранее в литературе соединений фармакологический скрининг прошли: 45 соединений на наличие МОС-модулирующей активности, 57 соединений - антидепрессивной активности, 31 - гемореологической активности, 28 - антиагрегационной активности, 88 - противомикробной активности, 18 - антиоксидантной активности. Среди них выявлены вещества, обладающие МОС-индуцирующей, антидепрессивной, гемореологической и антиагрегационной активностью, которая находится на уровне или превосходит действие препаратов, применяемых в медицинской практике.
3-Бром-5-(пиперазин-1-ил)-1,2,4-триазол рекомендован к углубленным испытаниям как индуктор микросомальных оксидаз печени. Выраженной гемореологической активностью обладают моноэтаноламмониевая и диэтаноламмониевая соли 2-[3-бром-1-(1,1-диоксотиетан-3-ил)-1,2,4-триазолил-5-сульфанил]уксусной кислоты, которые рекомендованы к углубленным фармакологическим испытаниям. Разработан лабораторный регламент на производство диэтаноламмониевой соли 2-[3-бром-1-(1,1-диоксотиетан-3-ил)-1,2,4-триазолил-5-сульфанил]уксусной кислоты и проект фармакопейной статьи. На калиевую соль 2-[3-бром-1-(тиетан-3-ил)-1,2,4-триазолил-5-сульфанил]уксусной кислоты, проявляющую антиагрегационную и антикоагуляционную активность, и проходящую углубленные фармакологические испытания, разработан лабораторный регламент на производство.
Производные тиетан-1,1-диоксида - 3-(2-изо-пропил-5-метилфенокси)тиетан-1,1-диоксид, 3-фенилсульфонилтиетан-1,1-диоксид и 3-метокситиетан-1,1-диоксид, проявляющие выраженную антидепрессивную активность, проходят углубленные фармакологические испытания. Разработан лабораторный регламент на производство 3-метокситиетан-1,1-диоксида.
Разработаны лабораторные регламенты на производство и технические условия на 2 новых реактива: 3,5-дибром-1-(тиетан-3-ил)-1,2,4-триазол (ЛР 01963597-59.03-10, ТУ-2631-001-01963597-2010), 3,5-дибром-1-(1,1-диоксотиетан-3-ил)-1,2,4-триазол (ЛР 01963597-59.04-10, ТУ-2631-002-01963597-2010).
Представленные в работе методы синтеза новых производных 1,2,4-триазола и тиетан-1,1-диоксида, результаты изучения их биологической активности используются при проведении научных исследований на кафедрах микробиологии, фармакологии №1 с курсом клинической фармакологии, биологической и биоорганической химии, фармацевтической химии с курсами аналитической и токсикологической химии Башкирского государственного медицинского университета, на кафедре фармакологии Волгоградского государственного медицинского университета, лаборатории физической химии ИОХ УНЦ РАН г. Уфа.
Положения, выносимые на защиту.
1. Основные закономерности взаимодействия 1,2,4-триазолов с монофункциональными тииранами и 2-хлорметилтиираном.
2. Новый способ аннелирования дигидротиазольного цикла к 1,2,4-триазолам, содержащим легко уходящие группы.
3. Новые методы синтеза производных 1-(тииран-2-илметил)-1,2,4-триазола и 5,6-дигидротиазоло[3,2-b]-1,2,4-триазола.
4. Новые методы синтеза производных 1-(тиетан-3-ил)-, 1-(1-оксотиетан-3-ил)-, 1-(1,1-диоксотиетан-3-ил)-1,2,4-триазолов, NH-незамещенных 1,2,4-триазолов и 3-замещенных тиетан-1,1-диоксидов.
5. Спектральные характеристики и строение региоизомерных 1,2,4-триазолов, а также производных тиетан-1,1-диоксида.
6. Результаты фармакологических испытаний, установленные закономерности взаимосвязи «структура - активность», а также выбор перспективных соединений для углубленных фармакологических испытаний.
7. Разработанные органические реактивы и их применение в синтезе биологически активных производных 1,2,4-триазола и тиетан-1,1-диоксида.
Апробация диссертации. Материалы диссертации обсуждены на Первой международной конференции «Химия и биологическая активность азотистых гетероциклов и алкалоидов» (Москва, 2001 г.), Третьем международном конгрессе молодых ученых и специалистов «Науки о человеке» (Томск, 2002 г.), XV, XVII Международных научно-технических конференциях «Реактив» (Уфа, 2002, 2004 гг.), XI Международной конференции и дискуссионном научном клубе IT + ME/ 2003 «Новые информационные технологии в медицине, биологии, фармакологии и экологии» (Ялта-Гурзуф, 2003 г.), IV, VI , VII, VIII Всероссийском научном семинаре с молодежной научной школой «Химия и медицина» (Уфа, 2003, 2007, 2009, 2010гг.), IV Межрегиональной научно-практической конференции «Фармация XXI века» (Новосибирск, 2004), региональных научных конференциях «Разработка, исследование и маркетинг новой фармацевтической продукции» (Пятигорск, 2004, 2005 гг.), на Международной научно-технической конференции «Актуальные проблемы технических, естественных и гуманитарных наук» (Уфа, 2005, 2006), на VI Всероссийской интерактивной конференции молодых ученых «Современные проблемы теоретической и экспериментальной химии» (Саратов, 2007), на Международной конференции по медицинской химии «Drug Discovery and Selection» (Lille, 2007), на XV Российском национальном конгрессе «Человек и лекарство» (Москва, 2008), V Международной конференции «Chemistry of nitrogen containing heterocycles» (Kharcov, 2009 г.), Научно-практической конференции «Biologically active substances: Fundamental and applied Problems» (Novy Svet, 2009 г.).
Публикации. Основное содержание диссертации изложено в 61 публикации, из них: 2 патента на изобретение, 17 статей в изданиях, рекомендуемых ВАК, 42 статьи и тезиса докладов в журналах, сборниках и материалах конференций различного уровня.
Объем и структура диссертации. Работа изложена на 425 страницах и состоит из введения, обзора литературы, 3 глав экспериментальных исследований, выводов, списка литературы, включающего 432 источника. Работа содержит 141 схему химических реакций, 74 таблицы, 35 рисунков, приложение.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
1. Синтез и биологическая активность N,C-замещенных 1,2,4-триазолов (обзор)
Систематизированы и обобщены литературные данные по методам получения N,C-замещенных 1,2,4-триазолов реакциями образования 1,2,4-триазольного цикла; введения заместителей по атомам азота или углерода 1,2,4-триазольного цикла; синтезом из других гетероциклов, а также биологической активности N,C-замещенных 1,2,4-триазолов за последние 15 лет. Отмечено отсутствие работ по исследованию взаимодействия 1,2,4-триазолов с тииранами и изучению их химических и биологических характеристик. Выявлена актуальность и перспективность поиска новых биологически активных соединений среди продуктов взаимодействия 1,2,4-триазолов с тииранами.
2. Реакции 1,2,4-триазолов с «модельным» тиираном
Реакции 1,2,4-триазолов с тииранами могут протекать по N1, N2 или N4 положениям триазольного кольца с образованием нескольких типов продуктов. Исследование реакций триазолов с тииранами затрудняет также процесс полимеризации, который сопровождает реакции тииранов с нуклеофильными реагентами.
Поэтому в качестве «модельного» тиирана для исследования взаимодействия 1,2,4-триазолов с тииранами нами использован 8-бром-1,3-диметил-7-(тииран-2-илметил)-3,7-дигидро-1Н-пурин-2,6-дион 2.23, при взаимодействии с нуклеофильными реагентами не образует полимерных продуктов, поскольку тиолят-анион эффективно стабилизируется внутримолекулярным замещением атома брома, что приводит к гетероциклизации в производные дигидротиазолопурина.
Установлено, что реакции «модельного» тиирана 2.23 с 1,2,4-триазолом, 3-моно- и 3,5-дизамещенными 1,2,4-триазолами в этаноле в присутствии калия гидроксида при нагревании 3-5 ч идут неизбирательно по положениям N1 и N2, за исключением 3-метилсульфонил-1Н-1,2,4-триазола 2.3, взаимодействующего региоспецифично по положению N1. В результате образуются смеси региоизомерных 1,3-диметил-7-(5-R-3-R/-1,2,4-триазол-1-илметил)- (2.24 – 2.27, 2.29, 2.31, 2.33, 2.35, 2.37, 2.39) и 1,3-диметил-7-(3-R-5-R/-1,2,4-триазол-1-илметил)-6,7-дигидро[1,3]тиазоло[2,3-f]пурин-2,4(1H,3H)-дионов (2.28, 2.30, 2.32, 2.36, 2.38), соотношение которых зависит от характера заместителей в положениях С3 и С5 триазольного цикла, с выходом 17 - 86% (схема 1).
При взаимодействии 3,5-дибром-1,2,4-триазола 2.5 с тиираном 2.23 тиолят-анион в промежуточном продукте замещает атом брома в положении С8 ксантина с образованием 7-[(3,5-дибром-1H-1,2,4-триазол-1-ил)метил]-1,3-диметил-6,7-дигидро[1,3]тиазоло[2,3-f]пурин-2,4(1H,3H)-диона (2.25) с выходом 77% (схема 1), а образования 8-бром-7-(2-бром-5,6-дигидротиазоло[3,2-b]-1,2,4-триазол-5-илметил)-1,3-диметил-3,7-дигидро-1Н-пурин-2,6-диона (А) не наблюдается, что подтверждается данными ЯМР 1Н и 13С спектроскопии и встречным синтезом соединения 2.25 из тиирана на основе триазола 2.58 и 8-бром-1,3-диметилксантина. Образцы соединения 2.25, полученные разными способами, не дают депрессии температуры плавления пробы смешения, а их ИК-спектры полностью совпадают.
Установлено, что в случае симметричных 1,2,4-триазола 2.4, 3,5-дибром-1H-1,2,4-триазола 2.5 и 4-амино-1,2,4-триазола образуется один продукт взаимодействия по положению N1(N2) триазольного цикла. Для 3-алкокси- и 3-арилокси-5-бром-1,2,4-триазолов реакция преимущественно протекает по положению N2 триазольного цикла с образованием 7-(5-алкил(арил)окси-3-бром-1,2,4-триазол-1-ил)метил-1,3-диметил-6,7-дигидро[1,3]тиазоло[2,3-f]пурин-2,4(1H,3H)-дионов, а для 3-аминозамещенных 5-бром-1,2,4-триазолов - по положению N1 триазольного цикла с образованием 7-(5-бром-3-амино-1,2,4-триазол-1-ил)метил-1,3-диметил-6,7-дигидро[1,3]тиазоло[2,3-f]пурин-2,4(1H,3H)-дионов. В случае 3-метилсульфанил-1,2,4-триазола реакция одинаково протекает по положениям N1 и N2 триазольного цикла. Продуктов взаимодействия по положению N4 не обнаружено. Строение синтезированных соединений подтверждено данными ЯМР–спектроскопии и встречного синтеза.
Схема 1
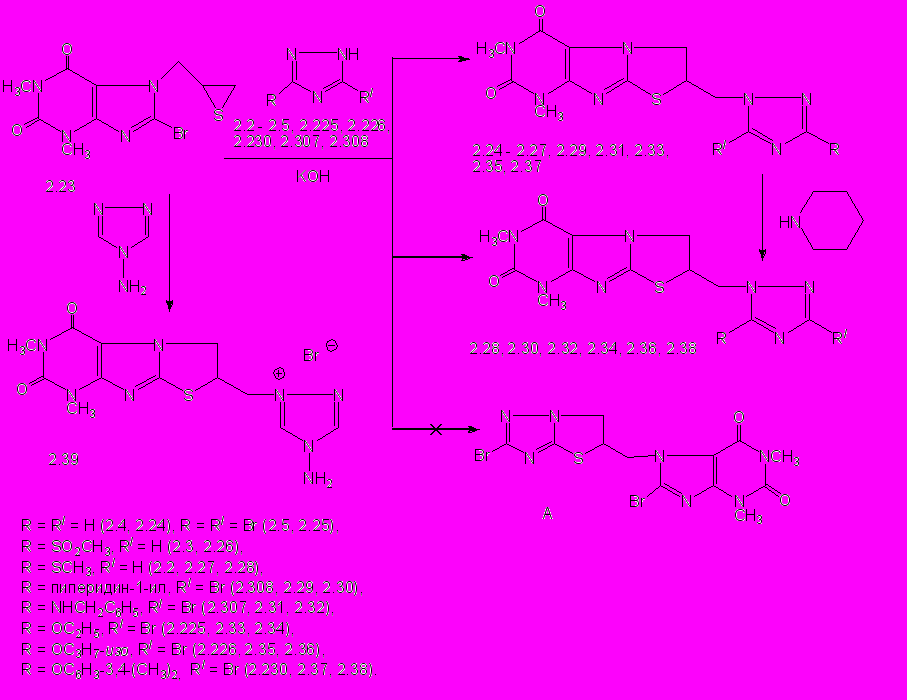 В спектрах ЯМР 1Н 7-(1,2,4-триазол-1-ил)метил-1,3-диметил-6,7-дигидро[1,3]тиазоло[2,3-f]пурин-2,4(1H,3H)-дионов (2.24 – 2.38) содержатся мультиплеты протонов дигидротиазольного цикла в интервалах 4,4-4,8 (NCH2) и 4,8 -5,3 м.д. (SCH) и взаимодействующих с ними 7-СН2 протонов. В спектрах содержатся также синглеты метильных групп и протонов, подтверждающие строение заместителя у 7-СН2-группы. Например, наличие в спектре соединения 2.24 двух синглетов при 8,02 и 8,58 м.д., принадлежащих протонам триазольного цикла, свидетельствует об их магнитной неэквивалентности и протекании реакции по положению N1(N2) триазольного цикла.
В спектрах ЯМР 1Н 7-(1,2,4-триазол-1-ил)метил-1,3-диметил-6,7-дигидро[1,3]тиазоло[2,3-f]пурин-2,4(1H,3H)-дионов (2.24 – 2.38) содержатся мультиплеты протонов дигидротиазольного цикла в интервалах 4,4-4,8 (NCH2) и 4,8 -5,3 м.д. (SCH) и взаимодействующих с ними 7-СН2 протонов. В спектрах содержатся также синглеты метильных групп и протонов, подтверждающие строение заместителя у 7-СН2-группы. Например, наличие в спектре соединения 2.24 двух синглетов при 8,02 и 8,58 м.д., принадлежащих протонам триазольного цикла, свидетельствует об их магнитной неэквивалентности и протекании реакции по положению N1(N2) триазольного цикла.В спектрах ЯМР 1Н соединений 2.27, 2.28 синглет протона =СН триазольного цикла 5-метилсульфанилизомера 2.28 регистрируется на 0,7 м.д. в более сильнопольной области, чем аналогичный сигнал 3-метилсульфанилизомера 2.27, что согласуется с литературными данными.
Спектры ЯМР 13С соединений 2.25, 2.28 также подтверждают образование системы дигидротиазолопурина.
Поскольку соединения 2.29, 2.30 не содержат протонов у триазольного цикла, то их отнесение к 3- и 5-пиперидинилизомерам затруднительно. Поэтому нами проведен встречный синтез 5-пиперидинилтриазола 2.30 реакцией триазола 2.25 с пиперидином при кипячении в бутаноле 5 ч (схема 1). Образцы соединения 2.30, синтезированные разными методами, не дают депрессии температуры плавления пробы смешения, а в их спектрах ЯМР 1Н наблюдается полное совпадение сигналов протонов.
На основании данных спектра ЯМР 1Н соединения 2.30 произведено отнесение синтезированных соединений к 3- и 5-аминоизомерам. Так, мультиплет протонов группы N(CH2)2 остатка пиперидина 3-пиперидинилизомера 2.29 регистрируется на 0,25 м.д. в более слабопольной области по сравнению с аналогичным сигналом 5-пиперидинилизомера 2.30.
При взаимодействии «модельного» тиирана 2.23 с 5-бром-3-алкокси-1,2,4-триазолами (2.225, 2.226) в реакционной смеси по данным ТСХ присутствуют два изомера, которые по данным ЯМР 1Н-спектроскопии отнесены к 3-алкокси- 2.33, 2.35 и 5-алкоксиизомерам 2.34, 2.36. Соотношение 3-алкокси – и 5-алкокси изомеров, вычисленное по интегральным интенсивностям, составляет 1:3 и 4:5 соответственно.
В случае 5-бром-3-(3,4-диметилфенокси)-1H-1,2,4-триазола (2.230) образуется смесь 3-(3,4-диметилфенокси)- (2.37) и 5-(3,4-диметилфенокси)изомеров (2.38) в соотношении 1:3, что подтверждается данными ЯМР 1Н спектроскопии смеси соединений, где наблюдается удвоение сигналов протонов дигидротиазолопурина и протонов метильных групп фрагмента диметилфенола и пурина.
