Синтез, свойства и биологическая активность продуктов взаимодействия 1,2,4-триазолов с тииранами 14. 04. 02 фармацевтическая химия, фармакогнозия
| Вид материала | Автореферат |
- Синтез, свойства, биологическая активность n-гетериламидов α-оксокислот и продуктов, 367.21kb.
- Синтез, свойства и биологическая активность енаминоамидов ацилпировиноградных кислот, 439.81kb.
- Синтез, химические свойства и биологическая активность 1,4-дизамещенных 5-арил-3-гидрокси-3-пирролин-2-онов, 667.95kb.
- Синтез соединений на основе химических превращений производных α- оксокарбоновых кислот, 643.93kb.
- Синтез и биологическая активность карбо- и гетероциклов на основе тетрацианоэтилена, 673.64kb.
- Синтез и свойства новых производных 2 (1,2,4 триазолил 5 тио)уксусных кислот 15. 00., 240.9kb.
- Синтез, свойства и биологическая активность производных 2-хлорникотинонитрилов, 264.36kb.
- Примерная программа рекомендуется для направления подготовки (специальности) 111801, 717.4kb.
- Программа курса «Аналитическая химия» специальность «Фармация», 92.69kb.
- Тематический план лекций по дисциплине «Фармацевтическая химия», 32.57kb.
3. Реакции 1,2,4-триазолов с монофункциональными тииранами.
Синтез 2-бром-5,6-дигидротиазоло[3,2-b]-1,2,4-триазолов
Реакции монофункциональных тииранов с триазолами представляют интерес для синтеза новых биологически активных соединений.
Взаимодействие 1,2,4-триазолов с монофункциональными тииранами может привести к смеси N1- и N2-(2-алкил-2-меркаптоэтил)замещенных 1,2,4-триазолов, 2,5-дизамещенных 5,6-дигидро[1,3]тиазоло[3,2-b]-1,2,4-триазолов и продуктов полимеризации. Для подавления процесса полимеризации использованы 1,2,4-триазолы, в структуре которых содержатся легко уходящие группы в С3 и/или С5 положениях: 3-метилсульфонил- 2.3, 3-бензиламино-5-бром- 2.307, 5-бром-3-(пиперидин-1-ил)- 2.308 и 3,5-дибром-1,2,4-триазолы 2.5.
В качестве монофункциональных тииранов, благодаря отсутствию в их структуре других алкилирующих групп, использованы: тииран, 2-метилтииран, алкоксиметилтиираны 2.16 – 2.18 и аминометилтиираны 2.19 - 2.21.
Реакции 1,2,4-триазолов с монофункциональными тииранами проводят при нагревании эквимольных количеств реагентов в присутствии калия гидроксида в среде ДМФА. Установлено, что реакции 3-метилсульфонил- 2.3, 3-бензиламино-5-бром- 2.307 и 5-бром-3-(пиперидин-1-ил)-1,2,4-триазолов 2.308 с тиираном или метоксиметилтиираном 2.16 приводят к неразделяемой смеси полимерных продуктов. По-видимому, как и в случае «модельного» тиирана, реакция идет по положениям N1 и N2 триазольного цикла.
Мономерные продукты удалось выделить при взаимодействии монофункциональных тииранов с 3,5-дибром-1,2,4-триазолом 2.5 в присутствии калия гидроксида. В случае низкокипящих тиирана и 2-метилтиирана реакции проводят при температуре 45-70оС. Производные 2-бром-5,6-дигидротиазоло[3,2-b]-1,2,4-триазола (2.40 - 2.47, схема 2) образуются с выходом 44 - 69%.
Схема 2
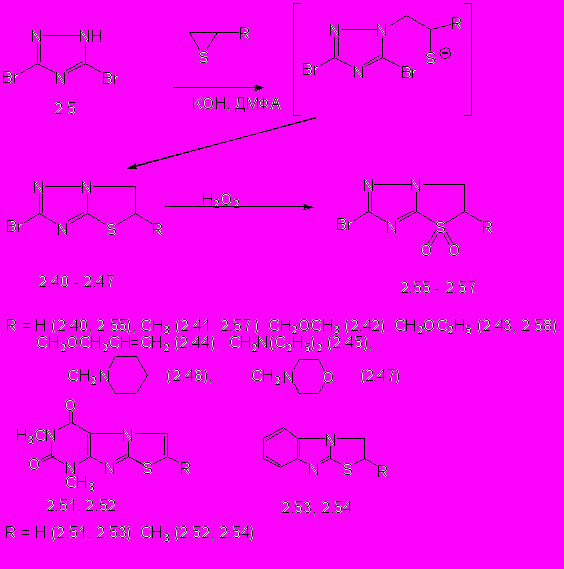
Алкилирование 3,5-дибром-1,2,4-триазола монофункциональными тииранами по положению N1(N2) триазольного кольца и образование 5-замещенных дигидротиазоло[3,2-b]-1,2,4-триазолов подтверждается встречным синтезом 5-аминометилзамещенных 2-бром-5,6-дигидротиазоло[3,2-b]-1,2,4-триазолов 2.45 - 2.47 (раздел 4). Образцы соединений 2.45 - 2.47, синтезированные разными способами, не дают депрессии температуры плавления пробы смешения, а их ИК–спектры полностью совпадают, что подтверждает раскрытие тииранового цикла согласно правилу Красуского. Образования продуктов алкилирования по положению N4триазольного кольца не обнаружено.
Сигналы протонов дигидротиазольного цикла в спектрах ЯМР 1Н синтезированных соединений, чаще всего, имеют вид АВК-части АВКХУ-системы. Спектр ЯМР 1Н дигидротиазолотриазола 2.40 содержит сигналы протонов дигидротиазольного цикла: мультиплеты протонов SCH2 и NCH2 групп регистрируются в интервалах 3,87-4,01 и 4,31-4,46 м.д. Смещение сигнала протона SCH группы в область слабых полей на 0,5 м.д. в спектре ЯМР 1Н соединения 2.41, подтверждает раскрытие тииранового цикла согласно правилу Красуского и образование 2-бром-5-метил-5,6-дигидротиазоло[3,2-b]-1,2,4-триазола 2.41.
В спектрах ЯМР 1Н 5-алкоксиметильных производных 2.42 - 2.44 мультиплеты протонов NCH2 групп имеют вид двух АВ-подспектров и регистрируются в интервале 4,2-4,4 м.д., а мультиплет протона SCH группы регистрируется в интервале 4,5-4,7 м.д.. Спектр ЯМР 1Н 5-пиперидинометилдигидротиазолотриазола 2.46 содержит сигналы протонов NCH2 группы в виде двух дублетов дублетов с центрами при 4,21 м.д. и 4,35 м.д. и геминальной константой 10,8 Гц. Протоны 5-СН2 группы соединений 2.42-2.44, 2.46 групп являются магнитно эквивалентными и регистрируются в виде дублета с интенсивностью в 2Н при 2,70 м.д. и 3,7 м.д. соответственно с вицинальной КССВ с SCH протоном 7,0 -7,7 Гц.
Сигналы углеродов дигидротиазольного цикла в спектрах ЯМР 13С также являются характерными. Сигнал углерода NCH2 группы соединений 2.40, 2.41 и 2.46 регистрируется в интервале 47,2-54,3 м.д. Сигнал углерода SCH группы зависит от заместителя в положении С5 и находится у соединения 2.40 при 33,21 м.д., у 5-метилдигидротиазолотриазола 2.41 сигнал смещен в область слабых полей на 13,5 м.д. и регистрируется при 46,76 м.д. Сигнал углерода SCH группы 5-пиперидинилметилпроизводного 4.46 регистрируется при 50,11 м.д., что подтверждается снятием спектров в режиме модуляции спин-спинового взаимодействия ядер углерода с протонами.
Для удобства проведения фармакологических испытаний синтезированы водорастворимые гидрохлориды 5-аминометильных производных 2.45 - 2.47 (2.48-2.50) с выходом 93-99%.
Окислением атома серы дигидротиазолотриазолов 2.40, 2.41 и 2.43 пероксидом водорода в среде ледяной уксусной кислоты получают ранее неизвестные 2-бром-5,6-дигидротиазоло[3,2-b]-1,2,4-триазол 4,4-диоксиды (2.55-2.57) с выходом 66-70% (схема 2), структура которых подтверждена данными ЯМР 1Н и ИК-спектроскопии.
Необходимо отметить, что реакции 2-хлорбензимидазола и 8-бром-1,3-диметилксантина с тиираном и 2-метилтиираном изучены недостаточно. Взаимодействие проводят при нагревании эквимольных количеств реагентов в присутствии калия гидроксида в среде ДМФА. 2,3-Дигидротиазоло[3,2-а]бензимидазолы (2.53, 2.54) и 1,3-диметил-6,7-дигидротиазоло[2,3-f]пурин-2,4(1Н,3Н)-дионы (2.51, 2.53) образуются с выходом 21-59% (схема 2).
Спектры ЯМР 1Н соединений 2.51 -2.54 также содержат характерные сигналы дигидротиазольного цикла. Характеристики соединений 2.51, 2.53 соответствуют литературным данным.
4. Реакции 1,2,4-триазолов с 2-хлорметилтиираном
2-Хлорметилтииран относится к реагентам, содержащим два реакционных электрофильных центра. Известно, что строение продуктов реакций 2-хлорметилтиирана, в первую очередь, определяется нуклеофильностью реагентов и природой применяемого растворителя. Например, ксантины и бензимидазолы реагируют с 2-хлорметилтиираном в полярном апротонном растворителе - ДМФА с образованием тииранов и продуктов их дальнейших превращений, а в протонном растворителе - воде - с образованием продуктов тииран-тиетановой перегруппировки.
С учетом вышеизложенного нами изучено взаимодействия 1,2,4-триазолов, содержащих легко уходящие группы, с 2-хлорметилтиираном в апротонных средах, не обладающих способностью к специфической сольватации анионов, при различных мольных соотношениях реагирующих веществ, использовании различных оснований. Установлено, что оптимальными условиями взаимодействия являются кипячение реагентов в среде ацетона в присутствии эквимольного количества калия карбоната в течение 3 ч (схема 3).
Схема 3
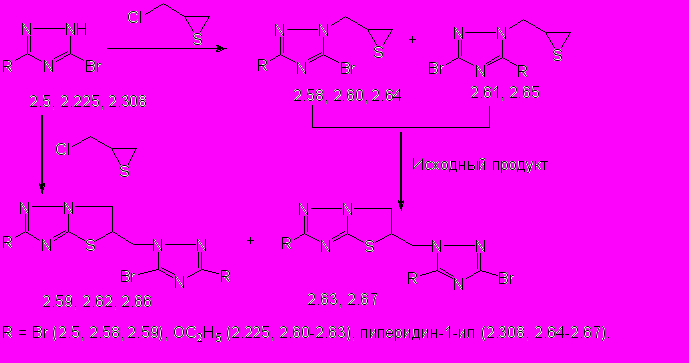
Взаимодействие 3,5-дибром-1,2,4-триазола 2.5 с эквимольным количеством тиирана 2.22 приводит к образованию 2-бром-5-[(3,5-дибром-1Н-1,2,4-триазол-1-ил)метил]-5,6-дигидротиазоло[3,2-b]-1,2,4-триазола (2.59) с выходом 71%. Увеличение избытка тиирана 2.22 до 5-кратного приводит к образованию смеси соединения 2.59 и промежуточного 3,5-дибром-1-(тииран-2-илметил)-1,2,4-триазола (2.58) с выходом 26 и 29% соответственно, которые выделяют колоночной хроматографией.
Спектр ЯМР 1Н тиирана 2.58 содержит мультиплеты тииранилметильного остатка, протоны которого можно охарактеризовать как ABKXY-систему. Протоны SСН2 группы тииранового цикла регистрируются в виде двух АВ-подспектров с геминальной константой 1,4 Гц. Химические сдвиги равны 2,20 и 2,31 м.д., вицинальные константы 5,1 и 6,1 Гц соответственно. Мультиплет SСН протона находится в интервале 2,93-3,03 м.д. Протоны NСН2 группы регистрируются в виде двух дублетов дублетов с геминальной КССВ 14,4 Гц. Химические сдвиги равны 3,76 и 4,23 м.д., вицинальные константы 7,5 и 5,0 Гц соответственно.
В спектре ЯМР 13С соединения 2.58 сигналы углеродов триазольного остатка регистрируются при 129,32 и 140,82 м.д., что свидетельствует об их магнитной неэквивалентности и образовании продукта алкилирования по положению N1(N2) триазольного цикла. Образования продуктов взаимодействия по положению N4 триазольного цикла не обнаружено.
Спектр ЯМР 1Н соединения 2.59 содержит мультиплеты протонов дигидротиазольного цикла и 5-СН2 группы. Наличие двух триазольных колец подтверждается четырьмя сигналами атомов углерода в слабопольной области: 130,81 м.д., 141,52 м.д., 143,40 м.д., 157,50 м.д. в спектре ЯМР 13С соединения 2.59, что свидетельствует об их магнитной неэквивалентности и образовании продукта алкилирования по положению N1(N2) триазольного цикла.
Реакции несимметричных 5-бром-3-R-1,2,4-триазолов 2.225, 2.308 с 1-, 3- и 5-кратным мольным избытком 2-хлорметилтиирана 2.22 приводят к образованию 5(3)-бром-1-(тииран-2-илметил)-3(5)-R-1,2,4-триазолов (2.60, 2.61, 2.64, 2.65) и 5-[(5(3)-бром-3(5)-R-1Н-1,2,4-триазол-1-ил)метил]-2-R-5,6-дигидротиазоло[3,2-b]-1,2,4-триазолов (2.62, 2.63, 2.66, 2.67), которые выделяют колоночной хроматографией с выходом 9 - 62% (схема 3).
Используя данные ЯМР 1Н-спектроскопии, установлено, что взаимодействие 5-бром-3-этокси-1,2,4-триазола 2.225 с 5-кратным мольным избытком тиирана 2.22 приводит к образованию смеси 5-бром-3-этокси- 2.60 и 3-бром-5-этокси-1-(тииран-2-илметил)-1,2,4-триазолов 2.61 в соотношении 2:3 с суммарным выходом 62%, а также 5-[(3-бром-5-этокси-1Н-1,2,4-триазол-1-ил)метил]-2-этокси-5,6-дигидротиазоло[3,2-b]-1,2,4-триазола 2.63 с выходом 16%. Использование эквимольного количества тиирана 2.22 приводит к образованию смеси тииранов 2.60, 2.61 и дигидротиазолотриазолов 2.62 и 2.63 (по данным ЯМР 1Н спектра).
Реакция 5-бром-3-(пиперидин-1-ил)-1,2,4-триазола 2.308 с 3-кратным мольным избытком тиирана 2.22 также приводит к образованию смеси соединений: 3-(пиперидин-1-ил)- (2.64) и 3-бром-5-(пиперидин-1-ил)-1-(тииран-2-илметил)-1,2,4-триазолов (2.65) в соотношении 4:5 (по данным ЯМР1Н спектра) с суммарным выходом 31%, а также 5-[(5-бром-3-(пиперидин-1-ил)-1Н-1,2,4-триазол-1-ил)метил]- (2.66) и 5-[(3-бром-5-(пиперидин-1-ил)-1Н-1,2,4-триазол-1-ил)метил]-2-(пиперидин-1-ил)-5,6-дигидротиазоло[3,2-b]-1,2,4-триазолов (2.67) в соотношении 13:3 (по данным ЯМР 1Н спектра) с суммарным выходом 10%. При использовании эквимольного количества тиирана 2.22 получают дигидротиазолотриазол 2.66 с выходом 16%.
Синтезированный 3,5-дибром-1-(тииран-2-илметил)-1,2,4-триазол 2.58 содержит в своей структуре легко уходящие группы, что позволяет использовать его для изучения реакций тииранов с азолами, аминами и другими нуклеофильными реагентами.
Установлено, что реакции тиирана на основе триазола 2.58 с 3,5-дибром-1,2,4-триазолом, 8-бром-1,3-диметилксантином, 1,3-диметилксантином, 2-хлорбензимидазолом не приводят к полимерным продуктам (схема 4). В результате взаимодействия с 3,5-дибром-1,2,4-триазолом, 1,3-диметилксантином и 2-хлорбензимидазолом образуются соответственно 2-бром-5-(азолилметил)-5,6-дигидротиазоло[3,2-b]-1,2,4-триазолы 2.59, 2.68, 2.69 с выходом до 94%. Образцы соединения 2.59, полученные разными способами, не дают депрессии температуры плавления пробы смешения, а их ИК-спектры полностью совпадают.
Схема 4
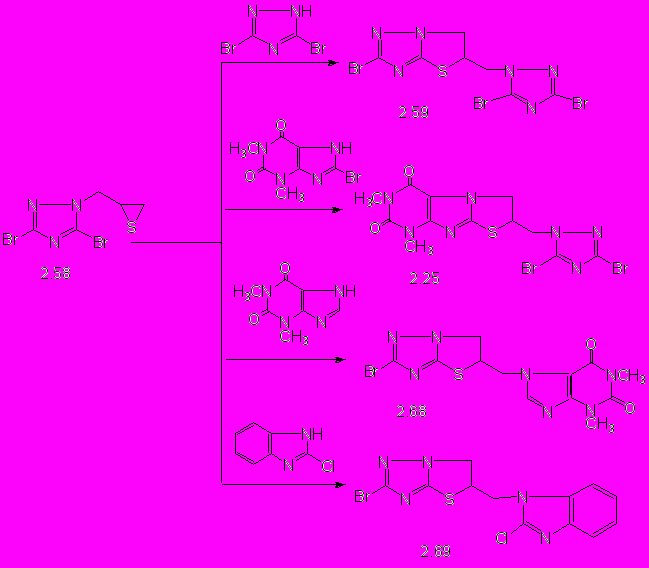
Однако при взаимодействии модельного тиирана на основе триазола 2.58 с 8-бром-1,3-диметилксантином тиолят-анион в промежуточном продукте замещает атом брома в положении С8 ксантина с образованием дигидротиазолопурина 2.25, который не дает депрессии температуры плавления пробы смешения соединением 2.25, синтезированным реакцией модельного тиирана на основе ксантина 2.23 с 3,5-дибром-1,2,4-триазолом, а их ИК-спектры полностью совпадают. Результат данных реакций подтверждает механизм взаимодействия тииранов на основе ксантина и триазола с нуклеофилами, который включает первоначальное образование тиолят-анионов и последующую гетероциклизацию в дигидротиазолоазолы, направление которой зависит от относительной скорости замещения легко уходящей группы азолов.
Тииран на основе триазола 2.58 изучен нами в реакциях с первичными и вторичными алифатическими аминами, а также с первичными ароматическими аминами (схема 5).
Реакции соединения 2.58 проводят с 3-х кратным мольным избытком алифатических аминов при кипячении в этаноле 3 ч. В случае легколетучего диэтиламина реакцию проводят в автоклаве при 100 оС. 5-Аминометилзамещенные 2-бром-5,6-дигидротиазоло[3,2-b]-1,2,4-триазолы (2.45 - 2.47, 2.70 – 2.74) образуются с выходом 18-98 % (схема 5). Полимерные продукты в результате реакций не выделены, что свидетельствует об эффективной стабилизации тиолят-аниона, образующегося при раскрытии тииранового цикла, внутримолекулярной гетероциклизацией в производные дигидротиазолотриазола.
Схема 5
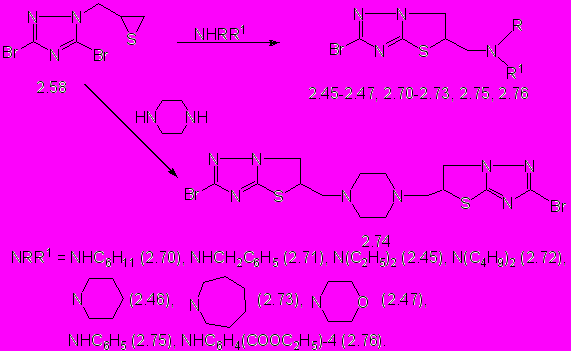
Образцы соединений 2.45 – 2.47, синтезированные реакцией соединения 2.58 с диэтиламином, пиперидином и морфолином, не дают депрессии температуры плавления пробы смешения с образцами синтезированными реакциями 3,5-дибром-1,2,4-триазола с диэтиламино-, приперидин-1-ил- или морфолин-4-илметилтииранами 2.19 - 2.21, а их ИК-спектры полностью совпадают. Спектры ЯМР 1Н-спектр соединения 2.46, полученного разными способами, также полностью совпадают.
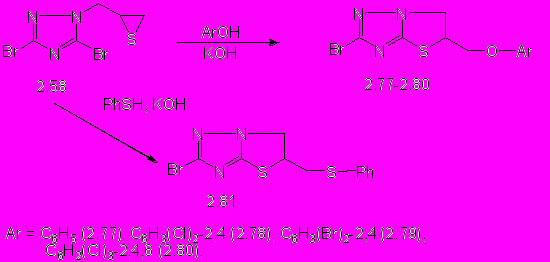
Исследование взаимодействия тиирана на основе триазола 2.58 c ароматическими аминами показало, что в условиях аналогичных реакциям с алифатическими аминами реакция идет медленно - около 7,5 ч. Проведение реакции в ДМФА приводит к сокращению времени реакции до 2 ч. 5-(Ариламино)метил-2-бром-5,6-дигидротиазоло[3,2-b]-1,2,4-триазолы (2.75, 2.76) образуются с выходом 37 - 74%.
Изучены также реакции тиирана на основе триазола 2.58 с фенолом, его ди-, тризамещенными производными и тиофенолом (схема 6). Реакции проводят при кипячении реагентов в среде этанола или н-бутанола в присутствии калия гидроксида. 5-Арилоксиметил- (2.77 - 2.80) и 2-бром-5,6-дигидротиазоло[3,2-b]-1,2,4-триазолы (2.81) выделяются с выходом 17 - 92%.
Спектры ЯМР 1Н, а также ИК-спектры синтезированных соединений подтверждают образование конденсированной системы дигидротиазолотриазола с заместителем в положении С5.
Схема 6
Нами впервые исследовано взаимодействие 1,2,4-триазолов с 2-хлорметилтиираном в водной среде. Установлено, что оптимальными условиями алкилирования 1,2,4-триазола, 3,5-дибром-1,2,4-триазола, 3-алкокси-, 3-арилокси- и 3-аминозамещенных 5-бром-1,2,4-триазолов являются проведение реакции с эквимольным количеством 2-хлорметилтиирана 2.22 в водной среде в присутствии щелочи при температуре 55-60оС. В результате тииран-тиетановой перегруппировки образуются региоизомерные N-(тиетан-3-ил)-1,2,4-триазолы, соотношение которых зависит от природы заместителей в положениях С3 и С5 триазольного цикла (схема 7).
В результате реакций 1,2,4-триазола, 3,5-дибром-1,2,4-триазола с 2-хлорметилтиираном образуются соответственно 1-(тиетан-3-ил)-1,2,4-триазол (2.83) и смесь региоизомерных 1-(тиетан-3-ил)- (2.84) и 4-(тиетан-3-ил)-3,5-дибром-1,2,4-триазолов (2.85) с выходом до 48%. Соотношение 3,5-дибром-1-(тиетан-3-ил)- 2.84 и 3,5-дибром-4-(тиетан-3-ил)изомеров 2.85 по данным ЯМР 1Н-спектроскопии смеси составляет примерно 6 : 1. 1-Тиетанилизомер 2.84 выделяют кристаллизацией из этанола, а 4-тиетанилизомер 2.85 - колоночной хроматографией на силикагеле.
Спектры ЯМР 1Н 1-тиетанилтриазолов 2.83, 2.84 подтверждают образование тиетанового цикла: мультиплеты в интервалах 3,2-3,5 и 3,8 - 4,2 м.д. с интенсивностью в 2Н каждый принадлежат протонам двух S(CH)2 групп тиетанового цикла, а мультиплет в интервале 5,0 - 5,8 м.д. принадлежит протону NCH группы. В спектре ЯМР 1Н 4-тиетанилтриазола 2.85 наблюдается слабопольное смещение сигналов протонов одной S(CH)2 группы (0,25 м.д.) и NCH группы (0,1 м.д.) тиетанового цикла. Наличие в спектре соединения 2.83 двух синглетов при 7,95 и 8,11 м.д., принадлежащих протонам триазольного цикла, свидетельствует об их магнитной неэквивалентности и протекании реакции по положению N1 (N2) триазольного цикла.
Спектры ЯМР 13С соединений 2.84, 2.85 содержат сигналы атомов углерода тиетанового цикла с химическими сдвигами около 33,5 м.д. [S(CH2)2] и 54,4 (NCH) м.д.. Наличие двух сигналов атомов углерода триазольного кольца при 127,61 м.д. (С5) и 140,46 м.д. (С3) в спектре ЯМР 13С соединения 2.84 подтверждает их магнитную неэквивалентность и отнесение данного соединения к 1-тиетанилизомеру. В спектре ЯМР 13С 4-тиетанилизомера 2.85 сигналы атомов углерода триазола являются магнитноэквивалентными и регистрируются при 129,39 м.д..
Схема 7

Взаимодействие 3-алкокси-5-бром-1,2,4-триазолов 2.225, 2.226 с 2-хлорметилтиираном 2.22 приводит к образованию смеси 3-алкокси-5-бром-1-(тиетан-3-ил)- (2.86, 2.89), 5-алкокси-3-бром-1-(тиетан-3-ил)- (2.87, 2.90) и 5-алкокси-3-бром-4-(тиетан-3-ил)-1,2,4-триазолов (2.88, 2.91) в соотношении 7(8) : 8 : 1 (по данным ЯМР 1Н спектра) с суммарным выходом 23-41%.
В спектрах ЯМР 1Н смесей соединений 2.86 - 2.88 и 2.89-2.91 наблюдаются сигналы протонов, соответствующие 3-алкокси-1-тиетанил-, 5-алкокси-1-тиетанил- и 5-алкокси-4-тиетанилизомерам. Отнесение сигналов проводилось на основании спектральных данных соответствующих региоизомеров, полученных реакциями нуклеофильного замещения атома брома. Например, квартет протонов ОСН2 группы 1-тиетанил-3-этоксиизомера 2.86 регистрируется на 0,13 м.д. в более сильнопольной области по сравнению с аналогичным сигналом 1-тиетанил-5-этоксиизомера 2.87 и на 0,26 м.д. в более сильнопольной области по сравнению с аналогичным сигналом 4-тиетанил-5-этоксиизомера 2.88.
Взаимодействие 5-бром-3-арилокси-1H-1,2,4-триазолов 2.228, 2.230 с 2-хлорметилтиираном 2.22 приводит к образованию 5-бром-1-(тиетан-3-ил)-3-арилокси- (2.92, 2.94) и 3-бром-1-(тиетан-3-ил)-5-арилокси-1,2,4-триазолов (2.93, 2.95) с суммарным выходом 39 - 59%, что подтверждается снятием спектров ЯМР 1Н смесей, в которых наблюдается удвоение всех сигналов протонов тиетанового цикла.
При взаимодействии 3-аминозамещенных 5-бром-1Н-1,2,4-триазолов 2.307 - 2.310 с 2-хлорметилтиираном 2.22 образуются продукты алкилирования по положениям N1 и N2 триазольного цикла с преобладанием 3-аминозамещенных 5-бром-1-(тиетан-3-ил)-1,2,4-триазолов (2.96, 2.98, 2.100), за исключением 3-(азепан-1-ил)-5-бром-1,2,4-триазола, где выделен только 5-(азепан-1-ил)-3-бром-1-(тиетан-3-ил)-1,2,4-триазол (2.102) с выходом 44%.
В спектрах ЯМР 1Н смесей региоизомеров 2.96 - 2.101 наблюдается удвоение сигналов протонов тиетанового цикла и фрагментов аминов. Сигналы протонов NCH группы тиетанового цикла 3-аминоизомеров наблюдаются на 0,2-0,3 м.д. в более слабопольной области по сравнению с аналогичными сигналами 5-аминоизомеров.
5. Реакции 3,5-дибром-N-(тиетан-3-ил)-1,2,4-триазолов с нуклеофильными реагентами. Синтез 5-замещенных 3-бром-1-(тиетан-3-ил)-1,2,4-триазолов
Интерес вызывает исследование реакционной способности 3,5-дибром-1-(тиетан-3-ил)- и 3,5-дибром-4-(тиетан-3-ил)-1,2,4-триазолов, которые представляют собой бифункциональные соединения, способные реагировать как по тиетановому циклу, так и подвергаться нуклеофильному замещению атомов брома.
Установлено, что реакции 3,5-бром-1-(тиетан-3-ил)-1,2,4-триазола 2.84 с эквимольным количеством алкоголятов натрия в среде соответствующего безводного спирта приводят к нуклеофильному замещению атома брома по положению С5 тиетанилтриазола 2.84 с образованием 5-алкокси-3-бром-1-(тиетан-3-ил)-1,2,4-триазолов (2.87, 2.90, 2.103-2.105) с выходом 51-87% (схема 8).
Схема 8
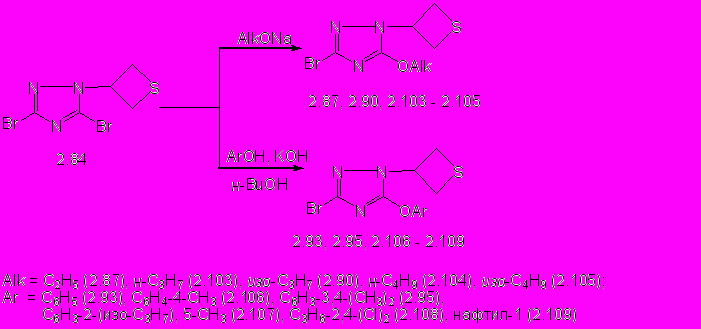 В результате реакций триазола 2.84 с эквимольным количеством фенолов в присутствии калия гидроксида в н-бутаноле тиетановый цикл также сохраняется, и образуются 5-арилокси-3-бром-1-(тиетанил-3)-1,2,4-триазолы (2.93, 2.95, 2.106 - 2.109) с выходами 40 – 93% (схема 8).
В результате реакций триазола 2.84 с эквимольным количеством фенолов в присутствии калия гидроксида в н-бутаноле тиетановый цикл также сохраняется, и образуются 5-арилокси-3-бром-1-(тиетанил-3)-1,2,4-триазолы (2.93, 2.95, 2.106 - 2.109) с выходами 40 – 93% (схема 8).Реакция 3,5-дибром-4-(тиетан-3-ил)-1,2,4-триазола 2.85 с 2,5-кратным мольным избытком этилата натрия приводит к замещению только одного атома брома на остаток спирта, и образуется 3-бром-4-(тиетан-3-ил)-5-этокси-1,2,4-триазол (2.88) с выходом 17%. Попытки получения 3-бром-4-(тиетан-3-ил)-5-фенилокси-1,2,4-триазола не привели к успеху.
Спектры ЯМР 1Н, 13С и ИК синтезированных соединений подтверждают сохранение тиетанового цикла и замещение атома брома по положению С5. Например, в спектре ЯМР 13С соединения 2.87 содержатся сигналы атомов углерода тиетанового цикла и сигналы атомов углерода этоксигруппы. Смещение сигнала атома углерода С5 триазольного цикла в область слабых полей на 29,6 м.д. по сравнению с аналогичным сигналом 3,5-дибром-1-(тиетан-3-ил)-1,2,4-триазола 2.84 согласуется с литературными данными, и подтверждает замещение атома брома в положении С5 триазольного цикла.
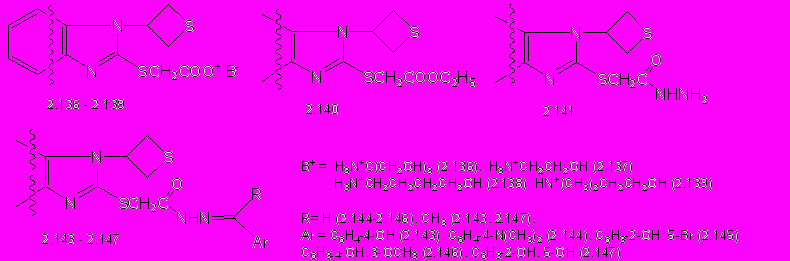
Реакции триазола 2.84 с эквимольным количеством этил- и фенилмеркаптанов проводят в присутствии калия гидроксида при кипячении 1-2ч в этаноле или н-бутаноле соответственно (схема 9). 5-Этилсульфанил- (2.110) и 5-фенилсульфанил-3-бром-1-(тиетан-3-ил)-1,2,4-триазолы (2.112) образуются с выходом 69 и 94%.
Проведении реакции с избытком тиогликолевой кислоты приводит к образованию 2-[3-бром-1-(тиетан-3-ил)-1,2,4-триазолил-5-сульфанил]уксусной кислоты (2.111) с выходом 51%. Взаимодействием кислоты 2.111 с 1,3-кратным мольным избытком оснований получены соли (2.113 – 2.122, схема 9). Эфиры 2.123 - 2.125 получают при кипячении кислоты 2.111 в среде низших спиртов в присутствии концентрированной серной кислоты с выходом 81-93% (схема 9). Разработаны методы синтеза гидразида и илиденгидразидов 2-[3-бром-1-(тиетан-3-ил)-1,2,4-триазолил-5-сульфанил]уксусной кислоты. Взаимодействием этилового эфира 2.124 с 3-кратным мольным избытком гидразингидрата получают гидразид 2-[3-бром-1-(тиетан-3-ил)-1,2,4-триазолил-5-сульфанил]уксусной кислоты (2.126) с выходом 80% (схема 9). Строение синтезированных соединений подтверждено ИК-, ЯМР 1Н-спектрами.
В ЯМР 1Н-спектре гидразида 2.126 проявляется явление Z, E-изомерии вокруг гидразидной C-N связи. В спектре наблюдается удвоенный набор сигналов протонов СН2СО-группы фрагмента тиогликолевой кислоты и гидразина. Преобладающим является Z-изомер, содержание которого приблизительно составляет 90%. При замене растворителя ДМСО-d6 на СDCl3 гидразид 2.126 существует в растворе в одной стереоизомерной форме, которая по значению химического сдвига протонов группы CH2CO (3,81 м.д.) может быть отнесена к Z-изомеру.
Реакциями гидразида 2.126 с замещенными бензальдегидами и ацетофенонами получают арилметилиденгидразиды 2-[3-бром-1-(тиетан-3-ил)-1,2,4-триазолил-5-сульфанил]уксусной кислоты (2.127-2.135, схема 9) с выходом 29 -95%.
Схема 9

Синтезированные арилметилиденгидразиды 2.127-2.135 могут существовать в виде геометрических Z/,E/-изомеров относительно двойной связи С=N и Z,E-изомеров за счет поворотной изомерии относительно связи C-N. В ЯМР ¹Н спектрах арилметилиденгидразидов 2.130, 2.135 наблюдается удвоение сигналов протонов СН2СО-, N=CH-, NH-групп, что, по-видимому, обусловлено заторможенным вращением вокруг С-N связи. Содержание изомеров приближенно равно 60% (Е) : 40% (Z) для соединения 2.130 и 10% (Е): 90% (Z) для соединения 2.135.
С целью изучения взаимосвязи «структура – активность» в ряду производных тиетанилазолилсульфанилуксусных кислот нами были синтезированы соли, эфиры, гидразиды и арилметилиденгидразиды 2-[1-(тиетан-3-ил)бензимидазолил-2-сульфанил]уксусной кислоты (схема 10).
Схема 10
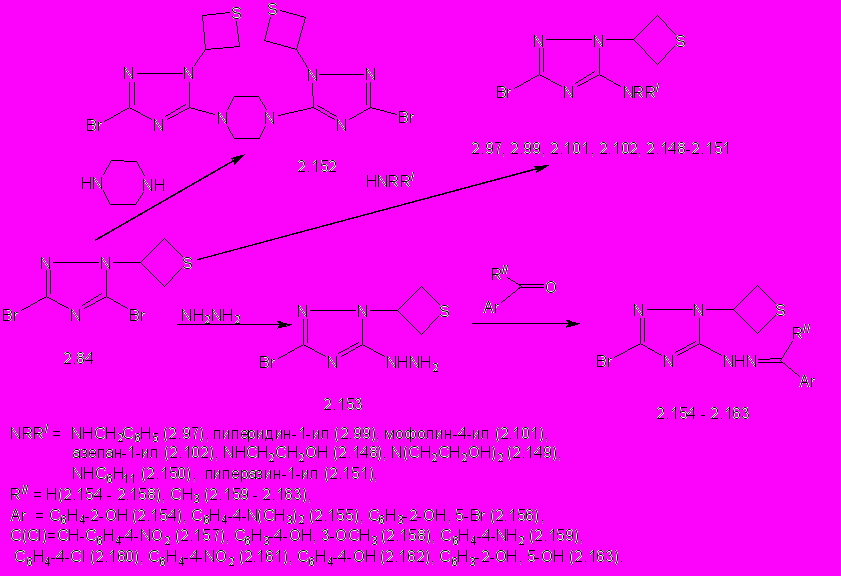
 Реакции триазола 2.84 с 3-5-кратным мольным избытком первичных и вторичных алифатических аминов проводят при кипячении в н-бутаноле в течение 3-10 ч. 5-Аминозамещенные 3-бром-1-(тиетан-3-ил)-1,2,4-триазолы (2.97, 2.99, 2.101, 2.102, 2.148 - 2.152) образуются с выходом 25-98% (схема 11).
Реакции триазола 2.84 с 3-5-кратным мольным избытком первичных и вторичных алифатических аминов проводят при кипячении в н-бутаноле в течение 3-10 ч. 5-Аминозамещенные 3-бром-1-(тиетан-3-ил)-1,2,4-триазолы (2.97, 2.99, 2.101, 2.102, 2.148 - 2.152) образуются с выходом 25-98% (схема 11). Схема 11
 В спектрах ЯМР 1Н 5-аминопроизводных 2.97, 2.99, 2.101 содержатся характерные сигналы протонов тиетанового цикла и фрагментов соответствующих аминов. Сохранение симметричного тиетанового цикла подтверждается также спектром ЯМР 13С 5-пиперидинилзамещенного 2.99, в котором содержатся два сигнала с химическими сдвигами 34,18 и 52,75 м.д., принадлежащие атомам углерода S(CH2)2- и NCH-групп. Смещение сигнала атома углерода С5 триазольного цикла в область слабых полей на 18,7 м.д. по сравнению с аналогичным сигналом тиетанилтриазола 2.84 подтверждает замещение атома брома в положении С5 триазольного цикла.
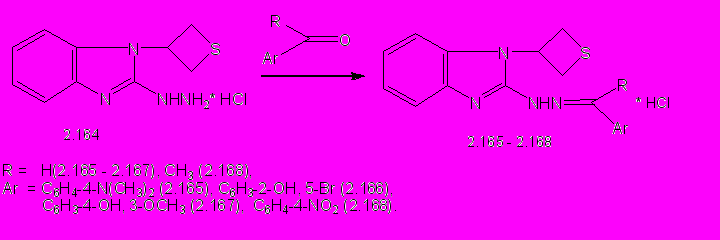
В спектрах ЯМР 1Н 5-аминопроизводных 2.97, 2.99, 2.101 содержатся характерные сигналы протонов тиетанового цикла и фрагментов соответствующих аминов. Сохранение симметричного тиетанового цикла подтверждается также спектром ЯМР 13С 5-пиперидинилзамещенного 2.99, в котором содержатся два сигнала с химическими сдвигами 34,18 и 52,75 м.д., принадлежащие атомам углерода S(CH2)2- и NCH-групп. Смещение сигнала атома углерода С5 триазольного цикла в область слабых полей на 18,7 м.д. по сравнению с аналогичным сигналом тиетанилтриазола 2.84 подтверждает замещение атома брома в положении С5 триазольного цикла. В продолжение изучения химических свойств триазола 2.84 нами исследовано его взаимодействие с гидразингидратом. Установлено, что при кипячении соединения 2.84 с 5-кратным мольным избытком гидразингидрата в н-бутаноле в течение 1 ч образуется 3-бром-5-гидразино-1-(тиетан-3-ил)-1,2,4-триазол (2.153) с выходом 75% (схема 11). При взаимодействии 5-гидразинотриазола 2.153 с 1,1-кратным мольным избытком ароматических карбонильных соединений получают его арилметилиденпроизводные (2.154 - 2.163) с выходом 43 -94% (схема 11).
Строение синтезированных 5-гидразино- и 5-арилметилиденгидразинотриазолов подтверждено ИК-, ЯМР 1Н-, 13С- и масс-спектрами. Наличие только одного набор сигналов остатка карбонильного соединения в ЯМР 1Н- и 13С-спектрах арилметилиденгидразинотриазолов, нерасщепленность синглета NH-группы свидетельствуют о присутствии только одного стерически более выгодного Е-изомера.
С целью изучения взаимосвязи «структура – активность» в ряду синтезированных 5-арилметилиденгидразинотиетанилазолов нами были синтезированы 2-арилметилиденгидразины 1-(тиетан-3-ил)бензимидазола (схема 12), среди которых найдены биологически активные соединения.
Схема 12
6. Синтез и свойства 5-замещенных 3-бром-1-(1-оксотиетан-3-ил)-1,2,4-триазолов
Исследование реакционной способности 3,5-дибром-1-(тиетан-3-ил)-1,2,4-триазола 2.84 показало, что тиетановый цикл устойчив к действию O-, S- и N-нуклеофилов. Увеличение степени окисления атома серы тиетанового цикла приводит к повышению электрофильных свойств последнего и, следовательно, к уменьшению его устойчивости к действию нуклеофилов.
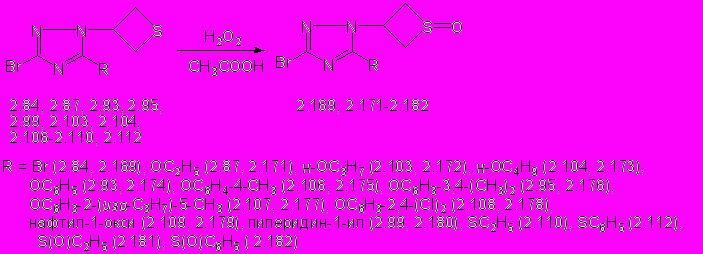
Нами исследованы реакции окисления 3-бром-1-(тиетан-3-ил)-1,2,4-триазолов, содержащих в положении С5 бром, алкокси-, фенокси-, этилсульфанил- и фенилсульфанильные группы, а также фрагмент пиперидина. В качестве окислителя использовался пероксид водорода в среде ледяной уксусной кислоты.
Установлено, что оптимальными условиями окисления тиетанилтриазолов 2.84, 2.85, 2.87, 2.93, 2.95, 2.99, 2.103, 2.104 2.106 - 2.109 являются проведение реакции при комнатной температуре в среде ледяной уксусной кислоты с 2-кратным мольным избытком 37% раствора пероксида водорода (схема 13). Для окисления 5-этилсульфанил- и 5-фенилсульфанил-3-бром-1-(тиетан-3-ил)-1,2,4-триазолов 2.110 и 2.112 используют 4-кратный мольный избыток пероксида водорода. 5-Замещенные 3-бром-1-(1-оксотиетан-3-ил)-1,2,4-триазолы (2.169, 2.171-2.180) и 3,5-дибром-4-(1-оксотиетан-3-ил)-1,2,4-триазол (2.170) образуются с выходом 19-82% (схема 13).
Схема 13
Окисление тиетанового цикла до тиетан-1-оксидного с образованием цис- и транс-изомеров подтверждается данными ЯМР-спектроскопии. В ЯМР 1Н спектрах соединений 2.169 – 2.172, 2.174, 2.176, 2.180 сигналы протонов тиетан-1-оксидного цикла удвоены. Сигналы протонов NCH- и одной S(CH2)-группы цис-тиетан-1-оксидного цикла смещены в область слабых полей в среднем на 0,38 и 0,29 м.д., а второй S(CH2)-группы– в область сильных полей на 0,12 м.д. относительно сигналов аналогичных групп тиетанового цикла. Для транс-изомеров оксотиетанилтриазолов характерно смещение сигналов протонов двух S(CH2)-групп в область слабых полей на 0,63 и 0,08 м.д., а NCH-группы – в область сильных полей на 0,86 м.д. относительно сигналов соответствующих протонов тиетанового цикла. В ряду 5-замещенных 3-бром-1-(1-оксотиетан-3-ил)-1,2,4-триазолов преобладающим является цис-изомер.
Образование тиетан-1-оксидного подтверждается также ЯМР 13С-спектром соединения 2.169, в котором сигналы атомов углерода S(CH2)2 группы смещены в область слабых полей по сравнению с неокисленным тиетановым циклом и регистрируются при 56,56 м.д. (цис-) и 58,98 м.д. (транс-). Кроме того, цис-расположение связей S=O и N-CH сдвигает сигнал атома углерода NCH-группы цис-изомера в область слабых полей на 8 м.д. (51,16 м.д.) по сравнению с аналогичным сигналом углеродного атома транс-изомера (43,07 м.д.).
Продолжая изучение химических свойств продуктов тииран-тиетановой перегруппировки, нами исследованы реакции 3,5-дибром-1-(1-оксотиетан-3-ил)-1,2,4-триазола 2.169 со спиртами, тиогликолевой кислотой и аминами. Установлено, что реакции соединения 2.169 с алкоголятами натрия приводят к осмолению реакционной смеси и образованию продуктов, которые не удалось идентифицировать.
В результате реакции триазола 2.169 с тиогликолевой кислотой при кипячении в этаноле в присутствии калия гидроксида получают 2-[3-бром-1-(1-оксотиетан-3-ил)-1,2,4-триазолил-5-сульфанил]уксусную кислоту, которая хорошо растворима в воде и выделена в виде калиевой (2.183) и натриевой солей (2.184) с выходом 69 и 60% (схема 14). При нагревании соли 2.183 в среде этанола в присутствии концентрированной серной кислоты получают этиловый эфир (2.185) с выходом 60% (схема 14).
Схема 14

Реакции триазола 2.169 с избытком первичных и вторичных алифатических аминов проводят в н-бутаноле (схема 15).
Схема 15
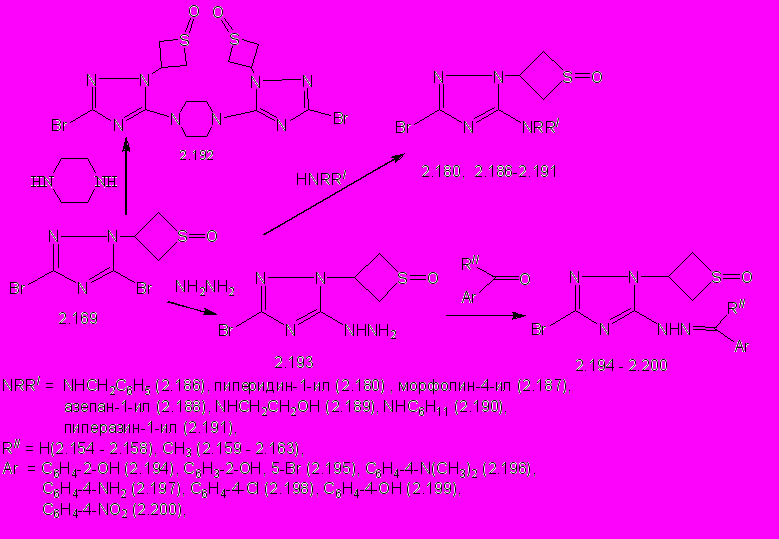 В результате нуклеофильного замещения атома брома в положении С5 триазольного цикла образуются 5-аминозамещенные 3-бром-1-(1-оксотиетан-3-ил)-1,2,4-триазолы (2.180, 2.186 -2.192) с выходом 36-92%, и сохраняется тиетан-1-оксидный цикл (схема 15). Соединение 2.180, синтезированное реакцией оксотиетанилтриазола 2.169 с пиперидином идентично образцу, полученному окислением 3-бром-1-(тиетан-3-ил)-5-(пиперидин-1-ил)-1,2,4-триазола 2.99.
В результате нуклеофильного замещения атома брома в положении С5 триазольного цикла образуются 5-аминозамещенные 3-бром-1-(1-оксотиетан-3-ил)-1,2,4-триазолы (2.180, 2.186 -2.192) с выходом 36-92%, и сохраняется тиетан-1-оксидный цикл (схема 15). Соединение 2.180, синтезированное реакцией оксотиетанилтриазола 2.169 с пиперидином идентично образцу, полученному окислением 3-бром-1-(тиетан-3-ил)-5-(пиперидин-1-ил)-1,2,4-триазола 2.99.Реакцией оксотиетанилтриазола 2.169 с гидразингидратом получают 3-бром-5-гидразино-1-(1-оксотиетан-3-ил)-1,2,4-триазол (2.193) с выходом 41 % (схема 15). 5-Арилметилиденгидразино-3-бром-1-(1-оксотиетан-3-ил)-1,2,4-триазолы (2.194 - 2.200) образуются при взаимодействии гидразина 2.193 с ароматическими альдегидами и кетонами с выходом 68-100 % (схема 15).
Строение синтезированных соединений подтверждено ИК, ЯМР 1Н-, 13С- и масс-спектрами. В спектрах ЯМР 1Н 5-аминопроизводных 2.180, 2.186 наблюдаются характерные сигналы протонов цис- и транс-изомеров тиетан-1-оксидного цикла и фрагментов соответствующих аминов. Преобладающим является цис-изомер.
Спектры ЯМР 1Н и 13С 5-арилметилиденгидразинов 3-бром-1-(1-оксотиетани-3-ил)-1,2,4-триазола содержат один набор сигналов тиетан-1-оксидного цикла, который по значению химических сдвигов протонов находится в цис-конфигурации, и фрагмента гидразона, что свидетельствуют о присутствии только одного стерически более выгодного Е-изомера относительно C=N связи.
