Синтез соединений на основе химических превращений производных α- оксокарбоновых кислот и их биологическая активность 15. 00. 02 фармацевтическая химия, фармакогнозия
| Вид материала | Автореферат диссертации |
- Синтез, свойства, биологическая активность n-гетериламидов α-оксокислот и продуктов, 367.21kb.
- Синтез, свойства и биологическая активность енаминоамидов ацилпировиноградных кислот, 439.81kb.
- Синтез и свойства новых производных 2 (1,2,4 триазолил 5 тио)уксусных кислот 15. 00., 240.9kb.
- Синтез, химические свойства и биологическая активность 1,4-дизамещенных 5-арил-3-гидрокси-3-пирролин-2-онов, 667.95kb.
- Синтез и биологическая активность карбо- и гетероциклов на основе тетрацианоэтилена, 673.64kb.
- Синтез, свойства и биологическая активность продуктов взаимодействия 1,2,4-триазолов, 669.98kb.
- Синтез, свойства и биологическая активность производных 2-хлорникотинонитрилов, 264.36kb.
- Реферат Синтез и превращения азотпроизводных карбоновых кислот, 346.86kb.
- Синтез и строение N,o- содержащих гетероциклических соединений на основе несимметричных, 201.05kb.
- Синтез, строение и реакции тиенилсодержащих кросс-сопряженных диеноновых производных, 287.71kb.
На правах рукописи
Пулина Наталья Алексеевна
Синтез соединений на основе химических превращений
производных α-оксокарбоновых кислот
И ИХ БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
15.00.02 – фармацевтическая химия, фармакогнозия
Автореферат
диссертации на соискание ученой степени
доктора фармацевтических наук
Пермь 2009
Работа выполнена в ГОУ ВПО «Пермская государственная фармацевтическая
академия Федерального агентства по здравоохранению и социальному развитию»
| Научные консультанты: |  доктор химических наук, профессор доктор химических наук, профессор Залесов Владимир Васильевич , доктор медицинских наук, профессор Юшков Владимир Викторович | |||
| Официальные оппоненты: | доктор фармацевтических наук, профессор Михалев Александр Иванович, ГОУ ВПО «Пермская государственная фармацевтическая академия Федерального агентства по здравоохранению и социальному развитию» доктор фармацевтических наук, профессор Марданова Людмила Геннадьевна, ГОУ ВПО «Пермский государственный университет» доктор химических наук, профессор Насакин Олег Евгеньевич, ГОУ ВПО «Чувашский государственный университет им. И. Н. Ульянова» | |||
| | Ведущая организация: | ГОУ ВПО «Санкт-Петербургская химико-фармацевтическая академия Федерального агентства по здравоохранению и социальному развитию» | | |
Защита состоится «21» апреля 2009 г. в 13.00 на заседании диссертационного совета Д 208.068.01 при Пермской государственной фармацевтической академии по адресу: 614990, г. Пермь, ул. Ленина, 48.
С диссертацией можно ознакомиться в библиотеке Пермской государственной фармацевтической академии по адресу: 614070, г. Пермь, ул. Крупской, 46.
Автореферат разослан «___» _________ 2009 г.
| Ученый секретарь диссертационного совета, кандидат фармацевтических наук, доцент | | И.А. Липатникова |
Общая характеристика работы
Актуальность проблемы. Создание высокоэффективных и малотоксичных лекарственных средств является основной проблемой фармацевтической науки и для ее решения одним из приоритетных направлений служит синтез и поиск биологически активных веществ (БАВ). Ранее было установлено, что соединения, полученные на основе химических превращений 4-арил-2-гидрокси-4-оксо-2-бутеновых (ароилпировиноградных) кислот (АрПК) и их γ-лактонной формы – 5-арил-2,3-дигидрофуран-2,3-дионов (5-АФД), обладают различной фармакологической активностью при низкой токсичности, что и привлекает к ним значительное внимание. Наименее изученными производными этого класса соединений являются N-гетериламиды и N2-замещенные гидразиды АрПК. Они представляют практический интерес, благодаря наличию нескольких реакционных центров 1,3-дикетонного, гетероциклического и гидразидного фрагментов, что позволяет использовать их для создания разнообразных ациклических и гетероциклических соединений. Известные методы синтеза нуждаются в доработке и требуют их дальнейшего исследования для расширения структурных возможностей целевых продуктов и введения в молекулу соединений биологически активных группировок. Среди важных в препаративном отношении реакций АрПК и их производных, имеющих теоретическое и практическое значение, особое место занимают нуклеофильные превращения (с гетероциклическими аминами, замещенными гидразинами, трифенилфосфоранилиденгидразонами (трифенилфосфазинами диазосоединений – фосфазинами), гидразонами кетонов, диазосоединениями), ранее не изученные или же проведенные на единичных примерах.
Интересным объектом для сравнительного изучения химического поведения гетероциклических аминов, фосфазинов и гидразонов кетонов с 2,3-диоксогетероциклами является 2,3-дигидробензо[b]фуран-2,3-дион (кумарандион – КД). Образованные на его основе N-гетериламиды и N2-замещенные гидразиды 2-(2-гидроксифенил)-2-оксоэтановой (о-гидроксифенилглиоксалевой) кислоты (о-ГФГК) могут обладать значительными синтетическими возможностями для получения БАВ, в том числе, растворимых в воде. Кроме того, представляет интерес исследование дальнейших химических превращений N-замещенных 2-метиленгидразоно-2,3-дигидро-3-бензо[b]фуранонов с целью поиска новых биологически активных производных о-ГФГК. Принимая во внимание, что химическая модификация соединений путем комплексообразования с металлами может привести к значительному усилению биологического действия и появлению новых фармакологических свойств лигандов, несомненно, перспективными являются ранее не изученные реакции N-гетериламидов и N2-замещенных гидразидов АрПК и о-ГФГК с галогенидами переходных металлов. Таким образом, изучение синтеза, химических свойств, биологической активности и зависимости «структура-активность» в ряду производных α-оксокарбоновых кислот является актуальным.
Цель работы. Целью настоящего исследования является поиск и разработка новых методов синтеза высокоэффективных, малотоксичных БАВ на основе химических превращений α-оксокарбоновых кислот, а также установление зависимости их строения с биологическим действием.
Задачи исследования:
- Осуществить синтез и изучить особенности строения N-гетериламидов АрПК и о-ГФГК, содержащих в своем составе фармакофорный гетероциклический фрагмент с одним, двумя или тремя гетероатомами, а также N2-замещенных гидразидов α-оксокарбоновых кислот, несущих биологически активные группировки.
- Изучить химические свойства АрПК и их производных в реакциях с гетериаламинами, замещенными гидразинами, фосфазинами, гидразонами кетонов, диазонуклеофилами.
- Изучить взаимодействие о-ГФГК и ее N-гетериламидов с гетериламинами, гидразонами кетонов, фосфазинами, в сравнении с АрПК и их N-гетериламидами, а также получить на их основе водорастворимые соединения.
- Провести сравнительное изучение химического поведения N-гетериламидов и N2-замещенных гидразидов α-оксокарбоновых кислот в реакциях комплексообразования с дихлоридами меди, цинка, кадмия.
- Осуществить поиск БАВ среди продуктов синтеза, изучить зависимость их строения с фармакологическим действием, выявить перспективные соединения для проведения доклинических исследований в качестве потенциальных лекарственных средств.
Научная новизна. Разработаны, усовершенствованы препаративные методы синтеза новых биологически активных N2-замещенных гидразидов и N-гетериламидов АрПК и о-ГФГК с различным характером заместителей в амидном и гидразидном фрагментах, а также 4-арил-2-гидрокси-4-оксо-2-бутеноатов и 2-(2-гидроксифенил)-2-оксоэтаноатов гетериламмония. Показано наличие тион-тиольной и амино-иминной прототропной таутомерии в растворе производных АрПК и о-ГФГК, содержащих 5-R-1,3,4-тиадиазол. Выявлено, что дециклизация 5-АФД под действием этилового эфира гидразинэтановой кислоты приводит к этоксикарбонилметилгидразидам АрПК и их кольчатым изомерам, количественный состав которых зависит от характера заместителя.
Установлено, что направление реакции гетериламинов, гидразонов кетонов и фосфазинов с КД не меняется, по сравнению с 5-АФД, в результате чего выделены, соответственно, N-гетериламиды, N2-замещенные гидразиды о-ГФГК и N-замещенные 2-метиленгидразоно-2,3-дигидро-3-бензо[b]фураноны. При изучении химических свойств 3-бензо[b]фуранонов найдены способы синтеза производных о-ГФГК и АрПК, содержащие в своем составе сохраненный биологически активный фурановый и бензо[b]фурановый цикл.
Установлено влияние заместителей в гетерильной части N-[5(6)-R-2-пиридил]амидов и N-(5-R-2-тиазолил)амидов АрПК, а также степени нуклеофильности исходного диазосоединения на состав и строение продуктов реакции. Показано, что взаимодействие бензоилметиленгидразидов АрПК с диазометаном региоселективно и приводит к продуктам α-О-алкилирования.
Изучены реакции АрПК и их амидов с фосфазинами и гидразонами кетонов, приводящие к соответствующим 2-метиленгидразинопроизводным, существующим в растворах в трех таутомерных формах. В то же время установлено, что взаимодействие N-гетериламидов АрПК с этиловым эфиром гидразинэтановой кислоты приводит к замыканию цикла с образованием производных 5-арил-1-этоксикарбонил-1Н-пиразол-3-карбоновых кислот.
Осуществлен синтез комплексных соединений на основе N-гетериламидов и N2-замещенных гидразидов α-оксокарбоновых кислот с дихлоридами меди, цинка, кадмия и подтверждено, что исходные реагенты координируются металлами как бидентатные О-О лиганды. Получены водорастворимые 2-[2-(N-гетериламино)-2-оксоацетил]феноляты натрия.
Исследована биологическая активность синтезированных соединений и выяснены некоторые закономерности связи строения с активностью. Новизна исследования подтверждена 1 патентом и 1 решением о выдаче патента РФ на изобретение.
Практическая значимость. В ходе исследования разработаны или усовершенствованы удобные препаративные методы синтеза более 40 типов ранее неизвестных или труднодоступных производных α-оксокарбоновых кислот. Определенную ценность имеет синтез 3 типов водорастворимых соединений, поскольку это позволяет увеличить их биологическую доступность и расширить спектр возможных биологических испытаний.
Получено 289 неописанных ранее соединений, при этом более 250 прошли фармакологический скрининг. Среди них выявлены вещества, обладающие противовоспалительной, анальгетической, жаропонижающей, антигипоксической, гипогликемической, противомикробной активностью, которая находится на уровне или превосходит действие препаратов, применяющихся в медицинской практике. Большинство изученных соединений относятся к малотоксичным или практически нетоксичным веществам. Выявлена связь между структурой испытанных соединений и их биологической активностью, используемая в целенаправленном поиске БАВ среди производных α-оксокарбоновых кислот и продуктов их химических превращений.
Проводятся доклинические исследования высокоэффективных N-[2-(5-этил-1,3,4-тиадиазолил)]амида 2-(2-гидроксифенил)-2-оксоэтановой кислоты и 2-(1,2-дифенил-2-оксоэтилиденгидразино)-4-(4-метоксифенил)-4-оксо-2-бутеновой кислоты, обладающих противовоспалительным, анальгетическим и жаропонижающим действием. Для углубленных фармакологических исследований также предложены: 2-гидрокси-4-оксо-4-фенил-2-бутеноат 5-метил-1,3,4-тиадиазолиламмония и бис{3-(4-хлорфенил)-1-[N-(5-бром-2-пиридил)]карбоксамидо-1,3-пропандионато}цинк, проявляющие высокую гипогликемическую активность и низкую токсичность.
Результаты научных исследований внедрены в научно-исследовательский и учебный процесс кафедр фармацевтической химии о/ф, фармакологии, клинической фармакологии ГОУ ВПО ПГФА Россздрава, кафедры природных и биологически активных соединений ГОУ ВПО ПерГУ, а также лаборатории БАВ ЕНИ ПерГУ.
Апробация работы. Результаты работы доложены на итоговых научных конференциях профессорско-преподавательского состава ГОУ ВПО ПГФА Россздрава в 1995-2008 гг., на Всесоюзных научных конференциях «Карбонильные соединения в синтезе гетероциклов» (Саратов, 1992, 2004, 2008), региональных научных конференциях «Разработка, исследование и маркетинг новой фармацевтической продукции» (Пятигорск, 1993, 2006, 2007), III, XIV Российском национальном конгрессе «Человек и лекарство» (Москва, 1995, 2007), Международной научно-технической конференции «Перспективы развития химии и практического применения алициклических соединений» (Самара, 2004), II Всероссийском съезде фармацевтических работников (Сочи, 2005), Международных конгрессах «Здоровье и образование в XXI веке» (Москва, 2005-2007), Российской научно-практической конференции «Новая технологическая платформа биомедицинских исследований» (Ростов-на-Дону, 2006), Российско-Китайской и Китайско-Российской научных конференциях по фармакологии (Пермь, 2006; Харбин, 2008), 3-й Всероссийской научно-методической конференции «Пути и формы совершенствования фармацевтического образования. Создание новых физиологически активных веществ» (Воронеж, 2007), Международных конференциях «Техническая химия. От теории к практике» (Пермь, 2006, 2008), Всероссийском симпозиуме «Результаты фундаментальных и прикладных исследований для создания новых лекарственных средств» (Москва, 2008) и других совещаниях и конференциях.
Публикации. Основное содержание работы представлено в 53 публикациях, из них: 12 статей в изданиях, рекомендуемых ВАК, глава в монографии, 38 статей и тезисов докладов в сборниках и материалах научных конференций различного уровня, получены 1 патент и 1 решение о выдаче патента РФ на изобретение.
Связь задач исследования с проблемным планом фармацевтических наук. Диссертационная работа выполнена в соответствии с планом научно-исследовательских работ ГОУ ВПО «Пермская государственная фармацевтическая академия Россздрава» (№ государственной регистрации 01.9.50 007419).
Объем и структура диссертации. Диссертационная работа общим объемом 328 страниц машинописного текста состоит из введения, литературного обзора по синтезу, строению, химическим свойствам и биологической активности N2-замещенных гидразидов ацилпировиноградных кислот (глава 1), обсуждения результатов собственных исследований (главы 2, 3), экспериментальной части (глава 4), изучения результатов биологической активности производных α-оксокарбоновых кислот и продуктов их химических превращений (глава 5), выводов, литературы, приложения. В главе 2 приводятся сведения по синтезу и строению N-гетериламидов и N2-замещенных гидразидов α-оксокарбоновых кислот. Глава 3 посвящена изучению химических свойств производных α-оксокарбоновых кислот и их γ-лактонных форм. Список литературы включает 299 работ отечественных и зарубежных авторов. Работа содержит 62 таблицы, 12 рисунков.
Основные положения, выносимые на защиту:
1. Синтез новых N-гетериламидов и N2-замещенных гидразидов α-оксокарбоновых кислот, содержащих биологически активные группировки, и изучение особенностей их строения.
2. Результаты исследования нуклеофильных превращений производных 4-арил-2-гидрокси-4-оксо-2-бутеновых и 2-(2-гидроксифенил)-2-оксоэтановой кислот с гетероциклическим аминами, замещенными гидразинами, трифенилфосфоранилиденгидразонами, гидразонами кетонов, диазосоединениями.
3. Результаты сравнительного изучения реакции комплексообразования N-гетериламидов и N2-замещенных гидразидов α-оксокарбоновых кислот с дихлоридами меди, цинка, кадмия.
4. Установленные взаимосвязи строения и фармакологической активности синтезированных соединений, а также выбор перспективных веществ для углубленных биологических испытаний.
Основное содержание работы
1. Синтез и строение N-гетериламидов α-оксокарбоновых кислот
1.1. Синтез N-гетериламидов 4-арил-2-гидрокси-4-оксо-2-бутеновых кислот
Для решения поставленных задач и синтеза исходных N-гетериламидов 4-арил-2-гидрокси-4-оксо-2-бутеновых кислот (2а-аи) была использована известная реакция 5-АФД 1 с различными гетероциклическими аминами в среде инертного растворителя при эквимолярном соотношении реагентов. С целью введения в структуру амидов биологически активных фрагментов и получения неописанных ранее соединений 2ц-аи в качестве гетериламинов нами взяты 2-амино-5-нитротиазол, 2-амино-5-циклопропилтиазол, 2-амино-1,3,4-тиадиазол, 2-амино-5-R-1,3,4-тиадиазолы, 2-аминобензимидазол (метод А). Установлено, что оптимальным растворителем для данной реакции служит безводный хлороформ.
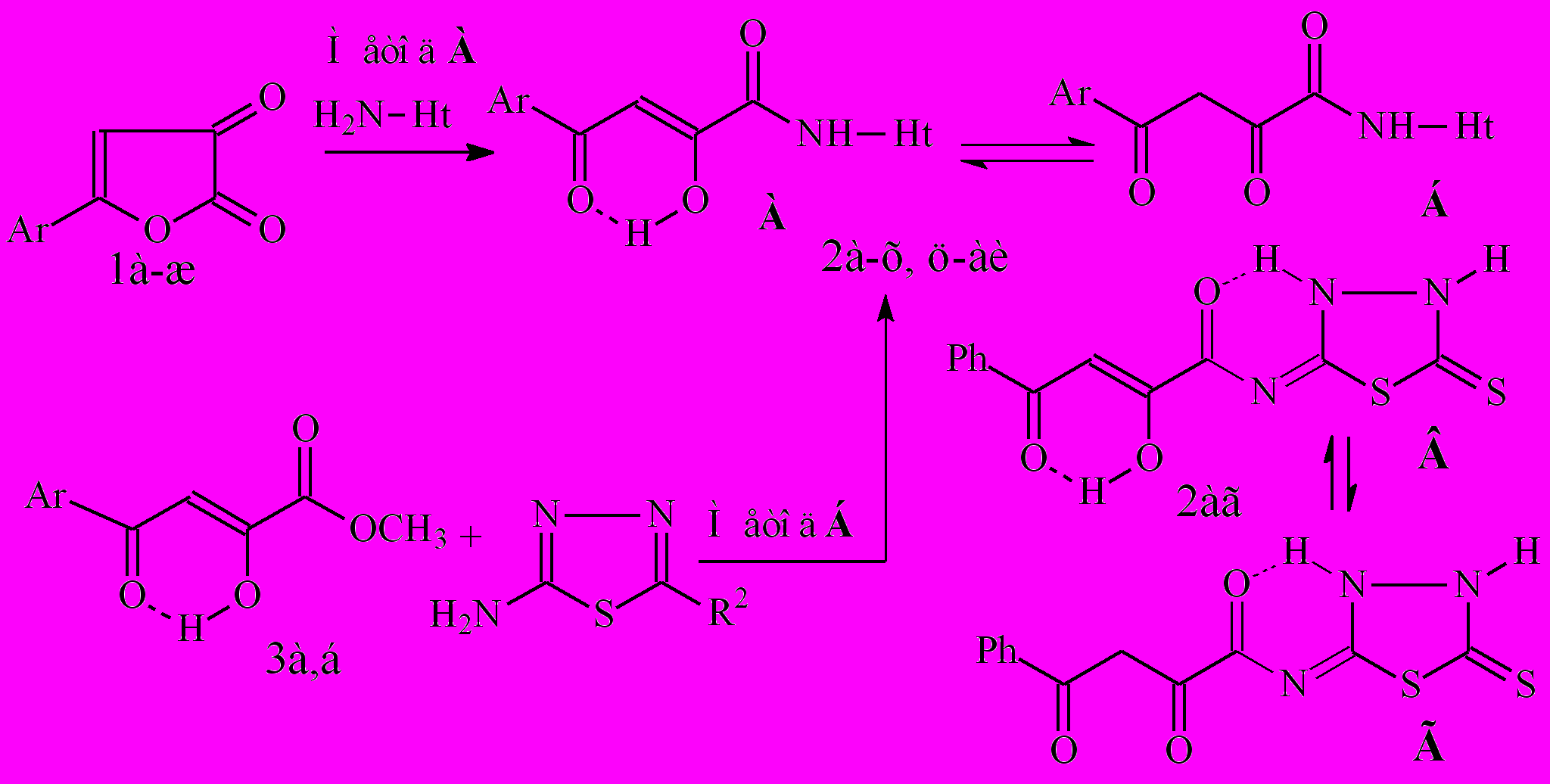

1: Ar=Ph(а), 4-СН3C6H4(б), 2,4-(СН3)2C6H3(в), 4-СН3OC6H4(г), 4-С2Н5OC6H4(д), 4-СlC6H4(е), 4-BrC6H4(ж) 2: Ht=2-С5Н4N (2-пиридил), С6Н6N [2-(6-метилпиридил)], С5Н3BrN[2-(5-бромпиридил)], 3-С5Н4N (3-пиридил), С11Н11N2О (1,5-диметил-3-оксо-2-фенил-2,3-дигидро-1Н-пиразол-4-ил), С3Н2NS (2-тиазолил), С3Н1N2О2S [2-(5-нитротиазолил)], С6Н6NS [2-(5-циклопропилтиазолил)], С2Н1N2S [2-(1,3,4-тиадиазолил)], С3Н3N2S [2-(5-метил-1,3,4-тиадиазолил)], С4Н5N2S[2-(5-этил-1,3,4-тиадиазолил)], С2Н1N2S2 [2-(5-меркапто-1,3,4-тиадиазолил)], С4Н5N2S2 [2-(5-этилтио-1,3,4-тиадиазолил)], С7Н5N2 (2-бензимидазолил)
Нами проведен встречный синтез N-[2-(5-R-1,3,4-тиадиазолил)]амидов 2 в результате реакции метиловых эфиров АрПК 3 с соответствующими аминами (метод Б). Однако выход амидов 2 оказался значительно ниже, чем в методе А, и в дальнейшем для синтеза целевых продуктов метод Б не использовался.
Спектральные характеристики новых гетериламидов 2ц-аи свидетельствуют о существовании соединений в кристаллическом состоянии в форме производных 2-бутеновых кислот с прочной внутримолекулярной водородной связью (ВВС) Н-хелатного типа между атомом водорода енольного гидроксила в положении 2 и атомом кислорода кетонного карбонила, что хорошо согласуется с литературными данными для родственных структур. По данным их спектров ЯМР1Н в растворе ДМСО-d6 наблюдается прототропная кето-енольная таутомерия и содержание дикетоформы Б составляет 0-11%. Отмечена полная енолизация N-бензимидазолиламидов и N-[2-(5-этил-1,3,4-тиадиазолил)]амидов 2, не зависимо от характера заместителя в ароильном фрагменте. В случае N-[2-(5-тиоксо-4,5-дигидро-1,3,4-тиадиазолил)]амида 2аг возможна реализация еще двух типов прототропной таутомерии: амино-иминной, за счет миграции протона от амидной группы на атом азота в положении 3 гетероцикла, с последующим его вовлечением во ВВС Н-хелатного типа с амидной карбонильной группой; тион-тиольной таутомерии, за счет миграции протона от сульфгидрильной группы к атому азота в положении 4 гетероцикла. Как показывают наши исследования, в растворе ДМСО-d6 реализуется таутомерное равновесие соответствующих форм В и Г гетериламида 2аг с соотношением 75% : 25%. Спектральные характеристики 2-(5-этилтио-1,3,4-тиадиазолил)амидов 2ад,ае также свидетельствуют о наличии амино-иминной таутомерии и в растворе ДМСО-d6 фиксируются 2 таутомера – енольный и дикетонный их соответствующей иминоформы с содержанием 88-90% : 10-12%.
1.2. Синтез N-гетериламидов 2-(2-гидроксифенил)-2-оксоэтановой кислоты
Циклическим производным 2-(2-гидроксифенил)-2-оксоэтановой кислоты (о-ГФГК) является кумарандион 5. Ранее выполненные квантово-химические расчеты КД 5 и 5-АФД 1показали, что гетероциклы являются близкими по своим геометрическим характеристикам и распределению в них зарядов. В продолжение изучения химического поведения 2,3-диоксогетероциклов в реакции с гетериламинами, нами впервые исследовано взаимодействие КД 5 с гетериламинами различного строения в условиях, аналогичных образованию соединений 2, в результате чего выделены N-гетериламиды 2-(2-гидроксифенил)-2-оксоэтановой кислоты (6а-з):

6: Ht=С5Н3BrN, 3-С5Н4N, 4-С5Н4N, С3Н2NS, С2Н1N2S, С3Н3N2S, С4Н5N2S, С7Н5N2
Продуктов реакции по кетонной карбонильной группе соединения 5 не обнаружено, что свидетельствует о региоселективности протекающего процесса.
Низкочастотное положение полосы поглощения кетонной карбонильной группы в ИК-спектрах гетериламидов 6, а также слабопольное положение сигнала протона ОН-группы в спектрах ЯМР1Н, вероятно, свидетельствует об их существовании в кристаллическом состоянии и в растворе в форме с ВВС Н-хелатного типа между протоном гидроксильной группы и атомом кислорода группы С2=О. Кроме того, в спектре ЯМР1Н N-[2-(5-этил-1,3,4-тиадиазолил)]амида 6ж присутствует уширенный синглет протона NН-группы при 12.85 м.д., положение которого указывает на миграцию протона от амидной группы на атом N3 в гетероцикле, подобно гетериламидам АрПК 2аг-ае, и существование соединения 6ж в растворе ДМСО-d6 в иминоформе со 100% содержанием.
По-видимому, образование соединений 6 происходит в результате нуклеофильной атаки аминогруппы исходного гетериламина на электронодефицитный атом углерода С2 КД 5 с последующим раскрытием лактонного кольца через интермедиат И1 до производного о-ГФГК 6. Подтверждением этому служит тот факт, что при использовании в данной реакции 2-амино-5-хлорбензоксазола, образующийся И1 является достаточно стабильным и выделяется из реакционной смеси в виде 2-гидрокси-2-[(5-хлор-1,3-бензоксазол-2-ил)амино]-1-бензофуран-3(2Н)-она (7) c выходом 65%.
