Синтез соединений на основе химических превращений производных α- оксокарбоновых кислот и их биологическая активность 15. 00. 02 фармацевтическая химия, фармакогнозия
| Вид материала | Автореферат диссертации |
- Синтез, свойства, биологическая активность n-гетериламидов α-оксокислот и продуктов, 367.21kb.
- Синтез, свойства и биологическая активность енаминоамидов ацилпировиноградных кислот, 439.81kb.
- Синтез и свойства новых производных 2 (1,2,4 триазолил 5 тио)уксусных кислот 15. 00., 240.9kb.
- Синтез, химические свойства и биологическая активность 1,4-дизамещенных 5-арил-3-гидрокси-3-пирролин-2-онов, 667.95kb.
- Синтез и биологическая активность карбо- и гетероциклов на основе тетрацианоэтилена, 673.64kb.
- Синтез, свойства и биологическая активность продуктов взаимодействия 1,2,4-триазолов, 669.98kb.
- Синтез, свойства и биологическая активность производных 2-хлорникотинонитрилов, 264.36kb.
- Реферат Синтез и превращения азотпроизводных карбоновых кислот, 346.86kb.
- Синтез и строение N,o- содержащих гетероциклических соединений на основе несимметричных, 201.05kb.
- Синтез, строение и реакции тиенилсодержащих кросс-сопряженных диеноновых производных, 287.71kb.
3.2. Синтезы на основе производных 2-(2-гидроксифенил)-2-оксоэтановой кислоты
В продолжение изучения химического поведения гетериламинов в реакциях с α-оксокислотами и с целью синтеза БАВ нами исследовано взаимодействие 2-(2-гидроксифенил)-2-оксоэтановой кислоты (4) с 2-, 4-аминопиридинами, 2-аминотиазолом и 2-амино-(5-R-1,3,4-тиадиазолом). Реакция протекает в условиях, аналогичных получению бутеноатов 20, с образованием соответствующих 2-(2-гидроксифенил)-2-оксоэтаноатов гетериламмония (43а-д):

43: Ht=2-С5Н4N (а),4-С5Н4N (б),С3Н2NS (в),С2Н1N2S (г),С3Н3N2S (д)
Реакция кислоты 4 с гидразонами бензофенонов и 9-флуоренона в среде безводного толуола и соотношении реагентов 1:1 или 2:1 приводит к 2-(2-гидроксифенил)-2-[(2-гидроксифенил)карбоксиметилен] гидразоноэтановой кислоте (46) (метод А) и азинам 47 а-в.
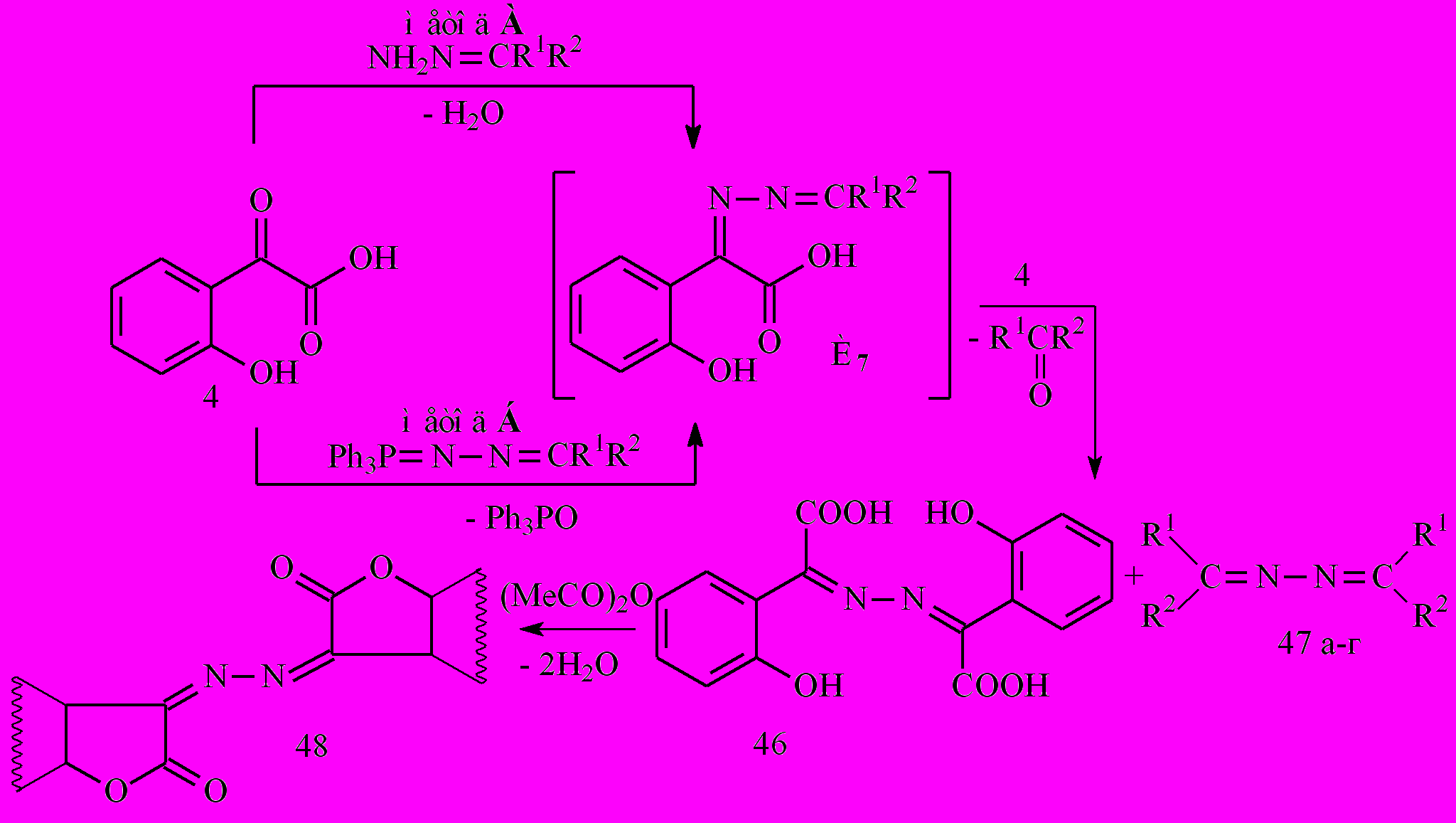
47: R1=C6H5, R2=C6H5(а), 4-BrC6H4(б); СR1R2=C13H8(в), C9H7NO (г)
Предполагаемый механизм реакции включает, по-видимому, промежуточное образование азинов (интермедиат И7), которые в процессе реакции взаимодействуют со второй молекулой кислоты 4, давая азин 46.
Взаимодействие кислоты 4 с соответствующими фосфазинами также завершается получением азина 46, симметричных азинов 47а-г и ТФО (метод Б). Соединение 46 при нагревании в уксусном ангидриде циклизуется с высоким выходом в 3-(2,3-дигидро-2-оксо-3-бензо[b]фуранилиден)гидразоно-2,3-дигидро-2-оксобензо[b]-фуран (48).
Нами установлено, что взаимодействие гидразонов бензофенона или 9-флуо-ренона с 2-тиазолиламидом 6г протекает по кетонной карбонильной группе последнего с образованием соответственно N-(2-тиазолил)амидов 2-(2-гидроксифенил)-2-дифенилметилен- и 2-флуоренилиденгидразоноэтановой кислоты (49а,б):
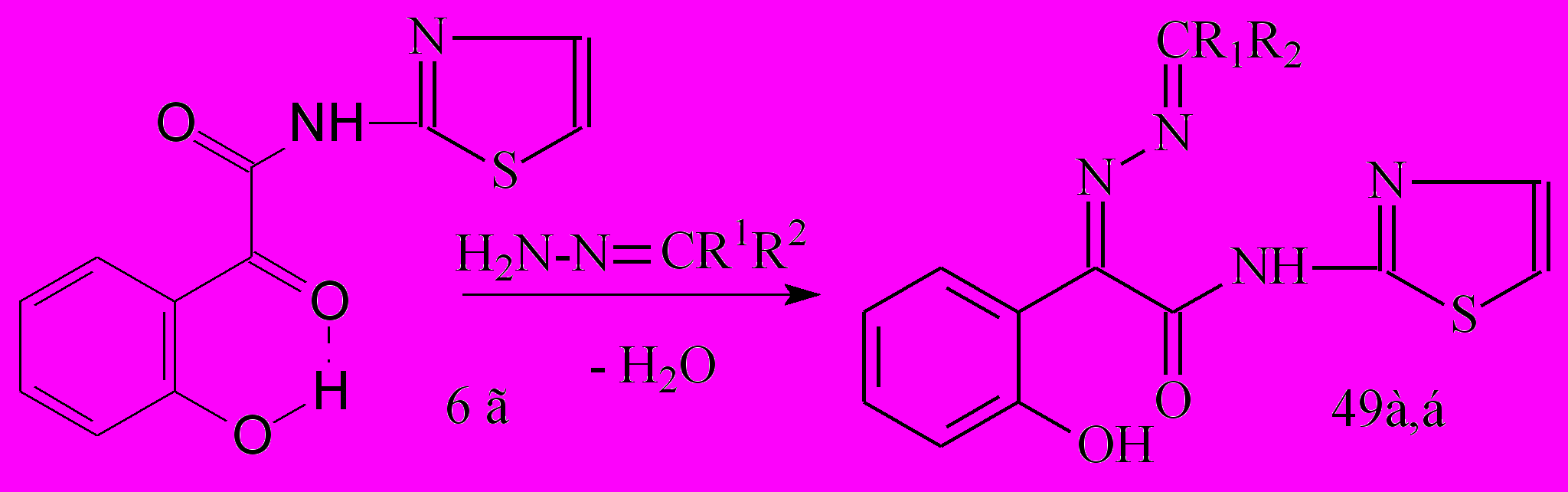
R1=R2=C6H5; CR1R2=C13H8
С целью получения водорастворимых БАВ нами изучена реакция N-гетериламидов о-ГФГК 6а,б,д,ж с натрия карбонатом при эквимолярном соотношении реагентов, в результате чего выделены 2-[2-(N-гетериламино)-2-оксоацетил]феноляты натрия (50а-г). При взаимодействии амидов 6г,е-з с дихлоридами цинка и кадмия при соотношении 2:1 в среде спирта этилового, образуются бис{2-[2-(N-гетериламино)-2-оксоацетил]феноляты} цинка и кадмия (51а-д):
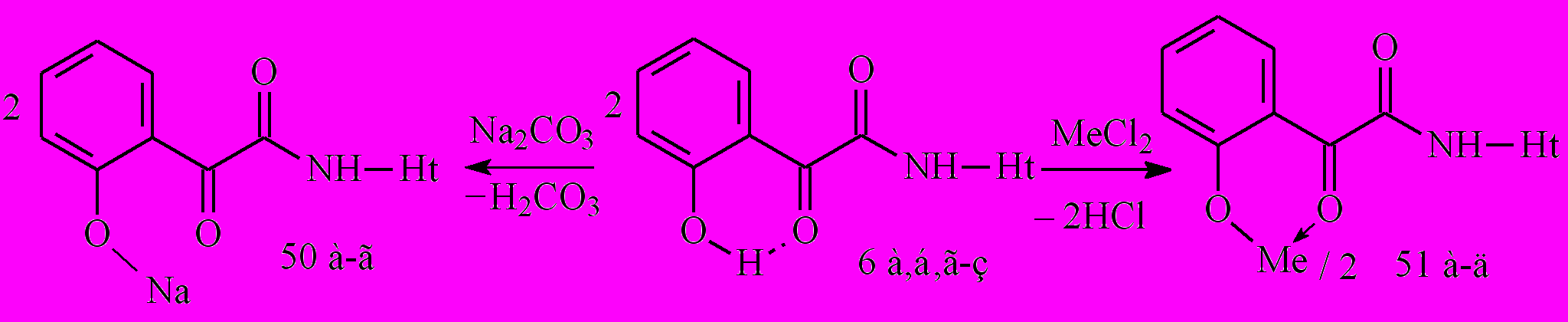
50: Ht=С5Н3BrN, 3-С5Н4N, С2Н1N2S, С4Н5N2S
51: Ме=Zn, Ht=С4Н5N2S; Ме=Сd, Ht=С3Н2NS, С3Н3N2S, С4Н5N2S, С7Н5N2
В спектрах ЯМР1Н полученных соединений отсутствует сигнал протона ОН-группы, что свидетельствует о депротонизации лиганда. Кроме того, в ИК-спектрах соединений 51а-д наблюдается сдвиг полос поглощения группы С2=О и С=С, С=N связей в область низших частот, по сравнению с таковыми исходных амидов 6, вследствие образования более прочной координационной связи, что также согласуется с данными для комплексных соединений 39-41.
3.3. Синтезы на основе N-замещенных 2-метиленгидразоно-2,3-дигидро-3-бензо[b]фуранонов
С целью поиска альтернативных путей синтеза производных N2-замещенных гидразидов α-оксокарбоновых кислот и введения в структуру исходных соединений биологически активных фрагментов нами изучены превращения бензо[b]фуранонов 17 с ароилкетеном, ариламинами, о-фенилендиамином (о-ФДА).
Установлено, что при взаимодействии эквимолярных количеств 3-бензо[b]фуранона 17в с п-метоксибензоилкетеном, генерируемым при термолизе 2,2-диметил-6-(4-метоксифенил)-1,3-диоксин-4-она, образуется 3'-бензоил-метиленамино-6'-(4-метоксифенил)-спиро[бензо[b]фуран-2(3Н),2'-[2H][1,3]-оксазин] -3,4'-(3'Н)-дион (52):
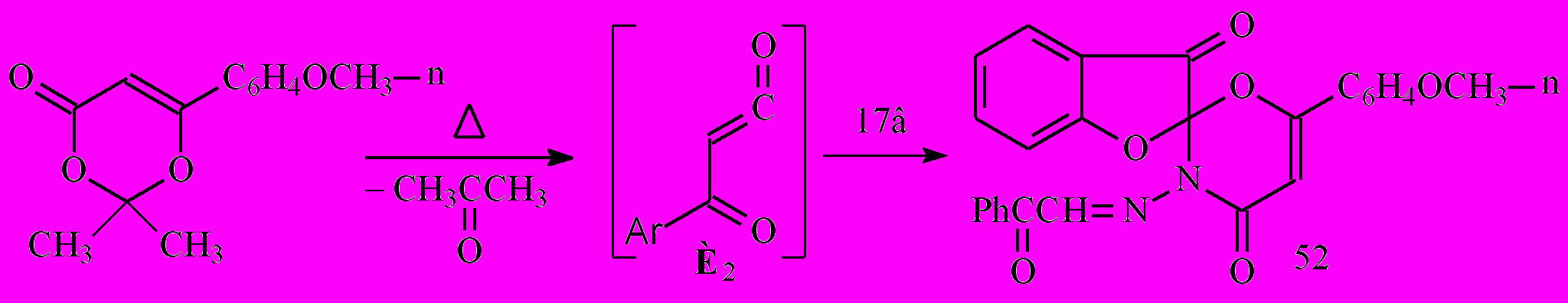
Спектральные характеристики спиросоединения 52 доказывают его структуру и свидетельствуют о протекании [4π+2π] циклоприсоединения ароилкетена по С=N связи исходного фуранона 17в, выступающего в роли диенофила. Продуктов циклоприсоединения по карбонильной группе и СН=N связи боковой цепи не выделено, что свидетельствует о региоселективности протекающего процесса.
Реакция бензо[b]фуранона 17в с анилином в среде четыреххлористого углерода при температуре 20-25°С приводит к образованию 2-[(2-оксо-2-фенил-1-фениламино)этил]гидразоно-2,3-дигидро-3-бензо[b]фуранона (53). Однако, при взаимодействии соединения 17в с п-анизидином в аналогичных условиях, вместо ожидаемого продукта, нами был выделен 2-гидразоно-2,3-дигидро-3-бензо[b]фуранон (54) (метод А). Очевидно, при взаимодействии бензофуранона 17в и амина с более высокой нуклеофильностью, чем образующийся гидразон 54, реакция не останавливается на стадии присоединения амина по активированной СН=N связи исходного соединения, а происходит вытеснение гидразона 54 более нуклеофильным реагентом с образованием продуктов переиминирования. Соединение 54 было также получено при взаимодействии фуранона 17в с о-ФДА (метод Б):
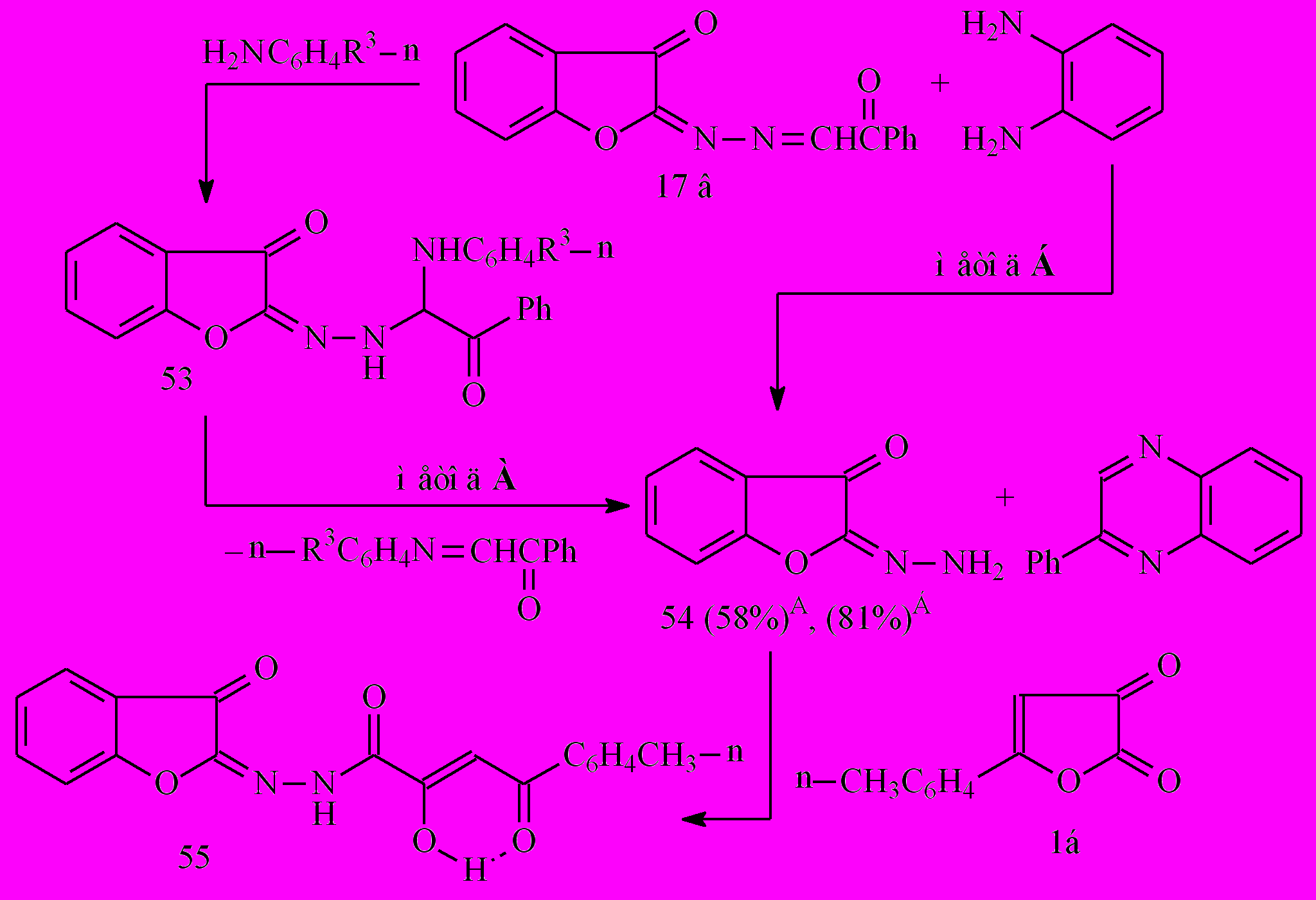
Необходимо отметить, что неустойчивость бензофуранового цикла препятствует получению его 2-гидразонопроизводного прямым взаимодействием с гидразинами, поэтому взаимодействие фуранонов 17 с о-ФДА или n-анизидином является удобным в препаративном отношении методом синтеза незамещенного гидразона 54.
Для подтверждения структуры соединения 54 проведена его реакция с фурандионом 1б с образованием N2-(3-оксобензо[b]фуран-2-илиден)гидразида 2-гидрокси-4-(4-метилфенил)-4-оксо-2-бутеновой кислоты (55). Таким образом, путем ароилацетилирования гидразона 54 можно получать различные представители нового типа N2-замещенных метиленгидразидов АрПК, содержащие сохраненный биологически активный бензо[b]фурановый цикл.
4. Биологическая активность синтезированных соединений
Производные α-оксокарбоновых кислот и продукты их химических превращений были подвергнуты биологическим испытаниям с целью поиска БАВ с противовоспалительной, анальгетической, жаропонижающей, антигипоксической, гипогликемической, антикоагулянтной, гемостатической и противомикробной активностью. Также изучена острая токсичность отдельных представителей в синтезированных рядах соединений. Испытания проводились в ГОУ ВПО ПГФА Росздрава на кафедрах: фармакологии, клинической фармакологии под руководством зав. каф., проф. В.Э. Коллы и зав. каф., проф. В.В. Юшкова, микробиологии под руководством зав. каф., доц. А.Н. Плаксиной и зав. каф., проф. Т.Ф. Одеговой, физиологии с основами анатомии под руководством зав. каф., проф. Б.Я. Сыропятова, а также в лаборатории Пермского НПО «Биомед» и в лаборатории БАВ ЕНИ ПерГУ доц. Махмудовым Р.Р. Автор выражает глубокую благодарность за проведенные исследования.
Результаты биологических испытаний обработаны статистически с определением критерия Стьюдента с помощью статистических программ Windows XP (Excel).
Исследование острой токсичности показало, что изученные соединения в рядах 2, 11-14, 17, 20, 27, 36-43, 51, 53 являются малотоксичными веществами по классификации Сидорова К.К., а производные 6ж, 16а,ф, 18в, 21б, 34е,ж,к,л,с относятся к практически нетоксичным соединениям и имеют значительные преимущества перед известными препаратами сравнения. Обнаружено, что соединения 9а и 20 е являются умеренно токсичными.
4.1. Противовоспалительная активность
Противовоспалительную активность (ПВА) изучали на модели острого воспалительного отека, вызванного субплантарным введением 0,1 мл 1% водного раствора каррагенина белым беспородным крысам обоего пола. О выраженности воспалительной реакции в динамике судили по изменению объема стопы, регистрируемой онкометрически. Исследуемые вещества в дозе 50 мг/кг вводили внутрибрюшинно (в/б) или перорально (п/о) в виде взвеси в 2% крахмальном растворе. Препаратом сравнения служил диклофенак в дозе 10 мг/кг, вводимый аналогично.
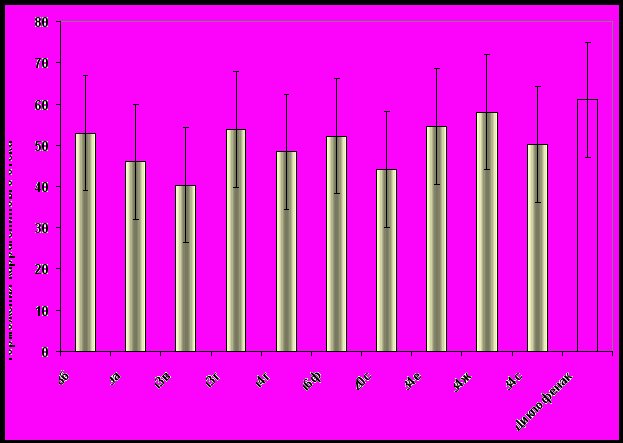
Примечание: по сравнению с контролем **= р<0,01 *** р<0,001
Рис. 1. Сравнительная характеристика наиболее активных соединений и диклофенака, проявивших противовоспалительную активность при внутрибрюшинном введении.
Проведенные исследования показали, что из 60 соединений, вводимых в/б, ПВА оказали 26 веществ, о чем свидетельствует достоверное торможение воспалительного отека на пике воспаления. Среди них 10 соединений тормозили воспалительную реакцию в такой же мере, что и препарат сравнения, однако его значение не превысили. С учетом данных по токсичности, следует выделить 4 активных соединения (пиридазин 16ф, 2-гидразинопроизводные АрПК 34 е,ж,с) (рис. 1).
Изучение ПВА у соединений, вводимых п/о, показало, что более 50 веществ проявили действие с различной степенью выраженности, из них 24 соединения тормозили воспалительный отек у животных во все сроки наблюдения. Сравнительная характеристика 5 наиболее активных изученных веществ (гетериламида 6ж, гидразида 11а, фуранона 12г, 2-гидразинопроизводного 34л и хелата 51б) представлена на рис. 2. Все они значительно превосходили по действию диклофенак на 1 ч. развития воспаления, а на 3 и 5 ч. опыта они действовали в такой же степени, что и препарат сравнения. Однако, с учетом данных по токсичности, более выигрышную позицию здесь занимают соединения 6ж и 34л.
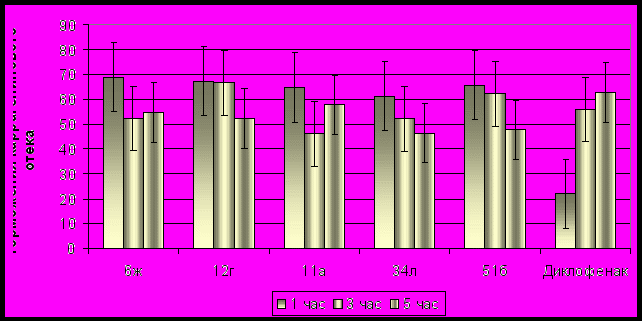
Рис. 2. Сравнительная характеристика наиболее активных соединений и диклофенака, проявивших противовоспалительную активность при пероральном введении.
На рис. 3 дана сравнительная оценка 19 изученных соединений, проявивших ПВА при п/о введении, но уступающих по действию вышеуказанным соединениям.
В целом, полученные данные позволили определить некоторые закономерности структуры веществ с действием в отдельных рядах. Так, в ряду N-[2-(5-R-1,3,4-тиадиазолил)]амидов 2 при увеличении алкильной цепи в 5 положении гетероцикла значительно уменьшается ПВА, вплоть до ее потери. Существенный вклад в изучаемое действие у гетериламидов 2 вносят электронодонорные заместители в ароильном фрагменте. N-Гетериламиды о-ГФГК 6, по сравнению с N-гетериламидами АрПК 2, проявляют более выраженную активность, и в первый 1 ч. воспаления все исследуемые вещества превышают активность диклофенака. У них отмечается прямая зависимость влияния заместителя в 5 положении 1,3,4-тиадиазолила на ПВА, которая увеличивается при увеличении алкильной цепи у соединений 6д-ж, в отличие от аналогичных производных 2ш-ав. Лидирующую позицию занимает гетериламид 6ж, не уступающий на пике воспаления диклофенаку, но в 20 раз менее токсичный. Таким образом, наряду с гетерилом, у производных 6 фармакофором – носителем ПВА является 2-(2-гидроксифенил)-2-оксоэтановый фрагмент.
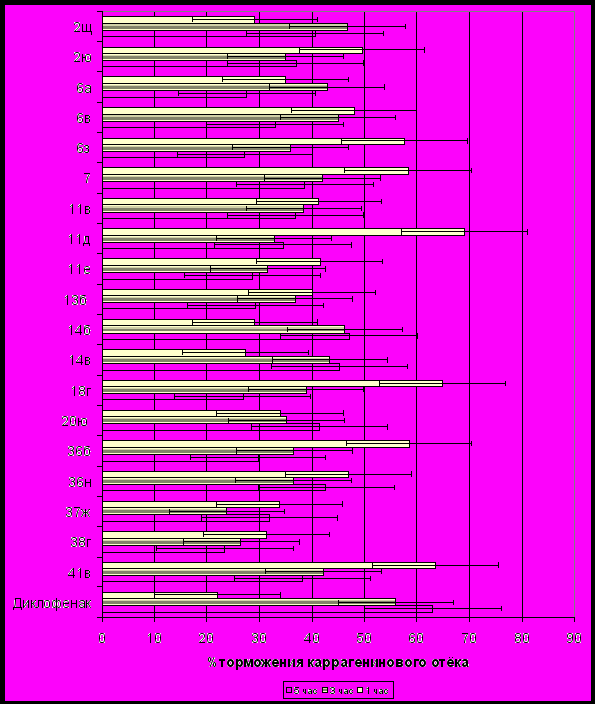
Рис. 3. Сравнительная характеристика противоспалительной активности некоторых изученных соединений и диклофенака при пероральном введении.
В ряду N2-замещенных гидразидов АрПК 11 высокую активность проявили бензоилметиленгидразиды 11а,в и адамантаноилгидразид 11д. Введение гетероциклического заместителя в гидразидный фрагмент у соединений 11з-к не привело к увеличению ПВА. В целом, в ряду гидразидов 11, не зависимо от строения гидразидного фрагмента, установлен наибольший вклад в ПВА электронодонорных заместителей. В то же время, в рядах гидразонов 13 и пиридазинонов 14 выраженность действия ПВА возрастает при введении электроноакцепторных заместителей.
Установлено, что пентантрионы 15 ПВА не обладают, а их модификация в пиридазины 16 приводит к различной активности. Наиболее существенное значение для ПВА оказывают электронодонорные заместители в арильном кольце в положении 6 гетероцикла. Выявлено, что кислотный гидролиз бензофуранона 17д до гидразида 18в приводит к увеличению его ПВА, а введение в молекулу гидразида 18г фуранового фрагмента также способствует флоголитическому действию. Невысокую активность показали бутеноаты 20. Однако, ввиду их низкой токсичности и водорастворимости, поиск БАВ в этом ряду является целесообразным.
В ряду замещенных 2-метиленгидразинопроизводных АрПК 34 обнаружены высокоактивные соединения. Установлено, что наибольшее действие проявляют производные АрПК, а замена кислотного фрагмента на ариламидную или сложноэфирную группы снижают его. В этом ряду наибольший вклад в ПВА вносят 1,2-дифенил-2-оксоэтилиденгидразиновый фрагмент и электронодонорный заместитель в арильном радикале. Введение в положение 2 исходных N-гетериламидов АрПК дифенилметиленгидразинового фрагмента приводит, как правило, к увеличению ПВА соединений 36. Меньшее влияние на этот вид активности оказывает введение флуоренилиденгидразинового заместителя у соединений 37. У соединений 38 отмечено повышение ПВА с увеличением алкильной цепи в положении 5 фрагмента 1,3,4-тиадиазола.
При переходе от N-гетериламидов 2 и 6 к их комплексным соединениям 39-41, 51 происходит усиление активности, при этом, в большей степени, влияет характер металла и строение гетероцикла.
Таким образом, обобщая результаты проведенных испытаний на противовоспалительное действие и с учетом данных по токсичности, наиболее перспективными для дальнейших исследований являются ряды соединений 6, 11, 12, 16, 34.
4.2. Анальгетическая активность
Анальгетическую активность (АА) изучали на белых беспородных мышах на моделях термического («горячая пластинка») и химического раздражения («уксусные корчи»). Исследуемые вещества в дозе 50 мг/кг вводили в/б или п/о в виде взвеси в 2% крахмальном растворе. Препараты сравнения – метамизол натрия (50 мг/кг) и диклофенак (10 мг/кг). Для анализа связи АА со строением скринингу были подвергнуты около 100 соединений.
Изучение АА у 35 соединений из трех рядов при в/б введении показало, что 15 веществ обладают анальгетическим действием, достоверно увеличивая порог болевой чувствительности у животных при термическом воздействии (рис. 4). Выявлено, что среди них пиридазины 16д,с и бутеноаты 20ж,ч не уступают по активности метамизолу натрия, но действуют слабее диклофенака.
При изучении АА некоторых производных α- оксокарбоновых кислот при п/о введении оказалось, что более 30 соединений достоверно проявили обезболивающее действие на модели термического раздражения (рис.5,6). Анализ степени выраженности эффекта показал, что соединения 11б,д,ж; 12а,в,г; 14б,г; 18г, 20я, 34б,г,е,ж,т; 36б,е,о; 37г, 39л, 41в проявили такой же обезболивающий эффект, что и метамизол натрия, но вместе с тем, они уступали диклофенаку. Производное 27а превышает действие метамизола натрия, но также уступает диклофенаку. Соединения 6ж, 11а, 18в, 27б, 36н, 40в проявили такое же действие, что и диклофенак. Производные 34к и 34л по АА превысили действие диклофенака, при этом лидирующую позицию заняло соединение 34л (рис.5).
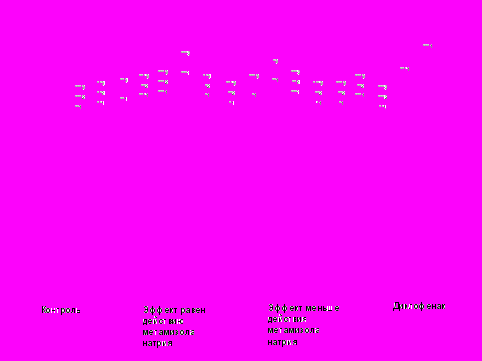
Примечание: * = p < 0,05, ** = p < 0,01, *** = p < 0,001;1 –по сравнению с контролем;
2- по сравнению с метамизолом натрия; 3 – по сравнению с диклофенаком
Рис. 4. Сравнительная характеристика анальгетической активности некоторых изученных соединений по методике «горячая пластинка» при внутрибрюшинном введении.
При изучении связи действия со строением в ряду амидов 2 установлено, что, как и в случае с ПВА, у N-[2-(5-R-1,3,4-тиадиазолил)] амидов 2 АА уменьшается с увеличением алкильной цепи в 5 положении гетероцикла. Среди N-гетериламидов о-ГФГК 6 наибольшей активностью также обладает соединение 6ж. В ряду гидразидов АрПК 11 наиболее активны, как и при изучении ПВА, бензоилметиленгидразид 11а и адамантаноилгидразид 11д (рис. 5, 6). В ряду фуранонов 12 лидирует соединение 12г, содержащее электроноакцепторный заместитель. В ряду пиридазинонов 14 введение электронодонорных заместителей незначительно увеличивают действие веществ. Среди пиридазинов 16 наибольшая АА отмечается у соединения 16с, содержащего в ароматическом кольце в положении 6 гетероцикла атом брома, а также у 16д, не имеющего заместителя. В ряду бутеноатов 20 наибольшую активность на уровне митамизола натрия проявили соединения с 3-, 4-пиридильным и 5-меркапто-1,3,4-тиадиазолильным заместителем.
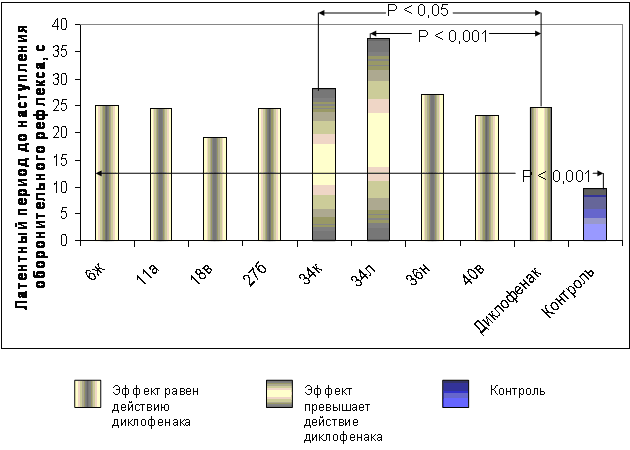
Рис. 5. Сравнительная характеристика анальгетической активности некоторых изученных соединений и диклофенака по методике «горячая пластинка» при пероральном введении.
Выявлено, что имидазо[2,1-b]тиазолы 27а,б проявляют выраженную АА, однако более активно производное 27б с электроноакцепторным заместителем. В ряду производных АрПК 34 соединение 34л значительно активнее диклофенака, но при этом оно в 20 раз менее токсично, чем препарат сравнения и также обладает высокой ПВА. Введение во второе положение исходных амидов 2 дифенилметиленгидразинового фрагмента, а также наличие электронодонорных заместителей в арильном радикале приводит к увеличению АА. Среди комплексных соединений 39-41 наиболее активен цинковый хелат 40в (рис. 5, 6).
Исследование АА на модели «уксусные корчи» показало, что из 7 изученных веществ производные 9а, 13в, 14а и 14г тормозили их развитие на уровне метамизола натрия, о чем свидетельствуют достоверные отличия в количестве корчей опытных и контрольных мышей. Установлено, что введение электронодонорных заместителей в структуру производных 13, 14 увеличивает их активность.
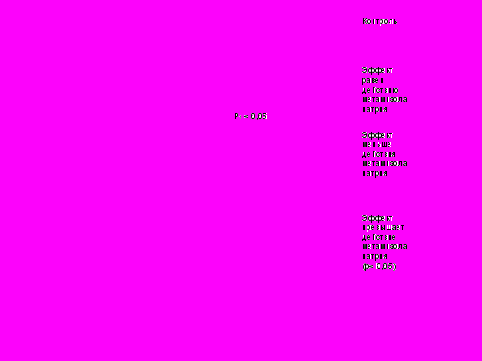 Примечание: 1 – по сравнению с контролем
Примечание: 1 – по сравнению с контролемРис. 6. Сравнительная характеристика анальгетической активности некоторых изученных соединений и метамизола натрия по методике «горячая пластинка» при пероральном введении.
Таким образом, поиск БАВ с анальгетическим действием целесообразно продолжить в рядах соединений 6, 11, 18, 27, 34, 36, 40, а соединения 6ж и 34л требуют дальнейшего изучения, поскольку они обладают также и высокой ПВА.
- Жаропонижающая активность
Жаропонижающее действие было изучено у соединений 6ж, 34к,л, показавших высокую ПВА и АА, а также бутеноатов 20ю,аг. Лихорадочную реакцию у белых беспородных крыс вызывали внутривенным введением пирогенала. Изменение температуры тела животных регистрировали ректально. Активность веществ оценивали по уменьшению гипотермии через 1 и 2 ч. после введения пирогенала. Изучаемые соединения в дозе 50 мг/кг вводили п/о в виде взвеси в 2% крахмальном растворе. Препарат сравнения – диклофенак в дозе 10 мг/кг.
Выявлено, что производные 20ю и 34к не проявили достоверного эффекта в исследуемой дозе. Соединения 6ж, 20аг и 34л во все сроки наблюдения оказали жаропонижающую активность, при этом гетериламид 6ж тормозил лихорадочную реакцию у животных на уровне диклофенака.
В целом, проведенные исследования показали, что соединения 6ж и 34л по выраженности и направленности эффектов относятся к потенциальным НПВС, при этом они превосходят препараты сравнения (табл. 1).
Таблица 1
Сравнительная характеристика наиболее перспективных соединений 6ж и 34л
| Соеди-нение | ЛД50, в/б | Доза от ЛД50 | Противово-спалительная активность | Анальгетическая активность | Жаропонижающая активность | |
| 1ч | 2ч | |||||
| 6ж | 1500 | 0,03 | 52,4±3,8***1 | 25,0±1,7***1*2 | 1,7***1 | 1,7***1 |
| 34л | 1500 | 0,03 | 52,0±2,5***1 **2 | 37,5±1,4***1 ***2***3 | 0,7***1 | 0,9***1 |
| дикло-фенак | 74 | 0,14 | 56,0±7,3***1 | 24,7±0,4***1 | 1,7***1 | 2,0***1 |
| мета- мизол натрия | 350 | 0,14 | | 19,4±0,8***1 | | |
Примечание: = p < 0,05, ** = p< 0,01, *** = p < 0,001
1− по сравнению с контролем; 2 –по сравнению метамизолом натрия; 3 - по сравнению с диклофенаком.
