Синтез, свойства, биологическая активность n-гетериламидов α-оксокислот и продуктов их химических превращений 15. 00. 02 фармацевтическая химия, фармакогнозия
| Вид материала | Автореферат диссертации |
- Синтез соединений на основе химических превращений производных α- оксокарбоновых кислот, 643.93kb.
- Синтез, свойства и биологическая активность енаминоамидов ацилпировиноградных кислот, 439.81kb.
- Синтез, свойства и биологическая активность продуктов взаимодействия 1,2,4-триазолов, 669.98kb.
- Синтез, химические свойства и биологическая активность 1,4-дизамещенных 5-арил-3-гидрокси-3-пирролин-2-онов, 667.95kb.
- Синтез и биологическая активность карбо- и гетероциклов на основе тетрацианоэтилена, 673.64kb.
- Синтез, свойства и биологическая активность производных 2-хлорникотинонитрилов, 264.36kb.
- Синтез и свойства новых производных 2 (1,2,4 триазолил 5 тио)уксусных кислот 15. 00., 240.9kb.
- Примерная программа рекомендуется для направления подготовки (специальности) 111801, 717.4kb.
- Программа курса «Аналитическая химия» специальность «Фармация», 92.69kb.
- Тематический план лекций по дисциплине «Фармацевтическая химия», 32.57kb.
На правах рукописи
МОКИН Павел Александрович
Синтез, свойства, биологическая активность N-гетериламидов α-оксокислот и продуктов их химических превращений
15.00.02 – фармацевтическая химия, фармакогнозия
Автореферат
диссертации на соискание ученой степени
кандидата фармацевтических наук
Пермь – 2007
Работа выполнена на кафедре фармацевтической технологии ГОУ ВПО «Пермская государственная фармацевтическая академия Федерального агентства по здравоохранению и социальному развитию»
Научный руководитель: кандидат химических наук, доцент
Пулина Наталья Алексеевна
Официальные оппоненты: доктор фармацевтических наук,
профессор Коркодинова Любовь Михайловна
ГОУ ВПО ПГФА Росздрава
кандидат химических наук,
доцент Пименова Елена Валентиновна
ГОУ ВПО «Пермский государственный университет»
Ведущая организация:
ГОУ ВПО «Пятигорская государственная фармацевтическая академия Федерального агентства по здравоохранению и социальному развитию»
Защита состоится «15» января 2008 г. _____ на заседании диссертационного совета Д 208.068.01 при Пермской государственной фармацевтической академии по адресу: 614990, г. Пермь, ГСП-277, ул. Ленина, 48.
С диссертацией можно ознакомиться в библиотеке Пермской государственной фармацевтической академии.
Автореферат разослан «_____» декабря 2007 г.

Ученый секретарь Е.В. Метелева
диссертационного совета,
кандидат фармацевтических наук, доцент
Общая характеристика работы
Актуальность темы. Общеизвестно, что одной из важных задач фармацевтической науки является синтез и поиск новых высокоэффективных химических соединений, обладающих низкой токсичностью, превосходящих по силе действия применяемые медицинские препараты. Научные исследования, традиционно проводимые в Пермской государственной фармацевтической академии, показывают, что соединения, полученные на основе превращений ацилпировиноградных кислот, обладают выраженным фармакологическим действием, зачастую, с сочетанием нескольких видов активности. Ранее был разработан простой препаративный метод синтеза амидов 4-арил-2-гидрокси-4-оксо-2-бутеновых (ароилпировиноградных) кислот (АрПК) на основе взаимодействия 5-арил-2,3-дигидрофуран-2,3-дионов (5-АФД) и соответствующих аминов ациклического и гетероциклического строения. В этом ряду наименее изучены N-гетериламиды АрПК, которые представляют практический интерес, благодаря наличию в своей структуре нескольких реакционных центров 1,3-дикетонного и гетероциклического фрагментов. Введение в молекулу исходных соединений потенциально биологически активных гетероциклических синтонов позволяет в определенной степени прогнозировать фармакологическое действие новых химических веществ. Интересным объектом для сравнительного изучения химического поведения гетероциклических аминов с 2,3-диоксогетероциклами является 2,3-дигидробензо[b]фуран-2,3-дион (кумарандион - КД). Образованные на его основе N-гетериламиды 2-(2-гидроксифенил)-2-оксоэтановой (о-гидроксифенилглиоксалевой) кислоты (о-ГФГК) могут обладать значительными синтетическими возможностями для получения биологически активных соединений различного строения, в том числе, растворимых в воде.
Среди важных в препаративном отношении реакций N-гетериламидов АрПК, имеющих теоретическое и практическое значение, особое место занимают их нуклеофильные превращения, при этом взаимодействие с гидразонами кетонов и замещенными гидразинами ранее не изучено. В настоящее время значительно повысился интерес к химической модификации биологически активных веществ путем комплексообразования с эсенциальными металлами. Это позволяет усиливать терапевтическое действие лигандов, выходить на новые виды биологической активности и, в ряде случаев, снижать их токсичность. Реакции N-гетериламидов АрПК и о-ГФГК с солями одно- и двухвалентных металлов ранее также не исследованы. В связи с этим, изучение синтеза, химических свойств N-гетериламидов α-оксокислот, а также поиск биологически активных соединений среди продуктов химических превращений является актуальным.
Цель работы. Целью данного исследования является синтез новых биологически активных соединений в ряду N-гетериламидов α-оксокислот и на основе их взаимодействия с нуклеофильными реагентами и солями одно-, двухвалентных металлов.
Задачи исследования. Для достижения поставленной цели необходимо решить следующие задачи:
Осуществить синтез N-гетериламидов α-оксокислот, содержащих в своем составе гетроциклический фрагмент с одним, двумя или тремя гетероатомами.
- Провести сравнительное изучение химического поведения N-гетериламидов 4-арил-2-гидрокси-4-оксо-2-бутеновых кислот и 2-(2-гидроксифенил)-2-оксоэтановой кислоты в реакциях комплексообразования с дихлоридами меди, цинка, кадмия, ртути.
- Получить водорастворимые соединения на основе реакции α-оксокислот с N-гетероциклическими аминами, а также взаимодействия N-гетериламидов 2-(2-гидроксифенил)-2-оксоэтановой кислоты с натрия карбонатом.
- Изучить взаимодействие N-гетериламидов 4-арил-2-гидрокси-4-оксо-2-бутеновых кислот с гидразонами бензофенона и 9-флуоренона, этиловым эфиром гидразинэтановой кислоты.
- Изучить физико-химические свойства и особенности строения неописанных ранее продуктов синтеза.
- На основании полученных результатов фармакологического скрининга синтезированных соединений выявить вещества, обладающие высокой противомикробной, противовоспалительной и анальгетической активностью, а также изучить взаимосвязь их строения с биологическим действием.
Научная новизна. Установлено, что 2-амино-5-R-1,3,4-тиадиазолы и 2-аминобензимидазол раскрывают цикл 5-АФД с образованием N-гетериламидов АрПК, находящихся в растворе в виде таутомерных кетоенольной и β-дикетонной форм. Показано, что направление реакции не меняется при взаимодействии N-гетероциклических аминов с КД, в результате чего выделены N-гетериламиды 2-(2-гидроксифенил)-2-оксоэтановой кислоты. Установлено, что при взаимодействии 2-(2-гидроксифенил)-2-оксоэтановой с гетериламинами образуются 2-(2-гидроксифенил)-2-оксоэтаноаты гетериламмония. Впервые осуществлен синтез комплексных соединений на основе N-гетериламидов АрПК с дихлоридами меди, цинка, кадмия, ртути и установлено, что исходные реагенты координируются металлами как бидентатные О-О лиганды. Установлено аналогичное химическое поведение N-гетериламидов о-ГФГК в реакциях с дихлоридами цинка и кадмия, а также получены водорастворимые 2-[2-(N-гетериламино)-2-оксоацетил]феноляты натрия. Изучены реакции N-гетериламидов АрПК с гидразонами бензофенона и 9-флуоренона и обнаружено наличие трех таутомерных форм в растворах полученных соединений. Установлено, что при взаимодействии N-гетериламидов АрПК с этиловым эфиром гидразинэтановой кислоты образуются соответствующие производные 3-арил-2-этоксикарбонилметил-2,3-дигидропиразол-5-карбоновых кислот, которые, в случае N-[2-(5-R-1,3,4-тиадиазолил)]амидов, существуют в растворах в виде двух таутомерных форм. По результатам биологических исследований комплексных соединений поданы две заявки на выдачу патента РФ на изобретения (регистрационный № 2006144010 от 11.12.2006 и № 2007128301 от 23.07.2007).
Практическая значимость. Усовершенствованы или предложены новые методы синтеза N-гетериламидов 4-арил-2-гидрокси-4-оксо-2-бутеновых кислот, N-гетериламидов 2-(2-гидроксифенил)-2-оксоэтановой кислоты, 4-арил-2-гидрокси-4-оксо-2-бутеноатов гетериламмония, 2-(2-гидроксифениламино)-2-оксоэтаноатов гетериламмония, бис[3-арил-1-(N-гетерил)карбоксамидо-1,3-пропандионато] меди, цинка, кадмия, ртути, 2-[2-(N-гетериламино)-2-оксоацетил]фенолятов натрия, бис{2-[2-(N-гетериламино)-2-оксоацетил]фенолятов} цинка и кадмия, N-гетериламидов 4-арил-2-дифенилметиленгидразино-4-оксо-2-бутеновых кислот, N-гетериламидов 4-арил-4-оксо-2-флуоренилиденгидразино-2-бутеновых кислот, N-гетериламидов 3-арил-2-этоксикарбонилметил-2,3-дигидропиразол-5-карбоновых кислот, которые просты по выполнению и могут быть использованы как препаративные при синтезе новых биологически активных соединений.
В процессе работы синтезировано 119 неописанных в литературе соединений. Установлены некоторые закономерности биологической активности от химического строения, которые могут быть использованы в дальнейшем поиске БАВ в ряду производных N-гетериламидов α-оксокислот.
Публикации. Материалы диссертационной работы отражены в 17 работах: 2 статьях в центральной печати, 5 статьях в сборниках и материалах научных конференций различного уровня и 10 тезисов докладов научных конференций.
Апробация работы. Результаты работы доложены на 70-й юбилейной итоговой Республиканской научной конференции студентов и молодых ученых «Вопросы теоретической и практической медицины» (Уфа, 2005), на VI, VII Международных научно-практических конференциях «Здоровье и образование в XXI веке» (Москва, 2005, 2006), на Международной научно-практической конференции «Фармация и здоровье» (Пермь, 2005), на Международной конференции «Приоритеты фармацевтической науки и практики» (Москва, 2006), на 61,62 Региональных конференциях по фармации и фармакологии (Пятигорск, 2006, 2007), на научной Юбилейной конференции «Актуальные вопросы современной фармации и фармацевтического образования» (Уфа, 2006), на VII конгрессе молодых ученых и специалистов «Науки о человеке» (Томск, 2006), на научно-практической конференции «Новая технологическая платформа биомедицинских исследований (биология, здравоохранение, медицина)» (Ростов-на-Дону, 2006), на Российско-Китайской интернациональной научной конференции по фармакологии «Фундаментальная фармакология и фармация - клинической практике» (Пермь, 2006), на XIV Российском национальном конгрессе «Человек и лекарство» (Москва, 2007), на 3-й Всероссийской научно-методической конференции «Пути и формы совершенствования фармацевтического образования. Создание новых физиологически активных веществ» (Воронеж, 2007).
Связь задач исследования с проблемным планом фармацевтических наук. Диссертационная работа выполнена в соответствии с планом научно-исследовательских работ ГОУ ВПО «Пермская государственная фармацевтическая академия Росздрава» (№ государственной регистрации 01.9.50 007419)
Объем и структура диссертации. Диссертационная работа общим объемомстраниц машинописного текста состоит из введения, литературного обзора по синтезу, строению, свойствам и биологической активности N-гетериламидов ацилпировиноградных кислот (глава 1), обсуждения собственных исследований (глава 2), экспериментальной химической части (глава 3), изучения результатов биологической активности N-гетериламидов α-оксокислот и продуктов их превращений (глава 4), выводов, литературы, приложения. Список литературы включает 160 работ отечественных и зарубежных авторов. Диссертация содержит 28 таблиц.
На защиту выносятся:
- Результаты синтеза новых N-гетериламидов α-оксокислот и их производных на основе взаимодействия с солями с одно-, двухвалентных металлов, гидразонами бензофенона и 9-флуоренона, этиловым эфиром гидразинэтановой кислоты.
- Установление структуры полученных соединений на основании данных спектров ЯМР1Н-, ИК-, и масс-спектроскопии.
- Изучение взаимосвязи строения и фармакологической активности синтезированных соединений, а также выявление перспективных веществ для дальнейших биологических испытаний.
Основное содержание работы
1. Синтез и строение N-гетериламидов α-оксокислот
1.1 Синтез и строение N-гетериламидов 4-арил-2-гидрокси-4-оксо-2-бутеновых кислот
Для получения исходных соединений нами была использована известная реакция 5-АФД 1а-г с гетероциклическими аминами в среде инертного растворителя при эквимолярном соотношении реагентов, при комнатной температуре. В качестве гетериламинов при получении новых соединений были взяты: 2-амино-1,3,4-тиадиазол, 2-амино-5-метил-1,3,4-тиадиазол, 2-амино-5-этил-1,3,4-тиадиазол, 2-аминобензимидазол. В результате реакции выделены N-гетериламиды 4-арил-2-гидрокси-4-оксо-2-бутеновых кислот (метод А) (2а-ч):
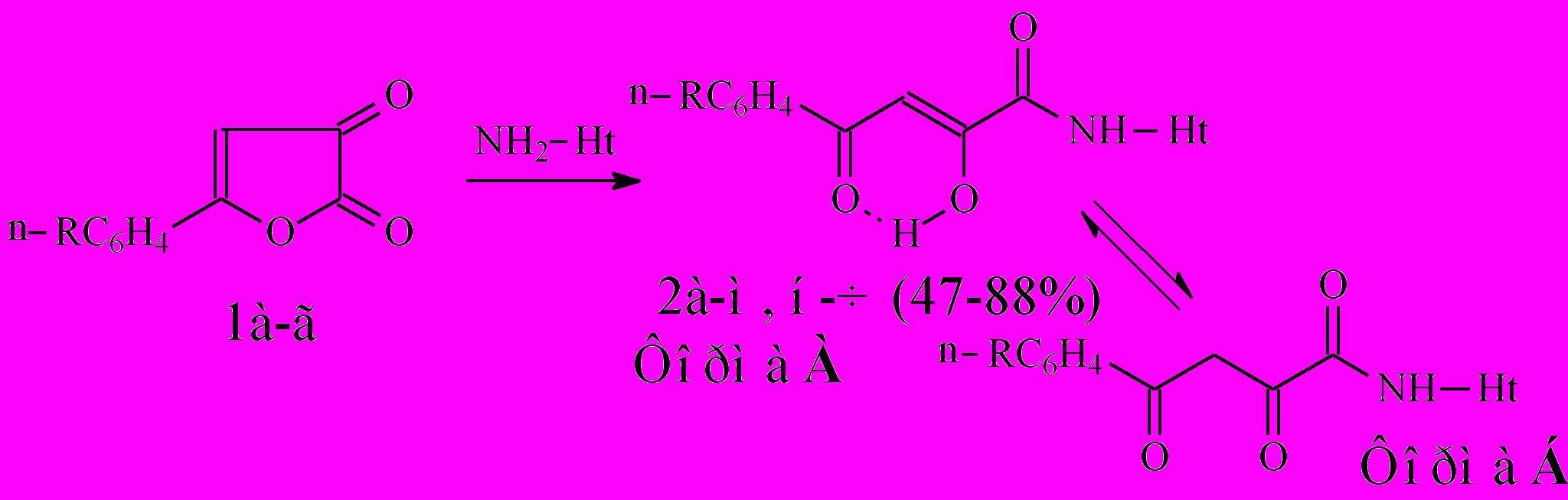
1: R=Н (а), СН3 (б), Cl (в), Br (г);
2: Ht=2-С5Н4N, R=Н (а), Cl (б), Br (в); Ht=3-С5Н4N, R=Н (г), Cl (д); Ht=2-С5Н3BrN, R=Н (е), Cl (ж); Ht=С3Н2NS, R=Н (з), Cl (и), Br (к); Ht=С11Н11N2О, R=Н (л), Cl (м); Ht=С2Н1N2S, R=Н (н), Cl (о), CН3 (п); Ht=С3Н3N2S, R=Н (р), Cl (с), CН3 (т); Ht=С4Н5N2S, R=Н (у), Cl (ф), CН3 (х); Ht=С7Н5N2, R=Н (ц), Cl (ч).
Где: Ht=2-С5Н4N (2-пиридил), С5Н3BrN [2-(5-бромпиридил)], 3-С5Н4N (3-пиридил), С3Н2NS (2-тиазолил), С2Н1N2S [2-(1,3,4-тиадиазолил)], С3Н3N2S [2-(5-метил-1,3,4-тиадиазолил)], С4Н5N2S [2-(5-этил-1,3,4-тиадиазолил)], С7Н5N2 (2-бензимидазолил), С11Н11N2О [4-(2,3-диметил-5-оксо-1-фенил-3-пиразолин)].
Соединения 2н-ч были синтезированы нами впервые. По данным спектров ЯМР1Н гетериламиды 2ф-ч в растворе ДМСО-d6 енолизованы нацело и содержат 100% кетоенольной формы А, в то время как гетериламиды 2н-у содержат еще 8-11% β-дикетонной формы Б.
N-[2-(5-R-1,3,4-Тиадиазолил)]амиды 2р,у получены нами также в результате реакции метилового эфира АрПК 3 с соответствующими гетероциклическими аминами (метод Б):

R=Me (р), Et (у).
Вещества, синтезированные двумя методами, были идентичны по физико-химическим и спектральным характеристикам, значению Rf при ТСХ. Однако выход соединений 2р,у значительно ниже, чем в методе А, что связано, по видимому, с конкурентной реакцией образования продуктов по группе С2=О эфира 3. Таким образом, данный способ уступает классическому способу раскрытия 5-АФД аминами и в дальнейшем для синтеза целевых N-гетериламидов АрПК нами не использовался.
1.2 Синтез и строение N-гетериламидов 2-(2-гидроксифенил)-2-оксоэтановой кислоты
Известно, что циклическим аналогом 2-(2-гидроксифенил)-2-оксоэтановой (о-гидроксифенилглиоксалевой) кислоты (о-ГФГК) 4 является кумарандион 5. В продолжение изучения химического поведения 2,3-диоксогетероциклов в реакции с гетериламинами, нами исследовано взаимодействие КД 5 с гетероциклическими аминами различного строения в условиях, аналогичных образованию соединений 2, в результате чего выделены соответствующие N-гетериламиды 2-(2-гидроксифенил)-2-оксоэтановой кислоты (6а-з):
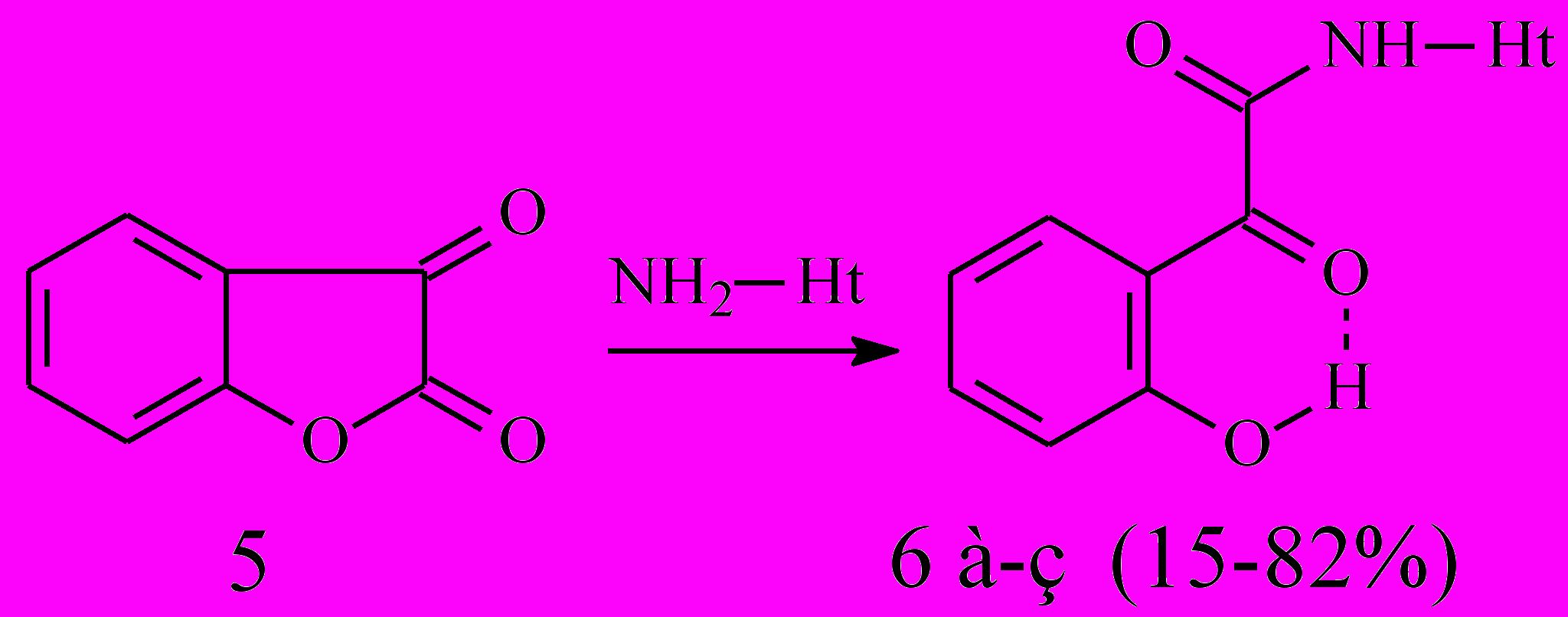
6: Ht=С5Н3BrN (а), 3-С5Н4N (б), 4-С5Н4N (в), С3Н2NS (г), С2Н1N2S (д), С3Н3N2S (е), С4Н5N2S (ж), С7Н5N2 (з).
Спектральные характеристики соединений 6а-з свидетельствует об их существовании в форме с ВВС Н-хелатного типа. По-видимому, образование соединений 6а-з происходит в результате нуклеофильной атаки аминогруппы исходного гетериламина на наиболее электроотрицательный атом углерода С2 кумарандиона с последующим раскрытием лактонного кольца до производного о-ГФГК.
2. Взаимодействие α-оксокислот с гетероциклическими аминами
2.1 Синтез и строение 4-арил-2-гидрокси-4-оксо-2-бутеноатов гетериламмония
Ранее было показано, что при синтезе гетериламидов АрПК на основе 5-АФД, в зависимости от строения гетероцикла и присутствия воды в реакционной смеси, в качестве сопутствующих соединений образуются соли АрПК. С целью получения биологически активных водорастворимых соединений нами изучено прямое взаимодействие АрПК 7а-в с 2-амино-5-R-1,3,4-тиадиазолами и 2-аминобензимидазолом, в результате чего выделены 4-арил-2-гидрокси-4-оксо-2-бутеноаты гетериламмония (8а-о) (метод А):
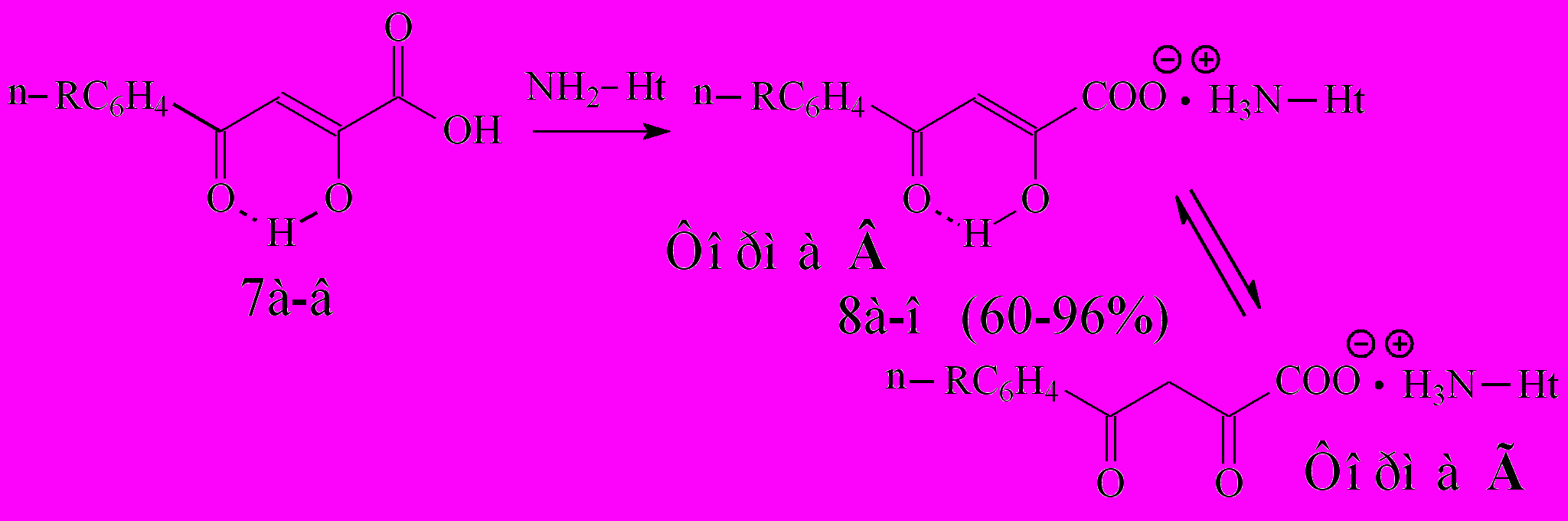
8: Ht=C2H1N2S, R=Н (а), Cl (б), CH3 (в); Ht=C3H3N2S, R=H (г), Cl (д), CH3 (е); Ht=C4H5N2S, R=H (ж), Cl (з), CH3 (и); Ht=С2Н1N2S2, R=H (к), Cl (л); Ht=C7H5N2, R=H (м), Cl (н),CH3 (о).
В процессе синтеза бутеноатов 8а-о установлено, что выход соединений зависит от последовательности добавления реагентов. Так, прибавление суспензии амина к суспензии АрПК в хлороформе при интенсивном перемешивании приводит к значительному повышению выхода продукта и не требует нагревания реакционной среды, как предлагалось ранее.
Как и у гетериламидов 2н-у, во всех спектрах ЯМР1Н солей 8а-и,м-о присутствует синглет протонов метиленовой группы слабой интенсивности, что свидетельствует о их существовании в растворе ДМСО-d6 в виде таутомерных форм В и Г с преобладанием кетоенольной формы В (92-96%). В тоже время, в спектрах ЯМР1Н соединений 8к,л, помимо сигналов протонов в ожидаемых областях, наблюдается уширенный синглет протона NH группы в слабом поле и отсутствует сигнал протона SH-группы, что свидетельствует об их существовании в формах Ж и З, имеющей ВВС Н-хелатного типа, и противоречит возможным формам Д, Е:

При сплавлении сухой смеси кислоты 7а и гетериламинов в соотношении 1:1, наряду с продуктами неустановленной структуры, с выходами 16-24% были выделены соли 8а,г,ж (метод Б). Следует отметить, что по данным ТСХ в реакционной смеси также присутствуют соответствующие N-гетериламиды АрПК 2.
2.2 Синтез и строение 2-(2-гидроксифенил)-2-оксоэтаноатов гетериламмония
В продолжение изучения химического поведения гетероциклических аминов в реакциях с α-оксокислотами и с целью синтеза БАВ нами исследовано взаимодействие о-ГФГК 4 с 2-, 4-аминопиридинами, 2-аминотиазолом и 2-амино-5-R-1,3,4-тиадиазолом, в результате чего выделены соответствующие 2-(2-гидроксифенил)-2-оксоэтаноаты гетериламмония (9а-д):

9: Ht=2-С5Н4N (а),4-С5Н4N (б),С3Н2NS (в),С2Н1N2S (г),С3Н3N2S (д).
В виду значительного осмоления реакционной смеси нам не удалось выделить соответствующие соли на основе 2-амино-5-бромпиридина и 2-амино-5-этил-1,3,4-тиадиазола. При плавлении солей 9б,в, и выдерживании их при температуре плавления не более 10 минут, по данным ТСХ образуются соответствующие N-гетериламиды 6в,г.
3 Получение металлорганических комплексных соединений на основе N-гетериламидов α-оксокислот
Комплексные соединения широко представлены в биологических системах и также применяются в качестве лекарственных препаратов. Однако реакции N-гетериламидов АрПК и о-ГФГК с солями металлов ранее не изучены.
3.1 Синтез и строение бис[3-арил-1-(N-гетерил)карбоксамидо-1,3-пропандионато] меди, цинка, кадмия и ртути
Нами установлено, что N-гетериламиды 2а-д,ж-л,р,у-х взаимодействуют с дихлоридами меди, цинка, кадмия, ртути в соотношении лиганд-металл 2:1 в мягких условиях, в среде спирта этилового с образованием бис[3-арил-1-(N-гетерил)карбоксамидо-1,3-пропандионато] меди (10а-м), цинка (11а-з), кадмия (12а-л) и ртути (13а-г):

10: Me=Сu, Ht=2-С5Н4N, R=H, (а), Br (б); Ht=С5Н3BrN, R=H (в); Ht=3-С5Н4N, R=Н (г), Ht=С3Н2NS, R=Н (д), Br (е); Ht=С3Н3N2S, R=Н (ж), Сl (з); Ht=С4Н5N2S, R=Н (и), Сl (к), СН3 (л); Ht=С11Н11N2О, R=Н (м).
11: Ме=Zn, Ht=2-С5Н4N, R=H, (а), Сl (б); Ht=С5Н3BrN, R=Cl (в); Ht=3-С5Н4N, R=Н (г), Cl (д); Ht=С3Н2NS, R=Н (е), Cl (ж); Ht=С3Н3N2S, R=Н (з).
12: Ме=Сd, Ht=2-С5Н4N, R=H, (а), Сl (б); Ht=3-С5Н4N, R=Н (в), Cl (г); Ht=С3Н2NS, R=Н (д), Сl (е); Ht=С3Н3N2S, R=Н (ж); Ht=С4Н5N2S, R=Н (з), Сl (и), СН3 (к); Ht=С7Н5N2, R=Н (л).
13: Ме=Нg, Ht=2-С5Н4N, Сl (а); Ht=3-С5Н4N, R=Н (б), Cl (в); Ht=С3Н2NS, R=Н (г).
На наш взгляд, для соединений 10-13 наиболее вероятными структурами продуктов реакции являются И, К, Л.
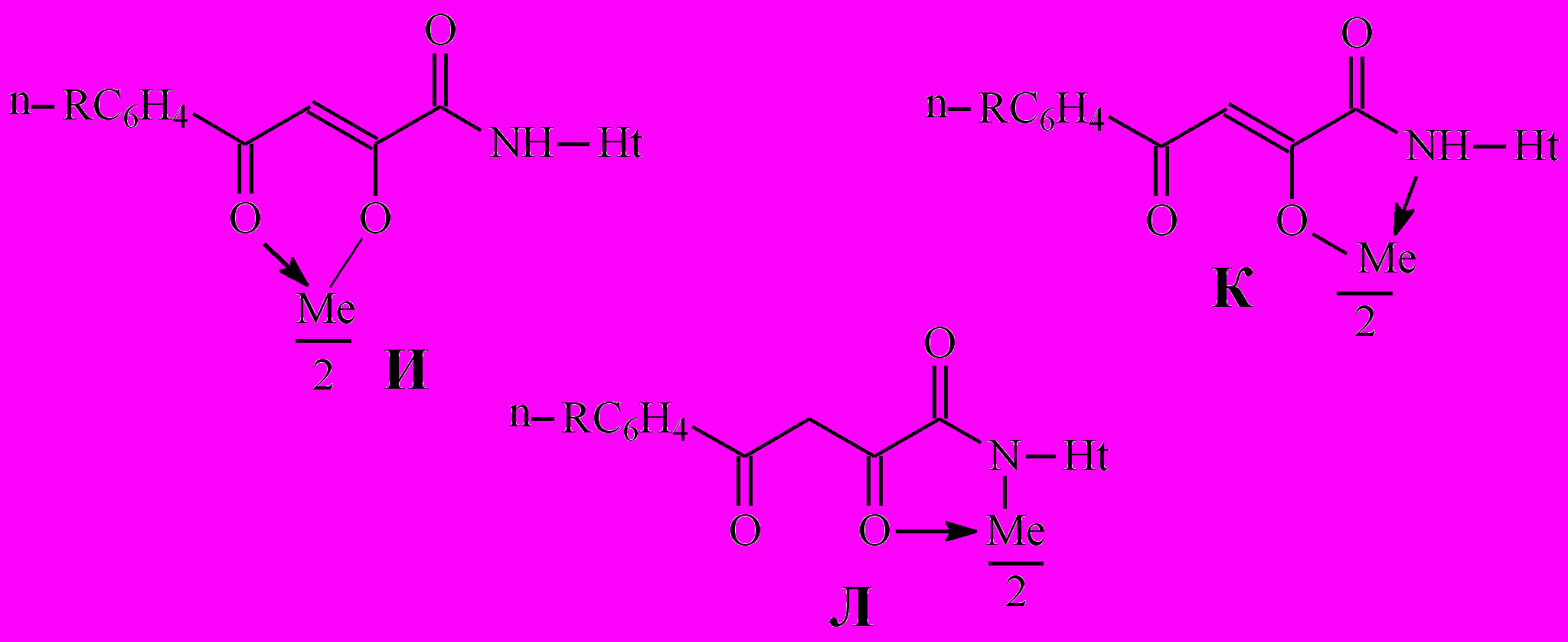
В пользу структуры И свидетельствует наличие полос поглощения NH-групп в ИК спектрах соединений 10-13, а также наличие сигнала протонов NH-групп в спектрах ЯМР1Н. В случае структуры Л данные сигналы должны отсутствовать. Кроме того, установлено, что в ИК спектрах комплексных соединений 10-13 полоса поглощения карбонильных групп С4=О смещена в область низших частот на 10-15 см-1, по сравнению с исходными N-гетериламидами 2, что свидетельствует об участии этих групп в образовании более прочной координационной связи. Для структуры К и Л следовало ожидать наличие в ИК спектре хелатов высокочастотной полосы поглощения данного кетонного карбонила. Таким образом, согласно спектральным данным, N-гетериламиды 2 в реакции комплексообразования координируются металлами как бидентатные О-О лиганды и образуют с ними продукты со структурой И.
