Синтез, свойства, биологическая активность n-гетериламидов α-оксокислот и продуктов их химических превращений 15. 00. 02 фармацевтическая химия, фармакогнозия
| Вид материала | Автореферат диссертации |
- Синтез соединений на основе химических превращений производных α- оксокарбоновых кислот, 643.93kb.
- Синтез, свойства и биологическая активность енаминоамидов ацилпировиноградных кислот, 439.81kb.
- Синтез, свойства и биологическая активность продуктов взаимодействия 1,2,4-триазолов, 669.98kb.
- Синтез, химические свойства и биологическая активность 1,4-дизамещенных 5-арил-3-гидрокси-3-пирролин-2-онов, 667.95kb.
- Синтез и биологическая активность карбо- и гетероциклов на основе тетрацианоэтилена, 673.64kb.
- Синтез, свойства и биологическая активность производных 2-хлорникотинонитрилов, 264.36kb.
- Синтез и свойства новых производных 2 (1,2,4 триазолил 5 тио)уксусных кислот 15. 00., 240.9kb.
- Примерная программа рекомендуется для направления подготовки (специальности) 111801, 717.4kb.
- Программа курса «Аналитическая химия» специальность «Фармация», 92.69kb.
- Тематический план лекций по дисциплине «Фармацевтическая химия», 32.57kb.
3.2 Синтез и строение 2-[2-(N-гетериламино)-2-оксоацетил]фенолятов натрия, бис {2-[2-(N-гетериламино)-2-оксоацетил]фенолятов} цинка и кадмия
С целью получения водорастворимых биологически активных соединений нами изучена реакция N-гетериламидов о-ГФГК 6а,б,д,ж с натрия карбонатом, в результате чего выделены 2-[2-(N-гетериламино)-2-оксоацетил]феноляты натрия (14а-г):
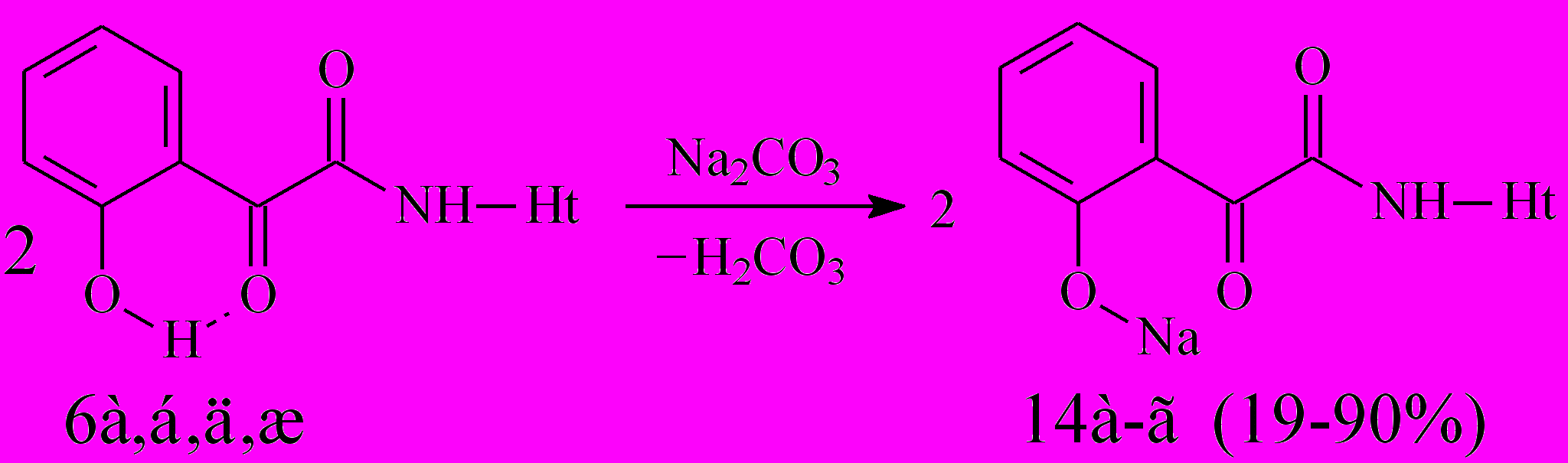
14: Ht=С5Н3BrN (а), 3-С5Н4N (б), С2Н1N2S (в), С4Н5N2S (г).
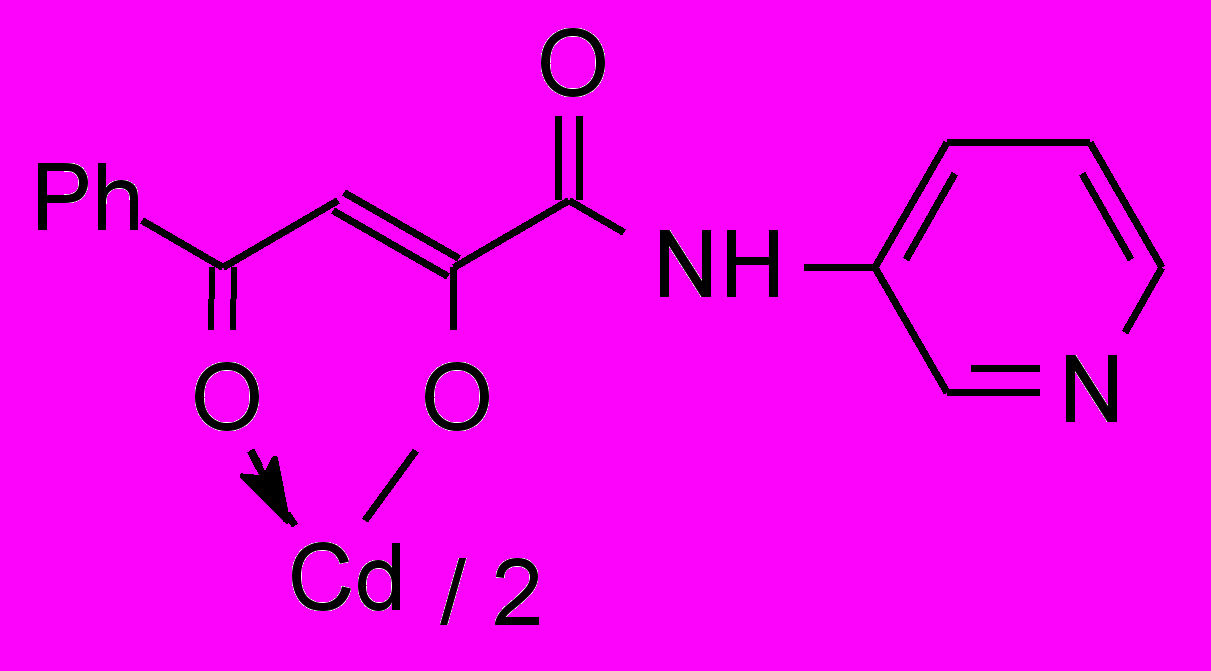
Установлено, что при взаимодействии N-гетериламидов 6г,е-з с дихлоридами цинка и кадмия при соотношении лиганд – металл 2:1 образуются бис{2-[2-(N-гетериламино)-2-оксоацетил]феноляты} цинк (15) и кадмий (16а-г):
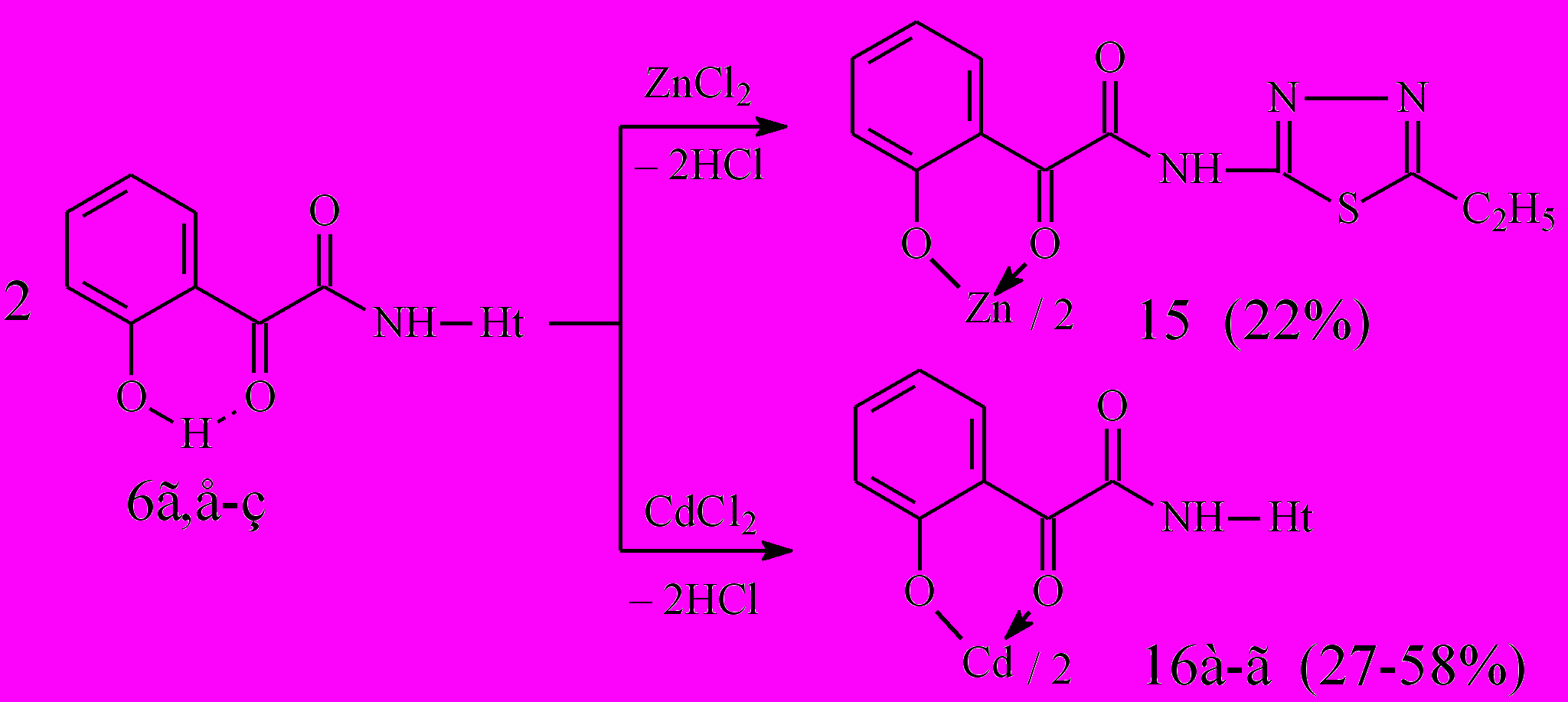
16: Ht=С3Н2NS (а), С3Н3N2S (б), С4Н5N2S (в), С7Н5N2 (г).
Спектральные характеристики подтверждают строение полученных соединений и свидетельствуют о депротонизации лиганда в ходе реакции комплексообразования. В процессе эксперимента нам не удалось получить медные и цинковые хелаты при взаимодействии соответствующих солей с N-гетериламидами 6г,д,е, так как в ходе реакции происходило сильное осмоление смеси. Также не удалось выделить ртутные хелаты и натриевый фенолят в реакции N-(2-тиазолил)амида 6г с Nа2CO3.
4. Взаимодействие N-гетериламидов 4-арил-2-гидрокси-4-оксо-2-бутеновых кислот с гидразонами кетонов
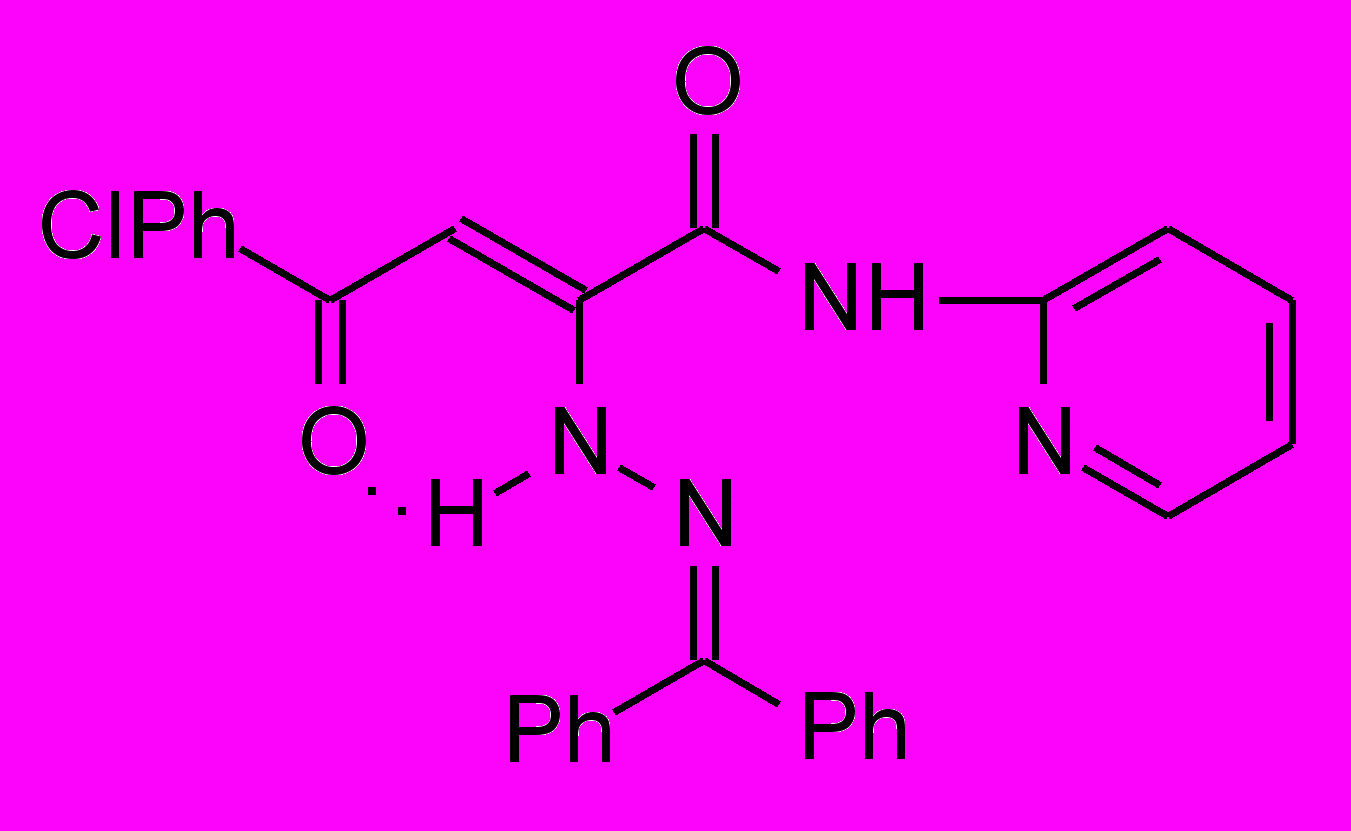
Нами установлено, что N-гетериламиды АрПК 2б,г,д,з,и,л-о,р,с,у-ц взаимодействуют с гидразонами бензофенона и 9-флуоренона с образованием соответственно N-гетериламидов 4-арил-2-дифенилметиленгидразино-4-оксо-2-бутеновых кислот (17а-п) и N-гетериламидов 4-арил-4-оксо-2-флуоренилиденгидразино-2-бутеновых кислот (18а-о):

17: Ht=2-С5Н4N, R=Сl (а); Ht=3-С5Н4N, R=Н (б), Сl (в); Ht=С3Н2NS, R=Н (г), Сl (д); Ht=С2Н1N2S, R=Н (е), Сl (ж); Ht=С3Н3N2S, R=Н (з), Сl (и); Ht=С4Н5N2S, R=Н (к), Сl (л), СН3 (м); Ht=С11Н11N2O, R=Н (н), Сl (о); Ht=С7Н5N2, R=Н (п).
18: Ht=2-С5Н4N, R=Сl (а); Ht=3-С5Н4N, R=Н (б), Сl (в); Ht=С3Н2NS, R=Н (г), Сl (д); Ht=С2Н1N2S, R=Н (е), Сl (ж); Ht=С3Н3N2S, R=Н (з), Сl (и); Ht=С4Н5N2S, R=Н (к), Сl (л), СН3 (м); Ht=С11Н11N2O, R=Н (н), Сl (о).
При изучении спектров ЯМР1Н соединений 17,18, снятых в ДМСО-d6 и CDCl3, установлено наличие Z-кетоенгидразинной ( Z-KEГ), Е-кетоенгидразинной (Е-КЕГ) и -кетогидразонной (-КГ) форм в растворе этих соединений:

R1=R2=С6H5, СR1R2=С13H8.
Нами установлено, что состав таутомерных форм в растворе определяется, в первую очередь, природой растворителя, а также строением гетероциклического и гидразинного фрагментов. В меньшей степени на содержание форм оказывает влияние заместитель в ароильном радикале. Так, в растворе ДМСО-d6 соединений 17,18 форма Z-КЕГ наблюдается у всех изученных соединений, за исключением производного 18з, и составляет 32-100% для соединений 17 и 15-80% для соединений 18. Минорная форма Е-КЕГ обнаруживается в растворе ДМСО-d6 у соединений 17к (48%) и 18и,к,н,о (15-28%). Содержание формы -КГ в растворе ДМСО-d6 у соединений 17 составляет 15-50%, в то время как у соединений 18 – 50-100%. Следует отметить, что форма Е-КЕГ присутствует в таутомерном равновесии трех форм только в растворе ДМСО-d6, а в растворе CDCl3 – только в равновесии с Z-КЕГ со значительным преобладанием последней. Введение электроноакцепторного заместителя в ароильный фрагмент производных 17,18 приводит к сдвигу таутомерного равновесия в сторону большего содержания формы Z-КЕГ только в растворах ДМСО-d6.
5. Взаимодействие N-гетериламидов 4-арил-2-гидрокси-4-оксо-2-бутеновых кислот с этиловым эфиром гидразинэтановой кислоты
У
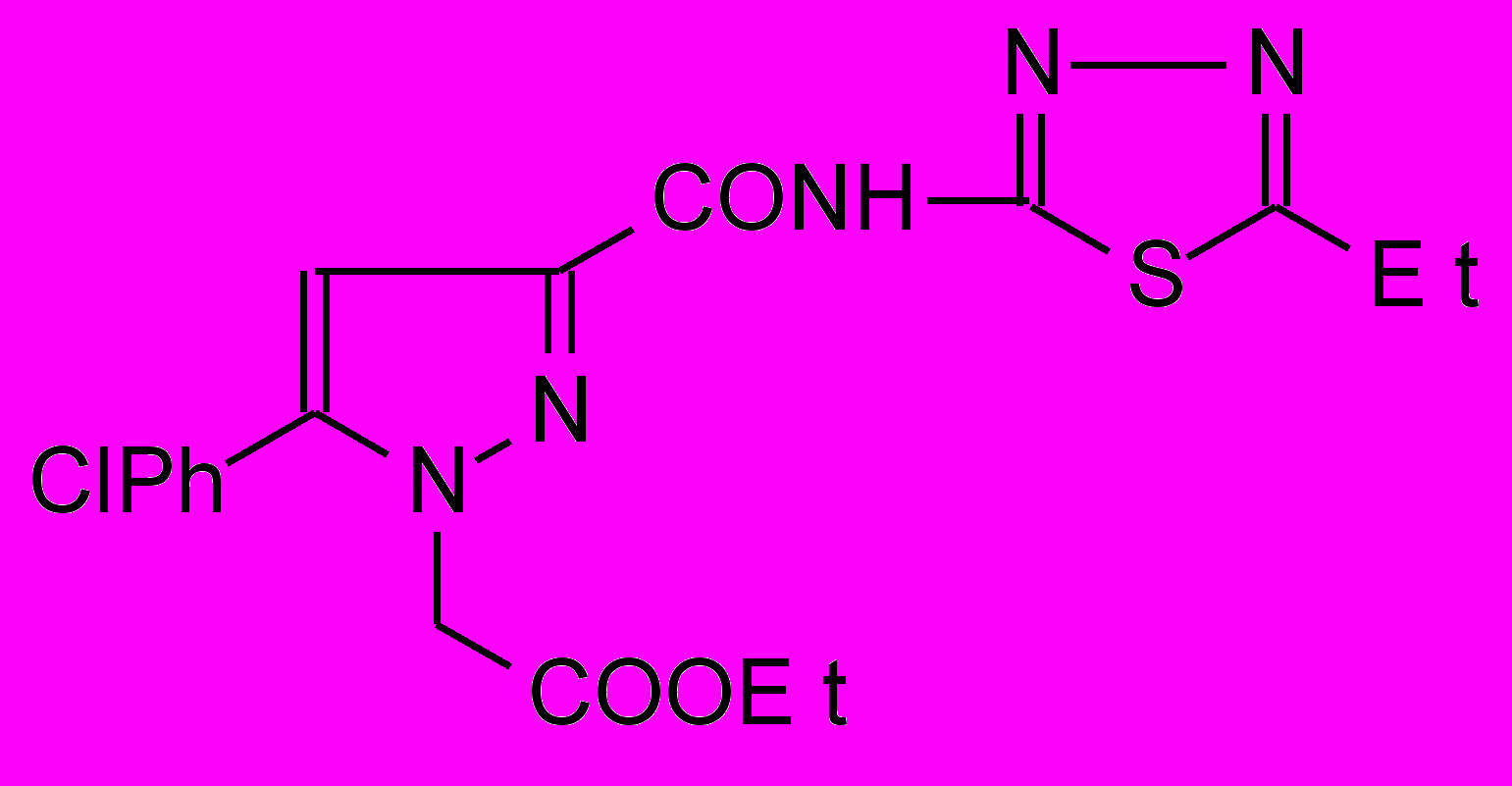
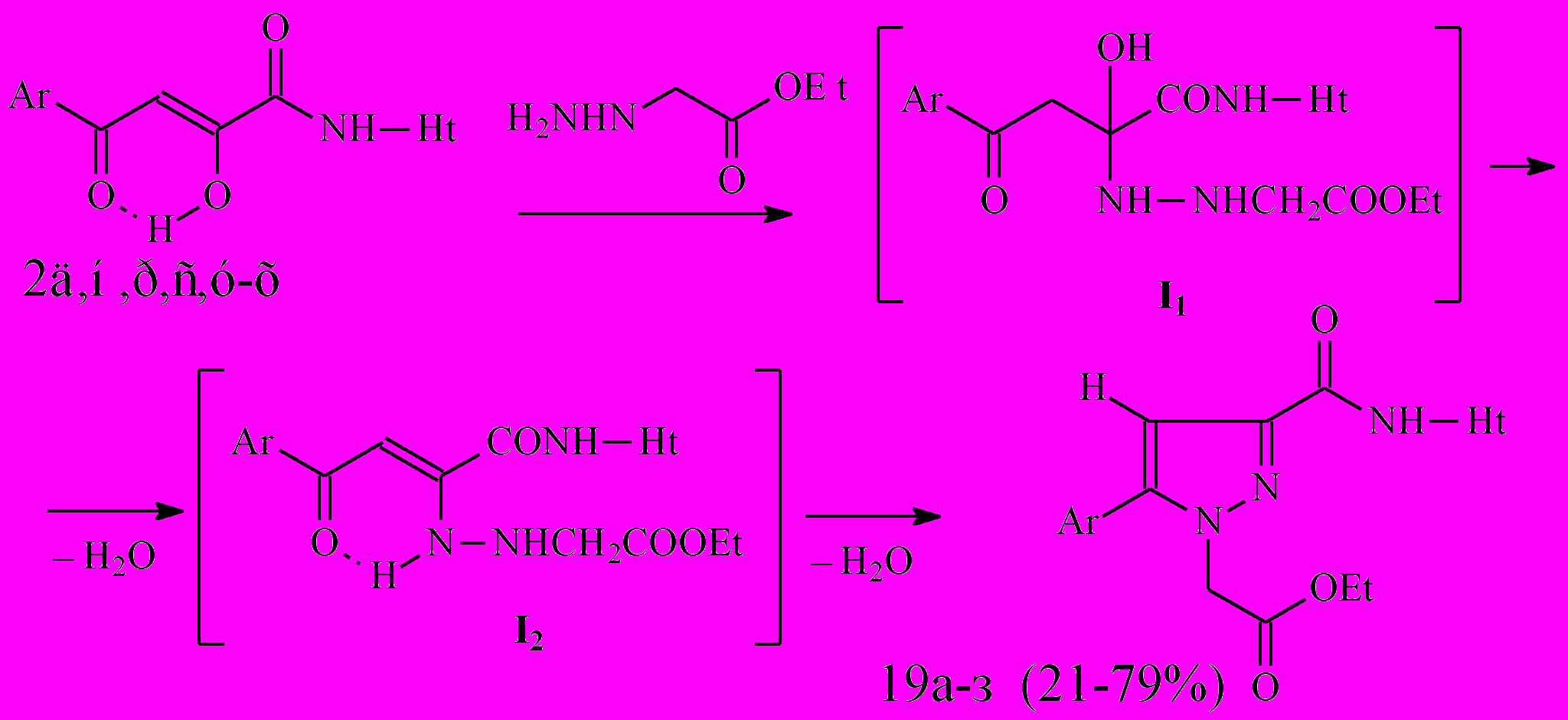 становлено, что при взаимодействии N-гетериламидов 2д,н,р,с,у-х с этиловым эфиром гидразинэтановой кислоты образуются соответствующие N-гетериламиды 3-арил-2-этоксикарбонилметил-2,3-дигидропиразол-5-карбоновых кислот (19а-з):
становлено, что при взаимодействии N-гетериламидов 2д,н,р,с,у-х с этиловым эфиром гидразинэтановой кислоты образуются соответствующие N-гетериламиды 3-арил-2-этоксикарбонилметил-2,3-дигидропиразол-5-карбоновых кислот (19а-з):19: Ht=3-С5Н4N, Ar=4-C6H4Cl (а); Ht=С2Н1N2S, Ar=C6H5 (б), 4-ClC6H4 (в); Ht=С3Н3N2S, Ar=C6Н5 (г), Сl (д); Ht=С4Н5N2S, Ar=C6H5 (е), 4-СlC6H4 (ж), 4-СН3C6H4 (з).
Обнаружено, что соединения 19б-з обладают ярко-голубой флуоресценцией при облучении УФ-светом, что использовалось нами в процессе детектирования пятен на пластинках «Silufol UV 254» при контроле реакции методом ТСХ.
При изучении спектров ЯМР1Н производных N-[2-(5-R-1,3,4-тиадиазолил)]амидов 19б-з, снятых в ДМСО-d6 и СDCl3, нами установлено наличие таутомерных форм М и Н в растворе этих соединений:
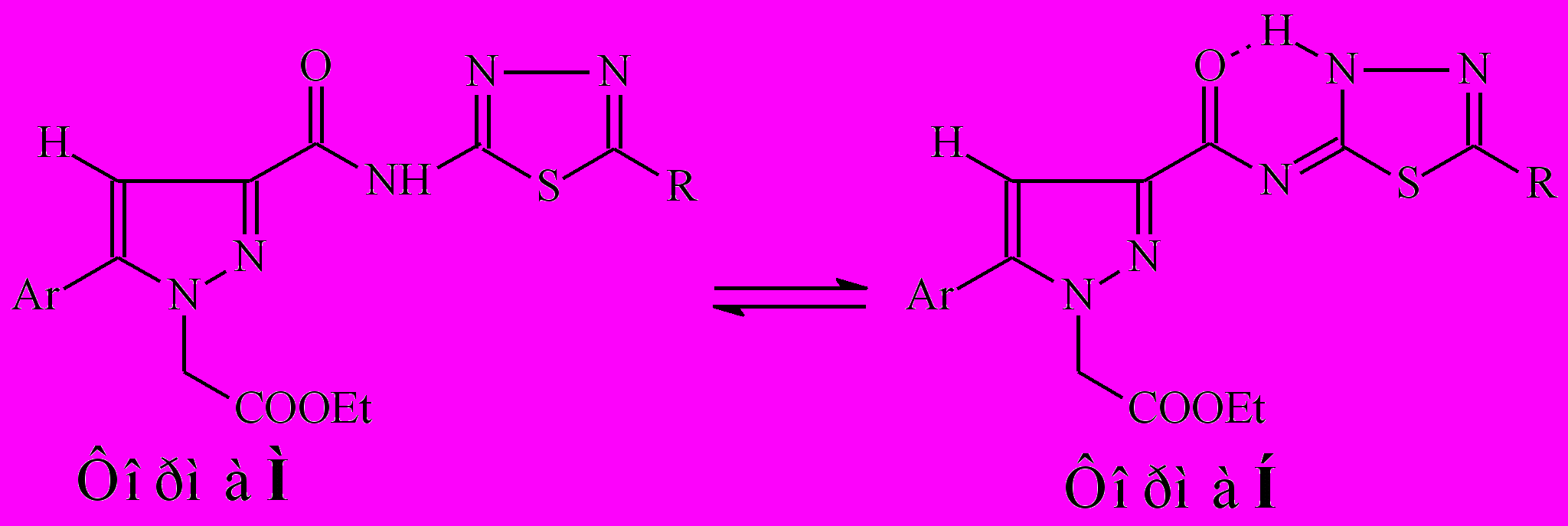
R=H, Me, Et
Таутомерное равновесие этих форм зависит от природы растворителя, а также от характера заместителя в арильном и гетерильном фрагментах молекулы. Так, при снятии спектров ЯМР1Н соединений 19г,д в разных растворителях установлено, что при введении заместителя в арильный фрагмент наблюдаются обе формы с преобладанием формы Н в ДМСО-d6 и формы М в СDCl3, в то время как отсутствие заместителя способствует их 100% содержанию в соответствующем растворителе. При анализе спектров соединений 19в-з, снятых в ДМСО-d6, выявлено, что соединения 19г,е существуют в форме Н (100%), в то время как их замещенные аналоги 19в,д,ж,з существуют в виде равновесных форм Н:М (43-62% : 38-57%).
Механизм образования соединений 19а-з, по видимому, включает первоначальную атаку первичной аминогруппы замещенного гидразина на карбонильную группу С2=О субстрата. Образующийся при этом карбиноламин (I1) элиминирует воду и превращается в енгидразин (I2), который циклизуется в пиразол за счет внутримолекулярной атаки вторичной аминогруппы гидразина на карбонильную группу С4=О субстрата c отщеплением воды.
6. Изучение биологической активности N-гетериламидов α-оксокислот и продуктов их превращений
N-гетериламиды α-оксокислот и продукты их превращений были подвергнуты биологическим испытаниям с целью поиска БАВ с противовоспалительной, анальгетической, противомикробной активностью, а также влияющих на свертывающую систему крови. Испытания проводились в ГОУ ВПО «Пермская государственная фармацевтическая академия Росздрава» на кафедрах фармакологии с курсом иммунологии, микробиологии, физиологии с основами анатомии.
6.1 Острая токсичность.
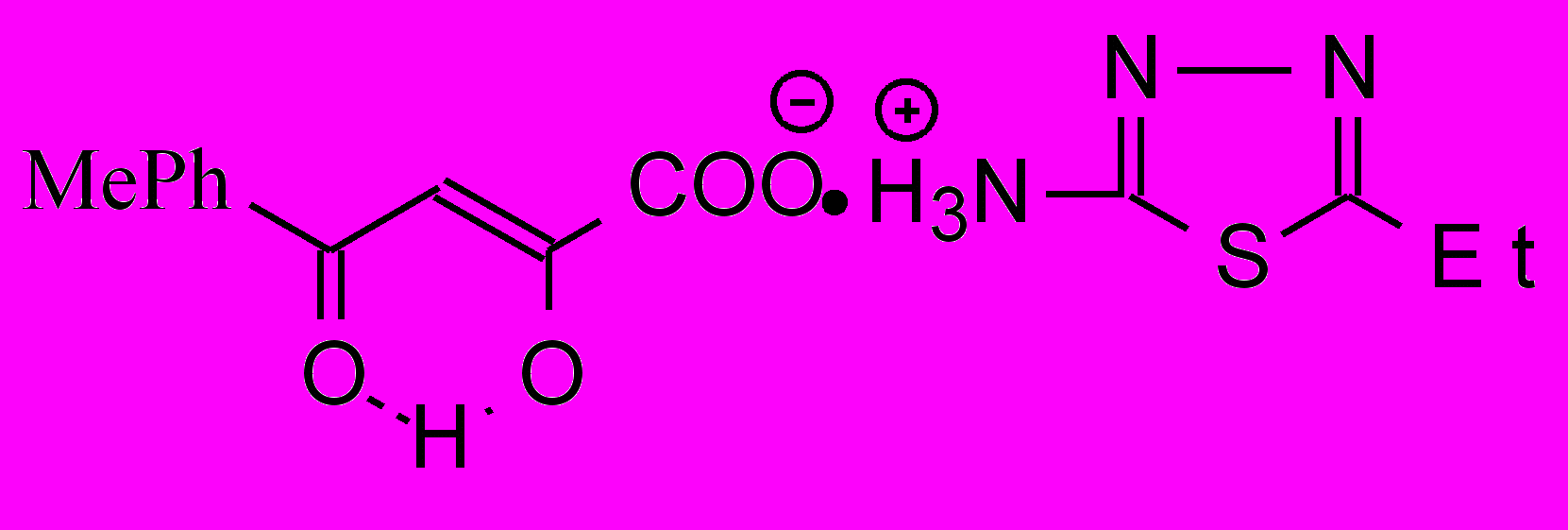
Установлено, что большинство производных α-оксокислот являются малотоксичными веществами. Так, LD50 соединений 2п, 6г,ж, 8ж, 10м, 11а, 12а,в,д, 13б,в, 16а составляет 500-3000 мг/кг при внутрибрюшинном способе введения. Таким образом, изученные соединения имеют определенные преимущества в плане их безопасности перед препаратами сравнения.
6.2 Противовоспалительная активность (ПВА).
ПВА полученных соединений в дозе 50 мг/кг изучали на модели острого воспалительного отека, вызванного субплантарным введением 0,1 мл 1% водного раствора каррагенина белым крысам обоего пола массой 170-200 г. Соединения вводили перорально в дозе 50 мг/кг в виде взвеси в 2% крахмальном растворе за 1 час до введения флогогенного агента. Препаратом сравнения служил диклофенак (10 мг/кг). Результаты испытаний наиболее активных соединений представлены в таблице 1.
Выявлено, что в ряду N-[2-(5-R-1,3,4-тиадиазолил)]амидов 2 при увеличении алкильной цепи в 5 положении гетероцикла наблюдается значительное уменьшение ПВА, вплоть до ее потери и наибольшую активность показывают производные 2п,т. В меньшей степени активны производные с бензимидазольным гетероциклом (2ц,ч). Также установлено, что не зависимо от строения гетероцикла, электронодонорные заместители в ароильном кольце увеличивают ПВА, а электроноакцепторные, как правило, незначительно влияют на данный вид активности.
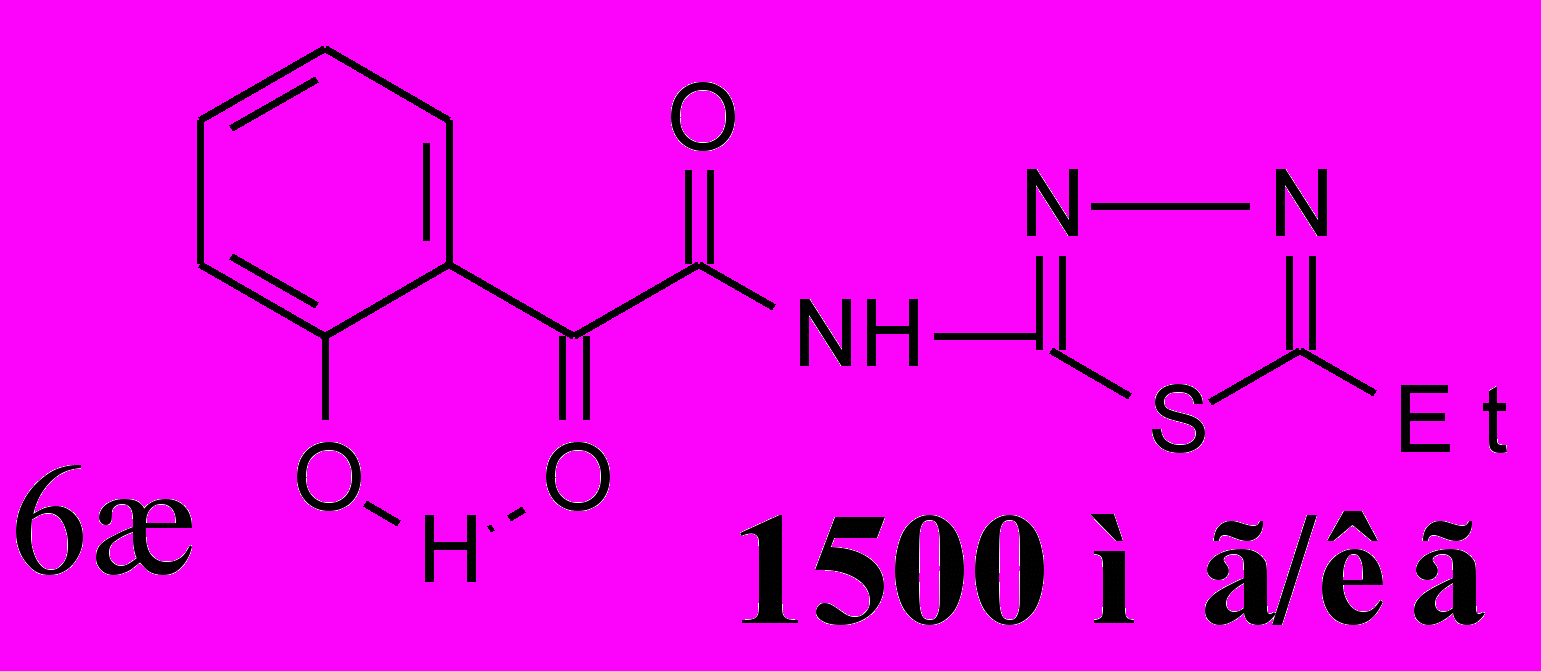
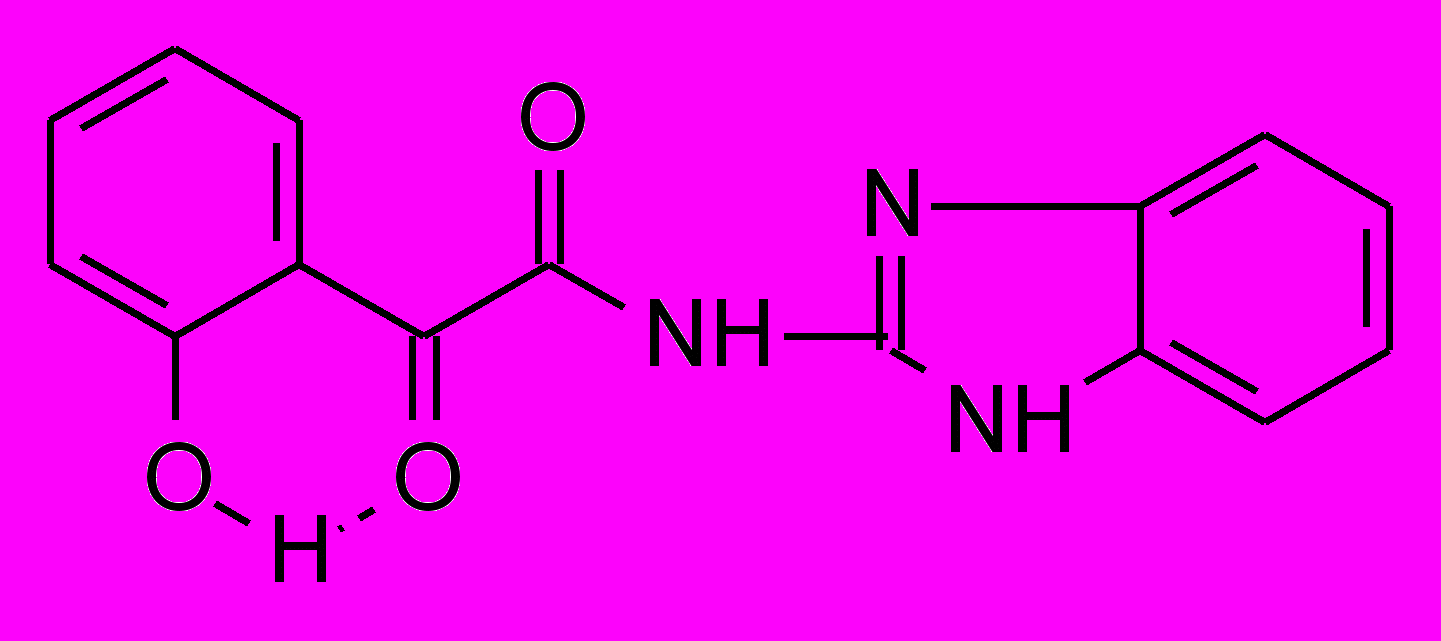
Установлено, что N-гетериламиды о-ГФГК 6, по сравнению с N-гетериламидами АрПК 2, проявляют более выраженную ПВА. Кроме того, в данном ряду производных отмечается прямая зависимость влияния заместителя в 5 положении 1,3,4-тиадиазолила на ПВА, которая увеличивается при увеличении алкильной цепи, и наиболее высокую активность проявляет гетериламид 6ж. На пике воспаления он практически не уступает диклофенаку и его эффективная доза от LD50 составляет 0.03. Таким образом, соединение 6ж превосходит по широте терапевтического действия препарат сравнения в 5 раз. Обнаружено значительное повышение ПВА у амида 6з, содержащего в качестве гетероцикла 2-бензимидазол, по сравнению со структурными аналогами – производными АрПК 2ц,ч.
В ряду бутеноатов 8 наибольшую активность проявили соединения 8ж,и,м,о содержащие 5-этил-1,3,4-тиадиазолильный и бензимидазольный заместители, однако их ПВА не превышает препарат сравнения.
При переходе от N-гетериламидов АрПК 2 к их комплексным соединениям 10-13 на ПВА, в большей степени, влияет характер металла и строение гетероцикла.
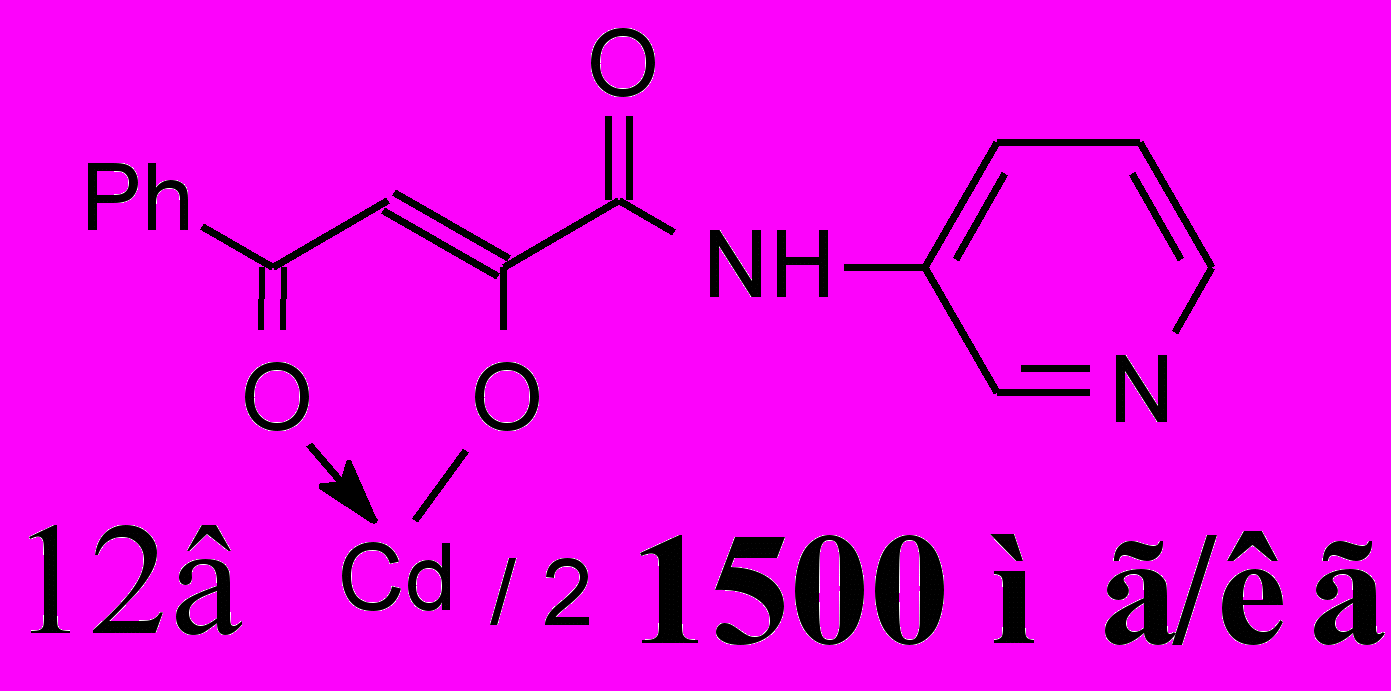
Нами установлено, что за исключением соединения 11в на основе N-[2-(5-бромпиридил)]амида 2ж, происходит значительное увеличение активности хелатов, по сравнению с исходными амидами 2. Наибольшую активность проявили соединения 12в и 13б, содержащие 3-пиридильный заместитель. При этом кадмиевый хелат 12в на пике воспаления незначительно уступает диклофенаку, но его его эффективная доза от LD50 составляет 0.03, что свидетельствует об определенных его преимуществах перед препаратом сравнения.
При оценке влияния природы металла на проявление ПВА в ряду соединений 10-13 выявлена следующая закономерность и наиболее активные соединения обнаружены среди кадмиевых производных:
[L]2Cd > [L]2Hg > [L]2Zn > [L]2Cu
Переход от N-2-тиазолиламида о-ГФГК 6г к соответствующему кадмиевому хелату 16а также приводит к значительному увеличению ПВА до уровня диклофенака.
Таблица 1
Данные по ПВА наиболее активных соединений
| Соединение (LD50 мг/кг) | Торможение каррагенинового отека в % | ||
| 1 час | 3 часа | 5 часов | |
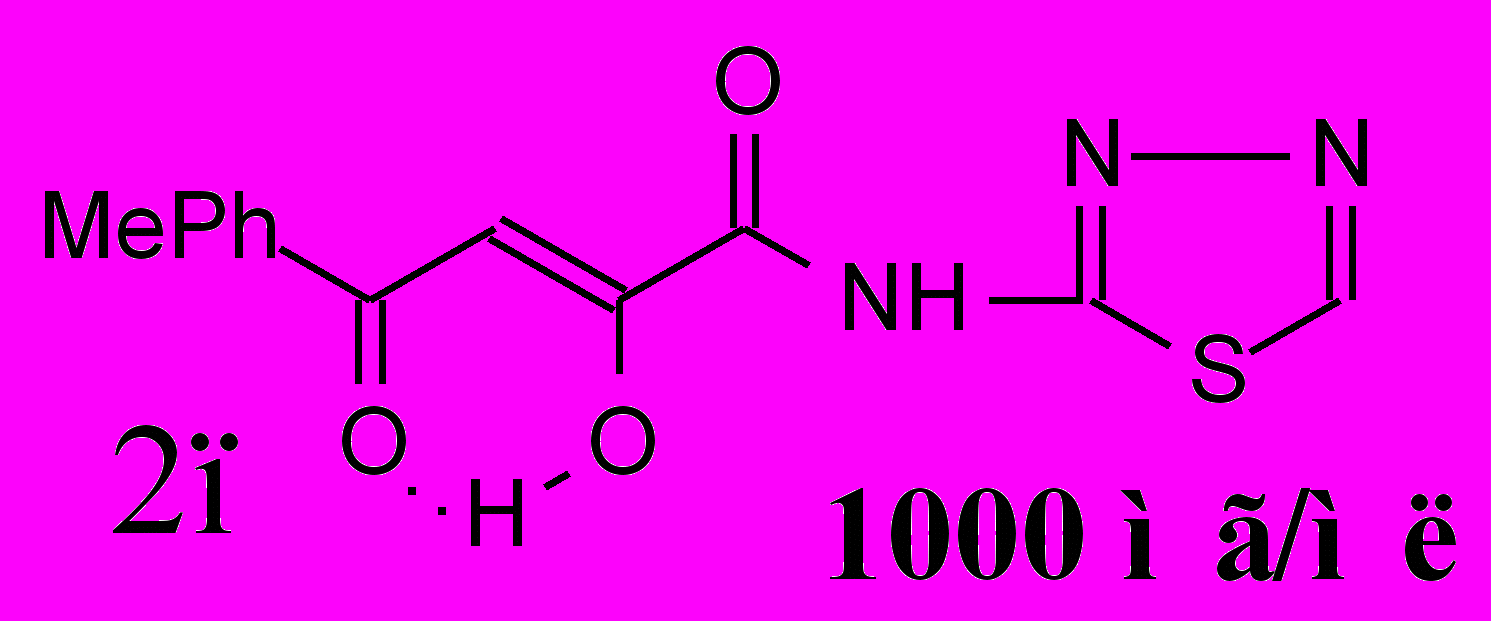 | 29,1±1,5*1 **2 | 46,7±2,1**1 *2 | 40,6±5,6**1 *2 |
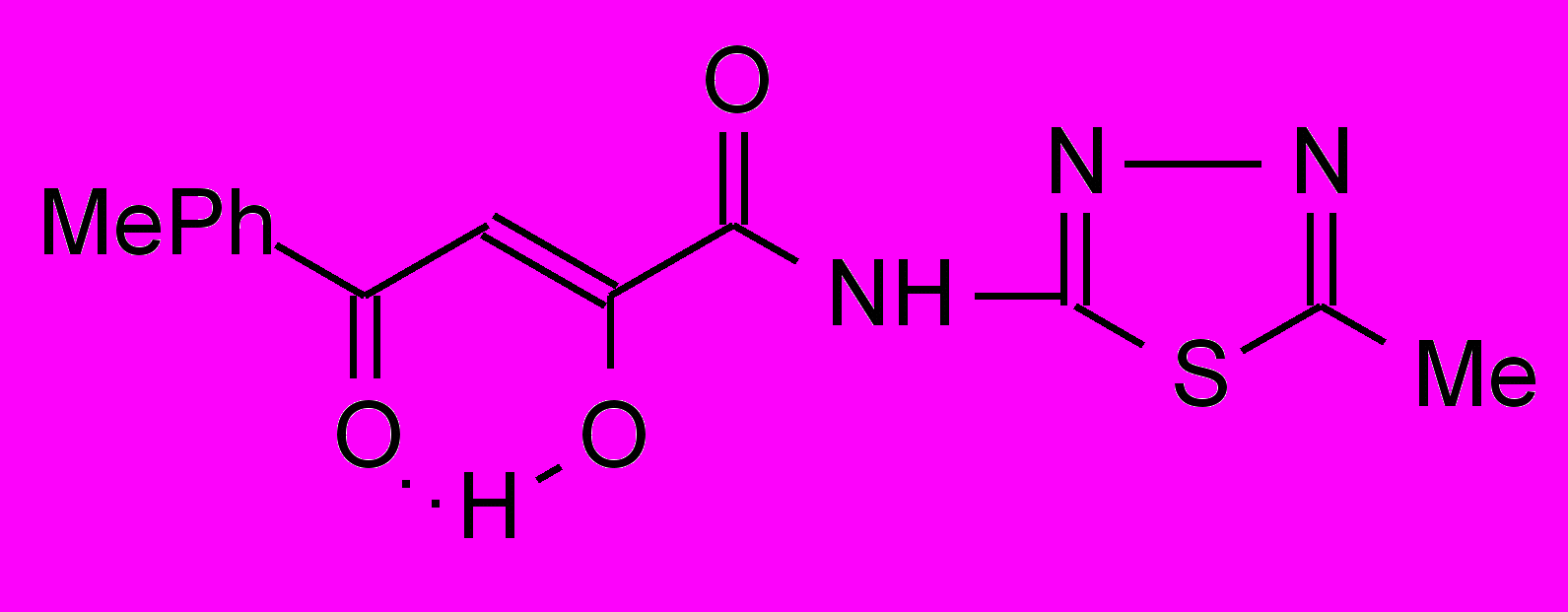 2т 2т | 49,5±17***1 ***2 | 35,9±0,9**1 ***2 | 35,9±0,9**1 ***2 |
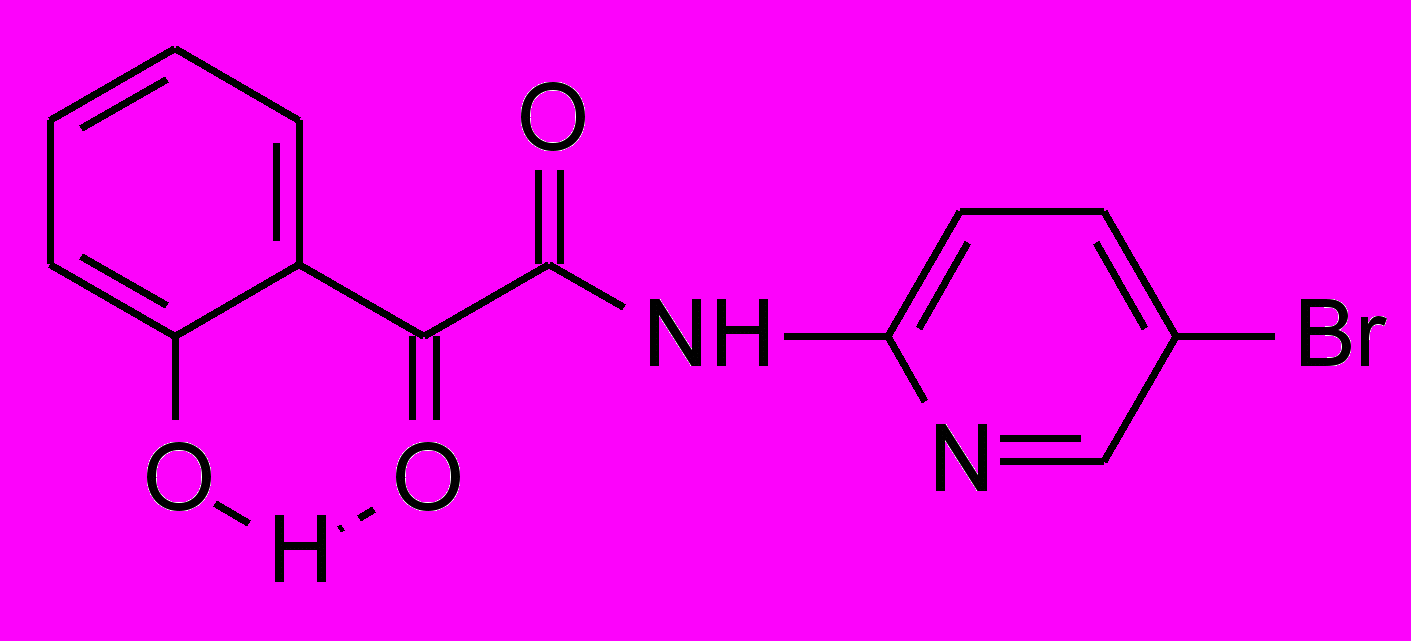 6а 6а | 34,9±8,9 | 42,9±2,3***1 | 27.5±3.8**1 |
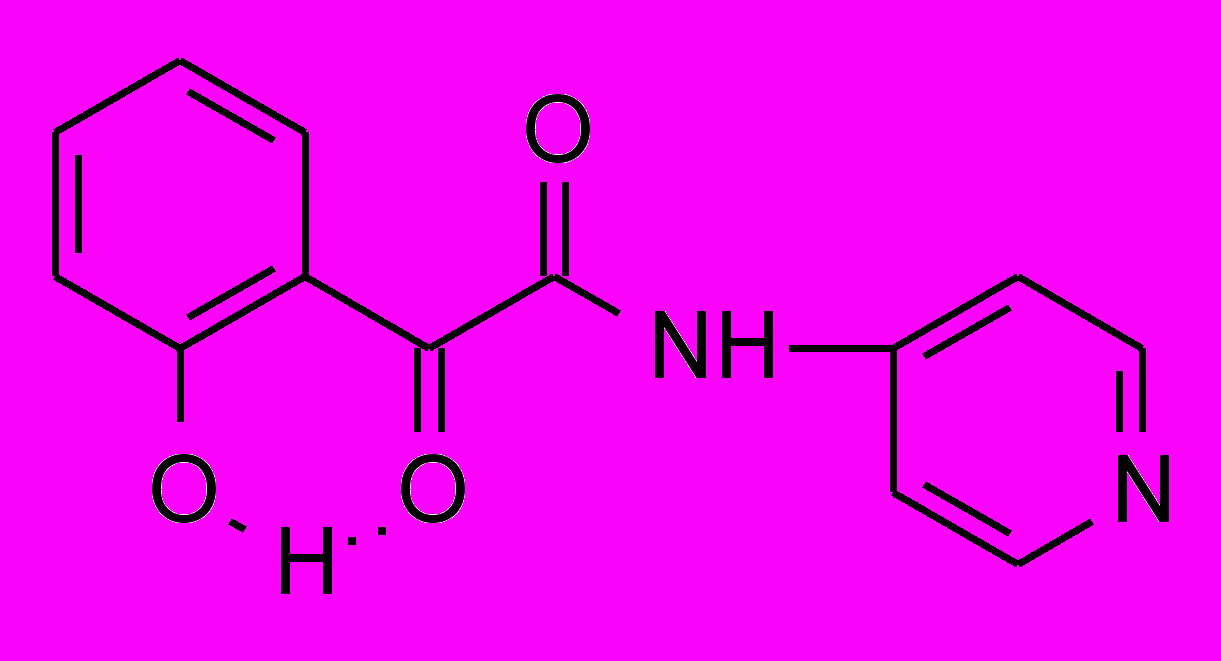 6в 6в | 48,0±5,3***1 ***2 | 45,0±4,2***2 | 33,0±4,1***2 |
 | 69,0±0,3***1 ***2 | 52,4±3,8***1 *2 | 54,5±2,5***1 |
 6з 6з | 57,6±2,6***1 ***2 | 35,9±0.9*1 **2 | 27.2±2.0*1 **2 |
 8и 8и | 33,9±7,4 | 35,1±6,3**1 | 41,4±8,0**1 |
 | 63,55,3***1 | 42,11,5**1 **2 | 38,24,9**1 **2 |
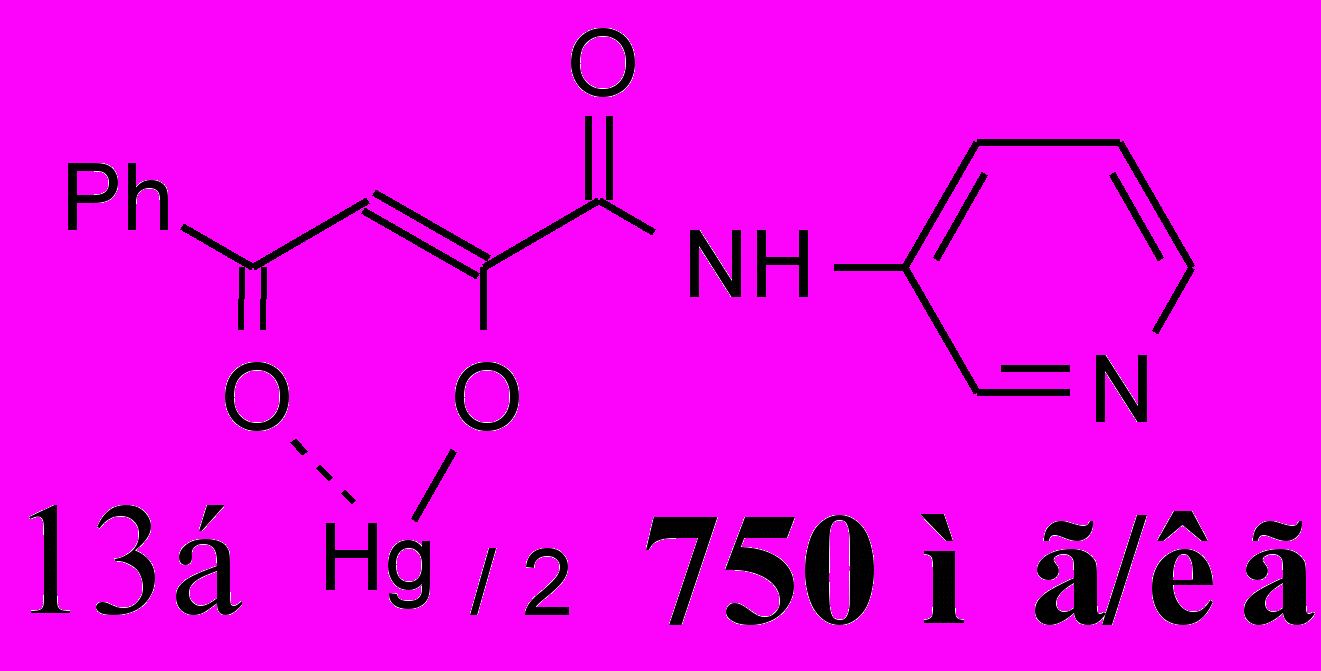 | 58,011,3**1 | 28,06,0**1 | 33,01,5**1 |
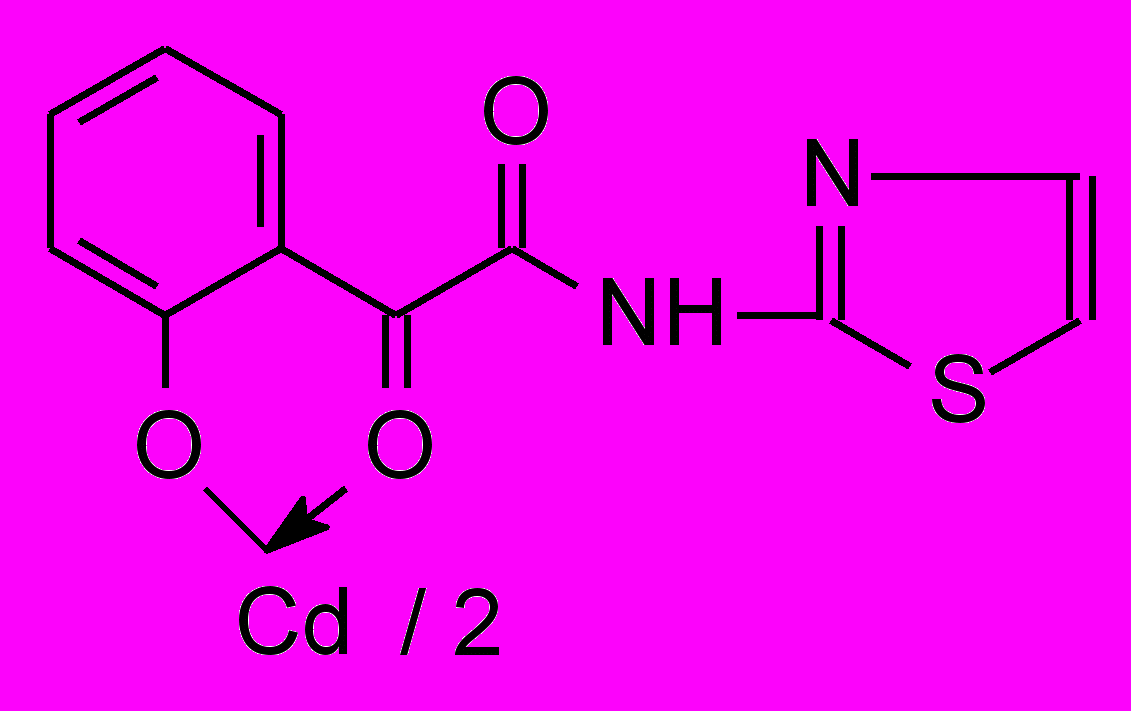 16а 16а | 65,75,9***1 *2 | 62,3±3,5***1 | 47,8±5,7**1 ***2 |
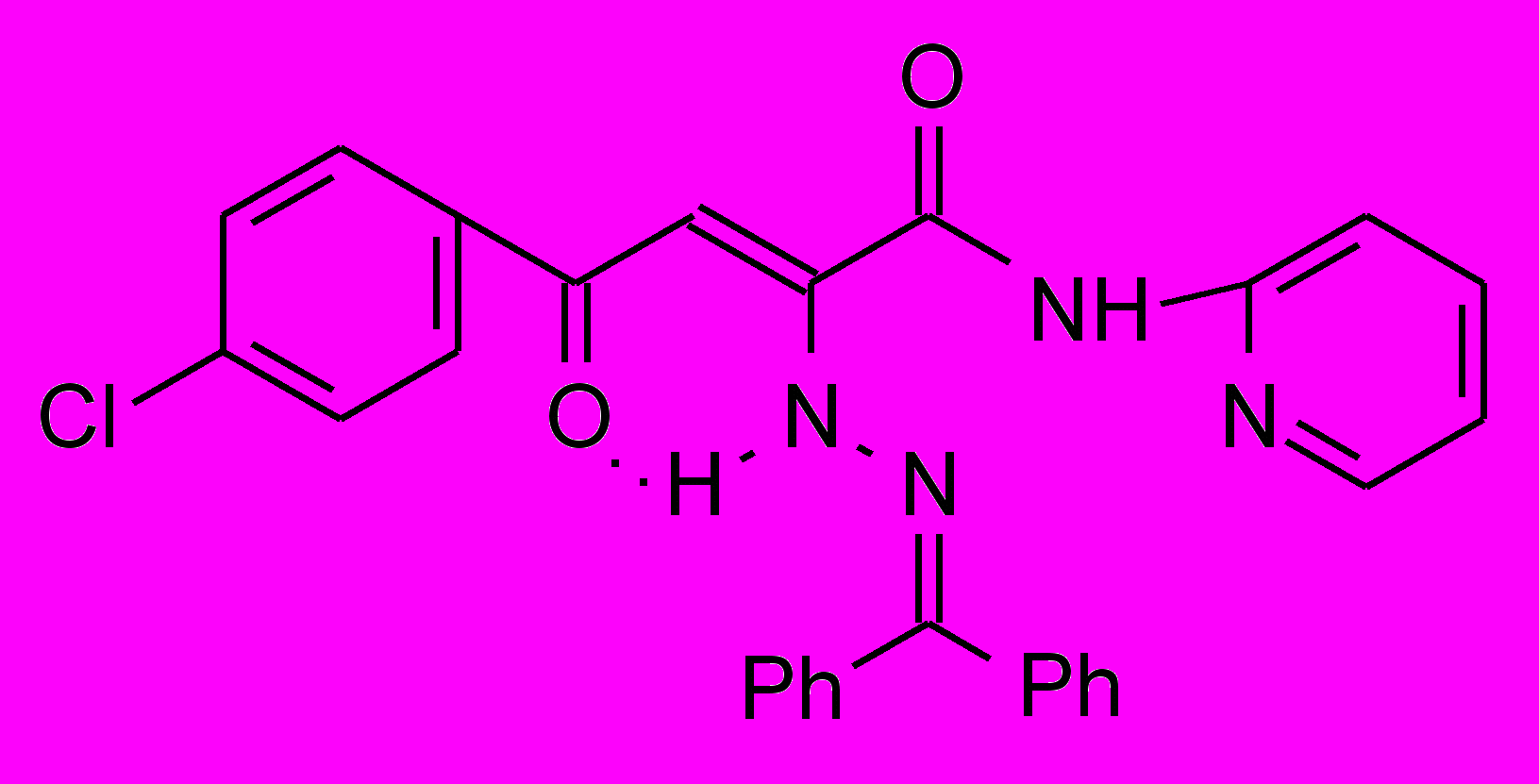 17а 17а | 58,5±1,6***1 ***2 | 36,6±2,6**1 *2 | 29,7±2,6***1 ***2 |
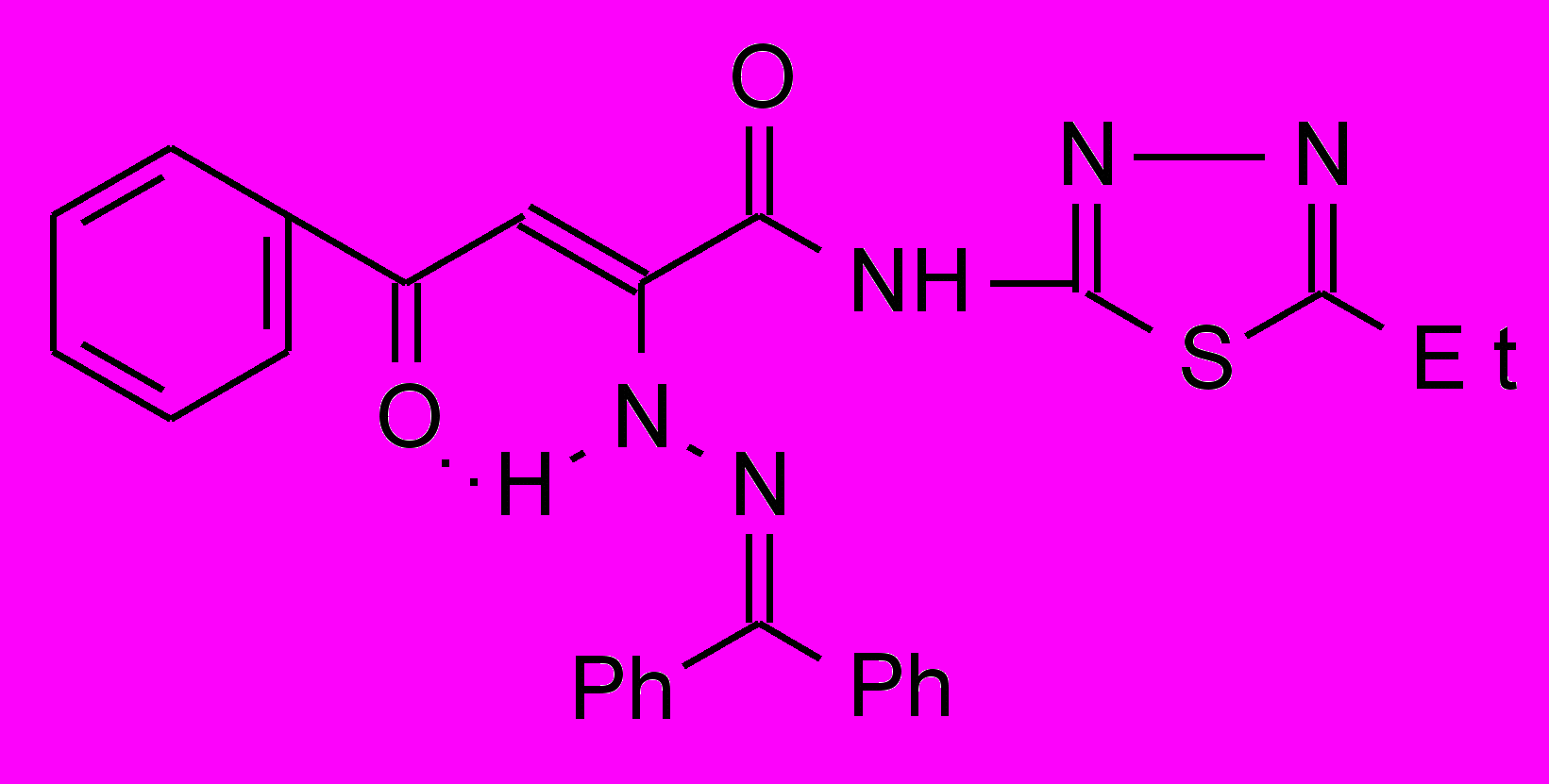 17к 17к | 47,0±3,6**1 | 36,5±6,1***1 | 42,7±5,9***1 |
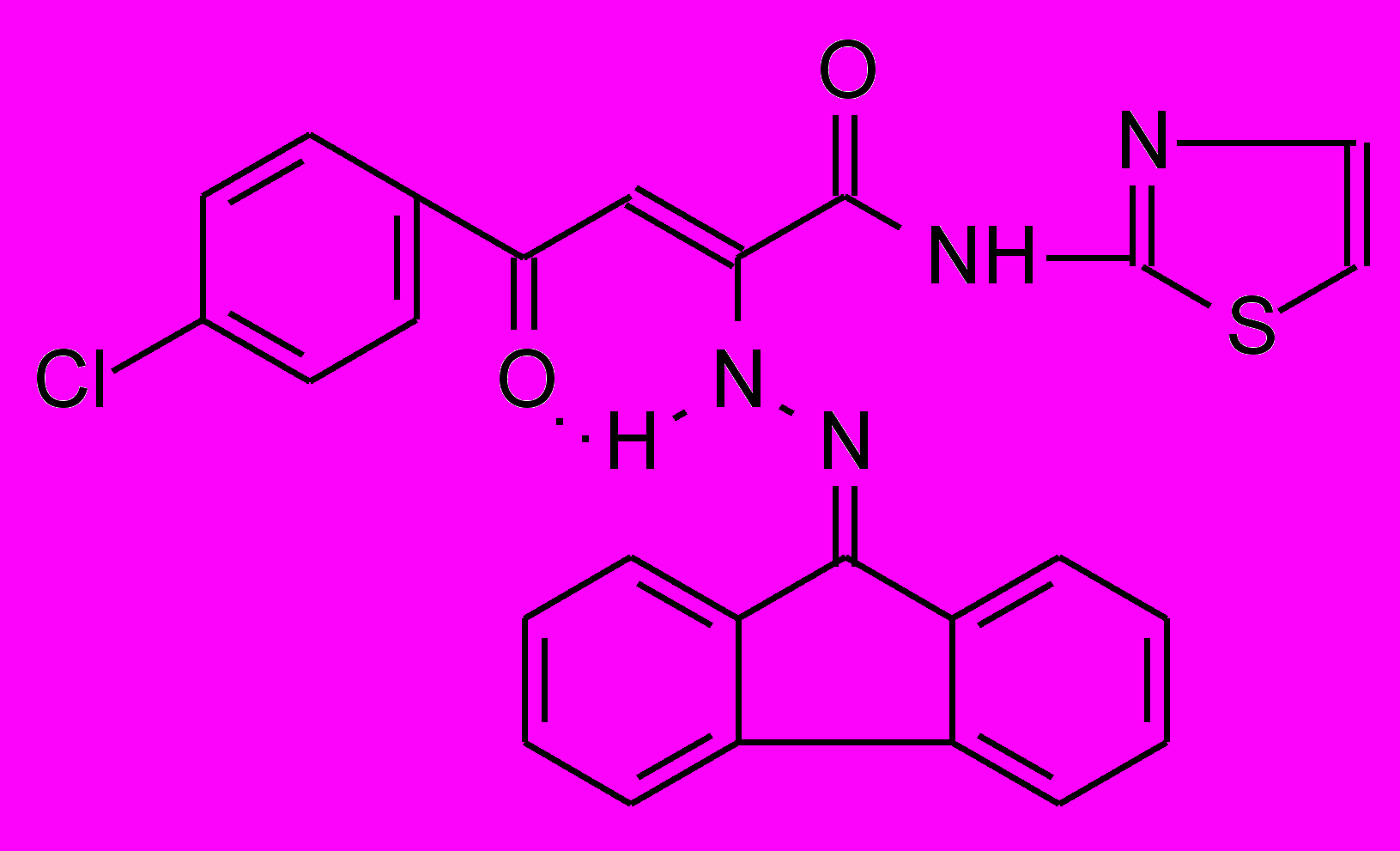 18д 18д | 33,8±5,8*1 | 23,7±5,8*1 ***2 | 31,8±6,7**1 **2 |
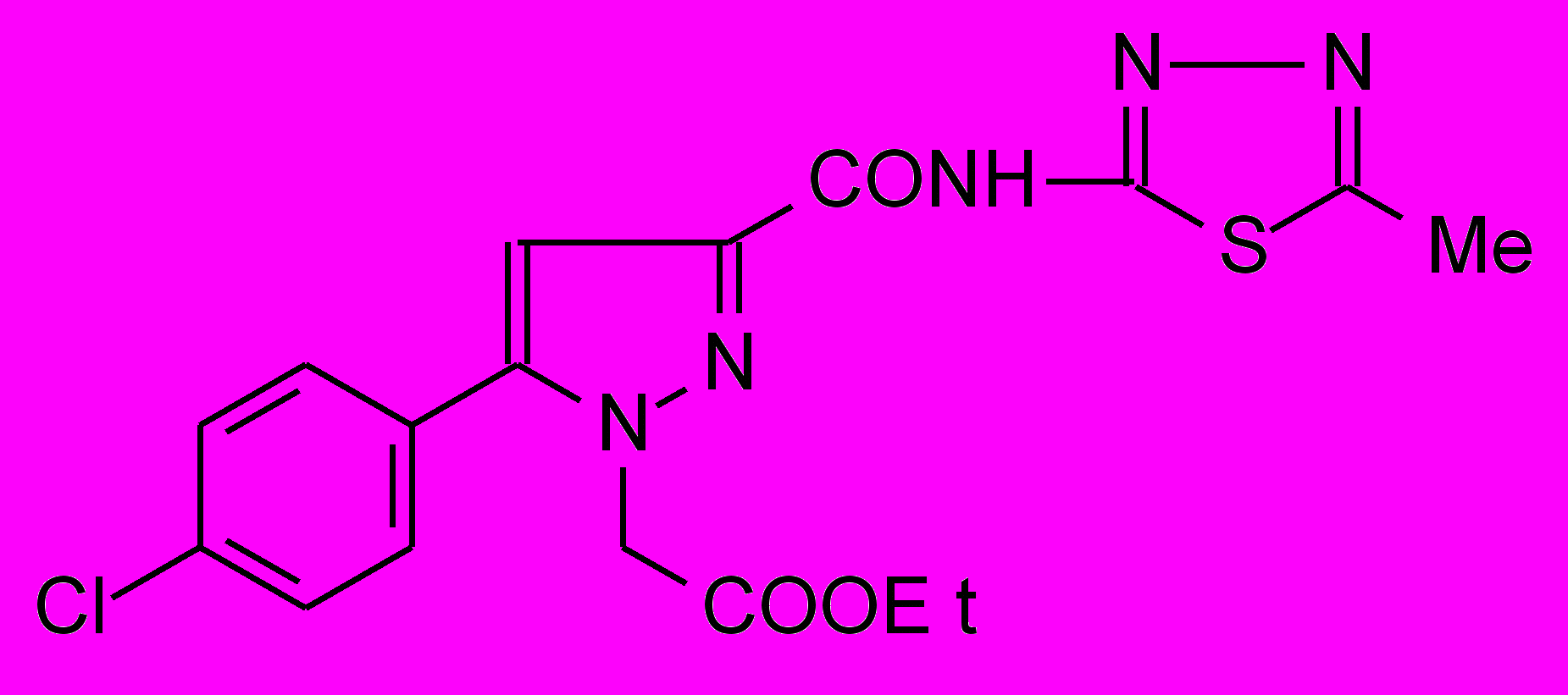 19д 19д | 12,7±1,5 | 39,5±4,3**1 ***2 | 48,9±1,4***1 *2 |
| Диклофенак | 40.2±4.8 | 65.6±4.3***1 | 60.1±4.7***1 |
* = p < 0,05, ** = p< 0,01, *** = p < 0,001
1− по сравнению с контролем; 2 – по сравнению с диклофенаком.
Введение во второе положение исходных N-гетериламидов 2-дифенилметиленгидразинового фрагмента также приводит к увеличению ПВА. Наибольшую активность в этом ряду проявили соединения 17а,к, содержащие в качестве гетероциклических заместителей 2-пиридил и 2-(5-этил-1,3,4-тиадиазолил) соответственно. В случае 2-производных N-[2-(5-R-1,3,4-тиадиазолил)]амидов увеличение ПВА наблюдается с возрастанием алкильной цепи в положении 5 гетероцикла и уменьшается при введении в арильный фрагмент электроакцепторного заместителя. Меньшее влияние на этот вид активности оказывает введение флуоренилиденгидразинового заместителя в молекулу исходных N-гетериламидов. Целенаправленное введение потенциально биологически активного фрагмента 4-аминоантипирила в молекулу гидразонопроизводных 17,18 не принесло ожидаемого результата. Так, соединения 17н,о и 18н,о не дали высокой активности, а у соединения 18о даже проявился провоспалительный эффект.
Установлено, что введение этоксикарбонилметильного заместителя во 2 положение пиразола у соединений 19, по сравнению с известными производными 3-пиразол-5-карбоновых кислот, не имеющих этого заместителя, приводит к значительному увеличению ПВА. Выявлено, что с увеличением алкильной цепи в положении 5 гетероцикла и при введении электроакцепторного заместителя в арильный фрагмент у соединений 19б-з активность, как правило, возрастает.
6.3 Анальгетическая активность (АА).
АА определяли на мышах обоего пола массой 16-22 г по методике «горячая пластинка». Исследуемые вещества вводили перорально в дозе 50 мг/кг в виде взвеси в 2 % крахмальном растворе. Препаратом сравнения служил метамизол натрия (50 мг/кг) и диклофенак (10 мг/кг). Результаты испытаний наиболее активных соединений представлены в таблице 2.
Установлено, что также как и при изучении ПВА, у N-2-[5-(R-1,3,4-тиадиазолил)]амидов АрПК 2 анальгетическое действие уменьшается с увеличением алкильной цепи в 5 положении гетероцикла. Однако высокоактивных соединений в этом ряду не обнаружено. Среди производных N-гетериламидов о-ГФГК 6 наибольшей активностью обладает соединение 6ж, чуть уступающее по силе действия диклофенаку, но имеющее меньшую токсичность.
При переходе от исходных N-гетериламидов АрПК 2 к их хелатным комплексам и бутеноатам существенного увеличения АА не выявлено. Только бутеноат 8к и кадмиевые хелаты 12в,л проявили активность на уровне метамизола натрия, но уступающем по действию диклофенаку.
Введение во второе положение исходных N-гетериламидов 2 дифенилметиленгидразинового фрагмента приводит к увеличению АА. Так наибольшей активностью, превышающей действие диклофенака, обладает соединение 17к. Меньшее влияние оказывает флуоренилиденгидразиновый заместитель, за исключением соединения 18б. Введение заместителя в ароильный радикал соединений 17,18 приводит к снижению АА, а увеличение алкильной цепи у производных N-2-[5-(R-1,3,4-тиадиазолил)]амидов, как правило, приводит к увеличению данного вида активности. Производные 17,18, содержащие антипирильный заместитель, проявили активность, не превышающую препараты сравнения. Производные N-гетериламидов пиразол-5-карбоновых кислот 19 обладают слабой АА, за исключением соединения 19ж.
Таблица 2
Данные по АА наиболее активных соединений
| Соединение | Время оборони-тельного рефлекса, в сек. | Соединение | Время оборони-тельного рефлекса, в сек. |
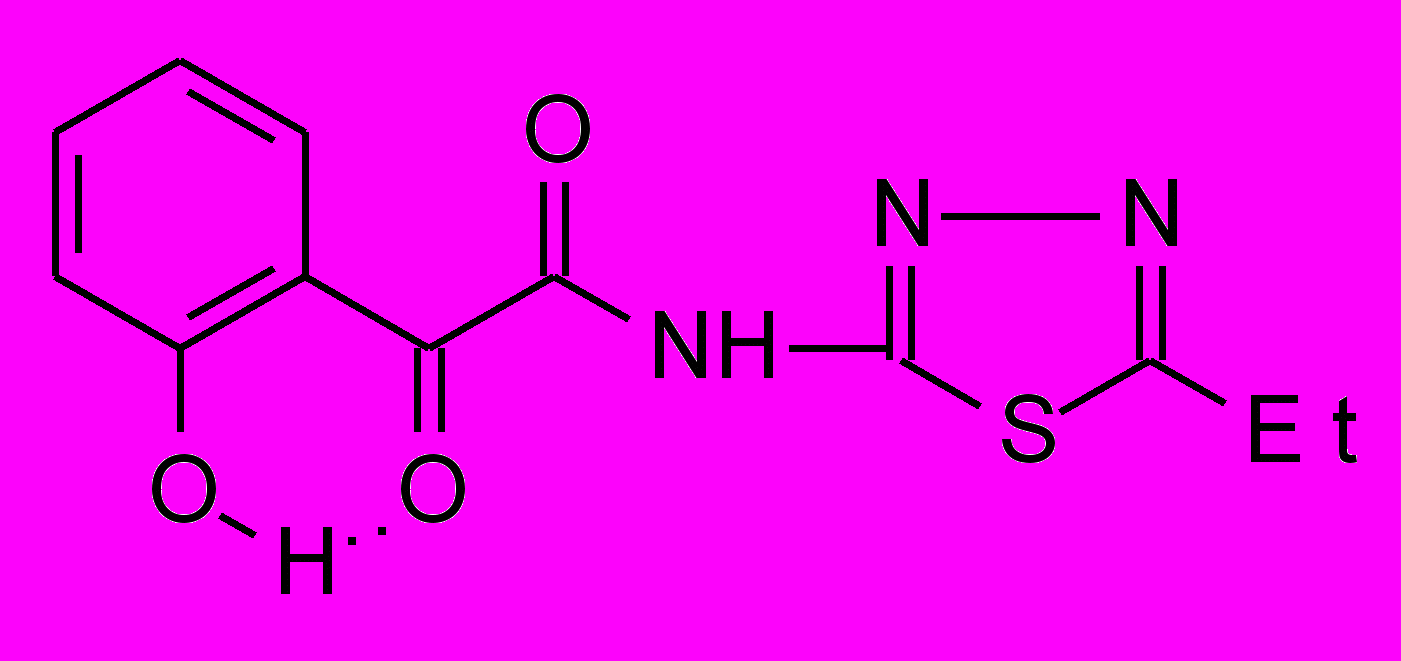 6ж 6ж | 23.0±1.7***1 | 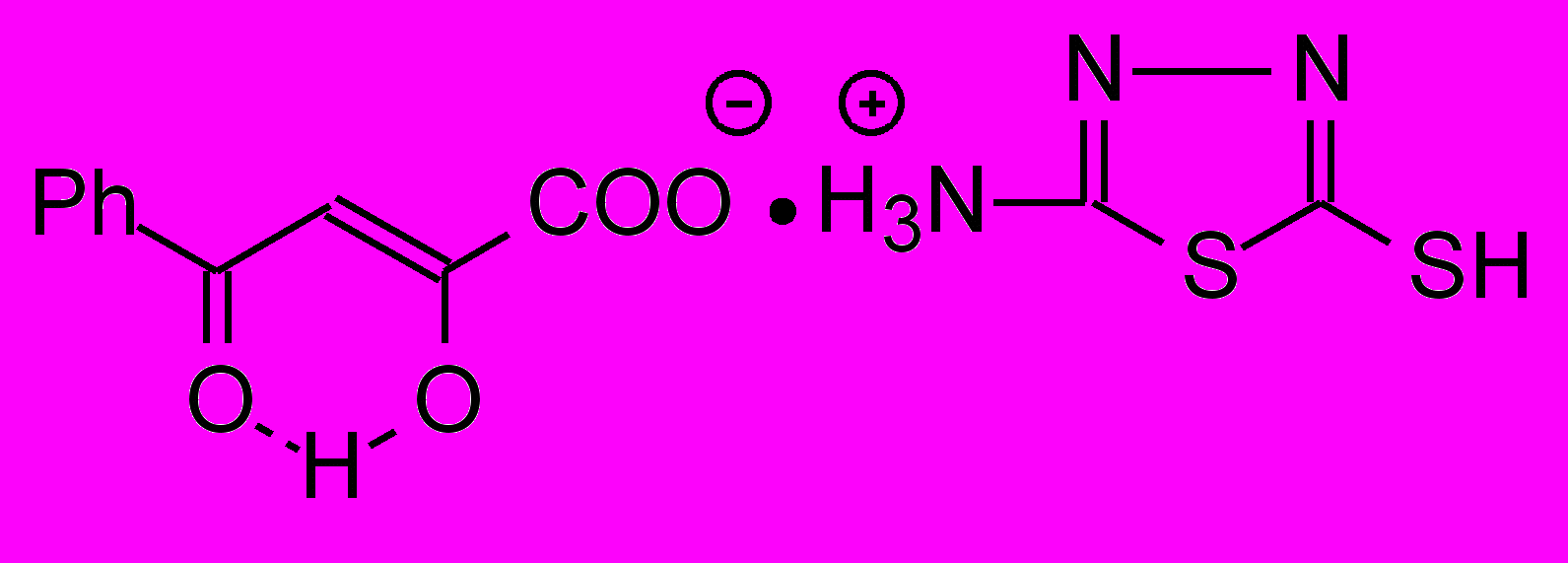 8к 8к | 17.3±1.3***1 |
 12в 12в | 17.5±1.4***1 | 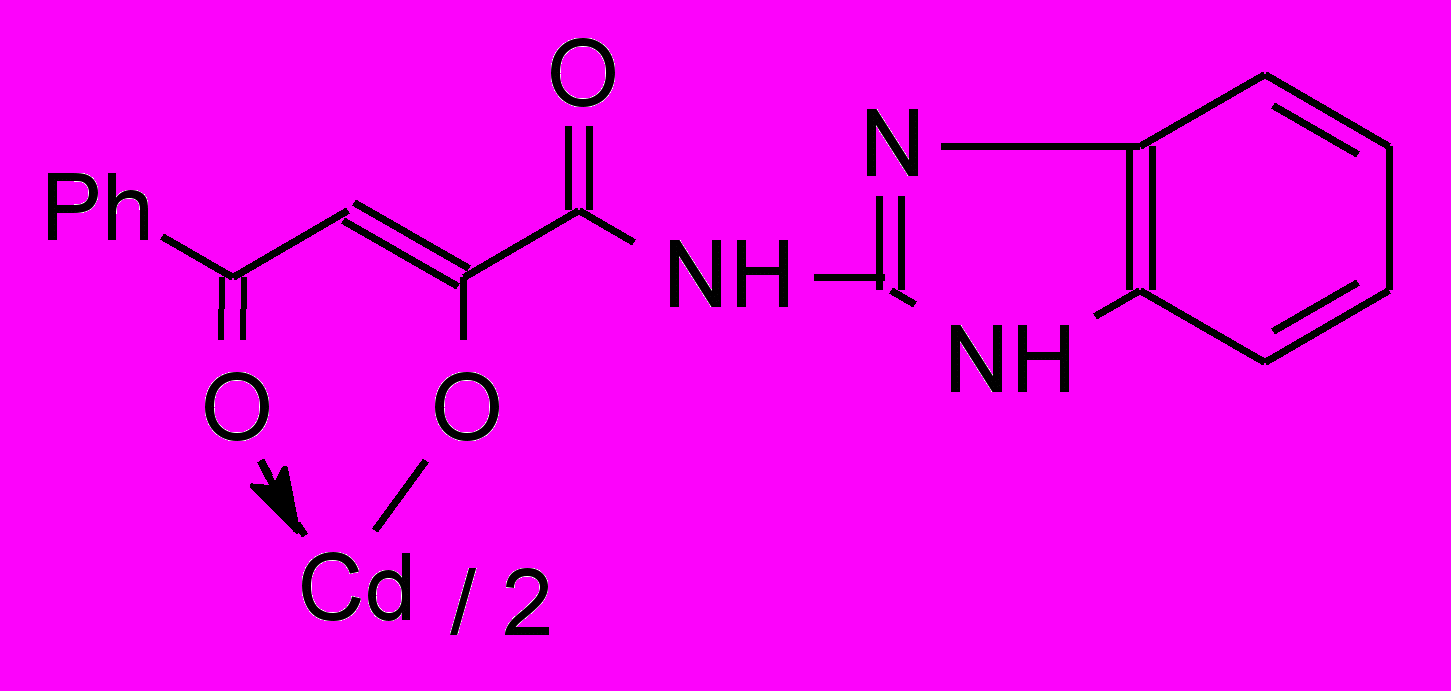 12л 12л | 18.0±0.7***1 ***2 |
 17а 17а | 16.7±1.05***1 | 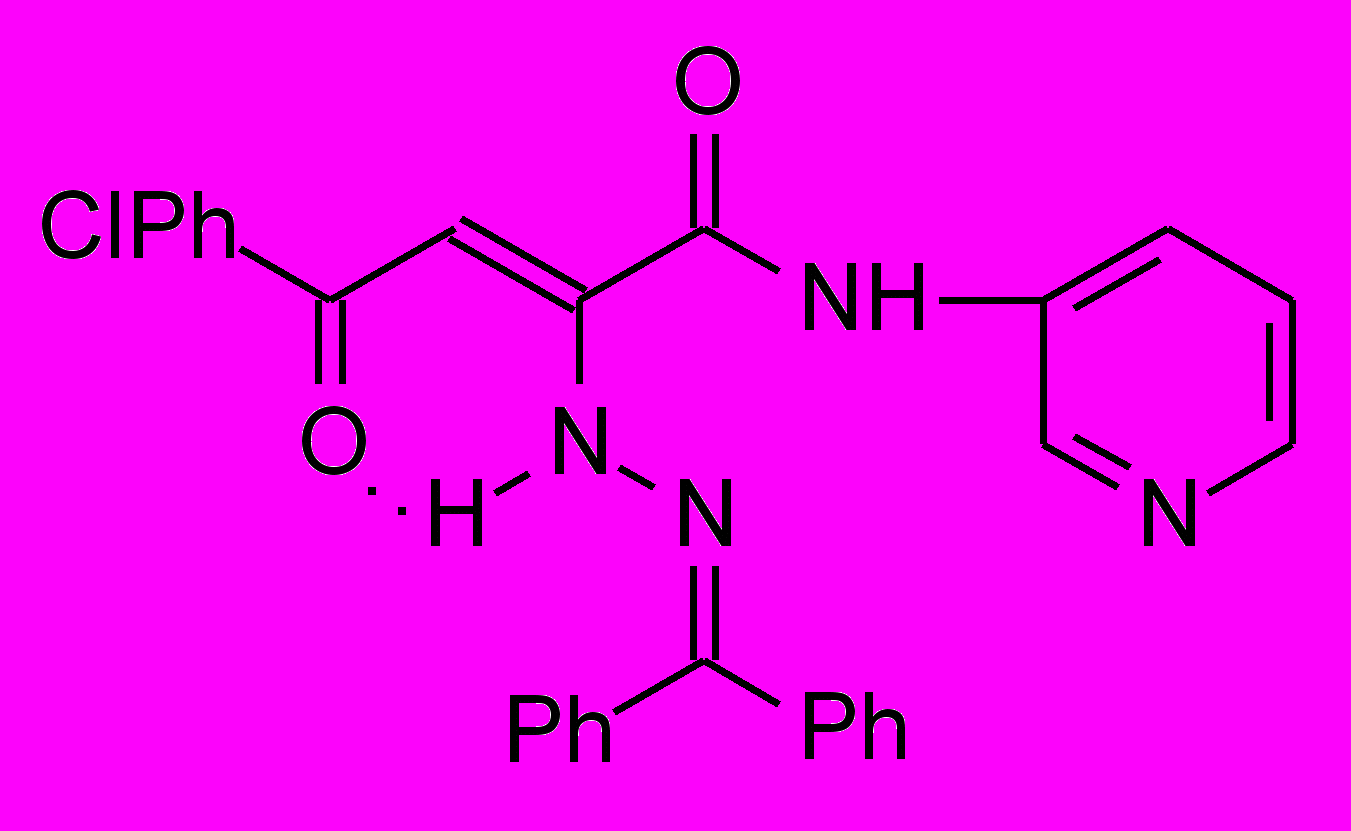 17в 17в | 18.3±1.05***1 ***2 |
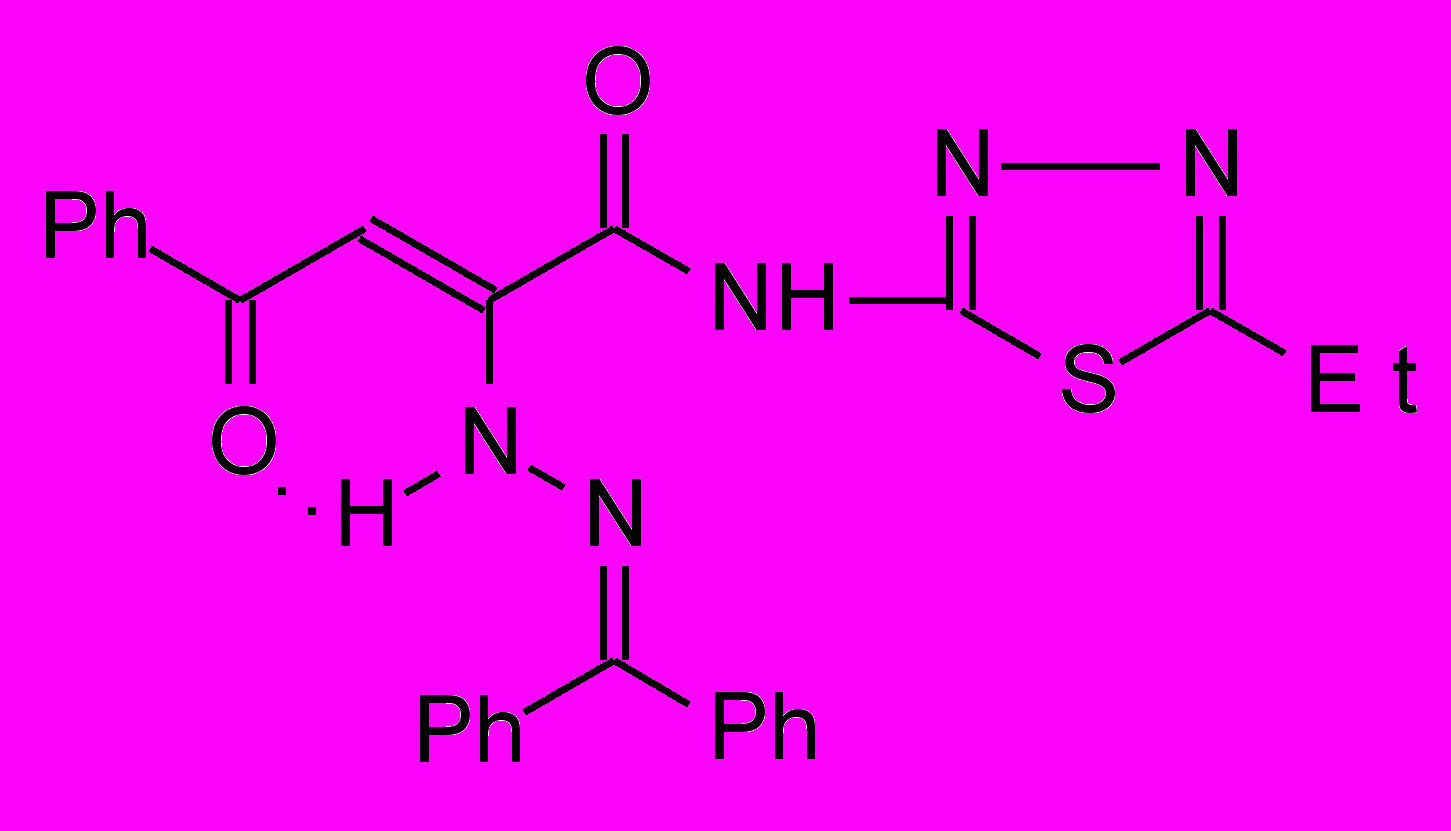 17к 17к | 27.0±1.2***1 | 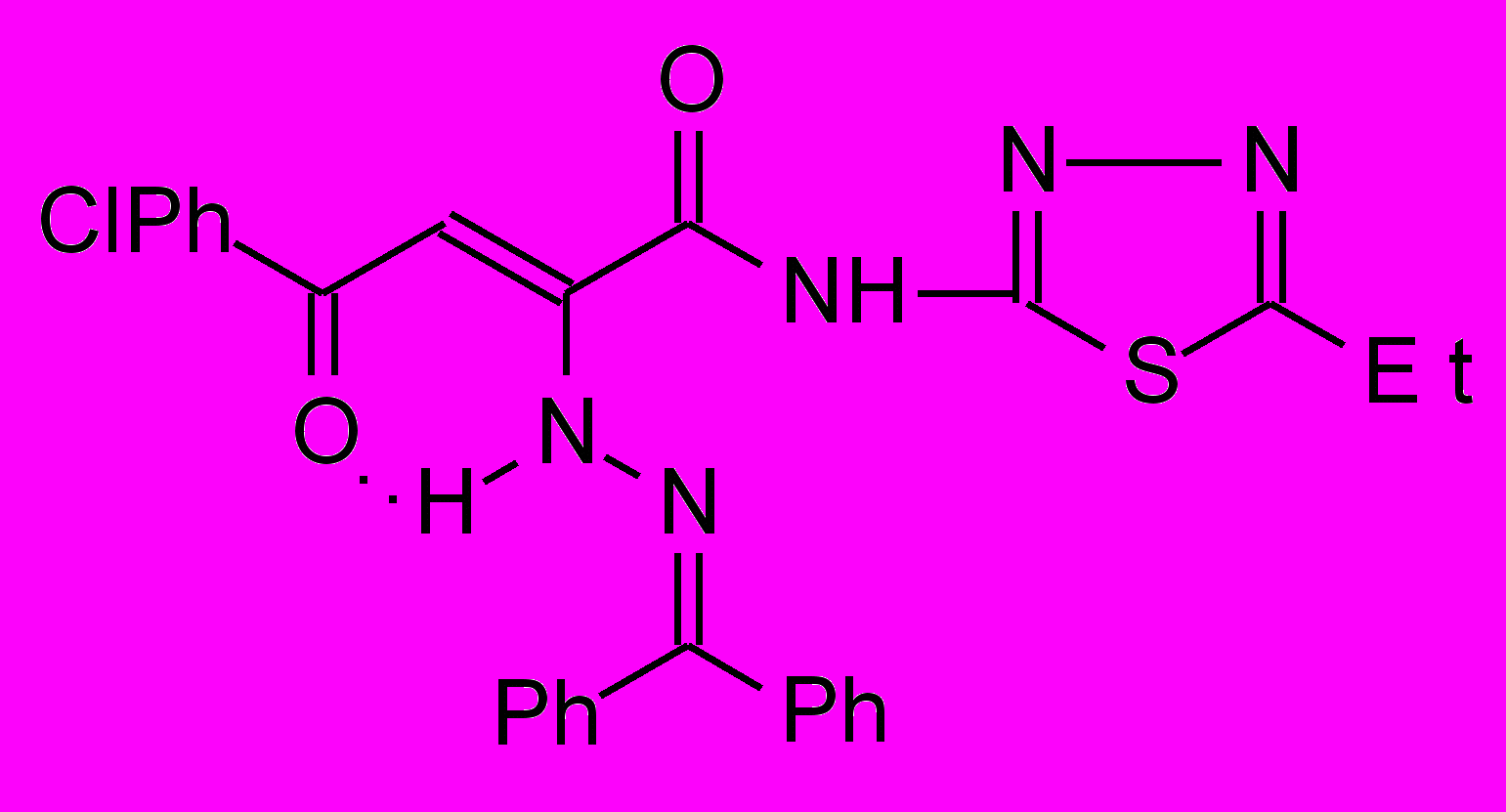 17л 17л | 17.6±0.9***1 ***2 |
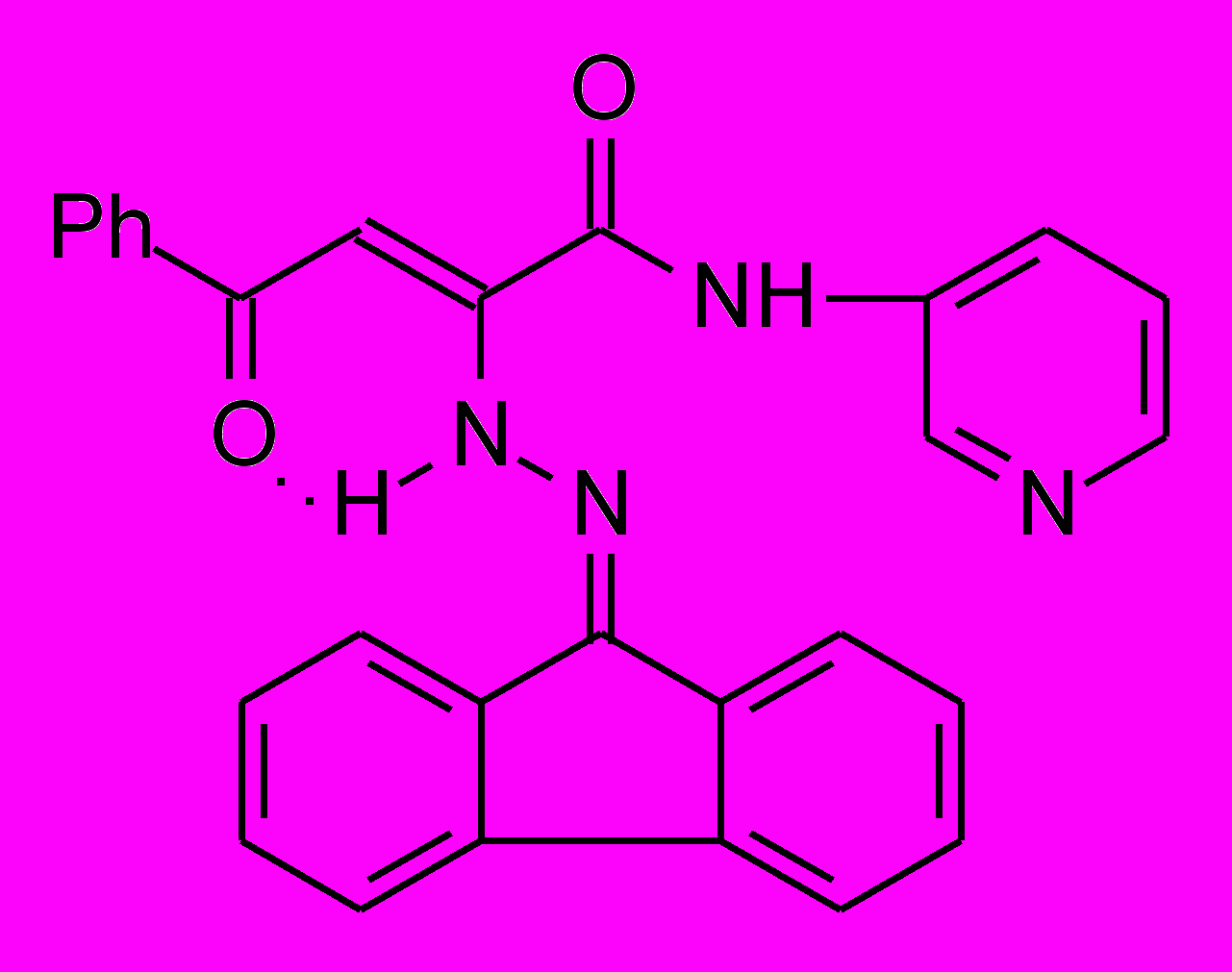 18б 18б | 21.0±0.4***1 ***2 | 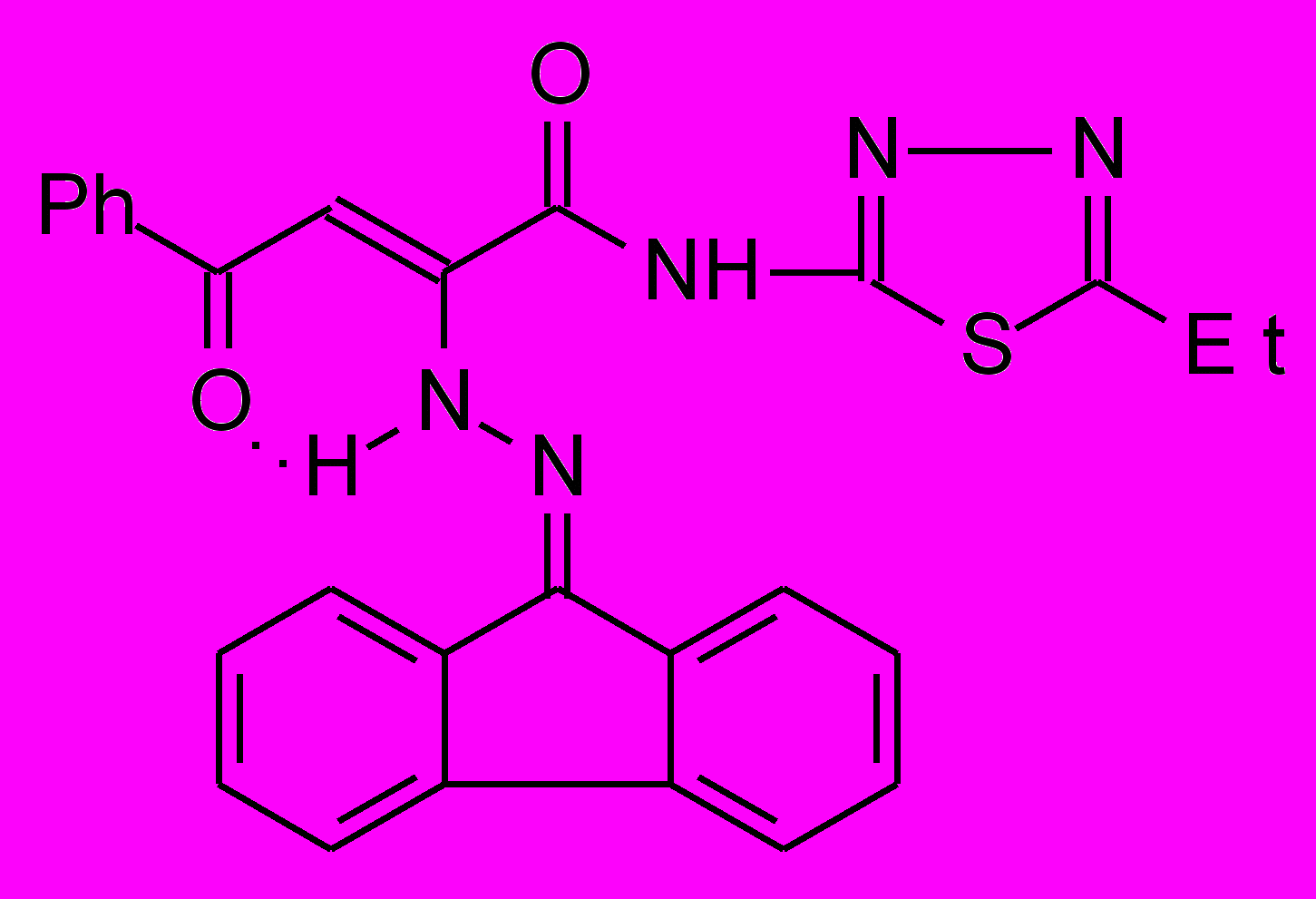 18к 18к | 16.0±0.6***1 ***2 |
 19ж 19ж | 16.3±0.8***1 ***2 | Контроль Метамизол натрия Диклофенак | 10.0±0.5 16.4±3.0*1 26.2±0.6***1 |
1− по сравнению с контролем; 2 – по сравнению с диклофенаком.
