Синтез и свойства новых производных 2 (1,2,4 триазолил 5 тио)уксусных кислот 15. 00. 02 фармацевтическая химия, фармакогнозия
| Вид материала | Автореферат |
- Синтез соединений на основе химических превращений производных α- оксокарбоновых кислот, 643.93kb.
- Синтез, свойства и биологическая активность енаминоамидов ацилпировиноградных кислот, 439.81kb.
- Синтез, свойства, биологическая активность n-гетериламидов α-оксокислот и продуктов, 367.21kb.
- Синтез, химические свойства и биологическая активность 1,4-дизамещенных 5-арил-3-гидрокси-3-пирролин-2-онов, 667.95kb.
- Синтез, свойства и биологическая активность продуктов взаимодействия 1,2,4-триазолов, 669.98kb.
- Химико-токсикологический анализ некоторых производных фенилалкиламина (кетамина, мидокалма,, 357.56kb.
- Примерная программа рекомендуется для направления подготовки (специальности) 111801, 717.4kb.
- Синтез и биологическая активность карбо- и гетероциклов на основе тетрацианоэтилена, 673.64kb.
- Программа курса «Аналитическая химия» специальность «Фармация», 92.69kb.
- Реферат Синтез и превращения азотпроизводных карбоновых кислот, 346.86kb.

На правах рукописи
АГЗАМОВА ЛИЛИЯ ФАТИХОВНА
СИНТЕЗ И СВОЙСТВА НОВЫХ ПРОИЗВОДНЫХ
2-(1,2,4-ТРИАЗОЛИЛ-5-ТИО)УКСУСНЫХ КИСЛОТ
15.00.02 – фармацевтическая химия, фармакогнозия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата фармацевтических наук
Москва – 2009
Р
 абота выполнена в Государственном образовательном учреждении высшего профессионального образования “Башкирский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию”.
абота выполнена в Государственном образовательном учреждении высшего профессионального образования “Башкирский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию”.Научный руководитель: доктор фармацевтических наук, профессор
Халиуллин Феркат Адельзянович
Официальные оппоненты: доктор химических наук, профессор
Звонкова Елена Николаевна
доктор фармацевтических наук, профессор
Прокофьева Вера Ивановна
Ведущая организация: Государственное образовательное учреждение высшего профессионального образования “Пермская государственная фармацевтическая академия Федерального агентства по здравоохранению и социальному развитию”
Защита диссертации состоится ”______”________________2009 г. в _______ на заседании диссертационного совета Д 006.070.01 при Всероссийском научно-исследовательском институте лекарственных и ароматических растений ВИЛАР РАСХН по адресу: 117216, Москва, ул. Грина,7.
С диссертацией можно ознакомиться в библиотеке ВИЛАР по адресу: 117216, Москва, ул. Грина,7.
Автореферат разослан ”______”________________2009 г.
Ученый секретарь
диссертационного совета Д 006.070.01,
доктор фармацевтических наук Алла Ивановна Громакова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность. Одним из направлений поиска новых лекарственных средств является синтез биологически активных веществ на основе гетероциклических соединений, являющихся фрагментами применяемых в медицине препаратов.
Среди гетероциклических лекарственных препаратов широко известны производные 1,2,4-триазола, которые применяются как высокоэффективные противогрибковые средства - флуконазол, итраконазол; противовирусные средства - рибавирин; противоопухолевые средства - летрозол и другие. У производных 1,2,4-триазола обнаружены и некоторые другие виды биологической активности: антибактериальная, антигипертоническая, аналептическая, анксиолитическая, антидепрессивная.
Ранее было установлено, что производные тиетансодержащих (бензимидазолилтио)- и (ксантинилтио)уксусных кислот обладают различной фармакологической активностью при низкой токсичности. Относящийся к ряду (триазолилтио)уксусных кислот, лекарственный препарат «тиотриазолин», разработанный на Украине, проявляет гепатопротекторное, антиоксидантное и иммуномодулирующее действие. Однако, тиетансодержащие (триазолилтио)уксусные кислоты в литературе не описаны.
На кафедре фармацевтической химии Башгосмедуниверситета синтезирован оригинальный ряд производных 1,2,4-триазола, содержащих четырехчленный тиетановый цикл - 3,5-дизамещенные 1-(тиетанил-3)-1,2,4-триазолы. Начато систематическое исследование свойств новых соединений. Остаются неизученными реакции тиетанилтриазолов с тиогликолевой кислотой; не разработаны также способы синтеза солей, эфиров, гидразидов и илиденгидразидов 2-(1,2,4-триазолил-5-тио)уксусных кислот, содержащих тиетановый цикл. Таким образом, разработка способов синтеза и поиск биологически активных соединений в ряду производных тиетансодержащих 2-(1,2,4-триазолил-5-тио)уксусных кислот составляют актуальную задачу.
Диссертационная работа выполнена в соответствии с планом научно-исследовательских работ ГОУ ВПО «Башкирский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию» по проблеме «Изыскание и изучение новых лекарственных средств».
Цель исследования. Разработка методов синтеза, установление физико-химических свойств и поиск биологически активных соединений в ряду новых производных 2-(1,2,4-триазолил-5-тио)уксусных кислот.
Задачи исследования.
1. Исследование реакций 3,5-дибром-1,2,4-триазолов, содержащих тиетановый цикл с различной степенью окисления серы, с тиогликолевой кислотой. Разработка методов синтеза тиетансодержащих производных 2-(3-бром-1,2,4-триазолил-5-тио)уксусных кислот.
2. Разработка методов синтеза солей, эфиров, гидразидов и илиденгидразидов тиетансодержащих 2-(3-бром-1,2,4-триазолил-5-тио)-уксусных кислот.
3. Исследование физико-химических свойств, установление строения и спектральных характеристик впервые синтезированных производных 2-(3-бром-1,2,4-триазолил-5-тио)уксусных кислот.
4. Оценка биологической активности синтезированных соединений с целью отбора высокоэффективных веществ для дальнейшего углубленного изучения.
Научная новизна. Впервые исследованы реакции 1-(тиетанил-3)-, 1-(1-оксотиетанил-3)- и 1-(1,1-диоксотиетанил-3)-3,5-дибром-1,2,4-триазолов с тиогликолевой кислотой. Разработаны способы синтеза 2-(3-бром-1,2,4-триазолил-5-тио)уксусных кислот, содержащих тиетановый, тиетаноксидный и тиетандиоксидный циклы.
Осуществлен синтез солей и эфиров 2-(3-бром-1,2,4-триазолил-5-тио)уксусных кислот, содержащих тиетановый, тиетаноксидный и тиетандиоксидный циклы.
Разработаны способы синтеза илиденпроизводных на основе реакций гидразидов 2-[1-(тиетанил-3)- и 2-[1-(1,1-диоксотиетанил-3)-1,2,4-триазолил-5-тио]уксусных кислот с ароматическими альдегидами и кетонами.
С помощью метода ЯМР 1Н - спектроскопии исследована Z, E - изомерия синтезированных гидразидов и илиденгидразидов. Установлено, что гидразиды и илиденгидразиды тиетансодержащих 2-(3-бром-1,2,4-триазолил-5-тио)уксусных кислот существуют в виде двух изомеров за счет заторможенного вращения вокруг гидразидной C-N связи.
Практическая значимость. Разработаны методы синтеза новых производных 2-(3-бром-1,2,4-триазолил-5-тио)уксусных кислот, содержащих тиетановый, тиетаноксидный и тиетанодиоксидный циклы. Синтезированные соединения представляют интерес как биологически активные вещества.
Производные 2-[1-(тиетанил-3)- и 2-[1-(1,1-диоксотиетанил-3)-1,2,4-триазолил-5-тио]уксусных кислот являются потенциальными антидепрессивными и антиагрегационными веществами. Изо-пропиловый эфир 2-[3-бром-1-(тиетанил-3)-1,2,4-триазолил-5-тио]уксусной кислоты, н-пропиловый и изо-пропиловый эфиры 2-[3-бром-1-(1,1-диоксотиетанил-3)-1,2,4-триазолил-5-тио]уксусной кислоты проявляют антидепрессивную активность, сравнимую с флуоксетином. Калиевая соль 2-[1-(тиетанил-3)-1,2,4-триазолил-5-тио]уксусной кислоты проявляет высокую антиагрегационную активность, превосходящую пентоксифиллин. Разработан лабораторный регламент на производство калиевой соли 2-[3-бром-1-(тиетанил-3)-1,2,4-триазолил-5-тио]уксусной кислоты.
Разработанные методы синтеза и результаты исследования биологической активности новых производных 2-(1,2,4-триазолил-5-тио)уксусных кислот могут использоваться для дальнейшего синтеза биологически активных соединений.
Внедрение в практику. Методики синтеза и данные биологической активности новых производных 2-(1,2,4-триазолил-5-тио)уксусных кислот используются при проведении научных исследований на кафедрах фармакологии №1, биологической и биоорганической химии, микробиологии Башкирского государственного медицинского университета и на кафедре фармакологии Волгоградского государственного медицинского университета.
Апробация диссертации. Материалы диссертации обсуждены на 71-й Республиканской итоговой научно-практической конференции студентов и молодых ученых с международным участием «Вопросы теоретической и практической медицины» (Уфа, 2006 г.), Республиканской конференции молодых ученых Республики Башкортостан «Медицинская наука - 2006» (Уфа, 2006 г.), VI Всероссийской интерактивной конференции молодых ученых «Современные проблемы теоретической и экспериментальной химии» (Саратов, 2007 г.), XV Российском национальном конгрессе «Человек и лекарство» (Москва, 2008г.).
Публикации. Основное содержание диссертации изложено в 8 печатных работах (4 статьях и 4 тезисах докладов научных конференций).
Положения, выносимые на защиту.
1. Разработанные методы синтеза 2-(3-бром-1,2,4-триазолил-5-тио)- уксусных кислот, содержащих тиетановый, тиетаноксидный и тиетандиоксидный циклы.
2. Разработанные методы синтеза солей и эфиров 2-(3-бром-1,2,4-триазолил-5-тио)уксусных кислот, содержащих тиетановый, тиетаноксидный и тиетандиоксидный циклы.
3. Разработанные методы синтеза гидразидов и илиденгидразидов 2-[1-(тиетанил-3)- и 2-[1-(1,1-диоксотиетанил-3)-3-бром-1,2,4-триазолил-5-тио]уксусных кислот.
4. Структуры впервые синтезированных соединений, установленные на основе спектральных исследований.
5. Результаты испытаний биологической активности синтезированных соединений.
Объем и структура диссертации. Диссертация изложена на 145 страницах, состоит из введения, обзора литературы, 3 глав экспериментальных исследований, выводов, списка литературы и приложения. Содержит 23 таблицы, 9 рисунков. Список литературы включает 191 источник.
СОДЕРЖАНИЕ ДИССЕРТАЦИИ
1. Синтез и биологическая активность замещенных 1,2,4-триазолов (литературный обзор)
В обзоре систематизированы литературные сведения о замещенных 1,2,4-триазолах, полученных реакциями по атомам азота и углерода 1,2,4-триазольного кольца, реакциями заместителей по атомам азота и углерода, а также об их биологической активности.
- Реакции 3,5-дибром-1,2,4-триазолов, содержащих тиетановый, тиетаноксидный и тиетандиоксидный циклы, с тиогликолевой кислотой
В качестве исходных соединений использовали 2-хлорметилтииран ( 1), 3,5-дибром-1,2,4-триазол (2), а также 3,5-дибром-1-(тиетанил-3)-1,2,4-триазол (3), 3,5-дибром-1-(1-оксотиетанил-3)-1,2,4-триазол (4), 3,5-дибром-1-(1,1-диоксотиетанил-3)-1,2,4-триазол (5), синтезированные по известным методикам с константами, соответствующими литературным данным.
Ранее были исследованы реакции 3,5-дибром-1,2,4-триазолов, содержащих тиетановый, тиетаноксидный и тиетандиоксидный циклы, с N- и O-содержащими нуклеофилами, а реакции с S-содержащими нуклеофилами остаются неисследованными. Нами изучены реакции нуклеофильного замещения 3,5-дибром-1,2,4-триазолов, содержащих тиетановый, тиетаноксидный и тиетандиоксидный циклы, с тиогликолевой кислотой.
Известно, что при наличии заместителя по N-1 положению 1,2,4-триазолов, содержащих галогены и нитрогруппу у атомов углерода в положениях 3 и 5, нуклеофильное замещение протекает по положению 5 триазольного кольца.
Исследование реакций 3,5-дибром-1-(тиетанил-3)-1,2,4-триазола 3 с тиогликолевой кислотой показало, что происходит замещение атома брома с образованием 2-[3-бром-1-(тиетанил-3)-1,2,4-триазолил-5-тио]уксусной кислоты (6). Для подбора оптимальных условий нами были исследованы различные условия получения кислоты 6. Наилучший выход 51% наблюдается при взаимодействии соединения 3 с двукратным избытком тиогликолевой кислоты в присутствии калия гидроксида в среде этанола при кипячении в течение 1 часа (схема 1).
Схема 1

Реакция 3,5-дибром-1-(1-оксотиетанил-3)-1,2,4-триазола 4 с тиогликолевой кислотой в условиях, аналогичных получению кислоты 6, приводит к 2-[3-бром-1-(1-оксотиетанил-3)-1,2,4-триазолил-5-тио]уксусной кислоте, которую трудно выделить из-за ее хорошей растворимости в воде. Поэтому выделили ее калиевую соль (7) с выходом 69% (схема 1). При использовании в реакции гидроксида натрия выделена натриевая соль 2-[3-бром-1-(1-оксотиетанил-3)-1,2,4-триазолил-5-тио]уксусной кислоты (8) с выходом 60% (схема 1).
Увеличение степени окисления атома серы может привести к повышению электрофильных свойств тиетанового цикла и, соответственно, уменьшению устойчивости тиетанового цикла к действию нуклеофильных реагентов. В литературе описаны случаи элиминирования тиетандиоксидного цикла под действием нуклеофильных реагентов (схема 2).
Схема 2

При взаимодействии 3,5-дибром-1-(1,1-диоксотиетанил-3)-1,2,4-триазола 5 с тиогликолевой кислотой установлено, что тиетандиоксидный цикл сохраняется и образуется 2-[3-бром-1-(1,1-диоксотиетанил-3)-1,2,4-триазолил-5-тио]уксусная кислота* (9) с выходом 67% (схема 1).
Спектр ЯМР 1Н соединения 6 содержит характерные сигналы протонов тиетанового цикла в виде трех мультиплетов в областях 3,3-3,5 м.д., 3,8-3,9 м.д. и 5,6-5,8 м.д., соответствующие двум S(CH)2-группам и одной NCH-группе. В спектре ЯМР 1Н соединения 7 содержатся мультиплеты протонов двух S(CH)2-групп тиетаноксидного цикла в областях 3,6-3,8 м.д. и 3,8-3,9 м.д. и мультиплет протона NCH-группы в интервале 5,7-5,8 м.д. В спектре ЯМР 1Н соединения 9 наблюдаются сигналы протонов двух S(CH)2-групп тиетандиоксидного цикла в областях 4,6-4,7 м.д. и 4,8-4,9 м.д. в виде двух мультиплетов с интенсивностью
в два протона, мультиплет протона NCH-группы регистрируется в интервале 5,3-5,5 м.д. Наличие в спектрах соединений 6, 7, 9 синглета около 4,0 м.д. с интенсивностью в два протона, принадлежащего CH2CO-группе, подтверждает наличие остатка тиогликолевой кислоты.
В ИК-спектрах кислот 6, 9 наблюдаются полосы поглощения С=О-связи при 1710 и 1728 см-1 соответственно, что подтверждает наличие карбоксильной группы. В ИК-спектрах солей 7, 8 наблюдаются сильные полосы поглощения около 1389 и 1580 см-1, обусловленные наличием карбоксилат иона. Сохранение тиетаноксидного и тиетандиоксидного циклов подтверждается полосами валентных колебаний S=O-связи при 1042 (7) и 1044 см-1 (8), SO2-группы при 1139 и 1313 см-1 (9).
________________________________________________________________________________
Примечание: * - данное соединение получено совместно с Макаровой Н.Н.
3. Синтез солей 2-(3-бром-1,2,4-триазолил-5-тио)уксусных кислот
Синтез солей 2-(3-бром-1,2,4-триазолил-5-тио)уксусных кислот представляет интерес с точки зрения поиска новых биологически активных веществ.
Установлено, что 2-(3-бром-1,2,4-триазолил-5-тио)уксусные кислоты 6, 9 при взаимодействии с основаниями образуют устойчивые соли.
Калиевые и натриевые соли (10, 11, 19, 20) получают при взаимодействии соответствующих кислот 6, 9 с 1,3-кратным мольным избытком калия или натрия гидроксида. Соли (10, 11) получают в водной среде с последующим высаживанием ацетоном. Соли (19, 20) получают в среде ацетона при добавлении калия или натрия гидроксида, растворенного в изо-пропаноле. Реакционную смесь кипятят 5 минут, после охлаждения осадок отфильтровывают. Выход солей 83-98% (схема 3).
При получении солей с аминами соответствующие кислоты 6, 9 растворяют в воде очищенной (12-16), ацетоне (21-23) или этаноле (17, 18, 22) при нагревании, добавляют 1,3-кратный мольный избыток амина и кипятят 5 минут. В случае соединений (12, 13, 16) реакционную смесь упаривают досуха и затирают остаток ацетоном. Соединения (17, 18, 21-23) отфильтровывают после охлаждения реакционной смеси, соединения (14, 15) высаживают ацетоном. Выход соединений 12-18, 21-23 составляет 43-97% (схема 3).
Схема 3

Спектры ЯМР 1Н синтезированных соединений 14, 15, 22, кроме сигналов протонов тиетанового, тиетаноксидного и тиетандиоксидного циклов в характерных областях, содержат сигналы протонов CH2CO-группы остатка тиогликолевой кислоты в виде синглета. Протоны остатка бензиламина соединения 14 регистрируются в виде мультиплета в области 7,30-7,48 м.д. и синглета при 3,97 м.д. В спектре соединения 15 два триплета при 2,82 м.д. и 3,56 м.д. принадлежат, соответственно, протонам NCH2- и OCH2-групп остатка моноэтаноламина. Сигналы протонов остатка морфолина соединения 22 наблюдаются в интервале 3,45-3,57 м.д. в виде мультиплета.
В ИК-спектрах солей 10-23 наблюдаются сильные полосы поглощения около 1400 см-1 и 1590 см-1, обусловленные наличием карбоксилат иона, а также группа небольших полос поглощения в интервале 2900-3042 см-1, обусловленная валентными колебаниями OH, NH, NH2+, NH3+-групп остатков аминов.
Данные спектров свидетельствуют о сохранении как остатка тиогликолевой кислоты, так и тиетанового цикла.
4. Синтез эфиров 2-(3-бром-1,2,4-триазолил-5-тио)уксусных кислот
С целью получения биологически активных соединений нами исследованы реакции синтезированных кислот 6, 9 и соли 7 со спиртами.
Установлено, что при кипячении соединений 6, 7, 9 в среде низших спиртов в течение 3 часов в присутствии концентрированной серной кислоты образуются соответствующие эфиры. Эфиры (24-26, 28-31) после охлаждения реакционной смеси отфильтровывают. В случае соединения (27) выделившееся масло извлекают диэтиловым эфиром. Эфиры 2-[3-бром-1-(тиетанил-3)-, 2-[3-бром-1-(1-оксотиетанил-3)- и 2-[3-бром-1-(1,1-диоксотиетанил-3)-1,2,4-триазолил-5-тио]уксусных кислот (24-31) образуются с выходом 60-93% (схема 4).
Схема 4
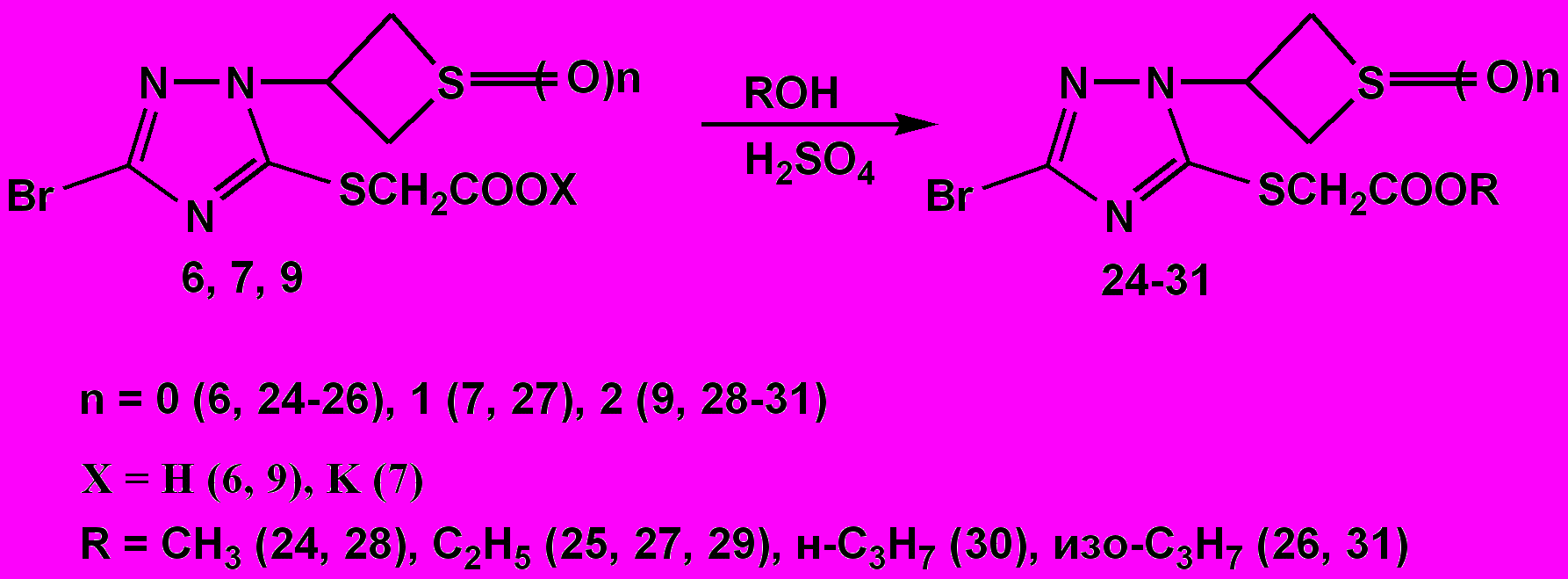
В ЯМР ¹Н спектрах синтезированных соединений 25, 27, 29 наблюдаются сигналы протонов тиетанового, тиетаноксидного и тиетандиоксидного циклов в характерных областях. Образование эфиров подтверждается сигналами протонов СН2СО-группы остатка тиогликолевой кислоты в виде синглета около 3,9 м.д., а также сигналами протонов остатка этанола в виде триплета с центром около 1,2 м.д. и квартета с центром около 4,1 м.д.
В ИК-спектрах эфиров 24-31 наблюдаются полосы поглощения около 1714-1738 см-1, обусловленные валентными колебаниями связи C=O.
5. Синтез гидразидов 2-(3-бром-1,2,4-триазолил-5-тио)уксусных кислот
С целью синтеза гидразидов нами исследованы реакции этиловых эфиров 2-(1,2,4-триазолил-5-тио)уксусных кислот, содержащих тиетановый цикл с различной степенью окисления серы, с гидразингидратом.
Гидразиды 2-[3-бром-1-(тиетанил-3)- ( 32) и 2-[3-бром-1-(1,1-диоксотиетанил-3)-1,2,4-триазолил-5-тио]уксусных кислот (33) образуются при кипячении этиловых эфиров соответствующих кислот 25, 29 с трехкратным мольным избытком гидразингидрата в этаноле с выходом 82-84% (схема 5).
Схема 5

Как известно, амидная группа является одним из примеров мезомерных структур. Все три заместителя у атома азота расположены в одной плоскости. Связь углерод - азот в амидах короче обычной связи С-N, а связь углерод-кислород длиннее обычной связи С=О. Двоесвязанность связи С-N создает определенный барьер вращения вокруг нее, поэтому появляется возможность существования двух плоских Z- и E-изомеров. Аналогичная возможность существует и у гидразидов.


R=2-[3-бром-1-(тиетанил-3)-1,2,4-триазолил-5-тио], 2-[3-бром-1-(1,1- диоксотиетанил-3)-1,2,4-триазолил-5-тио]
Наличие Z,E-изомерии у соединений 32, 33 подтверждается ЯМР-спектроскопией.
Например, спектр ЯМР ¹Н соединения 32, снятый в дейтерированном диметилсульфоксиде, содержит сигналы протонов тиетанового цикла в характерных областях. Два синглета при 3,83 и 4,27 м.д., принадлежат протонам СН2СО-группы и относятся к Z- и Е-изомерам соответственно. Два уширенных синглета при 8,73 и 9,29 м.д., принадлежащие протону СОNH-группы, соответствуют по интегральным интенсивностям Е- и Z-изомерам. Сигналы протонов NН2- группы также удвоены и регистрируются при 4,30 (Z) и 4,55 (Е) м.д. в виде уширенных синглетов. Преобладающим является Z-изомер, содержание которого вычислено по интегральным интенсивностям синглетов группы СН2СО и приблизительно составляет 90 %.
В спектре ЯМР ¹Н соединения 32, снятом в дейтерированном хлороформе, отсутствует удвоение сигналов CH2CO-, NH- и NH2-групп, что свидетельствует о том, что в хлороформе гидразид 32 существует только в единственной форме, которая по значению химического сдвига протонов группы CH2CO при 3,81 м.д. является Z-изомером.
В ИК-спектрах гидразидов 32, 33 поглощение валентных колебаний NH- и NH2-групп проявляется в виде нескольких полос в интервале 3186-3373 см-1. Валентные колебания C=O-группы обусловливают поглощение при 1670 (32) и 1715 (33) см-1.
УФ спектры соединения 32, снятые в 0,1 М растворе гидроксида натрия и 0,1 М растворе хлористоводородной кислоты, имеют максимумы поглощения при 220 нм и 205 нм, соответственно, что характерно для триазольного цикла.
6. Синтез илиденгидразидов 2-(3-бром-1,2,4-триазолил-5-тио)уксусных кислот
Для подтверждения структуры синтезированных гидразидов и поиска биологически активных соединений реакциями конденсации гидразидов 2-[3-бром-1-(тиетанил-3)- 32 и 2-[3-бром-1-(1,1-диоксотиетанил-3)-1,2,4-триазолил-5-тио]уксусных кислот 33 с ароматическими альдегидами и кетонами получен ряд илиденпроизводных.
Илиденгидразиды 2-[3-бром-1-(тиетанил-3)- (34-42) и 2-[3-бром-1-(1,1-диоксотиетанил-3)-1,2,4-триазолил-5-тио]уксусных кислот ( 43-51) получают кипячением раствора соответствующего гидразида 32, 33 и 1,1- кратного мольного избытка соответствующего ароматического альдегида или кетона в этаноле в течение 2-5 часов (34-39, 41-45, 48, 50). В случае соединений (40, 46, 47, 49) реакционную смесь кипятят 6-9 часов. Для протекания реакции с 2,5-дигидроксиацетофеноном (42, 51) и 4-гидроксиацетофеноном (41, 46) необходимо присутствие каталитических количеств хлористоводородной кислоты. Выход илиденгидразидов 34-51 составляет 51-97% (схема 6).
Схема 6

Илиденгидразиды 2-(3-бром-1,2,4-триазолил-5-тио)уксусных кислот могут существовать в виде четырех стереоизомерных форм за счет поворотной изомерии вокруг связи C-N (E, Z) и геометрической изомерии относительно связи C=N (E', Z').

Z Z' Z E' E Z' E E'
R = 2-[3-бром-1-(тиетанил-3)-1,2,4-триазолил-5-тио],
2-[3-бром-1-(1,1-диоксотиетанил-3)-1,2,4-триазолил-5-тио]

В ЯМР ¹Н спектрах соединений 34, 42, 43, 51 наблюдаются только два стереоизомера, что следует из удвоения сигналов протонов СН2СО-, N=CH-, NH-групп. По-видимому, появление изомеров обусловлено заторможенным вращением вокруг С-N связи.
Например, спектр ЯМР ¹Н соединения 34 содержит сигналы протонов двух S(CH)2- и NCH- группы тиетанового цикла. Синглеты при 4,01 и 4,40 м. д. принадлежат протонам СН2СО-группы Z- и Е- изомеров соответственно. Протоны N-метильных групп фиксируются в виде синглета при 2,96 м.д. Ароматические протоны наблюдаются при 6,72 м. д. в виде дублета и в интервале 7,40-7,54 м.д. в виде мультиплета с интенсивностью по два протона. Протон группы N=CH также дает два синглета при 7,87 м.д. (Е) и 8,01 м.д. (Z). Уширенные синглеты при 11,39 и 11,41 м.д. с суммарной интенсивностью в один протон принадлежат протону NH-группы (Е- и Z-изомеру соответственно). Содержание изомеров, вычисленное по интегральным интенсивностям синглетов группы СН2СО, приближенно равно 60% (Е) и 40% (Z).
В спектре соединения 42 синглеты метиленовых протонов СН2СО-группы также удвоены и регистрируются при 4,19 (Z) и 4,41 (Е) м.д. В области сильных полей наблюдаются синглеты протонов =ССН3-группы при 2,25 (Е) и 2,31 (Z) м.д. Также в спектре наблюдаются сигналы протона NH- группы виде синглетов при 10,18 м.д. (Е) и 11,23 м.д. (Z). Преобладающим является Z-изомер, содержание которого вычислено по интегральным интенсивностям синглетов группы СН2СО и приблизительно составляет 90%.
Для ИК-спектров илиденгидразидов 34-51 характерно поглощение в области 3005-3523 см-1, относящееся к валентным колебаниям O-H- и N-H-связей. Валентные колебания С=О-группы дают полосу в интервале 1664-1695 см-1. Вторая амидная полоса, связанная с деформационными колебаниями NH-группы, находится в интервале 1509-1539 см-1. Полосы поглощения в интервале 1602-1618 см-1 обусловлены валентными колебаниями азометиновой группы.
В УФ-спектрах соединений 34-37, 41, 42, снятых в 0,1М растворе гидроксида натрия или 0,1 М растворе хлористоводородной кислоты, максимумы поглощения наблюдаются в диапазоне длин волн 205-240 и 305-385 нм, характерных для триазольного цикла и азометиновой группы соответственно.
7. Биологическая активность синтезированных соединений
Биологические исследования новых производных 2-(1,2,4-триазолил-5-тио)уксусных кислот проводились на кафедрах фармакологии № 1, микробиологии, фармацевтической химии с курсами аналитической и токсикологической химии, биологической и биоорганической химии Башкирского государственного медицинского университета и на кафедре фармакологии Волгоградского государственного медицинского университета.
Для скрининга соединений, обладающих влиянием на гемореологический статус, использовали метод воспроизведения нарушений реологических свойств крови in vitro, заключающийся в инкубировании крови при 42,50С в течение 1 часа. В качестве препарата сравнения использовали пентоксифиллин в эквимолярной концентрации. Слабую антиагрегационную активность проявляют соединения 7, 32, а соединения 10, 12 и 15 проявили проагрегантное действие в отношении эритроцитов.
Таким образом, для солей 2-(3-бром-1,2,4-триазолил-5-тио)уксусных кислот, содержащих тиетановый цикл с различной степенью окисления серы, не характерна однонаправленность влияний на гемореологическую активность, они способны оказывать как антиагрегационное, так и проагрегантное действие в отношении эритроцитов.
Антиагрегационную активность производных 2-(1,2,4-триазолил-5-тио)уксусных кислот в отношении тромбоцитов изучали in vitro по методу Born на агрегометре “Thromlite-1006A” с использованием донорской крови человека. В качестве препарата сравнения использовали пентоксифиллин в эквимолярных концентрациях. Влияние соединений на агрегацию тромбоцитов оценивали по степени снижения агрегации при предварительной 5 минутной инкубации вещества в обогащенной тромбоцитами плазме.
Среди 10 исследованных солей 2-(3-бром-1,2,4-триазолил-5-тио)уксусных кислот высокую антиагрегационную активность проявила калиевая соль 10. Введение соединения 10 в концентрации 2 ммоль/л приводит к подавлению агрегации тромбоцитов на 61,0% относительно контроля. Пентоксифиллин в данной концентрации подавляет агрегацию тромбоцитов на 51,9%. При введении соединения 10 в концентрации 1 ммоль/л агрегация тромбоцитов снижается в среднем на 26,4%, что, примерно, в два раза превышает антиагрегационный эффект пентоксифиллина. При уменьшении концентрации до 0,5 ммоль/л агрегация тромбоцитов соединением 10 подавляется в среднем на 13,6%, а пентоксифиллин в данной концентрации активности не проявляет.
Острую токсичность (LD50) соединения 10 и препарата сравнения определяли по методу Литчфилда-Уилкоксона при однократном внутрибрюшинном введении мышам-самцам. Установлено, что LD50 соединения 10 составляет 900 мг/кг, а пентоксифиллина – 239 мг/кг, что позволяет отнести их к IV классу опасности (малотоксичные). Для соединения 10 разработан лабораторный регламент на производство.
Антидепрессивную активность 15 производных 2-(1,2,4-триазолил-5-тио)уксусных кислот определяли методом in vivo на половозрелых неинбредных мышах-самцах. В качестве препарата сравнения использовали флуоксетин, который вводили по схеме, аналогичной изучаемым соединениям в дозе 10 мг/кг. Антидепрессивная активность изучена в тестах принудительного плавания (FST) и подвешивания за хвост (TST). Из 15 исследованных производных 2-(1,2,4-триазолил-5-тио)уксусных кислот антидепрессивной активностью, сравнимой с флуоксетином в тесте FST, обладают соединения 26 и 30 в дозах 20 мг/кг (рис. 2). Соединение 31 в дозе 2 мг/кг проявляет антидепрессивную активность, сравнимую с флуоксетином в обоих тестах (рис. 1, 2). Депрессогенный эффект выявлен у соединения 43 (рис. 3).

Рис. 1. Влияние соединений 26, 30, 31, 43 и флуоксетина на длительность иммобилизации в TST
Примечание: ** - отличие от контроля статистически достоверно (р<0,05) по U-критерию Манна-Уитни.

Рис. 2. Влияние соединений 26, 30, 31, 43 и флуоксетина на длительность иммобилизации в FST.
Примечание: * - отличия от контроля статистически достоверно (р<0,05) по критерию Дана; ** - отличия от контроля статистически достоверно (р<0,05) по U-критерию Манна-Уитни.

Рис. 3. Влияние соединений 26, 30, 31, 43 и флуоксетина на индекс депрессивности в FST.
Примечание: * - отличия от контроля статистически достоверно (р<0,05) по критерию Дана; ** - отличия от контроля статистически достоверно (р<0,05) по U-критерию Манна-Уитни.
Противомикробную активность производных 2-(1,2,4-триазолил-5-тио)уксусных кислот определяли методом “диффузии в агар” на плотной элективной питательной среде. Из 26 исследованных соединений наибольшей активностью в отношении тестовых культур микроорганизмов обладают соединения 35, 44 и 45 в минимально подавляющей концентрации (МПК) 1,57 мг/мл. По-видимому, противомикробный эффект обусловлен наличием остатка бромсалицилового (35, 44) или салицилового альдегида (45).
Кардиотоническую активность производных 2-(1,2,4-триазолил-5-тио)уксусных кислот определяли in vitro путем установления наличия компексообразования с катионами кальция методом УФ-спектрофотометрии. Из 4 исследованных соединений (6, 9, 32, 33), только соединение 9 обладает слабой кардиотонической активностью.
Антиоксидантную активность солей 2-(1,2,4-триазолил-5-тио)уксусных кислот оценивали in vitro по способности исследуемых веществ ингибировать
Т
 аблица 1
аблица 1Антиоксидантная активность солей 2-(3-бром-1,2,4-триазолил-5-тио)уксусных кислот
| Ингибирование аутоокисления адреналина гидрохлорида, в %* | ||||||||||||
| Соединение | Аскорбиновая кислота | 10 | 11 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 22 | 2  3 3 |
| Концентрация иссл. в-ва, ммоль/л | ||||||||||||
| 0,1 | 6,8 | 26,9 | 22,5 | 24,8 | 6,7 | 0,6 | 7,4 | 4,6 | 4,3 | -9,2 | -5,9 | 7,5 |
| 0,05 | 4,9 | 16,6 | 26,2 | 9,5 | 9,0 | 1,5 | 10,3 | -0,4 | 1,9 | -6,2 | -5,6 | 6,3 |
Примечание: * - приведено среднее значение для трех измерений.
аутоокисление адреналина до адренохрома в щелочной среде при комнатной температуре методом УФ-спектрофотометрии. В качестве препарата сравнения использована аскорбиновая кислота. Из 11 исследованных соединений наибольшую антиоксидантную активность проявляют соли 10, 11, 14, 15, 17 в концентрациях 0,05 ммоль/л и 0,1 ммоль/л (табл. 1).
ВЫВОДЫ
1. Установлено, что при реакции 3,5-дибром-1,2,4-триазолов, содержащих тиетановый цикл с различной степенью окисления серы, с тиогликолевой кислотой происходит замещение атома брома по положению 5 триазольного кольца, а тиетановый цикл сохраняется. Разработаны методы синтеза 2-(3-бром-1,2,4-триазолил-5-тио)уксусных кислот, содержащих тиетановый, тиетаноксидный и тиетандиоксидный циклы.
2. Разработаны методы синтеза солей 2-(3-бром-1,2,4-триазолил-5-тио)уксусных кислот, содержащих тиетановый цикл с различной степенью окисления серы, реакциями соответствующих кислот с гидроксидами щелочных металлов и аминами.
3. Разработаны методы синтеза эфиров 2-(3-бром-1,2,4-триазолил-5-тио)уксусных кислот, содержащих тиетановый цикл с различной степенью окисления серы, реакциями соответствующих кислот или их калиевых солей с низшими спиртами в присутствии концентрированной серной кислоты.
4. Разработаны методы синтеза гидразидов 2-(3-бром-1,2,4-триазолил-5-тио)уксусных кислот, содержащих тиетановый цикл с различной степенью окисления серы, реакциями этиловых эфиров 2-[3-бром-1-(тиетанил-3)- и 2-[3-бром-1-(1,1-диоксотиетанил-3)-1,2,4-триазолил-5-тио]уксусных кислот с гидразингидратом.
5. Разработаны методы синтеза илиденпроизводных 2-[3-бром-1-(1-тиетанил-3)- и 2-[3-бром-1-(1,1-диоксотиетанил-3)-1,2,4-триазолил-5-тио]уксусных кислот взаимодействием гидразидов 2-[3-бром-1-(тиетанил-3)- и 2-[3-бром-1-(1,1-диоксотиетанил-3)-1,2,4-триазолил-5-тио]уксусных кислот с ароматическими альдегидами и кетонами.
6. Данными ЯМР 1Н-спектроскопии показано, что гидразиды и илиденгидразиды 2-[3-бром-1-(1-тиетанил-3)- и 2-[3-бром-1-(1,1-диоксотиетанил-3)-1,2,4-триазолил-5-тио]уксусных кислот существуют в виде Z- и E-изомеров относительно связи C(O)-N.
7. Среди синтезированных соединений обнаружены вещества с антиагрегационной, антидепрессивной, кардиотонической, антиоксидантной и противомикробной активностью.
8. Выявлены вещества, перспективные для дальнейшего углубленного изучения: изо-пропиловый эфир 2-[3-бром-1-(тиетанил-3)-1,2,4-триазолил-5-тио]уксусной кислоты, н-пропиловый и изо-пропиловый эфиры 2-[3-бром-1-(1,1-диоксотиетанил-3)-1,2,4-триазолил-5-тио]уксусной кислоты, проявляющие антидепрессивную активность; калиевая соль 2-[3-бром-1-(тиетанил-3)-1,2,4-триазолил-5-тио]уксусной кислоты, проявляющая высокую антиагрегационную активность. Разработан лабораторный регламент на производство калиевой соли 2-[3-бром-1-(тиетанил-3)-1,2,4-триазолил-5-тио]уксусной кислоты.
Основное содержание диссертации опубликовано в работах:
1. Набиева Г.И., Рассказова А.П., Багаутдинова Л.Ф. Синтез новых производных 2-(3-бром-1,2,4-триазолил-5)уксусных кислот, содержащих тиетаноксидный и тиетандиоксидный циклы / Вопросы теоретической и практической медицины: матер. 71-й Республиканской итог. науч.-практич. конф. студентов и молодых ученых с междун. участием. - Уфа, 2006. - С. 450-451.
2. Клен Е.Э., Багаутдинова Л.Ф., Набиева Г.И. Синтез илиденпроизводных 2-(3-бром-1,2,4-триазолил-5)уксусных кислот, содержащих тиетановый и тиетандиоксидный циклы / Медицинская наука - 2006: матер. 5-й юбил. Республиканской конф. молодых ученых РБ, посв. Году Благоустройства, Дню Медицинского работника. - Уфа, 2006. - С. 69-70.
3. Клен Е.Э., Мещерякова С.А., Багаутдинова Л.Ф., Халиуллин Ф.А. Синтез и кардиотоническая активность новых производных (3-бром-1,2,4-триазолил-5-тио)уксусных кислот / Актуальные вопросы современной фармации и фармацевтического образования: сб. науч. трудов юбил. конф., посв. 25-летию фарм. факультета БГМУ. - Уфа, 2006. - С. 197-199.
4. Багаутдинова Л.Ф., Клен Е.Э., Халиуллин Ф.А. Синтез 2-(3-бром-1,2,4-триазолил-5-тио)уксусных кислот, содержащих тиетановый цикл в различных степенях окисления серы / Современные проблемы теоретической и экспериментальной химии: матер. VI Всероссийской интерактивной конф. молодых ученых. - Саратов, 2007. - С. 62-63.
5. Халиуллин Ф.А., Клен Е.Э., Мещерякова С.А., Саитгалина А.З., Багаутдинова Л.Ф. Синтез потенциально биологически активных тиетансодержащих производных триазола и ксантина / Медицинский вестник Башкортостана. - 2007. - Т. 2, № 3-4. - С. 105-108.
6. Клен Е.Э., Макарова Н.Н., Никитина И.Л., Халиуллин Ф.А., Багаутдинова Л.Ф., Иванова О.А., Габидуллин Р.А., Алехин Е.К. Поиск биологически активных веществ среди производных 1,2,4-триазола, содержащих тиетановый цикл в различных степенях окисления серы / Сборник материалов конгресса: матер. XV Российского национ. конгресса «Человек и лекарство». - Москва, 2008. - С. 634-635.
7. Клен Е.Э., Халиуллин Ф. А., Спасов А.А., Макарова Н.Н., Багаутдинова Л.Ф., Науменко Л.В. Синтез новых производных 1,2,4-триазола и их влияние на реологические свойства крови / Хим.-фарм. журн. -2008. - Т. 42, № 9. - С. 72-74.
8. Клен Е.Э., Халиуллин Ф. А., Агзамова Л.Ф., Никитина И.Л., Алехин Е.К., Иванова О.А., Габидуллин Р.А. Синтез и антидепрессивная активность эфиров 2-(3-бром-1,2,4-триазолил-5-тио)уксусных кислот, содержащих тиетановый цикл / Башкирский химический журнал. - 2008. - Т. 15, № 4. - С. 21-22.

АГЗАМОВА ЛИЛИЯ ФАТИХОВНА
СИНТЕЗ И СВОЙСТВА НОВЫХ ПРОИЗВОДНЫХ
2-(1,2,4-ТРИАЗОЛИЛ-5-ТИО)УКСУСНЫХ КИСЛОТ
15.00.02 – фармацевтическая химия, фармакогнозия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата фармацевтических наук
Подписано к печати «___» ___________ 2009 г. Формат
Бумага книжно-журнальная. Печать ротапринтная. Усл. печ. л.
Тираж 100 экз. Заказ № ________.
ГОУ ВПО Башгосмедуниверситет росздрава
450000, г. Уфа, ул. Ленина,3

