Синтез, химические свойства и биологическая активность 1,4-дизамещенных 5-арил-3-гидрокси-3-пирролин-2-онов 15. 00. 02 Фармацевтическая химия, фармакогнозия
| Вид материала | Диссертация |
- Синтез, свойства и биологическая активность енаминоамидов ацилпировиноградных кислот, 439.81kb.
- Синтез, свойства, биологическая активность n-гетериламидов α-оксокислот и продуктов, 367.21kb.
- Синтез соединений на основе химических превращений производных α- оксокарбоновых кислот, 643.93kb.
- Синтез, свойства и биологическая активность продуктов взаимодействия 1,2,4-триазолов, 669.98kb.
- Синтез и биологическая активность карбо- и гетероциклов на основе тетрацианоэтилена, 673.64kb.
- Синтез и свойства новых производных 2 (1,2,4 триазолил 5 тио)уксусных кислот 15. 00., 240.9kb.
- Синтез, свойства и биологическая активность производных 2-хлорникотинонитрилов, 264.36kb.
- Примерная программа рекомендуется для направления подготовки (специальности) 111801, 717.4kb.
- Синтез и физико-химические свойства координационных соединений рения(V) с производными, 208.83kb.
- Синтез и химические свойства дикарбонильных соединений адамантанового ряда 02. 00., 667.04kb.
На правах рукописи
ГЕЙН Людмила Федоровна
Синтез, химические свойства и биологическая активность 1,4-дизамещенных 5-арил-3-гидрокси-3-пирролин-2-онов
15.00.02 – Фармацевтическая химия, фармакогнозия
АВТОРЕФЕРАТ
Диссертация на соискание ученой степени
доктора фармацевтических наук
Пермь, 2009
Работа выполнена в ГОУ ВПО «Пермская государственная медицинская академия им. ак. Е.А. Вагнера Федерального агентства по здравоохранению и
социальному развитию» и в ГОУ ВПО «Пермская государственная фармацевтическая академия Федерального агентства по здравоохранению и социальному развитию»
Официальные оппоненты: доктор фармацевтических наук, профессор
Петриченко В.М., ГОУ ВПО «Пермская
государственная фармацевтическая академия
Федерального агентства по здравоохранению и
социальному развитию»
доктор фармацевтических наук, профессор
Халиуллин Ф.А., ГОУ ВПО «Башкирский
государственный медицинский университет
Федерального агентства по здравоохранению и
социальному развитию»
доктор химических наук, профессор
Шкляев Ю.В., Институт технической химии
УрО РАН, г. Пермь
Ведущая организация: «Пятигорская государственная фармацевтическая
академия Федерального агентства по здравоохранению и социальному развитию»
Защита состоится « 27 » октября 2009 года в 13 часов на заседании диссертационного совета Д 208.068.01 при Пермской государственной фармацевтической академии по адресу: 614990, г. Пермь, ГСП-277, ул. Ленина, 48, e-mail: perm@pfa.ru, факс 212-94-76
С диссертацией можно познакомиться в библиотеке Пермской государственной фармацевтической академии по адресу: 614070, г.Пермь,
ул. Крупская, 46.
Автореферат разослан «____ » сентября 2009 г.
Ученый секретарь диссертационного совета,
кандидат фармацевтических наук, доцент Липатникова И.А.
Общая характеристика работы
Актуальность проблемы. Важнейшей задачей современной фармацевтической химии является поиск новых малотоксичных соединений с высокой биологической активностью. Среди соединений ряда пирролидин-2,3-дионов и их производных, которые являются структурными аналогами пирацетама, а также конденсированных систем, полученных на их основе, обнаружены вещества с различными видами биологической активности, а именно ноотропной противовоспалительной, анальгетической, противомикробной, антиагрегантной по отношению к тромбоцитам, и противовирусной активностью. Биологической активностью обладают и ближайшие структурные аналоги тетрагидропиррол-2,3-дионов – тетрагидрофуран-2,3-дионы. С этой точки зрения 1,4,5-тризамещенные тетрагидропиррол-2,3-дионы – пятичленные азотистые гетероциклы, содержащие в положениях 1,4,5 различной природы заместители, представляют интерес, как класс органических веществ, одним из перспективных путей использования которых является синтез на их основе новых биологически активных веществ. В связи с этим не менее важным является разработка способов синтеза тетрагидропиррол-2,3-дионов, позволяющих широко варьировать заместители в положениях 1,4 и 5 гетероцикла, используя общую методологию формирования замещенных тетрагидропиррол-2,3-дионов, что значительно расширяет круг изучаемых объектов. Тетрагидропиррол-2,3-дионы обладают своеобразными химическими свойствами, они легко вступают в реакции с различными нуклеофильными и бинуклеофильными реагентами за счет карбонильной группы как в положении 3 гетероцикла, так и карбонильной группы боковой цепи в положении 4, что позволяет формировать различные конденсированные гетероциклические системы. Для фармацевтической химии тетрагидропиррол-2,3-дионы интересны прежде всего как модели для синтеза соединений с ноотропной, анальгетической, противовоспалительной и противомикробной активностью. Таким образом, синтез тетрагидропиррол-2,3-дионов, изучение их химических свойств, биологической активности и влияния строения на биологическую активность является актуальным.
Цель работы. Совершенствование известных и поиск новых методов синтеза эффективных и малотоксичных биологически активных соединений на основе 1,4,5-тризамещенных тетрагидропиррол-2,3-дионов, содержащих в положении 1 различным образом функционализированные алкильные, гетерильные заместители, атом водорода, а также ароильные или гетероильные заместители в положении 4.
Задачи исследования.
- Осуществить синтез 5-арил-4-ацил-3-гидрокси-3-пирролин-2-онов,
содержащих в положении 1 атом водорода, различные алкильные, гидроксиалкильные, карбоксиалкильные заместители и их функцио- нальные производные;
- Осуществить синтез 5-арил-3-гидрокси-3-пирролин-2-онов, содержащих
в положении 1 и 4 гетерильные заместители;
- Изучить трехкомпонентную реакцию эфиров ароилпировиноградных
кислот со смесью ароматического альдегида и 5-аминотетразола,
установить влияние нингидрина и изатина на протекание трехкомпонентной реакции вместо ароматического альдегида;
- Разработать простые препаративные методы синтеза 1-алкил и 1,5-
диарил-4-метилсульфонил-3-гидрокси-3-пирролин-2-онов;
- Изучить реакции синтезированных 3-гидрокси-3-пирролин-2-онов с
моно- и бинуклеофильными реагентами, алифатическими диазосоедине-
ниями, солями арилдиазония и другими алкилирующими и
ацилирующими реагентами;
- Провести фармакологический скрининг полученных соединений,
проанализировать его результаты, установить зависимость между
биологической активностью веществ и их строением, выбрать
наиболее перспективные вещества для их дальнейшего углубленного
изучения в качестве потенциальных лекарственных средств.
Научная новизна. Разработана методология синтеза 1,4,5-тризамещенных пирролидин-2-онов на основе трехкомпонентной реакции метиловых эфиров ацилпировиноградных кислот со смесью ароматического альдегида и амина. Разработан метод синтеза 5-арил-4-ацил-1Н(алкил, гидроксиалкил)-3-гидрокси-3-пирролин-2-онов, 5-арил-4-ацил-1-гетерил-3-гидрокси-3-пирролин-2-онов и 1,5-диарил-4-(2-тиеноил)(2-фураноил)-3-гидрокси-3-пирролин-2-онов. На основе трехкомпонентной реакции с участием аминокарбоновой кислоты (ее эфира, амида, нитрила) разработан простой способ синтеза 5-арил-4-ацил-1-карбоксиалкил-3-гидрокси-3-пирролин-2-онов и их функциональных производных. Установлено, что при использовании в реакции формирования пирролидинового цикла глицинамида образуются 3-бензоилметилен-5-арилметиленпиперазин-2,6-дионы. Установлено, что взаимодействие этилового эфира метилсульфонилпировиноградных кислот или его натриевой соли с смесью ароматического альдегида и алкил- или ариламина приводит к образованию солей, из которых при обработке соляной кислотой получаются 1-алкил и 1,5-диарил-4-метилсульфонил-3-гидрокси-3-пирролин-2-оны. Для установления пространственного строения полученных соединений проведен рентгеноструктурный анализ молекул 1,5-дифенил-3-гидрокси-4-метилсульфонил-3-пирролин-2-она. Изучено взаимодействие полученных 1,4,5-тризамещенных 3-гидрокси-3-пирролин-2-онов с моно- и бинуклеофилами. Установлено, что в основном реакция протекает по атому углерода енолизованной карбонильной группе в положении 3 гетероцикла с образованием арил(алкил)-аминопроизводных. При использовании в качестве исходных соединений 5-арил-4-ацетил-3-гидрокси-1-карбоксиалкил-3-пирролин-2-онов в реакциях с ароматическими аминами атака нуклеофильного реагента переносится на карбонильную группу боковой цепи и единственным продуктом реакции являются 5-арил-4-(1-арил(алкил)аминоэтилиден)-1-карбоксиалкилпиррол-2,3-дионы. Впервые взаимодействием эфиров ароилпировиноградных кислот со смесью ароматического альдегида и 5-аминотетразола получены тетразоло[1,5-a]пиримидины. Установлено, что взаимодействие метилового эфира ацетилпировиноградной кислоты, нингидрина и метиламина приводит к образованию спиропроизводных фурана, тогда как аналогичная реакция с изатином в качестве альдегида – спиропроизводных пиррола. Разработан простой способ синтеза 4-незамещенных 1-арил-5-метил-5-этоксикарбонилтетрагидропиррол-2,3-дионов и их 3-ариламинопроизводных. Взаимодействие 1,4,5-тризамещенных 3-гидрокси-3-пирролин-2-онов с гидразингидратом и этилендиамином, о-фенилендиамином приводит соответственно к образованию конденсированной системы пирролопиразола, пирролодиазепина. Взаимодействием 1,5-диарил-4-метилсульфонил-3-гидрокси-3-пирролин-2-нов с о-фенилендиамином впервые получены конденсированные системы пирроло[2,3-b]хиноксалина. На основании данных ИК и ЯМР 1Н спектроскопии, масс-спектрометрии и рентгеноструктурного анализа установлена структура полученных соединений. Осуществлен синтез 530 новых веществ, 303 из которых подвергнуто биологическим испытаниям на различные виды биологической активности.
Приактическая значимость. Разработаны препаративные методы синтеза 5-арил-4-ацил-3-гидрокси-1Н-3-пирролин-2-онов, 5-арил-4-ацил-3-гидрокси-1-алкил-3-пирролин-2-онов, 5-арил-4-ацил-1-гидроксиметил(алкил)-3-гидрок-си-3-пирролин-2-онов, 5-арил-4-ацил-3-гидрокси-1-карбоксиалкил-3-пирро-лин-2-онов и их производных: 5-арил-4-ацил-3-гидрокси-1-метокси(этокси)-карбонилметил-3-пирролин-2-онов и 1-аминокарбонилметил-5-арил-4-ацил-3-гидрокси-3-пирролин-2-онов, 5-арил-4-ацил-3-гидрокси-1-(карбокси-2-фенилпропил)-3-пирролин-2-онов, 1,5-диарил-4-(2-тиеноил(фураноил))-3-гидрокси-3-пирролин-2-онов, 5-арил-4-ароил-1-гетерил-3-гидрокси-3-пирро-лин-2-онов, 1,5-диарил-3-гидрокси-4-метилсульфонил-3-пирролин-2-онов, 1-арил-5-метил-5-этоксикарбонил-3-пирролин-2-онов, 3-ариламинопроизвод-ных 3-пирролин-2-онов, 4-(1-ариламиноэтилиден)пиррол-2,3-дионов, 4-арилгидразонов 1-арил-5-метил-5-этоксикарбонилпирролидин-2,3,4-трионов, 7-арил-6-ацил-5-метоксикарбонил-4,7-дигидротетразоло[1,5-a]пиримидинов, 4-ацил-3-гидроксиспиро-[2.5-дигидрофуран-5,2’-индан]-2,1’,3’-трионов, 3-гидрокси-4-(3-метоксибензоил)-спиро[2.5-дигидрофуран-5,3’-индол]- 2,2’-дионов, 1-замещенных 4-ацетил-3-гидроксиспиро-[2,5-дигидропиррол-5,3’-индол]-2,2’-дионов, 3-амино-4-бензоил-1-карбоксиалкил-5-фенил-3-пирролин-2-онов и 3-амино-1,5-диарил-метилсульфонил-3-пирролин-2-онов,
5-замещенных 3,4-диарилпирроло[3,4-с]пиразол-6-онов, 6-арил-5-метил-8-оксо-6Н-пирроло[3,4-f]1Н,7Н-2,3-дигидро-1,4-бензодиазепинов, 5-метил- и 5-фенил-8-оксо-6-фенил-6Н-пирроло[3,4-f]1Н,7Н-2,3-дигидро-1,4-диазепиов, 2,3-диарил-4-метилсульфонилпирроло[2,3-b]хиноксалинов.
Среди полученных соединений обнаружены практически нетоксичные вещества с ноотропной, противовоспалительной, анальгетической и антимикробной активностью, сравнимой с активностью препаратов, применяемых в медицинской практике. 4-Ацетил-1-карбоксипентил-5-фенил-3-гидрокси-3-пирролин-2-он, проявляющий высокую антиамнестическую активность, превосходящую активность пирацетама в меньших дозах (1/60 от ЛД50) и обладающий низкой токсичностью рекомендован для углубленных исследований.
Апробация работы. Материалы диссертационной работы обсуждались на научно-практической конференции «Достижения современной фармации в медицинскую практику» (г. Харьков, 1996 г); на научной сессии ПГМА «К 80-летию старейшего на Урале медицинского вуза» (г. Пермь, 1996 г); на IV Российском национальном конгрессе «Человек и лекарство» (г. Москва, 1997 г); на V Российском национальном конгрессе «Человек и лекарство» (г. Москва, 1998 г); на Шестой международной конференции «Химия карбенов и родственных интермедиатов» (г. Санкт-Петербург, 1998 г); на III Уральской конференции «Енамины в органическом синтезе» (г. Пермь, 1999 г); на межвузовской научно-практической конференции «ВУЗы и регионы» (г. Пермь, 2002 г); на II международной конференции «Химия и биологическая активность кислород- и серусодержащих гетероциклов» (г. Москва, 2003 г); на VII научной школе-конференции по органическому синтезу (г. Екатеринбург, 2004 г); на международной научно-практической конференции «Фармация и здоровье» (г. Пермь, 2005 г); на Четвертой международной конференции молодых ученых по органическому химии «Современные тенденции в органическом синтезе и проблемы химического образования» (г. Санкт-Петербург, 2005 г); VI Региональная конференции молодых ученых и студентов «Актуальные проблемы химии» (г.Днепропетровск, 2005 г); на конференции Российского фонда фундаментальных исследований «Фундаментальная наука в интересах развития критических технологий» (г. Владимир, Новосибирск, 2005 г); на всероссийской конференции «Техническая химия. Достижения и перспективы» (г. Пермь, 2006 г); на Региональной научной конференции «35 лет синтеза фурандионов» (г. Пермь, 2008 г); на конференции «Фармация и общественное здоровье» (г. Екатеринбург, 2008 г); на российской научно-практической конференции «Рациональное использование лекарств» (г. Пермь, 2004 г), на научной конференции профессорско-преподавательского состава ПГФА (г. Пермь, 2004).
Публикации. По материалам диссертации опубликовано 19 статей в центральной печати, 1 статья в сборнике, тезисы 38 докладов на конференциях различного уровня, получено 2 патента.
Личный вклад автора в работы, включенные в диссертацию, заключается в теоретическом обосновании задач и практическом их выполнении, в непосредственном участии во всех этапах исследования: проведении синтезов, обработке результатов, доказательстве структуры соединений, написании и оформлении публикаций. В проведении отдельных этапов исследования принимали участие аспиранты Безматерных Э.Н., Катаева А.В., Чиркова М.В., Силина Т.А., Платонов В.С.
Структура и объем диссертации. Содержание работы изложено на 397 стр., включающих 148 таблиц и 4 рисунка, и состоит из литературного обзора, экспериментальной части, биологической части, выводов, списка литературы (210 наименований).
Основные положения, выносимые на защиту:
- Синтез 1-замещенных 5-арил-4-ацил-3-гидроксипирролин-2-онов, содержащих в положении 1 атом водорода, различные фукционализированные алкильные заместители или гетероциклы, а в положении 4 метилсульфонильный или гетероильный фрагмент.
- Распространение трехкомпонентной реакции на синтез тетразолопиримидинов, спирофуранов и спиропирролов.
- Взаимодействие полученных соединений с моно-, бинуклеофильными и алкилирующими реагентами.
- Результаты испытания антиамнестической, противовоспалительной, анальгетической и противомикробной активности синтезированных веществ, установление взаимосвязи их строения с активностью, выбор перспективных соединений для углубленных исследований.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
1.1. Синтез 5-арил-4-ацил-3-гидрокси-1H и 1-алкил-3-пирролин-2-онов
Взаимодействием метиловых эфиров ацилпировиноградных кислот со смесью ароматического альдегида и ацетата аммония в этаноле были получены 5-арил-4-ацил-3-гидрокси-1H-3-пирролин-2-оны (1а-н).
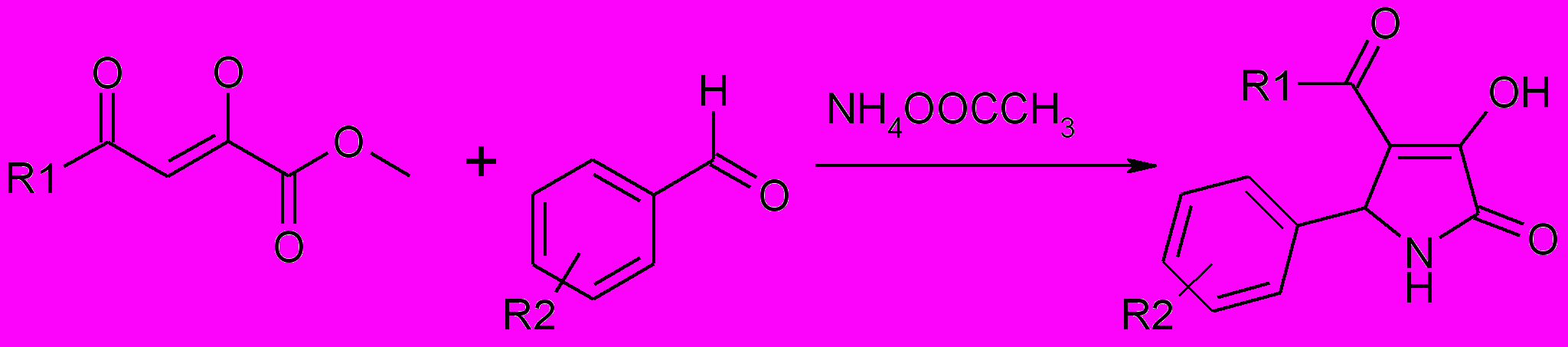
1а-н
R1=С6H5(а-г), 4-СlC6H4(д,л-н), CH3(е-и), 4-CH3OC6H4(к); R2=H(а,е), 4-Br (б,д,ж), 4-NO2(в,и), 4-CH3O(г,з), 4-Cl(к), 4-(CH3)2N(л), 4-F(м), 3,4-(CH3O)2(н)
Для синтеза 1-алкил-4-ацил-5-арил-3-гидрокси-3-пирролин-2-онов изучена трехкомпонентная реакция эфиров ацилпировиноградных кислот со смесью ароматического альдегида и алкиламина. В качестве последних нами были использованы первичные амины: метил-, пропил-, бутил-, гексил-, 2-этилгексил-, октиламины, 1-аминоадамантан.
Было установлено, что взаимодействие метиловых эфиров ацетил- и ароилпировиноградных кислот со смесью ароматического альдегида и алкиламина в диоксане приводит к образованию с хорошим выходом 5-арил-4-ацил-1-алкил-3-гидрокси-3-пирролин-2-онов.
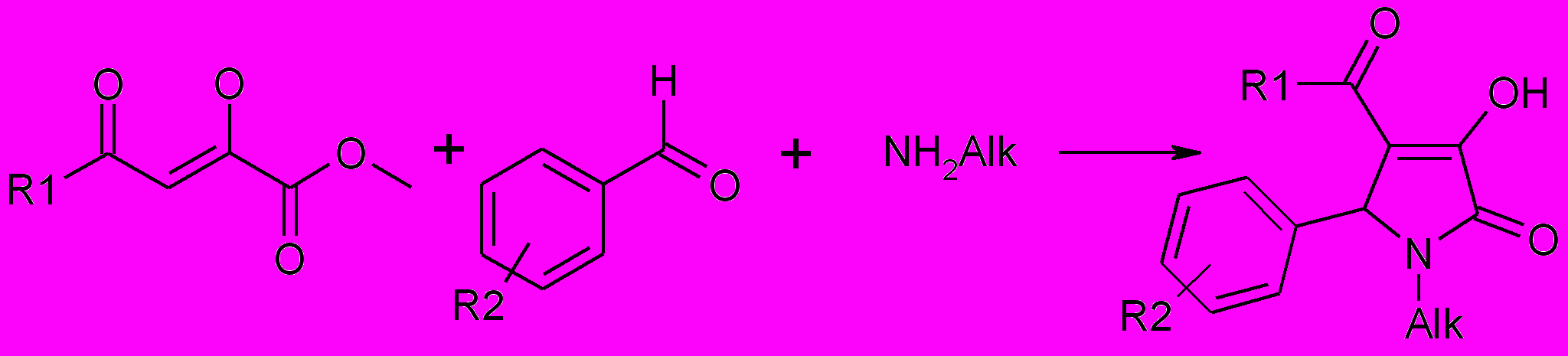
2-7
Alk= CH3 (2), С3H7 (3), С4H9 (4), С6H13 (5), С8H17 (6), CH2CH(С2H5)С4H9 (7)
2а-р: R1=CH3 (а-г), С6H5 (д,е). 4-CH3C6H4 (ж,з), 4-СlC6H4 (и,к), 4-BrC6H4 (л), 4-
CH3OC6H4 (м), 3,4-(CH3O)2C6H4 (н,о,п,р); R2=4-HO-3-CH3O (а), 4-F (б,ж,н),
4-NO2 (в), 3-NO2 (г), 2-NO2 (д), 4-I( е,з,л), 2-F (и), 3,4-ОCH2О (к), 2,4-(CH3O)2 (м), R2С6H4=3-С5H5N (o), 4-CH3O (п), 3-CH3O (р)
3а-п: R1=CH3 (а-л), С6H5 (м-п); R2=Н (а), 4-CH3 (б), 4-CH3O (в), ), 2,4-(CH3O)2
(г), 3,4-(CH3O)2 (д,н), 4-С2H5О (е), 4-CH3СOО (ж), 2,4-Сl2(з), 4-F (и), 3-F (к),
2-F (л), 2,5-(CH3O)2 (м), 2-фурил (o), 2-тиенил (п)
4а-м: R1=CH3 (а), С6H5 (б,в), 4-CH3C6H4 (г), 4-CH3OC6H4 (д-з), 4-NO2C6H4 (и-м); R2=4-F (а), H (б), 4-HO-3-CH3O (в), 2-CH3O (г), 4-NO2 (д,к), 3-NO2 (е,л), 4-Cl (м), 3,4-ОCH2О (ж), 4-CH3 (з), 4-N(CH3)2 (и)
5а-м: R1= С6H5 (а,б), 4-CH3C6H4 (в-м); R2=3-NO2 (а), 3,4-ОCH2О (б,в), 4-
N(CH3)2 (г), H (д), 4-СН(CH3)2 (е), 4-Cl (ж), 4-Br (з), 3-F (и), 2-F (к), 3-ОCH3 (л), 2-OCH3 (м)
6а-е: R1= СH3 (а-д), C6H5 (е); R2=4-HO-3-CH3O (а), R2С6H4=3-С5H5N (б,е),
R2С6H4=2-С5H5N (в), 4-HO (г), 3-HO (д)
7а-н: R2= H (а), 4-CH3 (б), 4-F (в), 4-HO-3-CH3O (г), 4-HO-3-C2H5O (д), 3,4-
(CH3O)2 (е), 4-CH3OCO (ж), 4-HO (з), 3-HO (и); R2С6H4=3-С5H4N (к), 2-С5H4N (л), 2-фурил (м), 2-тиенил (н)
При проведении реакции в этаноле взаимодействие с алифатическими аминами может осложняться образованием халконов вместо 1-алкилпирро-лидин-2,3-дионов.

Было установлено, что взаимодействие эфира ацетилпировиноградной кислоты с ароматическим альдегидом и 1-аминоадамантаном, у которого аминогруппа находится у третичного атома углерода, приводит к образованию аддуктов 5-арил-4-ацетил-3-гидрокси-2,5-дигидрофуран-2-онов с аминоадамантаном (7о,п).
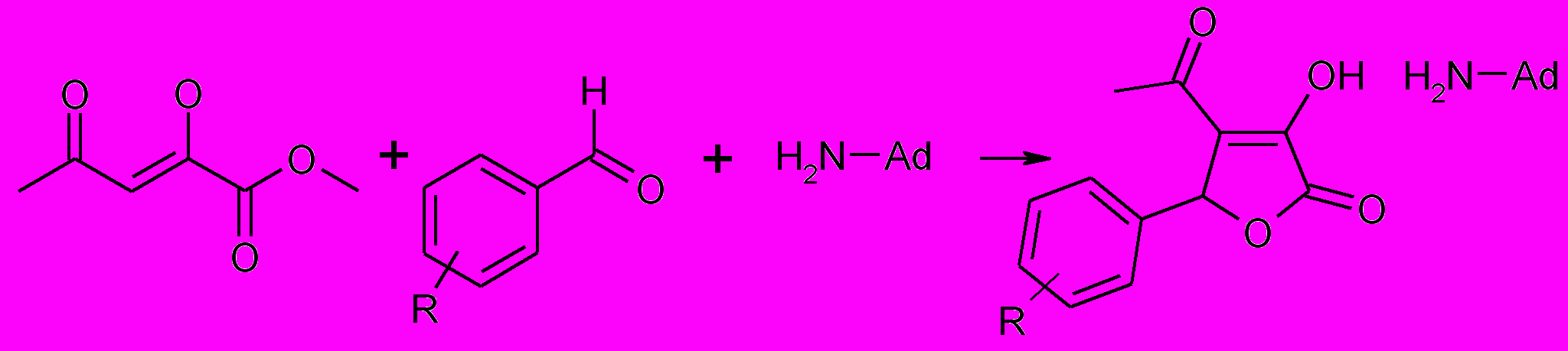
7о,п
R= 4-CH3O (o), 2-F (п)
По-видимому, в данном случае вследствие стерических препятствий 1-аминоадамантан выступает в качестве основного катализатора в реакции образования фуран-2-онов (7).
1.2. Синтез 5-арил-4-ацил-1-гидроксиалкил-3-гидрокси-3- пирролин-2-онов
С целью введения в положение 1 пирролинового цикла фармакофорной гидроксиалкильной группы в качестве аминоспирта были использованы эта-ноламин, 3-аминопропанол и 2-аминопропанол. Установлено, что взаимо-действие метиловых эфиров ацилпировиноградных кислот со смесью арома-тического альдегида и аминоспирта приводит с хорошим выходом к образо-ванию 5-арил-4-ацил-1-(гидроксиалкил)-3-гидрокси-3-пирролин-2-онов.
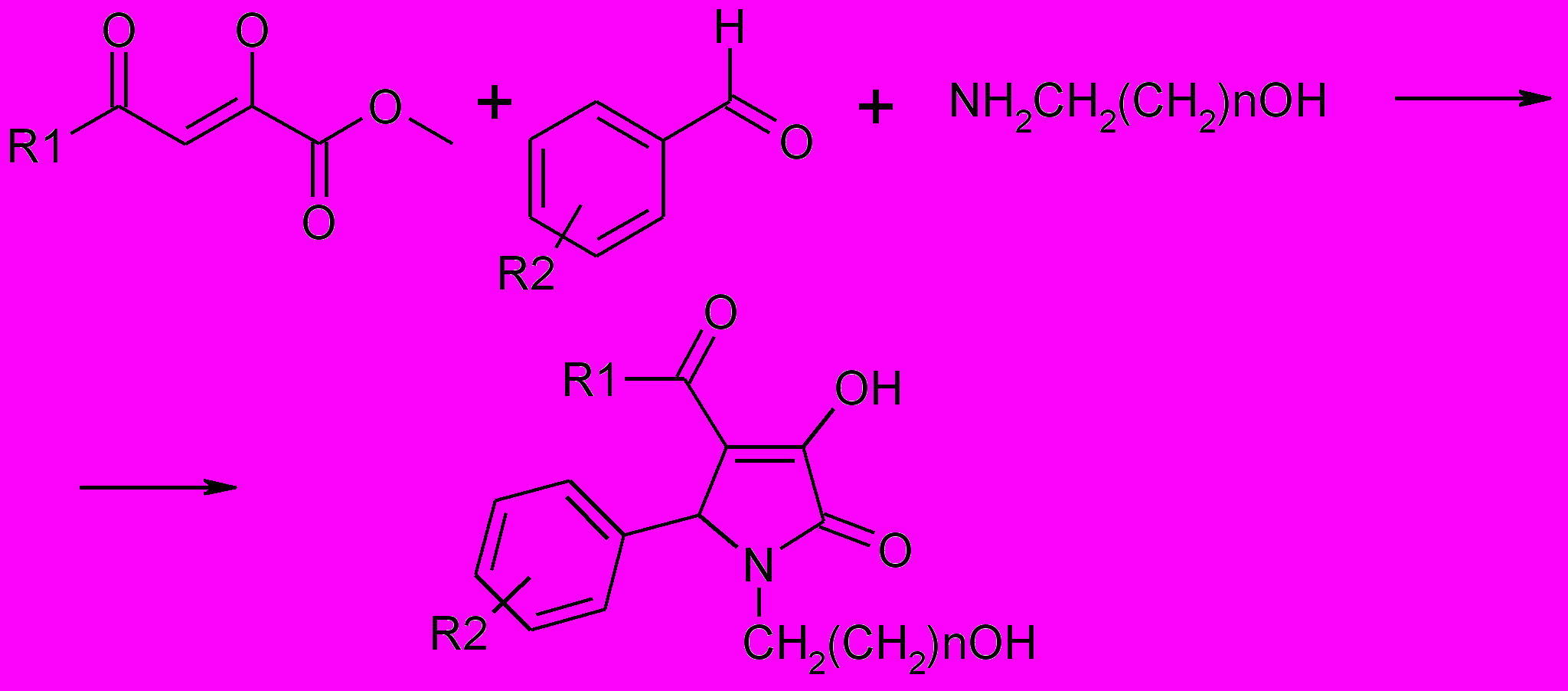
9-11*
n=1 (9), 2(10); 11*-СН2СН(ОН)СН3
9а-е: R1= CH3 (a-е); R2=4-Br (a), H (б), 4-NO2 (в), 2,4-(CH3O)2 (г), 4-I (д), 4-HO-3-C2H5O (е)
10а-м: R1=CH3 (а-ж), 4-ClС6Н4 (з), 4-CH3С6Н4 (и-м); R 2=H (а), 4-Br (б,и), 4-NO2 (в,к), 4-CH3O (г,з), 3-NO2 (д,м), 4-I (е), 3,4-(CH3O)2 (ж,л)
11а-ш: R1=CH3 (а,б), С6Н5 (в-з), 4-CH3С6Н4 (и-ш); R2=4-CH3OCO(а,ф), R2С6H4=3-С5H4N(б,ч), 4-CH3О (в,и), 4-C2H5O (г), 4-HO(д), 4-HO-3-C2H5O (е,т), 4-СН(CH3)2 (ж,ц), 2-F(з), 2-CH3О (к), 3-CH3О (л), 2-Cl (м), 2,4-Cl2 (н), 4-F (о),
3-F (п), 2,4-(CH3O)2 (р), 3,4-(CH3O)2 (с), 3-ОН (у), 4- (CH3)2N (х), R2С6H4=2-С5H4N (ш)
