Синтез, химические свойства и биологическая активность 1,4-дизамещенных 5-арил-3-гидрокси-3-пирролин-2-онов 15. 00. 02 Фармацевтическая химия, фармакогнозия
| Вид материала | Диссертация |
- Синтез, свойства и биологическая активность енаминоамидов ацилпировиноградных кислот, 439.81kb.
- Синтез, свойства, биологическая активность n-гетериламидов α-оксокислот и продуктов, 367.21kb.
- Синтез соединений на основе химических превращений производных α- оксокарбоновых кислот, 643.93kb.
- Синтез, свойства и биологическая активность продуктов взаимодействия 1,2,4-триазолов, 669.98kb.
- Синтез и биологическая активность карбо- и гетероциклов на основе тетрацианоэтилена, 673.64kb.
- Синтез и свойства новых производных 2 (1,2,4 триазолил 5 тио)уксусных кислот 15. 00., 240.9kb.
- Синтез, свойства и биологическая активность производных 2-хлорникотинонитрилов, 264.36kb.
- Примерная программа рекомендуется для направления подготовки (специальности) 111801, 717.4kb.
- Синтез и физико-химические свойства координационных соединений рения(V) с производными, 208.83kb.
- Синтез и химические свойства дикарбонильных соединений адамантанового ряда 02. 00., 667.04kb.
2.1 Взаимодействие с мононуклеофильными реагентами.
4,5-Дизамещенные 3-гидрокси-3-пирролин-2-оны содержат несколько реакционных центров. С целью изучения их химических свойств была исследована реакция различных пирролин-2-онов, содержащих в положении 1 атом водорода, алкильный, карбоксиалкильный или гетерильный заместитель с ароматическими аминами. Было установлено, что при кипячении 1,4-дизамещенных 5-арил-3-гидрокси-3-пирролин-2-онов с ариламинами реакция протекает по положению 3 гетероцикла с образова-нием соответствующих 3-ариламинопроизводных 3-пирролин-2-онов.
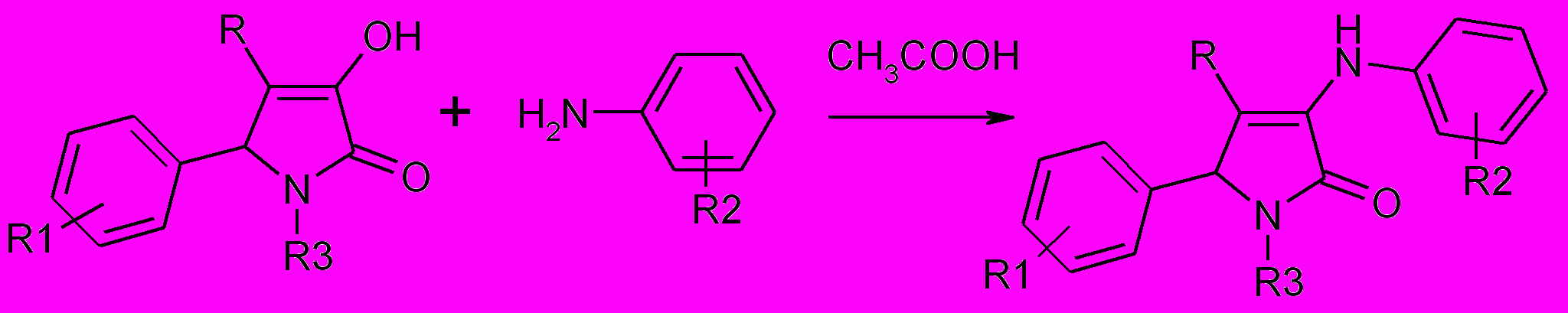
41-45,48
R=H (41), ArCO (42,43), HetCO (44,45), CH3SO2 (48)
41а-н: R1=H (а,б,в,г), 4-Br (д,е,ж,з,и), 4-NO2 (к,л), 4-CH3O (м,н); R 2= H (а,д,к,м), 4-Br (б,е,н), 4-CH3 (в,ж), 2-CH3 (г,з), 4-CH3О (и,л); R3=H
42а-г: R1 =4-F (а), 3-пиридил (б), 4-CH3O (в), 3-CH3О (г); R2=4-CH3 (а-г);
R3=CH3
43а-ф: R 1 = Н (а,в,е-и,н,о,р,с,у,ф-ц), 4-Br (б,г,л,п,т), 4-F (д,м), 4-СН3О (к)
R2 = H (а-в), 4-CH3 (г-к), 3-CH3 (к-о), 2-CH3 (п-с), 4-CH3О (т), 4-C2H5О (у,ф),
R3 = AlkCOOH
44а-з: R 1=С6Н5 (а-е), CH3 (ж), 4-ClС6Н4 (з); R 2=Н (а-ж), 4-NO2 (з); R 3=2-пиридил (а-е,з), 2-тиазолил (ж); R 4=4-CH3 (а), Н (б,ж), 2-CH3(в), 4-Br (г), 4-C2H5О (д), 4-CH3O (е), 4-NO2 (з); R3=Het
45а-о: R=фураноил (а-ж), R=тиеноил (з-о); R2 = H (а,з), 4-CH3 (б,о), 4-CH3O (в,н), 2-CH3O (г,и), 4-Br (д), 2-CH3 (е,к), 3-CH3 (ж,л), 4-Cl (м); R3=C6H5
48а-и: R1=Н (а-д,ж,з), 4-CH3O (е), 4-Br (з); R2=4-CH3O (а,д-ж), 4-СН3 (б,з,и), 4-C2H5O (в), 3-CH3O (г), 4-Br (з); R3=Н(а-г,е), 4-Cl (д), 4-F (ж), 4-Br (з), 4-OН (и)
1,5-Диарилтетрагидропиррол-2,3-дионы ( 35 а,б) и 1-фенил-5-метил-5-этоксикарбонил-3- пирролин-2-она (36 б) также взаимодействуют с ароматическими аминами с образованием 3-ариламинопроизводных.
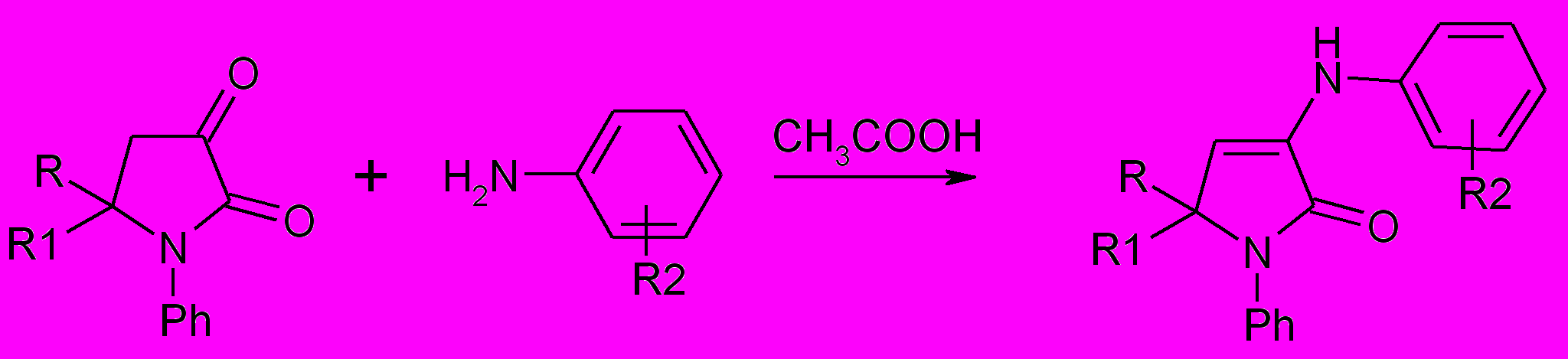
35, 36 46,47
46 а,б: R=H; R1= C6H5 (а), 4-CH3OC6H4 (б); R2= 4-СООН, 3-НО (а), 5-СООН, 4-НО (б)
47а-н: R=CH3; R1=COOC2H5; R2= 4-СООН, 3-НО (а), 5-СООН, 4-НО (б), 4-Cl (в), 4-NO2 (г); 4-Br (д), 3-СООН (е), 4-СООН (ж), 4-СОNН2 (з), 2-СОNН2 (и), 4-SO2NH2 (к), 3-CF3(л), 3-CH3O (м), 3-NO2 (н)
На образование аминопроизводных оказывает влияние характер заместителя в исходном гетероцикле и ароматическом амине. Замещение енольной гидроксильной группы протекает легче, если в пара-положении арильного заместителя в положении 5 гетероцикла находится электроноакцепторный заместитель, а в молекуле амина электронодонорный заместитель. Электроноакцепторные заместители в орто- и пара-положении ариламина затрудняют течение реакции. В частности, при проведении реакции 3-пирролин-2-она с о-нитро- и п-нитроанилином было выделено исходное соединение. Введение метилсульфонильной группы в положение 4 гетероцикла затрудняет реакцию, поэтому взаимодействие 1,5-диарил-3-гидрокси-4-метилсульфонил-3-пирролин-2-онов с активными ариламинами, содержащими электронодонорные заместители (п-толуидин, п-анизидин, п-фенетедин, м-анизидин) протекает в течение более длительного времени.
Следует отметить, что пирролидин-2,3-дионы, не содержащие заместителя в положении 4 гетероцикла, легче реагируют с ароматическими аминами, чем 4-ароилпроизводные. По-видимому, это объясняется преимущественным существованием 4-незамещенных соединений в кетонной форме, а также стерической доступностью карбонильной группы в положении 3 гетероцикла.
При использовании в качестве исходных соединений 5-арил-4-ацетил-3-гидрокси-3-пирролин-2-онов в реакциях с ароматическими аминами атака нуклеофильного реагента направлена на карбонильную группу ацетильного фрагмента, более реакционноспособную, чем бензоильная вследствие отсутствия сопряжения с ароматическим кольцом. В качестве единственного продукта получены 1-замещенных 5-арил-4-(1-ариламиноэтилиден)тетра-гидропиррол-2,3-дионов.
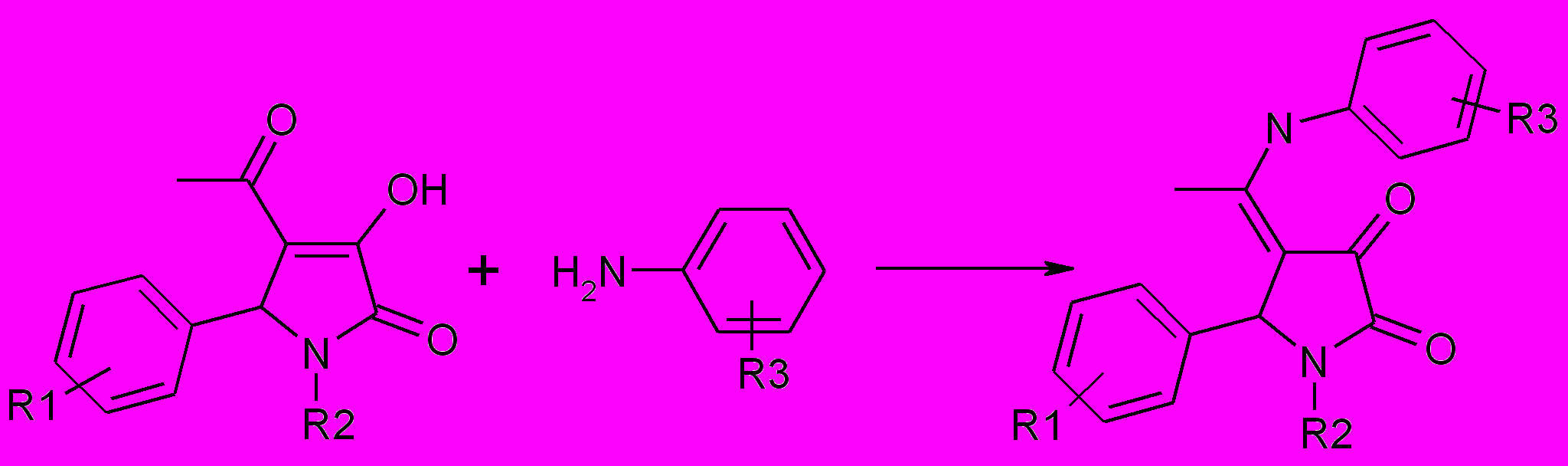
49а-н
49а-н: R 1= H (а,г,к-н), 4-Br (б,в,д,ж,з,и), 4-NO2 (е); R 2= H (а,б), CH2CH2COOH (в), CH2CH2OH (г,е,и), CH2CONH2 (д), CH2COOC2 H5 (ж), CH2COOH (з,н), (CH2)5COOH (к,л), (CH2)3COOH (м); R 3=4-Br (а), 4-CH3 (б,л,м), 4-CH3O (в-и,н), H (к)
Для доказательства структуры соединений ( 49а-н) нами было проведено рентгеноструктурное исследование кристалла соединения 49л, полученного медленной кристаллизацией из спиртового раствора. Строение молекулы изображено на рисунке 3.
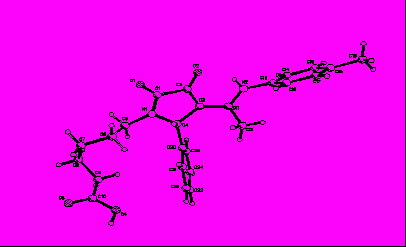
Рис.3. Строение молекулы 1-(5-карбоксипентил)-4-(1-п-метилфениламино)-этилиден-5-фенилтетрагидропиррол-2,3-дион (49л).
При взаимодействии 3-гидрокси-3-пирролин-2-онов с алифатическими аминами на первой стадии образуются соли.
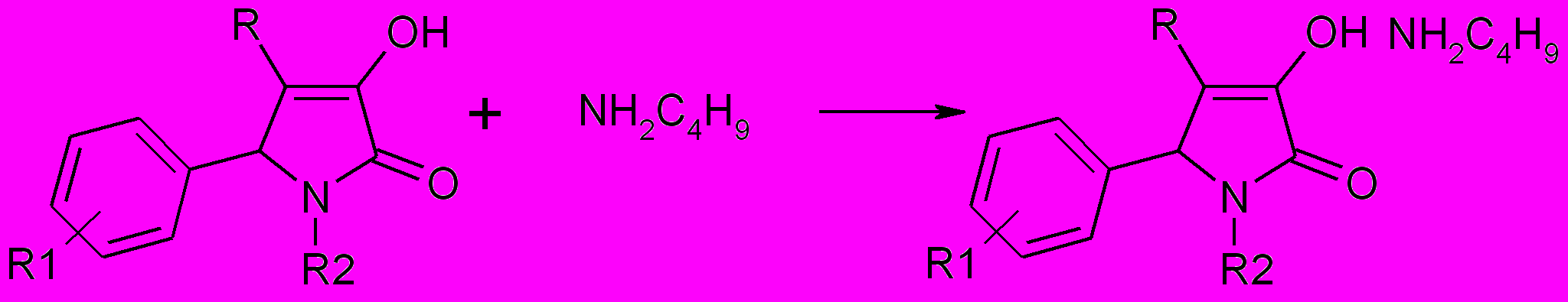
50,51*,52
R=PhCO (50); CH3SO2 (51); HetCO (52)
50а,б: R1=4-Br (а); 4-CH3O (б); R2=H
51*а,б: R1=R2=H; амин=NH2C6H13 (а); NH2(CH2)5COOH (б);
52а-и: R1=4-(CH3)2CH (a), H (б,в,е-ж), 4-Cl (г), 3-NO2 (д), 4-F (з), 4-Br( и);
R2=C6H5 (а,г,д,з,и), 4-CH3C6H4 (б), 2-тиазолил (в,е), 3-CH3C6H4 (ж);
HetСО=фураноил (а-д), тиеноил (е-и).
Установлено, что при нагревании соответствующих солей 1,5-диарил-4-гетероил-3-гидрокси-3-пирролин-2-онов (52) и бутиламина на металлической бане при температуре 170-200оС происходит образование 1,5-диарил-3-бутиламино-4-гетероил-3-пирролин-2-онов (53а-ж).
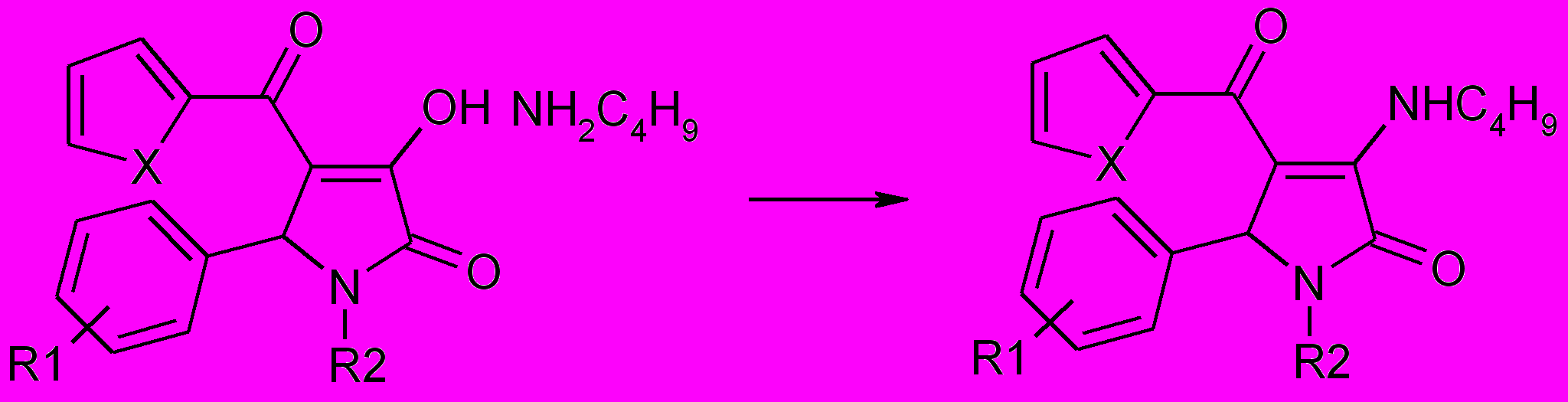
53а-ж
R1=H (а,г,ж), 4-Cl (б), 3-NO2(в), 4-F (д), 4-Br (е); R2=H (б,в,д-ж), 4-CH3 (б), 2-тиазолил (а,г); X=O (а-в), S (г-ж).
Полученные соединения в отличие от исходных солей не дают вишневое окрашивание со спиртовым раствором хлорида железа III, что подтверждает образование 3-ариламинопроизводных, которые в соответствии с данными спектров существуют в енаминной форме.
2.2. Взаимодействие с бинуклеофильными реагентами.
Известно, что взаимодействие пирролидин-2-онов с бинуклеофильными реагентами, такими как гидразин, фенилгидразин, орто-фенилендиамин, этилендиамин, может приводить к образованию различных конденсиро-ванных гетероциклических систем. Для исследований были взяты пирролин-2-оны с различными заместителями в положениях 1,4,5 гетероцикла. 4-Ароил и 4-гетероил-3-гидрокси-3-пирролин-2-оны, содержащие в 1 положении алкильные заместители, гетерильные, остатки аминокислот и атом водорода взаимодействуют гидразином при кипячении в уксусной кислоте с образованием 3,4, 5-тризамещенных пирроло[3,4-c]пиразол-6-онов (54а-ю).
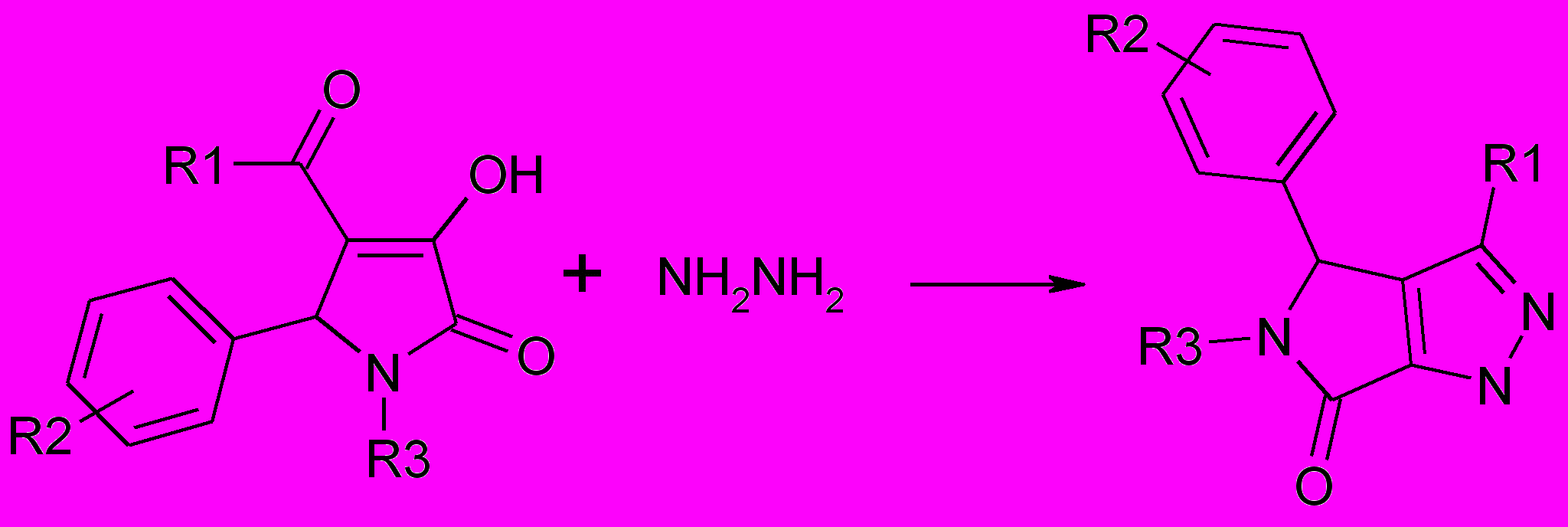
54, 55
54(а-ю): R1=C6H5 (а-г,к,л,о,п), СН3 (д,е,з,и,м,н,т,ф), 4-CH3ОC6H4 (ж,ш),
4-NO2C6H4 (р), 4-ClC6H4 (с,у,э,ю), 4-BrC6H4 (х,ц,щ);
R2= H (а,д,к-м,т,ф,ю), 4-CH3О (б,х), 4-NO2 (в,у), 4-Br (г, ц-ш), 3-CH3О, 4-ОН (е) 2,4-(CH3О)2 (ж), 4-C2H5О (з), 2,4-Cl2 (и), 4-Cl (н,о,р,щ,э), 2-Cl (п), 4-F (с),
R3= Н (а-д), СН3 (е,ж), С3Н7 (з,и), СН2СООН (п), (СН2)3СООН (л,о), (СН2)5СООН (к,м,н,р,с), 2-пиридил (т,у,х-ю), 2-тиазолил (ф)
55(а-ж): R1= фурил (а,г,е,ж), тиенил(б,в,д); R2=H (а,б,д-е), 3-NO2 (в,ж),
2,4-Cl (г); R3=C6H5 (а,б,ж), H (в-е)
На основании имеющихся литературных данных можно предположить, что, по-видимому, на первой стадии реакции образуется соответствующий гидразон, который затем циклизуется в конденсированную систему пирроло[3,4-c]пиразола.
При проведении реакции в диоксане при комнатной температуре были выделены 3-гидразоны 5-арил-4-гетероил-1-фенил-3-гидрокси-3-пирролин-2-онов (56а,б), существующие преимущественно в гидразонной форме, которая, возможно, стабилизируется за счет возникновения внутримолекулярной водородной связи.
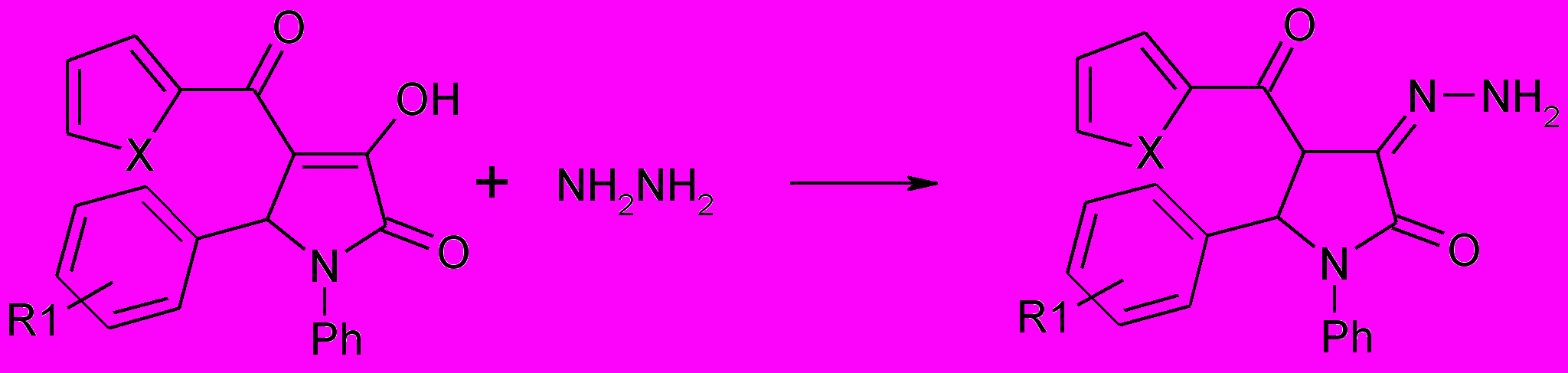
56а,б
R1=4-(CH3)2CH (a), H (б); X= S (а), O (б).
При взаимодействии 1-арил-5-фенил-3-гидрокси-4-метилсульфонил-3- пирролин-2-онов с 50% гидразингидратом в диоксане с хорошим выходом образуются соли (57а,б), что, по-видимому, объясняется кислыми свойствами енольного гидроксила в положении 3 гетероцикла.
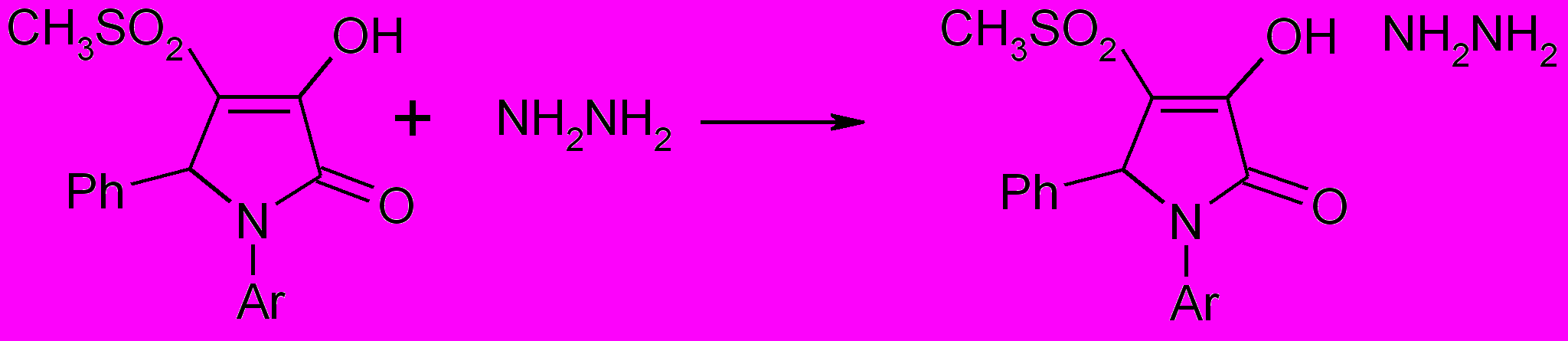
57а,б
R=C6H5 (a), 4-OHC6H4 (б)
Получить 3-гидразоны 1,5-диарил-3-гидрокси-4-метилсульфонил-3-пирролин-2-онов с использованием 98% гидразингидрата при длительном кипячении в ледяной уксусной кислоте не удалось. Взаимодействие 1-арил-5-метил-5-этоксикарбонилпирролидин-2,3-дионов с гидразином и фенил-гидразином приводит к образованию 3-гидразонов и 3-фенилгидразонов 1-арил-5-метил-5-этоксикарбонилпирролидин-2,3-дионов (58а-г, 59а-г).
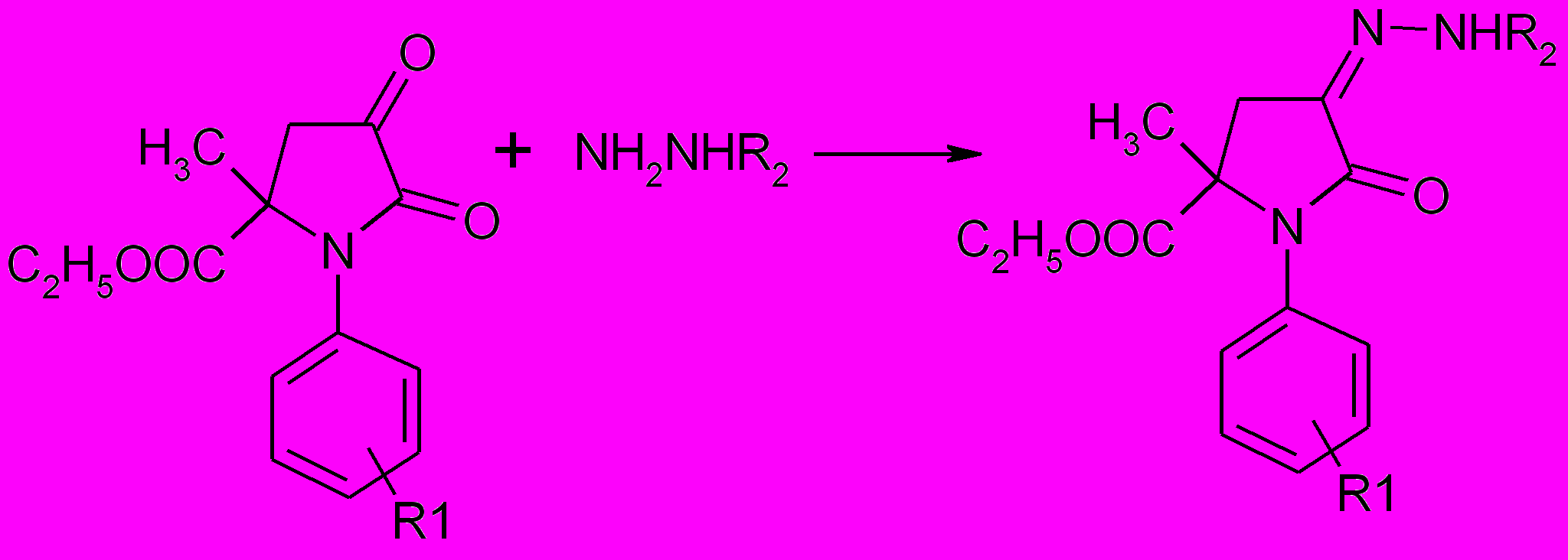
58а-г, 59а-г
R1=H (58а, 59а), 4-F (58б, 59б), 4-Br (58в, 59в) 4-Cl (58г, 59г); R2=H (58а-г), C6H5 (59а-г).
Как известно тетрагидропиррол-2,3-дионы при взаимодействии с этилендиамином образуют N,N’-ди-(4-ароил-1,5-дифенил-2,5-дигидропиррол-2-он-3-ил)-этилендиамины, которые в более жестких условиях циклизуются в конденсированную систему пирроло[3,4-f]диазепина
Взаимодействие 5-арил-4-ацил-3-гидрокси-1Н-3-пирролин-2-онов с этилендиамином протекает аналогично с образованием 5-метил- и 5-фенил-8-оксо-6-фенил-6Н- пирроло[3,4-f]1Н,7Н-2,3-дигидро-1,4-диазепинов (60а,б). .
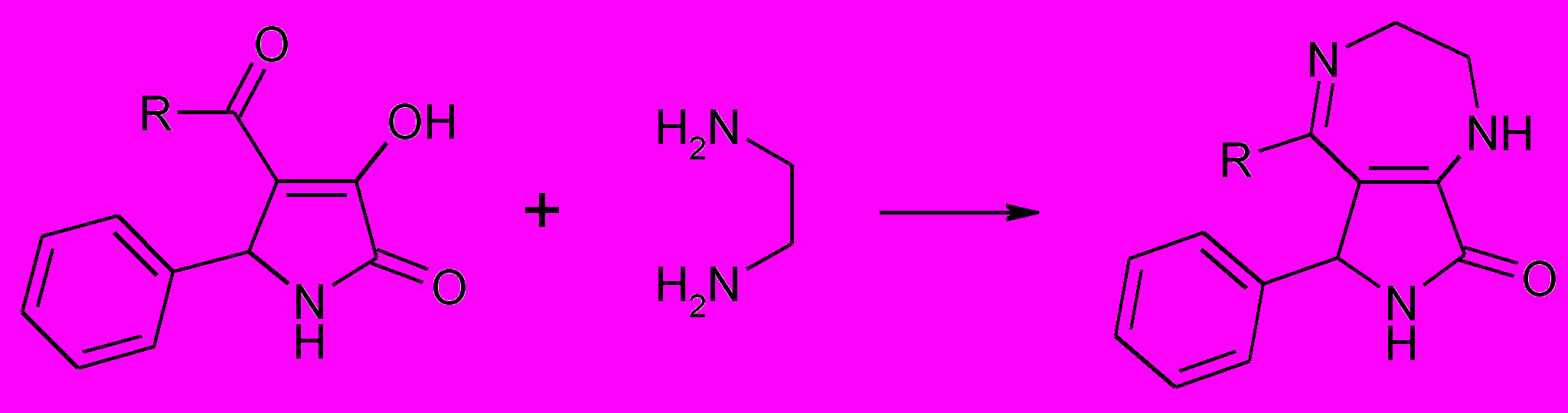
60 а,б
R=СH3 (а), C6H5 (б);
В случае гетерильного заместителя в положении 1 реакция протекает в более жестких условиях и с низким выходом. Взаимодействие 4-метилсульфонил-3-пирролин-2-онов (32ж,т) с этилендиамином в соотношении реагентов 1:1 или 1:2 приводит к образованию двойной соли этилендиамина и 1,5-диарил-3-гидрокси-4-метилсульфонил-3-пирролин-2-она (62а,б). При проведении реакции в более жестких условиях, а именно при кипячении реагентов, выходы продуктов (62а,б) снижаются. .
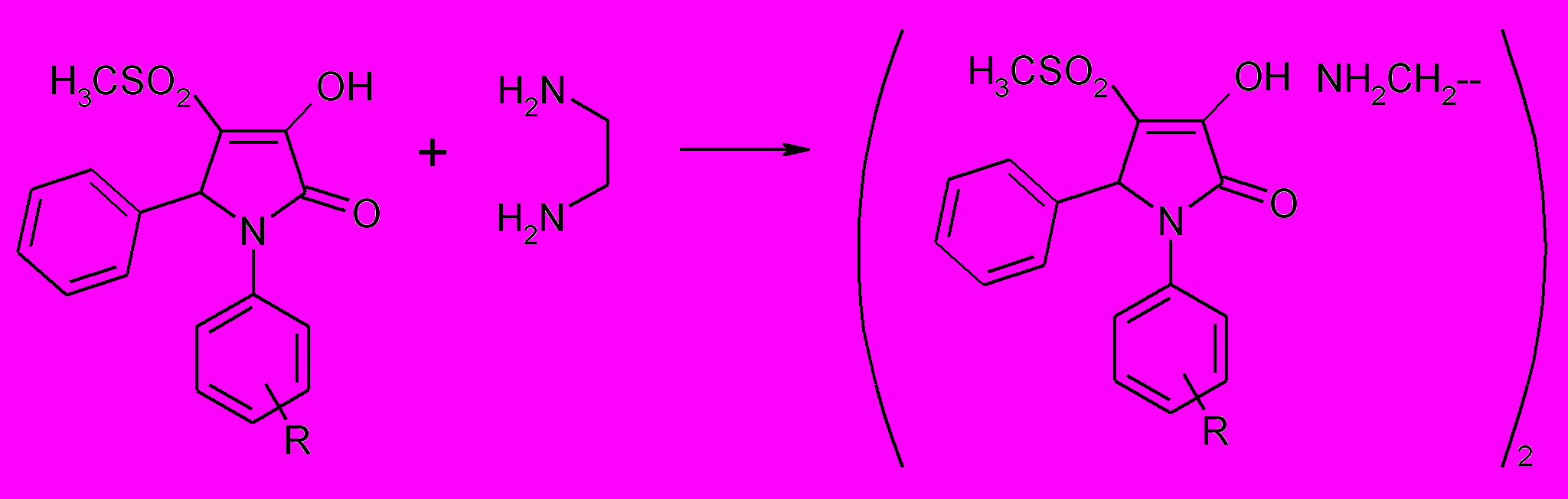
62 а,б
R=H (62a), 4-ОН (62б)
При выдерживании соединения (62а) на металлической бане при температуре 180-185о С образуется N,N’-ди-(1,5-дифенил-3-гидрокси-4-метилсульфонил-3-пирролин-2-он-3-ил)-этилендиамин (63).
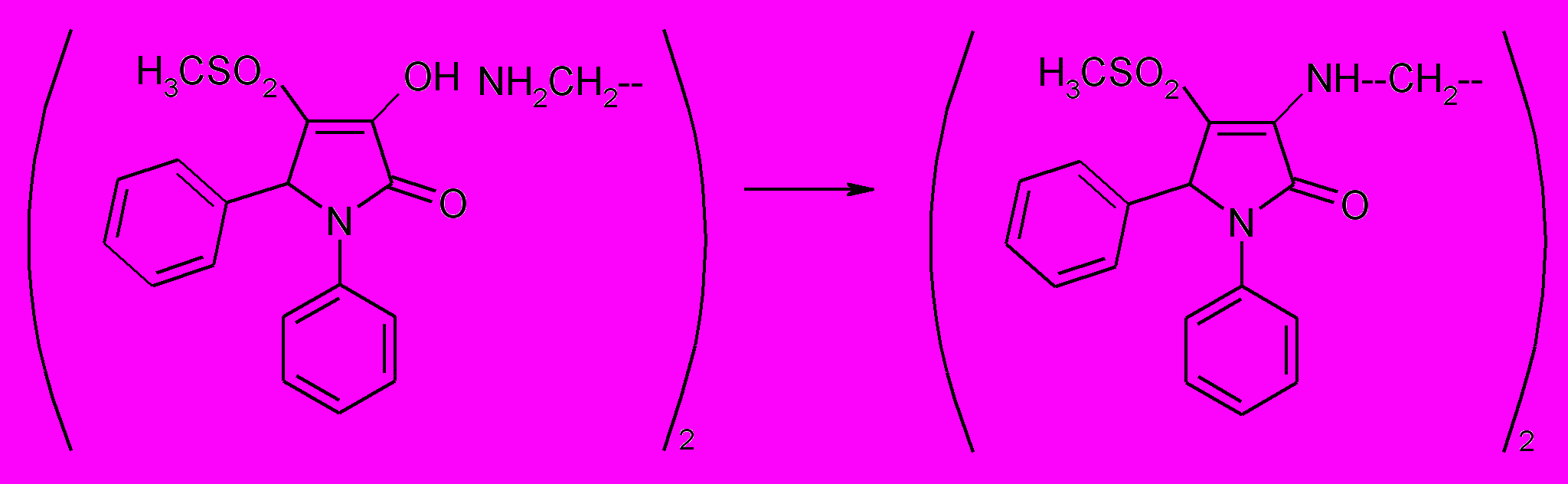 63
63 Взаимодействие 5-арил-4-ацетил-3-гидрокси-1Н(1-гетерил)-3-пирролин-2-онов с орто-фенилендиамином в условиях длительного кипячения в этаноле, с добавлением каталитических количеств ледяной уксусной кислоты приводит к 6-арил-5-метил-8-оксо-6Н-пирроло[3,4-f]1Н,7Н-2,3-дигидро-1,4-бензодиазепинам (64 а,б).
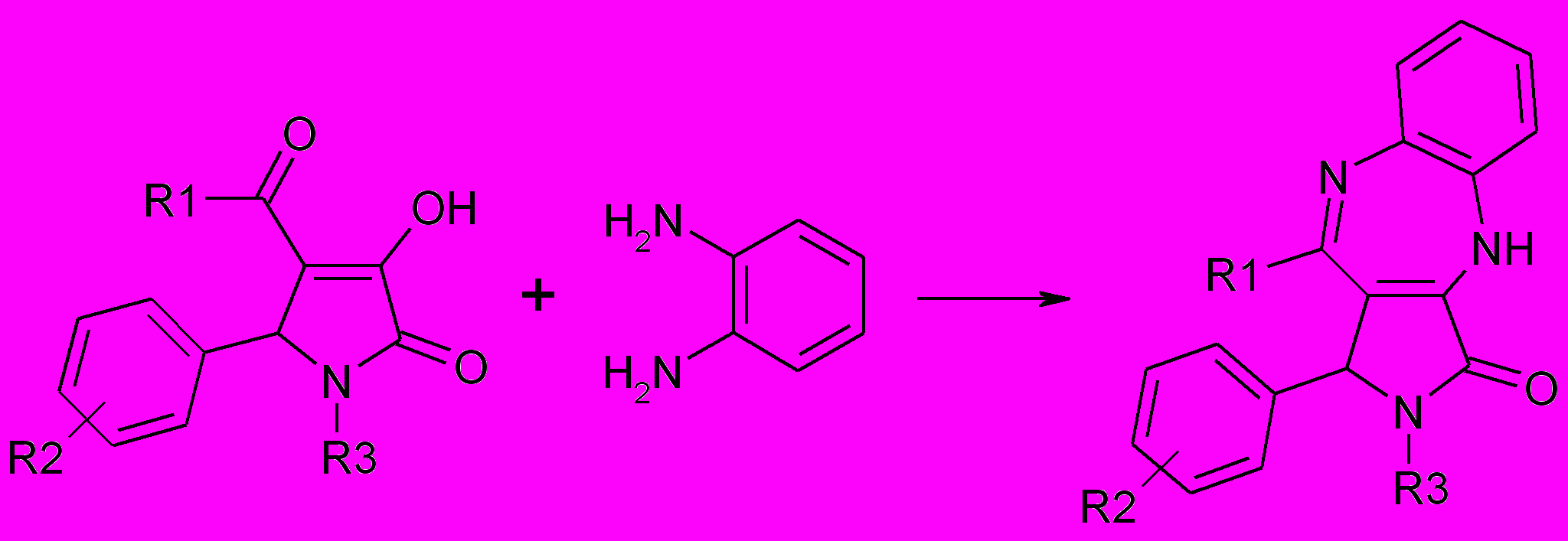
64 а,б; 65 а-в
R1=СH3 (64а,б, 65б), 4-ClC6H4 (65a), 4-BrC6H4 (65в); R2=H (64а, 65б), 4-СН3О (64б), 4-NО2 (65а), 4-BrC6H4 (65в); R3=H (64а,б), 2-пиридил (65а,б,в)
1,5-Диарил-3-гидрокси-4-метилсульфонил-3-пирролин-2оноы взаимо-действуют с орто-фенилендиамином (при сплавлении реагентов 190оС в течение 30 минут) иначе: реакция протекает по карбонильным группам в положении 2 и 3 гетероцикла, сопровождается дегидрированием и образо-ванием 2,3-диарил-4-метилсульфонилпирроло[2,3-b]хиноксалинов (66а-ж).
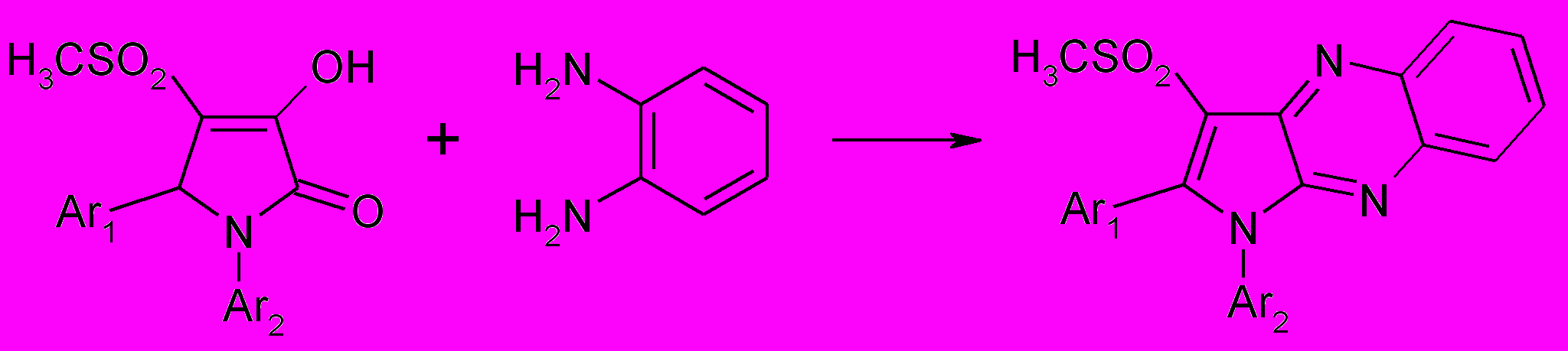
66а-ж
Аr1=C6H5 (а-в,д-ж), 4-CН3С6H4 (г); Ar2=C6H5 (a,г), 4-ОНС6H4 (б), 4-ClС6H4 (в),
4-FС6H4 (д), 4-NO2SO2С6H4 (е), С6H5CН2 (ж)
При нагревании 1,5-диарил-3-гидрокси-4-метилсульфонил-3-
пирролин-2-оны с мочевиной при температуре 170-180оС были получены 3-амино-1,5-диарил-метилсульфонил-3-пирролин-2-оны (67а-е).
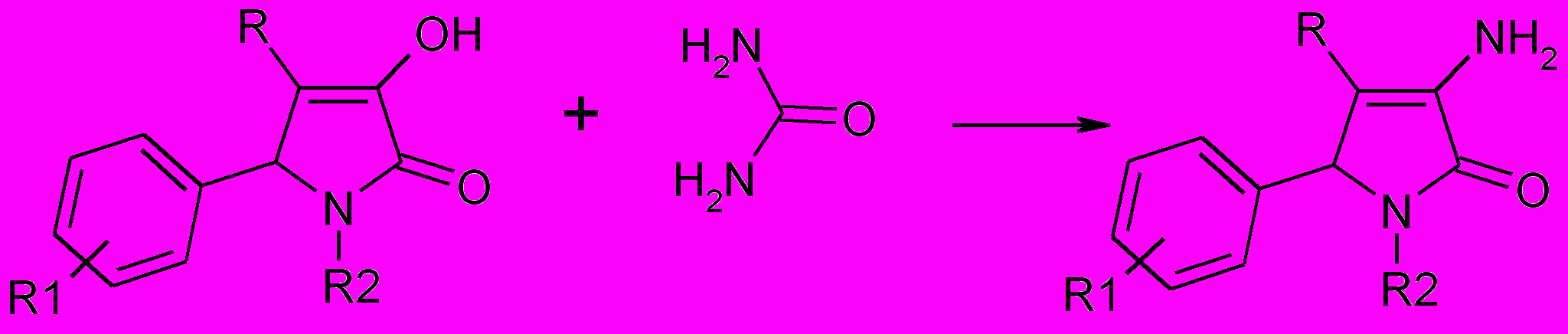
67,68
R=CH3SO2 (67); PhCO (68);
67а-е: R1=H (а,б,г,е), 4-CН3О (в), 4-Br (в); R2=C6H5 (a,в), 4-ClС6H4 (б),
4-FС6H4 (г), 4-BrС6H4 (д), 4-ОНС6H4 (е)
68а-г: R1=H; R2=(СН2)nCOOH, n = 1 (г), 2 (б), 3 (а), 5 (в)
3-Пирролин-2-оны, содержащие в положении 1 гетероцикла карбокси-алкильный заместитель, а в положении 4 бензоильный заместитель, также взаимодействуют с мочевиной с образованием 3-аминопроизводных (68а-г).
Взаимодействие 4-ацетил-5-фенил-1Н-3-гидрокси-3-пирролин-2-онов с гидразоном бензофенона протекает с участием карбонильной группы ацетильного фрагмента. Единственным продуктом реакции является 5-фенил -4-(1-N-дифенилметилиден-гидразиноэтилиден)-1Н-тетрагидропиррол-2,3-дион (69).
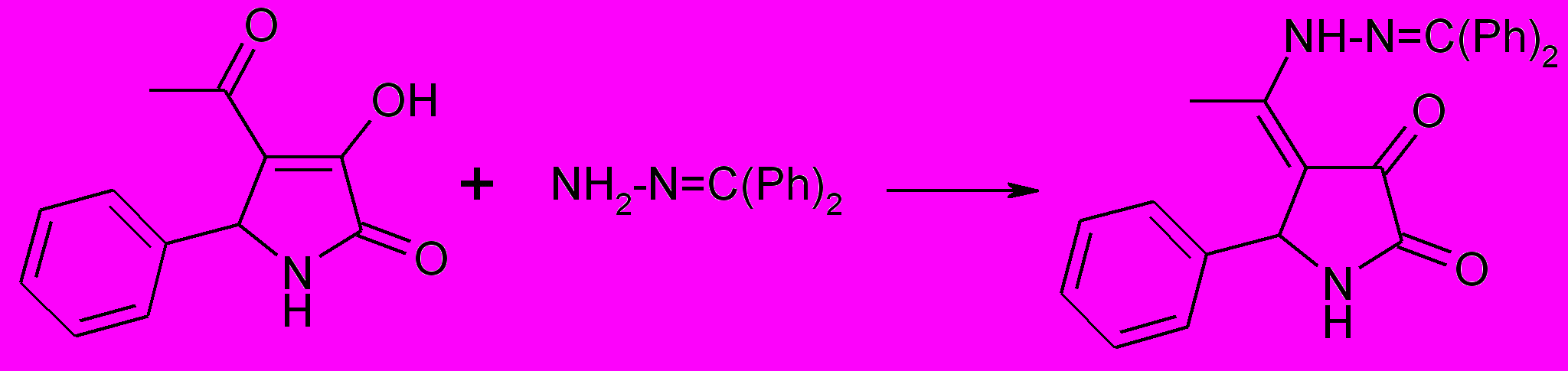
69
Взаимодействие 4-ацетил-5-арил-3-гидрокси-3-пирролин-2-онов, содержащих в положении 1 гетероцикла карбоксиалкильный или этоксикарбонилалкильный заместитель, с тиосемикарбазидом протекает с участием карбонильной группы ацетильного фрагмента. При этом образуются 1-замещенные 5-арил-4-(1-аминотиокарбонилгидразино-этилиден)тетрагидропиррол-2,3-дионы (70а-в).
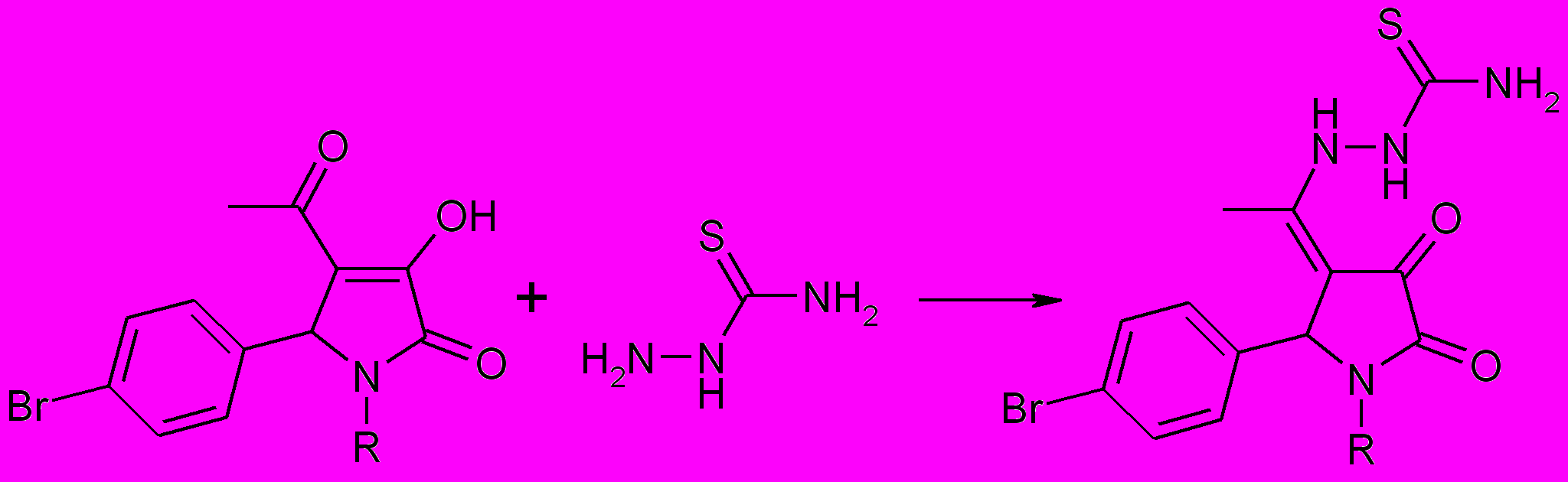
70(а-в)
R=CH2CH2COOH (a), CH2COOC2H5 (б), CH2COOH (в)
При введении в реакцию с тиосемикарбазидом 1-фенил-5-метил-5-это-ксикарбонилпирролидин-2,3-диона был получен 3-тиосемикарбазон 1-фенил -5-метил-5-этоксикарбонилпирролидин-2,3-диона (71). Реакция 1-арил-5-метил-5-этоксикарбонилпирролидин-2,3-дионов с гидразидами кислот (изоникотиновой, бензойной) протекает аналогично с образованием соответствующих N-ацилгидразонов (72,73).
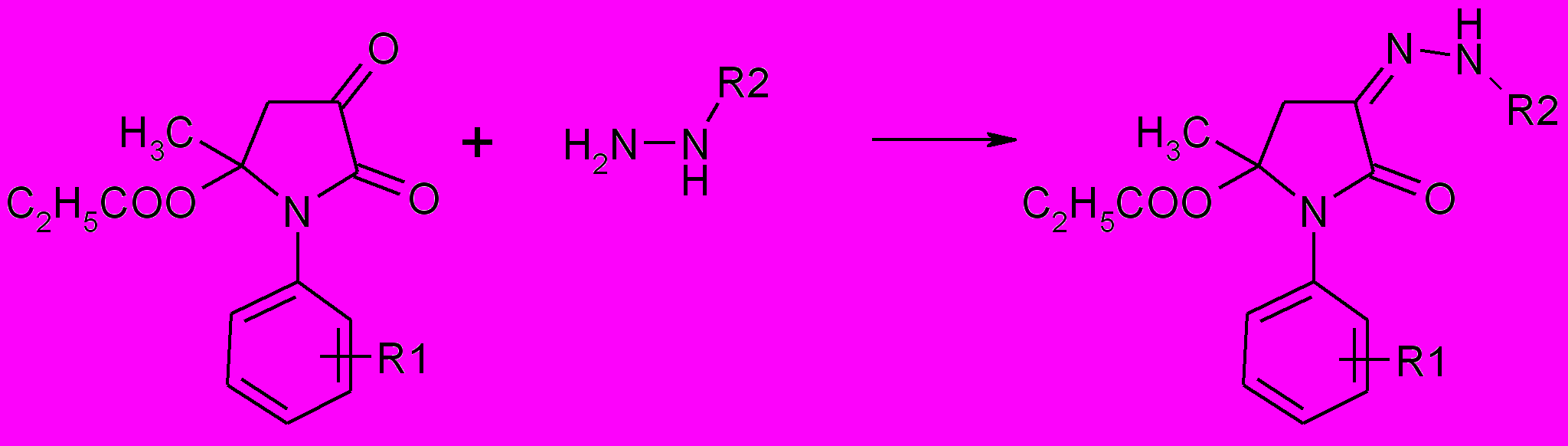
71,72,73
71: R1=H, R2=NH2CS
72а-в: R1=H (a), 4-Cl (б), 4-Br (в); R2=4-пиридил (72a-в)
73: R1=H, R2=C6H5
Соотношение интегральной интенсивности позволяет сделать вывод, что 90% вещества находится в гидразонной форме (А) и 10% – в енгидразинной (Б). Существование продуктов реакции в двух формах, по-видимому, объясняется электроноакцепторным действием пиридинового цикла.
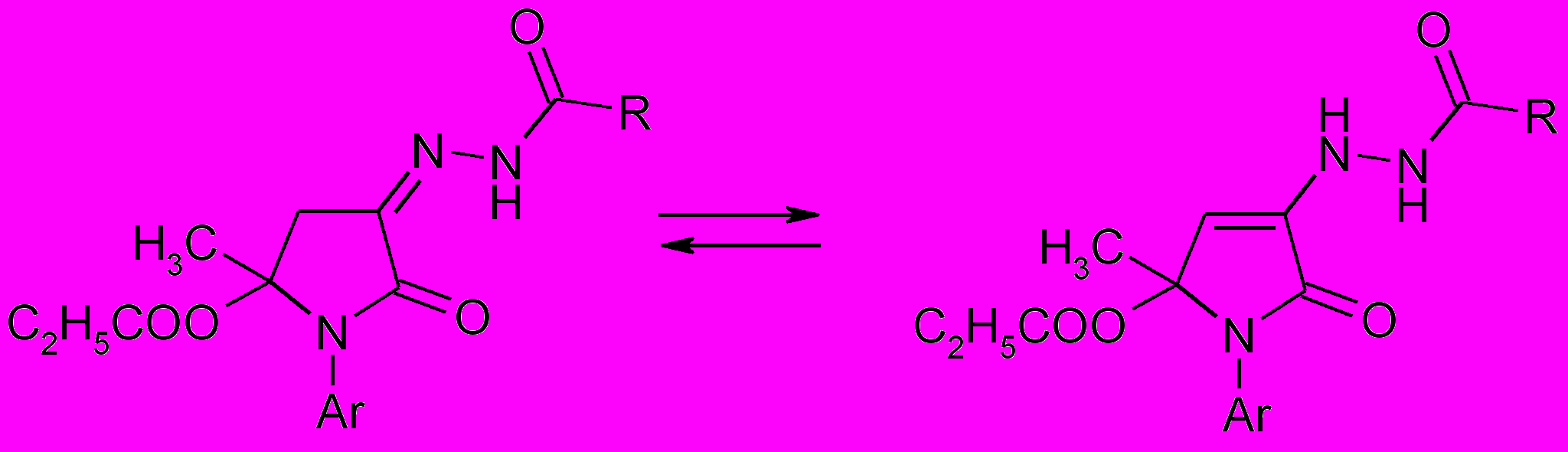
А Б
2.3. Взаимодействие 3-гидрокси-3-пирролин-2-онов сэлектрофильными реагентами.
Молекула 5-арил-4-ацил-3-гидрокси-1Н-3-пирролин-2-онов может быть проалкилирована по двум положениям: енолизованной карбонильной группе в положении 3 гетероцикла, с образованием продуктов О-алкилирования, и по аминогруппе в положении 1 с образованием продуктов N-алкилирования.
С целью выяснить, какая из этих возможностей реализуется на практике, нами были изучены реакции 1,4,5-тризамещнных пирролин-2-онов с такими алкилирующими реагентами как формальдегид, смесь формальдегида и морфолина и дифенилдиазометан. При нагревании смеси эквимолярных количеств 5-арил-4-ацил-3-гидрокси-1Н-3-пирролин-2-онов и формальдегида в присутствии основания – карбоната калия образуются продукты N-алкилирования – 5-арил-4-ацил-1-гидроксиметил-3-гидрокси-3-пирролин-2-оны (74а-д).
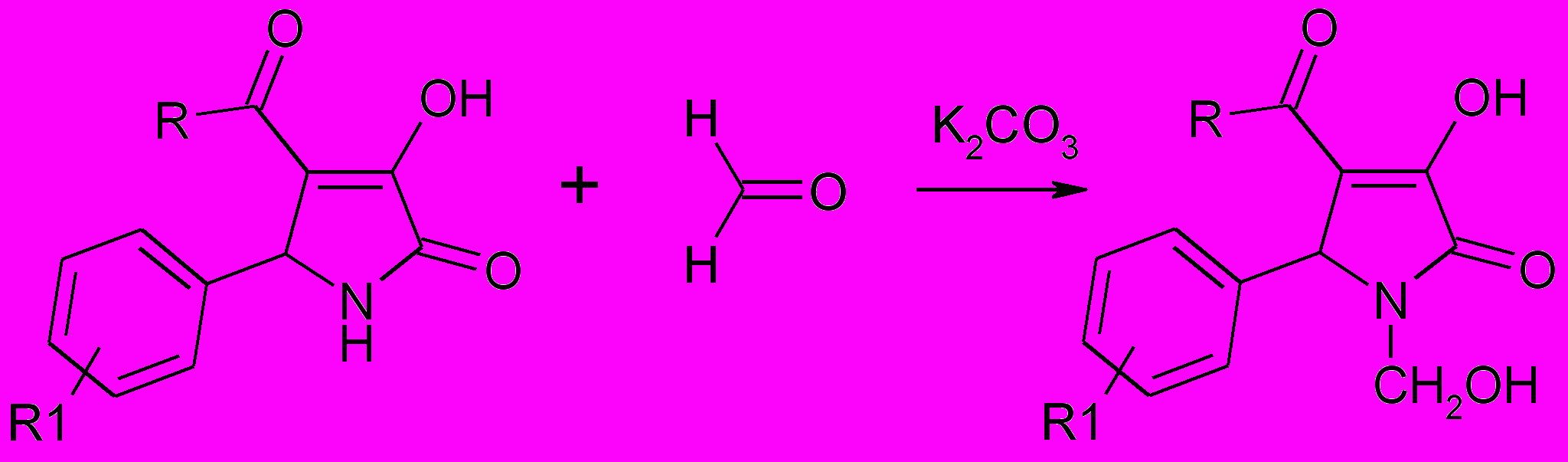
74а-д
R=С6H5 (а-г), CН3 (д); R1=H (a, д), 4-Br (б), 4-NO2 (в), 4-CН3О (г);
При взаимодействии 5-арил-4-бензоил-3-гидрокси-1Н-3-пирролин-2-онов (1) со смесью эквимолярных количеств формальдегида и морфолина образуются с хорошим выходом – 5-арил-4-бензоил-1-морфолилметил-3-гидрокси-3-пирролин-2-оны (75а-г).
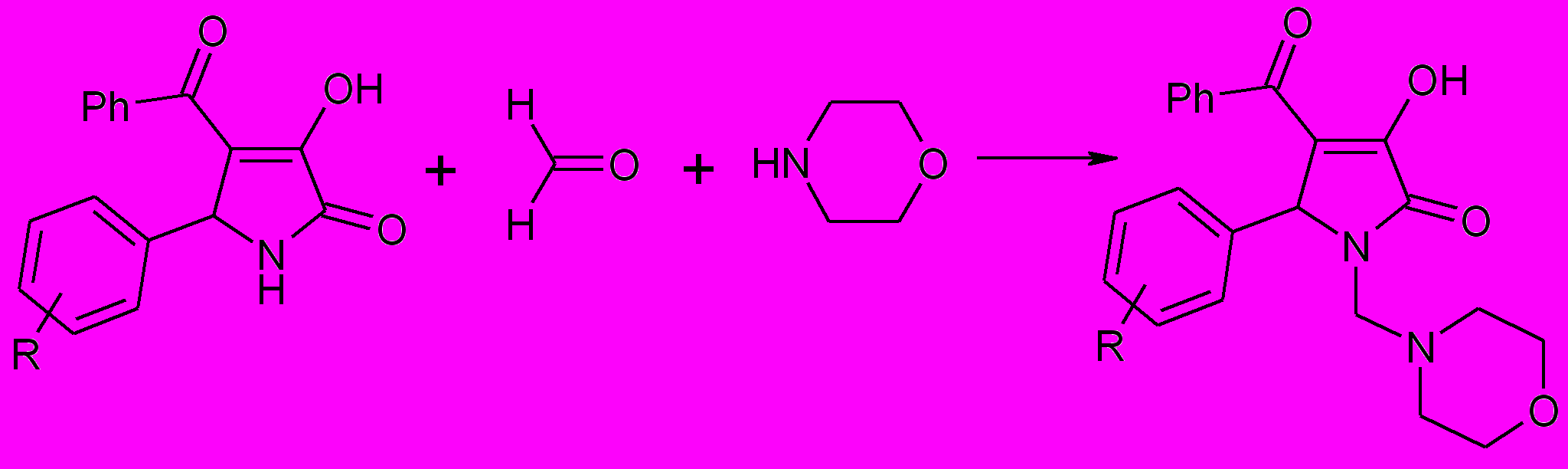
75а-г
R=H (a), 4-Br (б), 4-NO2 (в), 4-CН3О (г)
Алкилирование 5-арил-4-бензоил-3-гидрокси-1Н-3-пирролин-2-онов
(1а-г) дифенилдиазометаном в условиях длительного перемешивания в диоксане при комнатной температуре приводит к образованию продуктов О-алкилирования, а именно – 5-арил-4-бензоил-1Н-3-дифенилметокси-3-пирролин-2-онов (76а-г).
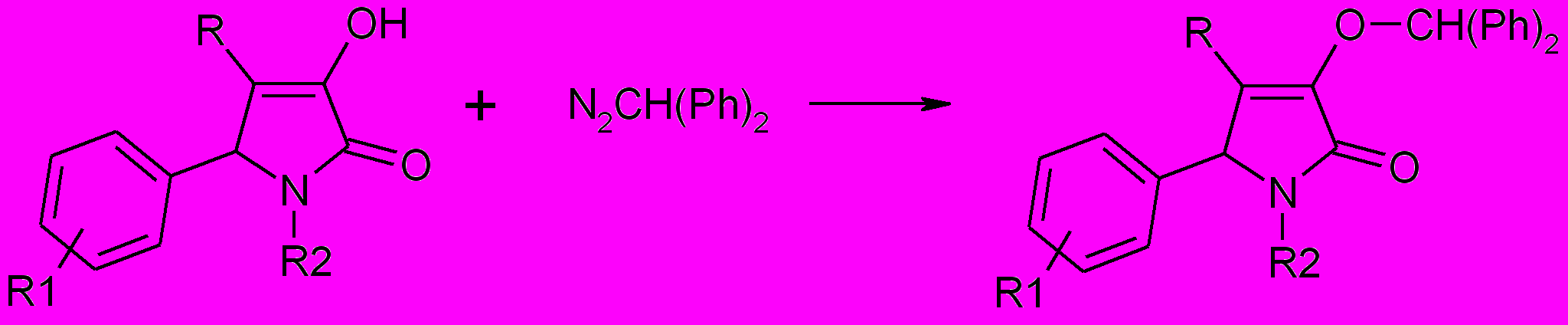
76,77, 79
R= С6H5CO (76), HetCO (77); CH3SO2 (79);
76а-д: R1=H (а,д), 4-Br (б), 4-NO2 (в), 4-CН3О (г); R2=H (a-г), 4-CН3С6H4 (д)
77а-е: R1=H (а,г), 4-CH3 (б,д), 4-Br (в), 4-NO2 (е); R2=С6H5 (a,г); Het=2-фурил
(а-в), 2-тиенил (г-е)
79a-д: R1=H (а-в), 4-Cl (г), 4-Br (д); R2=С6H5 (a,г), С6H4NH2SO2 (б), 4-IС6H4 (в), 4-BrС6H4 (д)
При изучении возможности супраповерхносной {1,3}- и {1,5 }- сигматропной перегруппировки полученных продуктов было обнаружено, что при нагревании соединений (77а-е) при температуре 170-180оС в течение 5-10 минут они претерпевают {1,5 }- сигматропную перегруппировку с высокими выходами в 5-арил-4-[гетерил(дифенилметокси)метилен]-1-фенилпирролидин-2,3-дионы (78а-д).
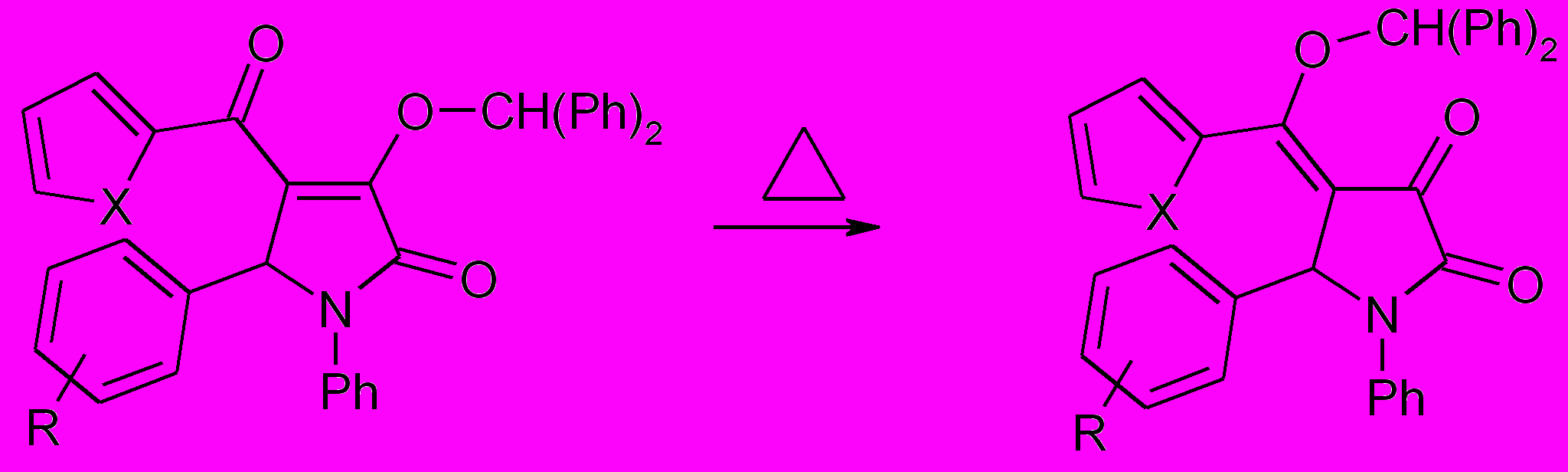
78а-д
R=H (а,г), 4-CH3 (б,д), 4-Br (в); X=O (а-в), S (г,д).
Ацилирование 1,5-диарил-3-гидрокси-4-метилсульфонил-3-пирролин-2-онов избытком уксусного ангидрида при комнатной температуре приводит к 1,5-диарил-3-ацетокси-4-метилсульфонил-3-пирролин-2-онам (80а-ж).
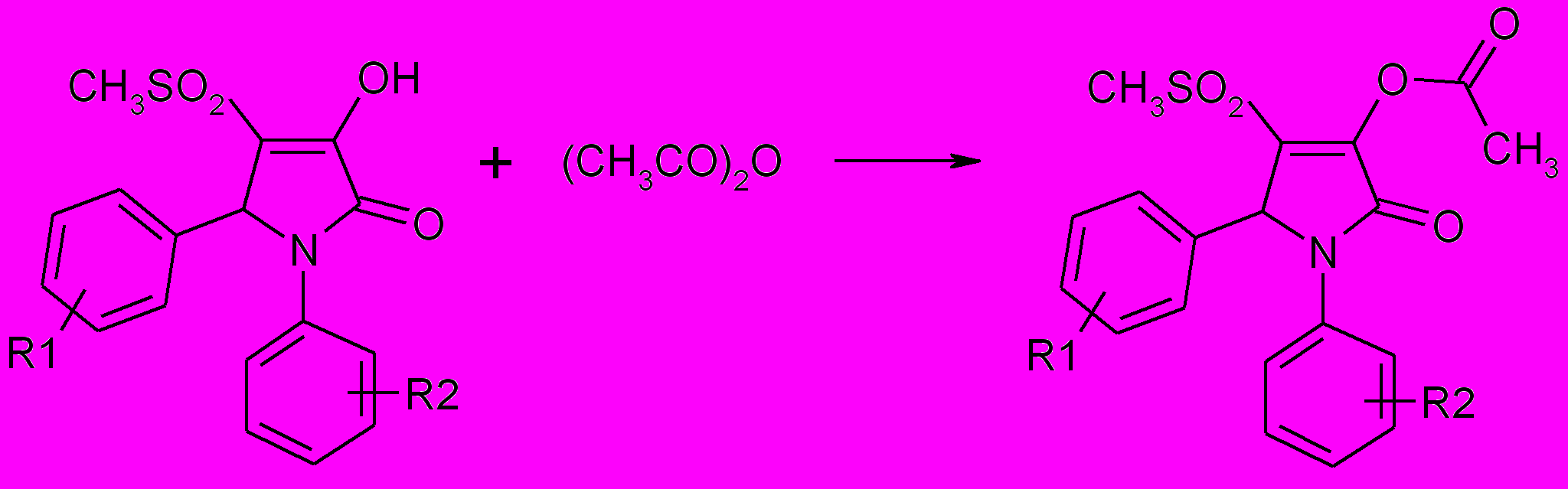
80а-ж
R1=H (а,в, г,ж), 4-CН3О (б), 4-Br (д,е); R2=H (a,б,д), 4-Cl (в), 4-F (г), 4-Br (е), 4-CH3COO (ж).
С целью изучения свойств 4-незамещеных 1-арил-5-метил-5-этоксикарбонилпирролидин-2,3-дионов нами было исследовано их взаимодействие с бромом. Реакция протекает в хлороформе при комнатной температуре в течение часа с образованием 1-арил-4-бром-5-метил-5-этоксикарбонилпирролидин-2,3-дионов (83а-г).
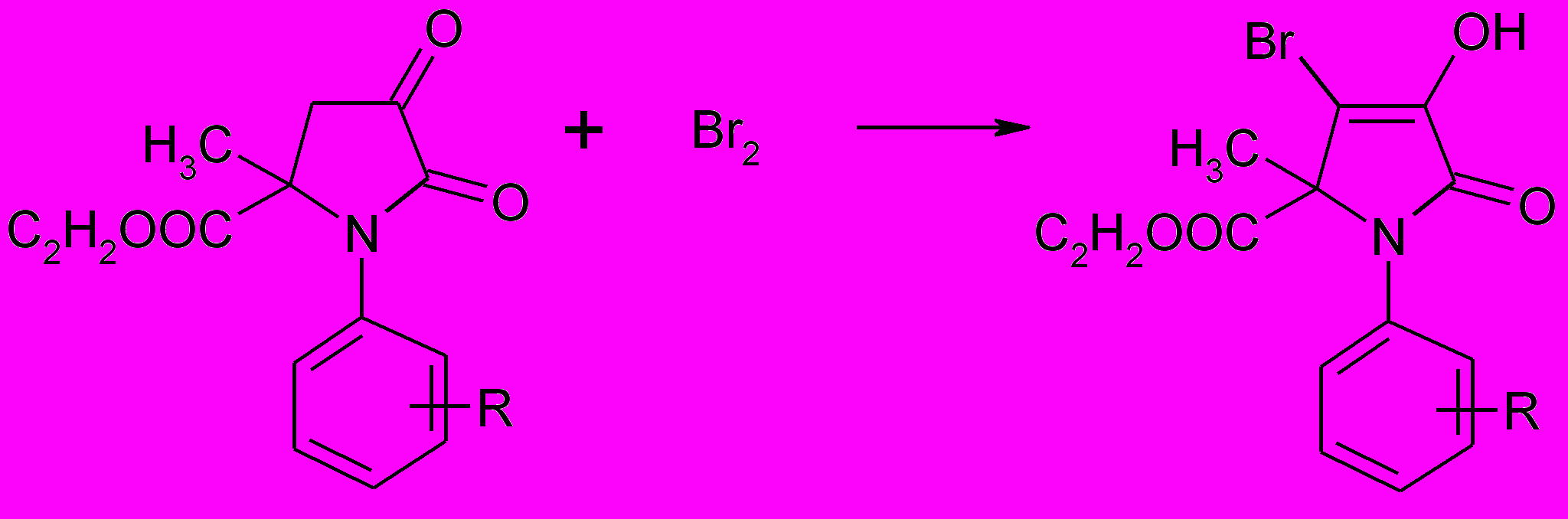
83а-г
R=H (а), 4-Br (б), 4-Cl (в), 4-F (г)
Соединения, молекулы которых содержат активированную метиленовую группу, при взаимодействии с солями арилдиазония образуют арилгидразоны. Взаимодействие солей арилдиазония с 1-арил-5-метил-5-этоксикарбонилпирролидин-2,3-дионами, являющимися СН-кислотами приводит к образованию 4-арилгидразонов 1-арил-5-метил-5-этоксикарбонилпирролидин-2,3,4-трионов (84а-ф). Характер и положение заместителя в ароматическом амине существенно не влияют на протекание реакции азосочетания.
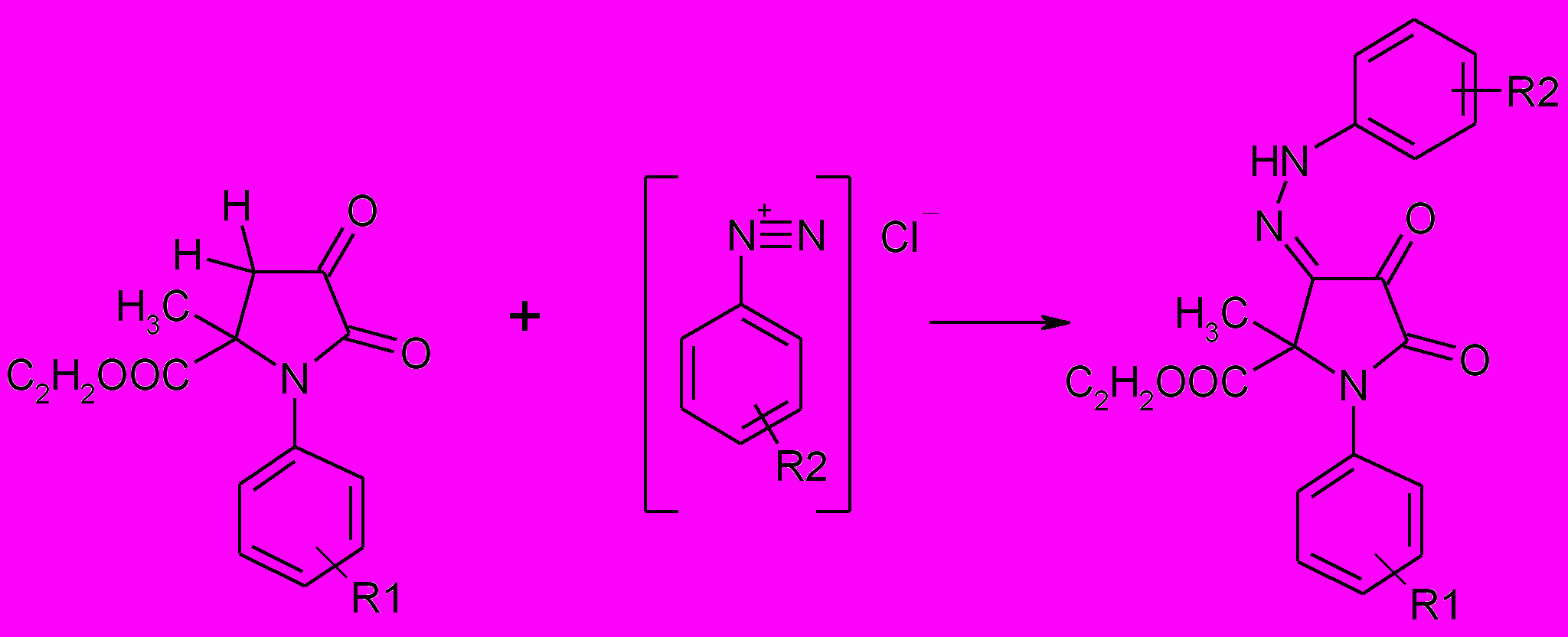
84а-ф
R1=H (а-р), 4-F (с), 4-Br (т) 4-Cl (у,ф) ; R2=H (a,с,у), 4-NO2 (б), 2-Cl (в), 3-Cl (г), 4-Cl (д,ф), 4-Br(е,т), 2-CН3(ж), 3-CН3(з), 4-CН3(и), 4-SO2NH2 (к), 2-CН3О (л), 3-CН3О (м), 4-CН3О (н), 4-COOС2Н5 (о), 4-F (п), 4-COOН (р)
4-Арилгидразоны 1-арил-5-метил-5-этоксикарбонил-пирролидин-2,3-дионов с ариламинами взаимодействуют с образованием 1-арил-3-арилимино-4-арилгидразоно-5-метил-5-этоксикарбонилпирролидин-2,3-дионы (86а-г), данные спектров свидетельствуют о существовании полученных соединений (86а-г) в азометиновой форме.
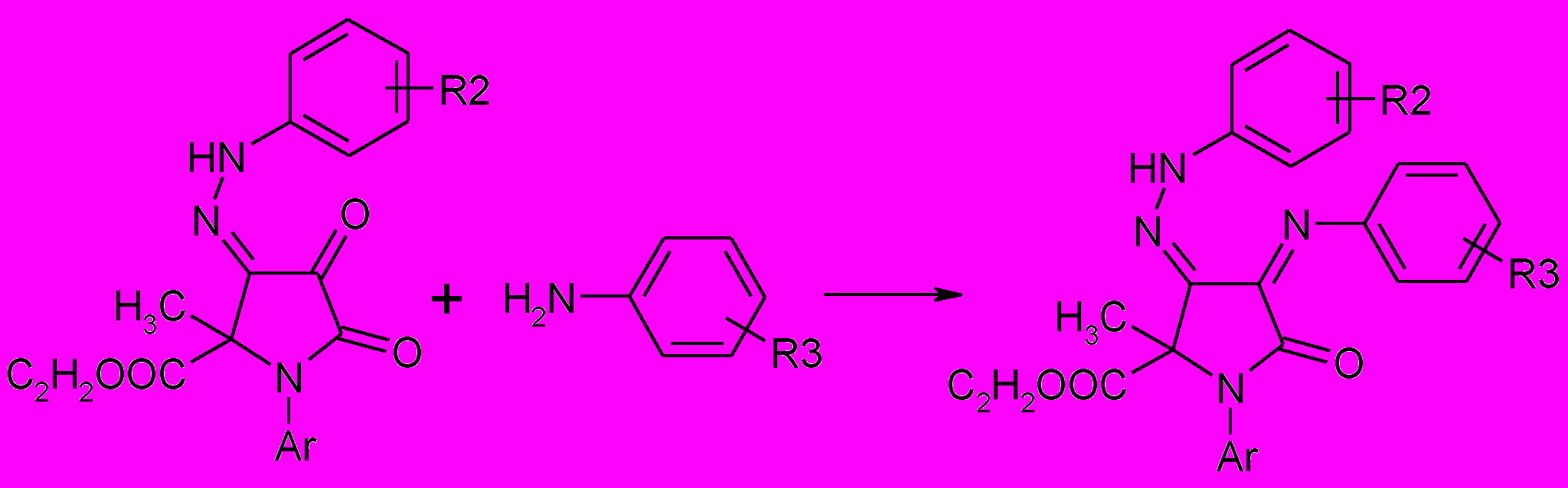
86а-г
Ar=С6H5 (а-в), 4-ClС6H4 (г); R2=H (a,г), 4-Cl (б), 3-Cl (в); R3=H (а,в), 4-Cl (б),
4-CН3 (г)
