Синтез, химические свойства и биологическая активность 1,4-дизамещенных 5-арил-3-гидрокси-3-пирролин-2-онов 15. 00. 02 Фармацевтическая химия, фармакогнозия
| Вид материала | Диссертация |
- Синтез, свойства и биологическая активность енаминоамидов ацилпировиноградных кислот, 439.81kb.
- Синтез, свойства, биологическая активность n-гетериламидов α-оксокислот и продуктов, 367.21kb.
- Синтез соединений на основе химических превращений производных α- оксокарбоновых кислот, 643.93kb.
- Синтез, свойства и биологическая активность продуктов взаимодействия 1,2,4-триазолов, 669.98kb.
- Синтез и биологическая активность карбо- и гетероциклов на основе тетрацианоэтилена, 673.64kb.
- Синтез и свойства новых производных 2 (1,2,4 триазолил 5 тио)уксусных кислот 15. 00., 240.9kb.
- Синтез, свойства и биологическая активность производных 2-хлорникотинонитрилов, 264.36kb.
- Примерная программа рекомендуется для направления подготовки (специальности) 111801, 717.4kb.
- Синтез и физико-химические свойства координационных соединений рения(V) с производными, 208.83kb.
- Синтез и химические свойства дикарбонильных соединений адамантанового ряда 02. 00., 667.04kb.
2.4. Реакции циклизации и рециклизации пирролидин-2,3-дионов и их 3-ариламинопроизводных под действием концентрированной серной кислоты.
При кратковременном нагревании в концентрированной серной кислоте 5-арил-3-ариамино-4-бензоил-1Н-3-пирролин-2-онов и последующей длительной выдержке смеси при комнатной температуре происходит внутримолекулярная циклизация с образованием 1-арил-(5,7)-R-9-фенилпирроло[3,4-b]хинолин-3-онов (87а-е).
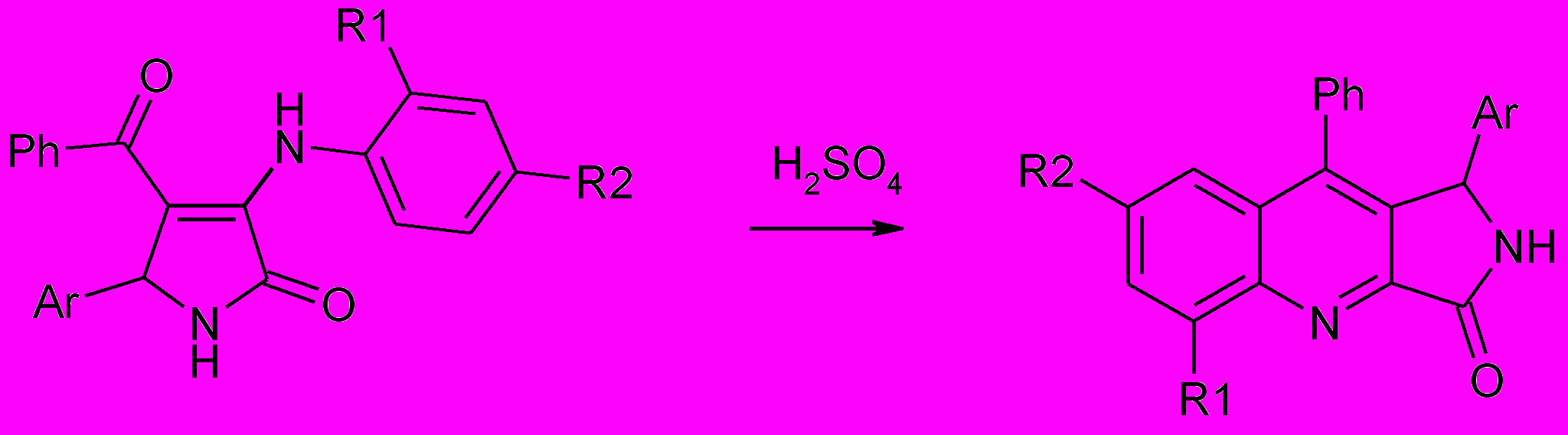
87а-д
R1=H (а-в), CН3 (г,д); R2=Br (a), CН3 (б), CН3O (в), H (г,д); Ar=Ph (а,б,г),
4-BrC6H4 (в,д)
При нагревании 3-гидрокси-5-(3-нитрофенил)-4-(2-тиенил)-1-фенил-3-пирролин-2-она в концентрированной серной кислоте образуется 2,5-дигидро-4-гидрокси-2-(3-нитрофенил)-5-оксо-3-(2-тиенил)-1Н-бензоазепин (88).
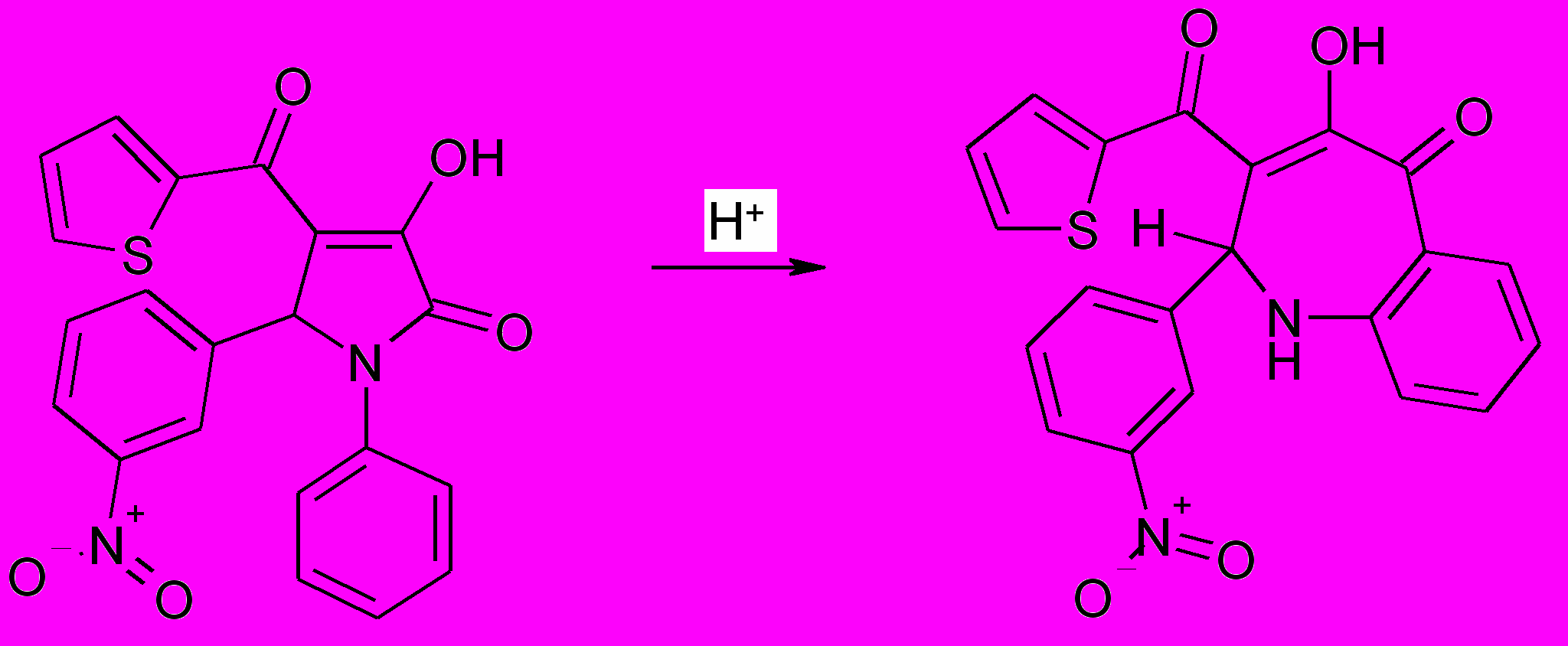
88
3. Биологическая активность полученных соединений
Представители большинства рядов синтезированных соединений были подвергнуты испытаниям на антимикробную, анальгетическую, противовоспалительную, ноотропную активности.
Исследования анальгетической, противовоспалительной, ноотропной активности и острой токсичности проведены на кафедре фармакологии Пермской государственной фармацевтической академии ассистентом Шуклиной Н.С. под руководством профессора Колла В.Э. и профессора Юшкова В.В. Испытания на антимикробную активность осуществлены на кафедре микробиологии с курсом гигиены и экологии доцентом Ворониной Э.В., заведующая кафедрой профессор Одегова Т.Ф.
3.1. Противомикробная активность
Всего на противомикробную активность было испытано 341 соединение, из них 153 вещества проявили выраженную противомикробную активность. Обнаружено значительное число активных соединений (табл. 1), наиболее активными являются 22л и 28з, МИК которых в отношении в отношении стафилококка и кишечной палочки составляет 3,9 мкг/мл. Оба соединения относятся к пирролин-2-онам, содержащим в положении 1 или 4 гетероцикла гетерильный заместитель. Среди других пирролин-2-онов и их 3- и 4-замещенных производных вещества с высокой противомикробной активностью не обнаружены (их максимальная активность составляет 125 мкг/мл). Таким образом, поиск веществ с высокой противомикробной актив-ностью следует вести среди 1-и 4-гетерилпроизводных пирролин-2-онов.
Таблица 1
Противомикробная активность 1-дизамещенных 5-арил-4-ацил-3-гидроксипирролин-2-онов.
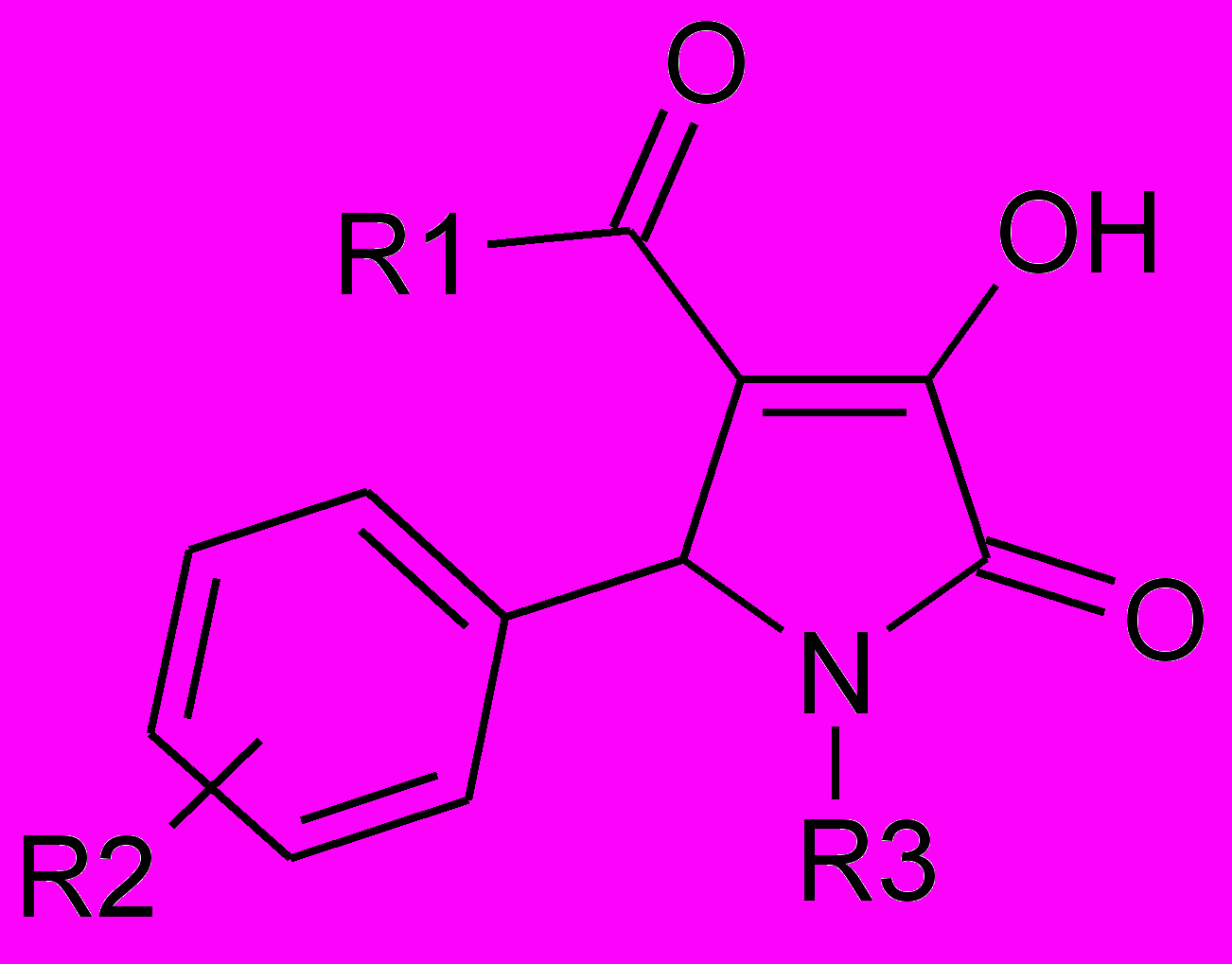
| № | R1 | R2 | R3 | ПМА, МИК, мкг/мл | |
| St. aureus | E. coli | ||||
| 1б | C6H5 | 4-Br | Н | 125 | 250 |
| 1д | 4-ClC6H4 | 4-Br | Н | 62 | 62 |
| 8б | C6H5 | Н | 4-BrC6H4 | 31 | 62 |
| 8в | C6H5 | 4-Br | C6H5 | 7,8 | 250 |
| 8е | C6H5 | 4-NO2 | 4-BrC6H4 | 15,6 | 15,6 |
| 21е | C6H5 | 4-Br | 2-пиридил | 31 | 31 |
| 21ж | C6H5 | 4-Cl | 2-пиридил | 31 | 31 |
| 21о | 4-BrC6H4 | Н | 2-пиридил | 31 | 31 |
| 22г | CH3 | 4-Br | 5-бром-2-пиридил | 7,8 | 7,8 |
| 22л | 4-ClC6H4 | Н | 5-бром-2-пиридил | 3,9 | 3,9 |
| 26у | 4-ClC6H4 | 2-F | 2-тиазолил | 15,6 | 62 |
| 28ж | 2-тиенил | 4-(CH3)2СН | C6H5 | 7,8 | 7,8 |
| 28з | 2-тиенил | 4-(CH3)3С | C6H5 | 3,9 | 3,9 |
| 28е | 2-тиенил | 4-Br | C6H5 | 15,6 | 15.6 |
| 28а | 2-тиенил | 4-Cl | C6H5 | 31 | 31 |
| 28в | 2-тиенил | 4-CH3 | C6H5 | 31 | 31 |
| 29ж | 2-фурил | 4-(CH3)2СН | C6H5 | 15,6 | 15,6 |
| 29з | 2-фурил | 4-(CH3)3С | C6H5 | 7,8 | 78 |
| 29е | 2-фурил | 4-Br | C6H5 | 31 | 31 |
| Диоксидин | 62,5-1000 | 3,9-62,5 | |||
3.2. Анальгетическая активность
Испытаниям на анальгетическую активность было подвергнуто 49 соединений разных рядов. При изучении анальгетической активности прослеживается четкая зависимость «структура – активность». Наиболее высокую активность проявляют 4-ацетил(4-метилсульфонил)-3-гидрокси-3-пирролин-2-оны содержащие в положении 1 карбоксиметильный заместитель и атом галогена в пара-положении бензольного кольца в положении 5 гетероцикла. Наиболее высокое анальгетическое действие показал 4-ацетил-5-(4-йодфенил)-1-карбоксиметилтетрагидропиррол-2,3-дион (12в) (табл. 2).
Таблица 2
Анальгетическая активность 5-арил-4-ацетил-1-карбоксиалкил-3-гидрокси-3-пирролин-2-онов
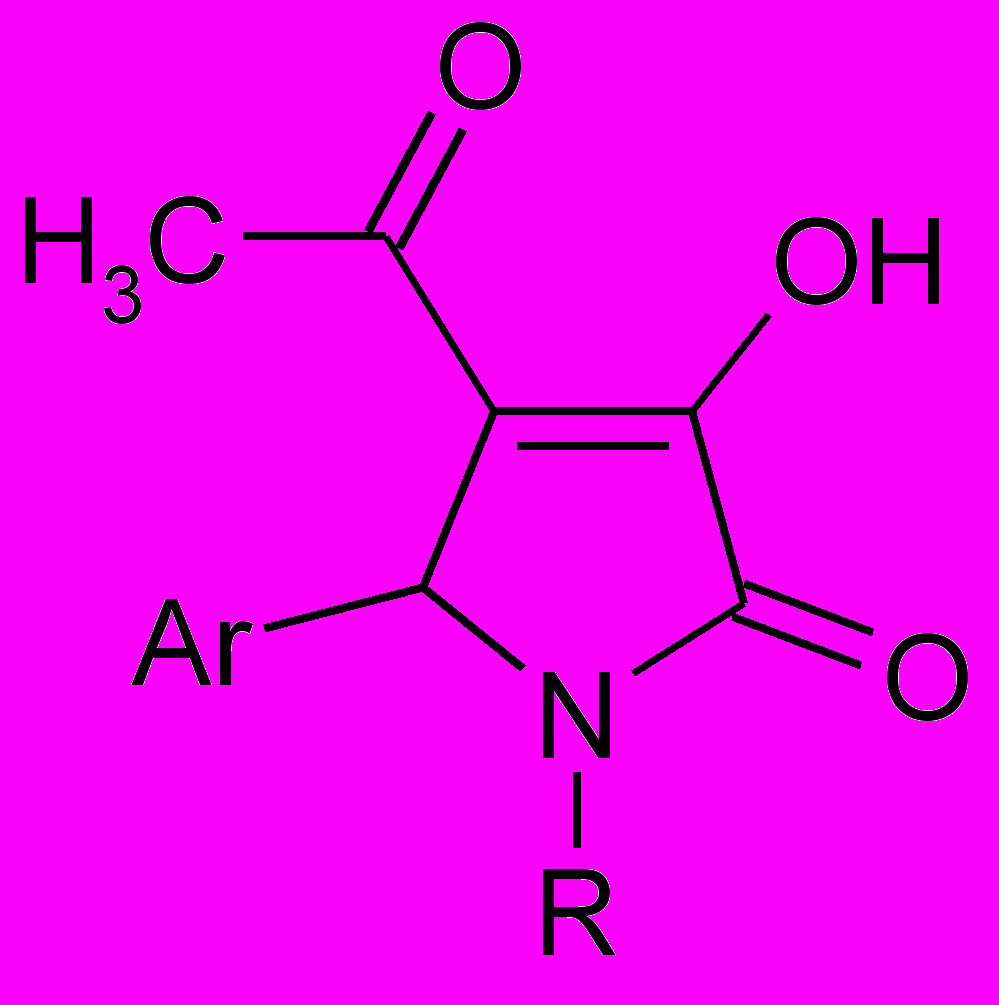
| № | Ar | R | Время оборонительного рефлекса, сек |
| 12а | C6H5 | CH2CОOН | 27,8±1,9 |
| 12б | 4-BrC6H4 | CH2CОOН | 32,0±2,7* |
| 12в | 4-IC6H4 | CH2CОOН | 35,4±4,1* |
| 12е | 4-CH3OC6H4 | CH2CОOН | 32,2±2,2* |
| 14б | C6H5 | CH2CH2CОOН | 28,9±2,6 |
| 14г | 4-IC6H4 | CH2CH2CОOН | 25,5±2,1 |
| Контроль (2% крахмальная слизь) | 12,0±1,1 | ||
| Анальгин | 23,2±0,7 | ||
* достоверно отличается от анальгина при p ≤ 0,05
3.3. Противовоспалительная активность
На противовоспалительную активность испытано 57 соединений с различными заместителями в положениях 1,3,4,5 гетероцикла. Как показывают исследования, наибольшую противовоспалительную активность проявляют представители 4-незамещенных пирролин-2-онов, среди которых следует вести поиск новых противовоспалительных средств (табл.3).
Таблица 3
Противовоспалительная активность соединений 33, 34, 46, 47, 84
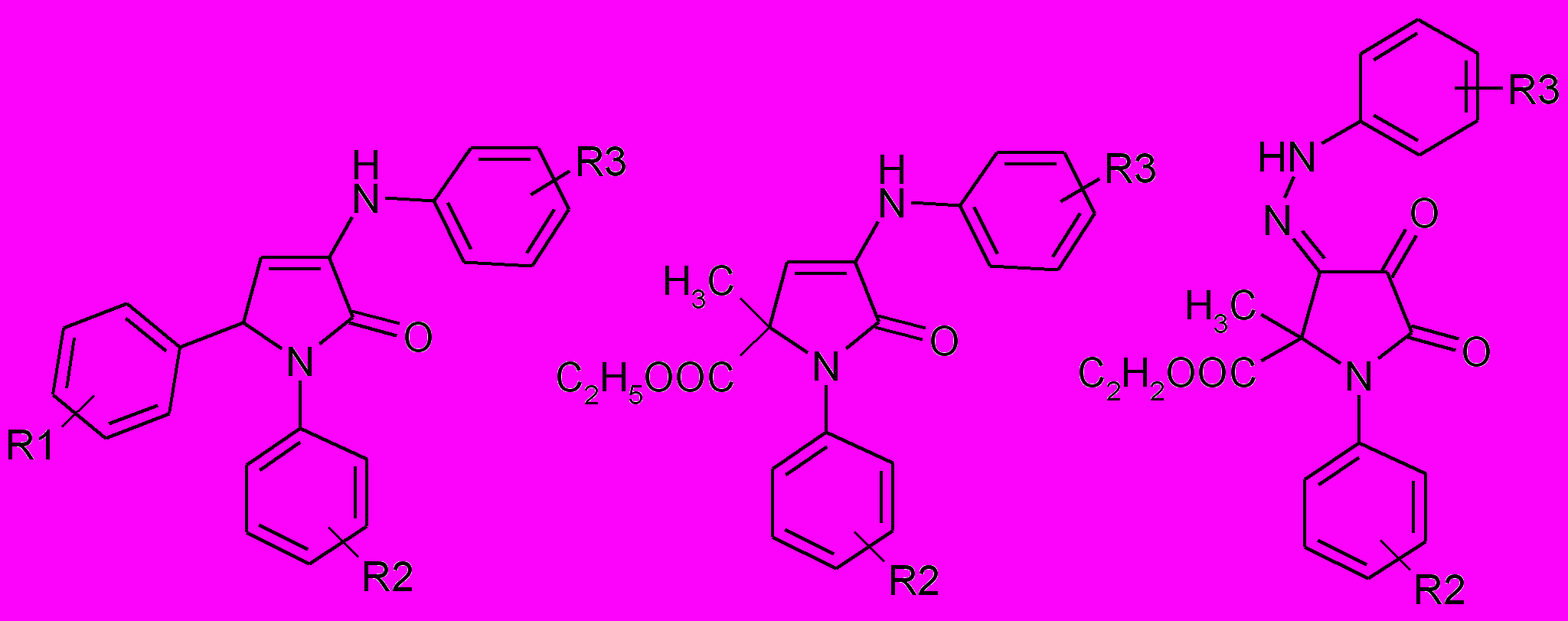
33, 46 34, 47 84
| № | R1 | R2 | R3 | % торможения каррагенинового отека | ||
| 1 час | 3 часа | 5 часов | ||||
| 33а | 2-CH3O | H | H | 22,7±9,2 | 29,7±8,3* | 19,3±2,4 |
| 33в | 3,4-(CH3O)2 | H | H | 61,7±2,2 *** | 14,0±7,3 | 38,0±4,2** |
| 33ж | 3,4-(CH3O)2 | 4-CH3 | 4-CH3 | 57,7±2,6 *** | 18,3±6,5 | 31,7±3,4** |
| 33з | 3-CH3O, 4-OH | 4-CH3 | 4-CH3 | 46,0±4,6 *** | 49,6±4,8 *** | 40,0±6,9 *** |
| 33ш | 2,4-Cl2 | 4-COOЕt | 4-COOЕt | 80,3±2,1 *** | 69,9±6,3 *** | 34,2±5,6 *** |
| 33щ | 4-C2H5O | 4-COOЕt | 4-COOЕt | 40,5±12,8 *** | 38,9±1,0 *** | 39,7±1,0 *** |
| 34а | - | 4-CH3 | 4-CH3 | 12,0±7,6 | 23,0±9,9 | 32,0±14,1 ** |
| 34б | - | H | H | 3,6±2,2 | 39,8±6,0** | 32,4±4,3** |
| 46б | 4-CH3O | H | 5-COOH, 4-OH | 44,0±13,9** | 14,7±9,3 | 18,3±7,6 |
| 84о | - | H | 4-COOЕt | 22,9 | 40,8** | 44,8*** |
| Диклофенак | 22,3±3,7 | 29,0±2,8 | 38,7±4,3 | |||
Примечание: * = p ≤ 0,05, **= p ≤ 0,01, ***= p ≤ 0,001 по сравнению с контролем

Примечание: * = р < 0,05, a = р < 0,01, b = р < 0,001
Рис.4. Сравнительная характеристика противовоспалительной активности соединений ряда 4-незамещенных пирролин-2-онов.

Примечание: * = р < 0,05
Рис.5. Сравнительная характеристика противовоспалительной активности соединений ряда 4-гетероилпирролин-2-онов.
Таблица 4
Противовоспалительная активность соединений 28, 29, 45, 52, 53
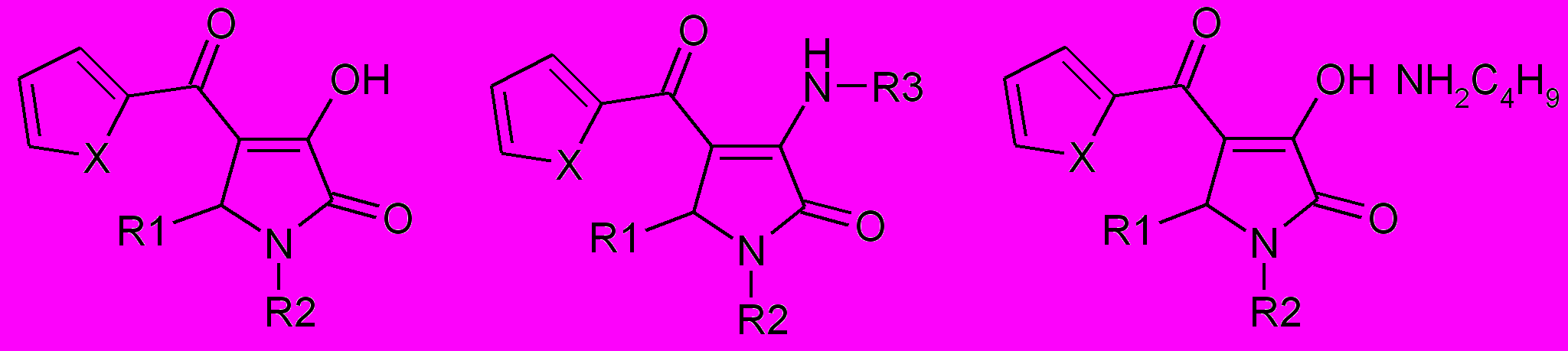
28, 29 45, 53 52
| № | X | R1 | R2 | R3 | % торможения каррагенинового отека | ||
| 1 час | 3 часа | 5 часов | |||||
| 28г | S | 4-CH3O-С6H4 | С6H5 | - | 24,6±6,6 | 21,6±4,8 | 32,9±4,1* |
| 28л | S | 2-ClС6H4 | С6H5 | - | 45,3±2,3* | 38,8±0,7* | 40,7±0,8* |
| 29г | O | 4-CH3O-С6H4 | С6H5 | - | 43,8±0,9* | 31,2±3,1* | 33,7±5,4* |
| 53н | S | С6H5 | С6H5 | 4-СH3О-С6H4 | 30,7±1,8* | 24,3±7,7 | 20,9±6,2 |
| 53в | O | С6H5 | С6H5 | 4-СH3О-С6H4 | 45,3±4,0* | 18,0±3,3 | 29,9±2,7 |
| 45е | S | 4-BrС6H4 | С6H5 | C4H9 | 31,4±5,2* | 40,1±4,6* | 38,2±2,9* |
| 45г | S | С6H5 | 2-тиа-золил | C4H9 | 47,5±6,3* | 14,8±4,2 | 15,6±6,3 |
| 52е | S | С6H5 | 2-тиа-золил | - | 46,4±6,1* | 31,9±10,1* | 11,1±6,7 |
| Диклофенак 10 мг/кг | 22,3±3,7 | 29,0±2,8 | 38,7±4,3 | ||||
