Синтез, химические свойства и биологическая активность 1,4-дизамещенных 5-арил-3-гидрокси-3-пирролин-2-онов 15. 00. 02 Фармацевтическая химия, фармакогнозия
| Вид материала | Диссертация |
- Синтез, свойства и биологическая активность енаминоамидов ацилпировиноградных кислот, 439.81kb.
- Синтез, свойства, биологическая активность n-гетериламидов α-оксокислот и продуктов, 367.21kb.
- Синтез соединений на основе химических превращений производных α- оксокарбоновых кислот, 643.93kb.
- Синтез, свойства и биологическая активность продуктов взаимодействия 1,2,4-триазолов, 669.98kb.
- Синтез и биологическая активность карбо- и гетероциклов на основе тетрацианоэтилена, 673.64kb.
- Синтез и свойства новых производных 2 (1,2,4 триазолил 5 тио)уксусных кислот 15. 00., 240.9kb.
- Синтез, свойства и биологическая активность производных 2-хлорникотинонитрилов, 264.36kb.
- Примерная программа рекомендуется для направления подготовки (специальности) 111801, 717.4kb.
- Синтез и физико-химические свойства координационных соединений рения(V) с производными, 208.83kb.
- Синтез и химические свойства дикарбонильных соединений адамантанового ряда 02. 00., 667.04kb.
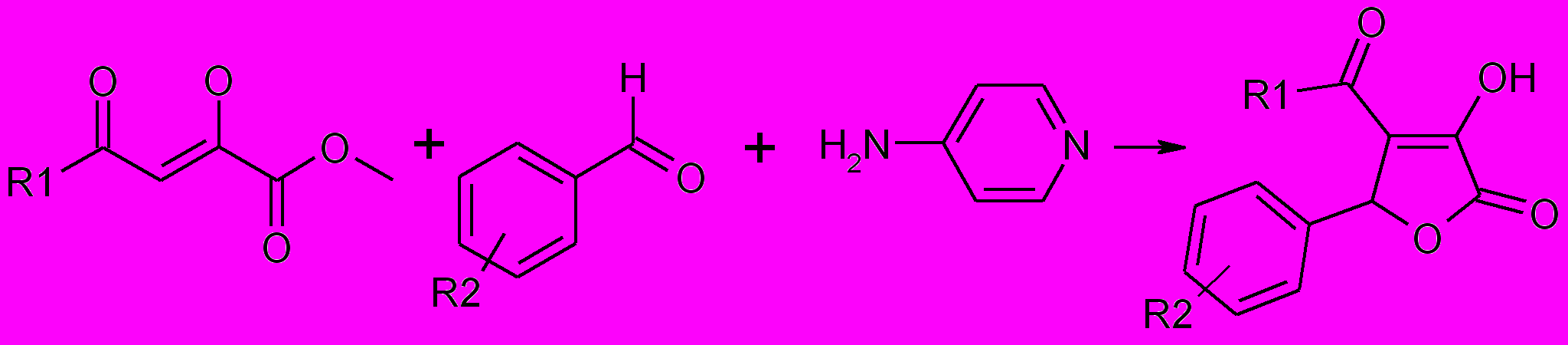
1. 3. Синтез 5-арил-4-ацил-1-карбоксиалкил-3-гидрокси-3-
пирролин-2-онов
Принимая во внимание, что карбоксильная группа и ее функциональные производные являются фармакофорными фрагментами, нами была изучена возможность получения пирролидин-2,3-дионого цикла с участием амино-кислот. В качестве последних были выбраны наиболее доступные аминокис-лоты, аминокислоты являющиеся непосредственно фармацевтичес-кими препаратами: гликокол, α- и β-аланин, γ-аминомасляная, ε-аминокапро-новая и β-фенил-γ-аминомасляная кислоты, а также функциональные производные гликокола. Установлено, что взаимодействие метиловых эфиров ацилпировиноградных кислот со смесью ароматического альдегида и аминокислоты приводит к образованию 5-арил-4-ацил-1-карбоксиалкил-3-гидрокси-3-пирролин-2-онов.
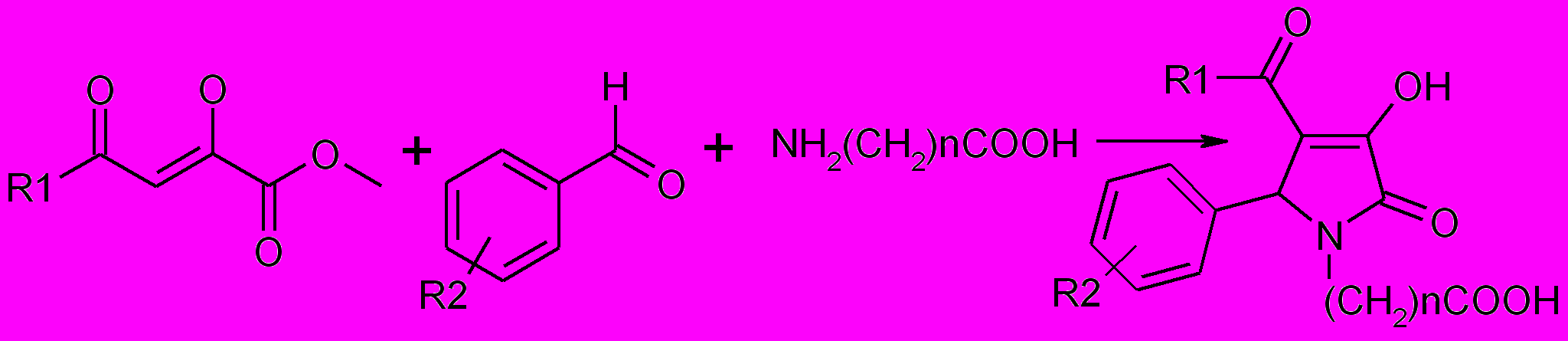
12,14,15,16*,17
n=1 (12), 2 (14), 3 (15), 5 (17); 16*(СН)nCOOH=CH2CH(Ph)CH2COOH
12а-ц: R1=CH3 (а-и,с,т), С6Н5 (к,л,у,ф,х), 4-ClС6Н4 (м,о,п), 4-CH3С6Н4 (н), 4-CH3OС6Н4 (р), (CH3)3С) (ц) ; R 2=H (а,к,м,р,ц), 4-Br (б,л,н,п), 4-I (в,о), 4-Cl (г), 4-NO2 (д), 4-CH3O (е), 2-F (ж), 3,4-(CH3O)2 (з), 4-F(и), 4-ОН (с), 3-CH3O (т,ф), 2-Cl (у), 2-NO2 (х)
14а-л: R1=CH3 (а-д), С6Н5 (е-з,к), 4-ClС6Н4 (и,л); R 2=4-Br (а), H (б), 4-NO2 (в,е), 4-I (г), 2,4-(CH3O)2 (д), 3-NO2 (ж), 2-F (з,и), 3,4-(CH3O)2 (к,л)
15а-н: R1=CH3 (а-з), С6Н5 (и,к), 4-NO2С6Н4 (л-н); R 2=H (а,и), 4-I (б), 4-CH3O (в), 2-F (г), 4-NO2 (д), 3-NO2 (е,к.м), 3,4-(CH3O)2 (ж), 4-F (з.н), 4-(CH3)2N (л);
17а-п: R1=CH3 (а-з), С6Н5 (и), 4-NO2С6Н4 (к), 4-ClС6Н4 (л), 4-BrС6Н4 (м-п)
R 2=H (а,и.л), 4-CH3O (б), 4-NO2 (в,н), 3-NO2 (г), 4-I (д), 2-F (е), 2,4-(CH3O)2 (ж), 3,4-(CH3O)2 (з,м), 4-Cl (к), 3-F (о), 4-CH3 (п)
16а-н: R1=CH3 (а-з), С6Н5 (и-н); R 2=4-BrС6Н4 (а,к), 4-NO2 (б), 4-CH3O (в), 4-I
(г), H (д,и), 3-NO2 (е,л), 2-F (ж,м), 4-F (з), 4-Cl (н)
При использовании в качестве аминокислоты – α-аланина, у которого аминогруппа находится у вторичного углеродного атома, выход пиррол-диона значительно снижается.
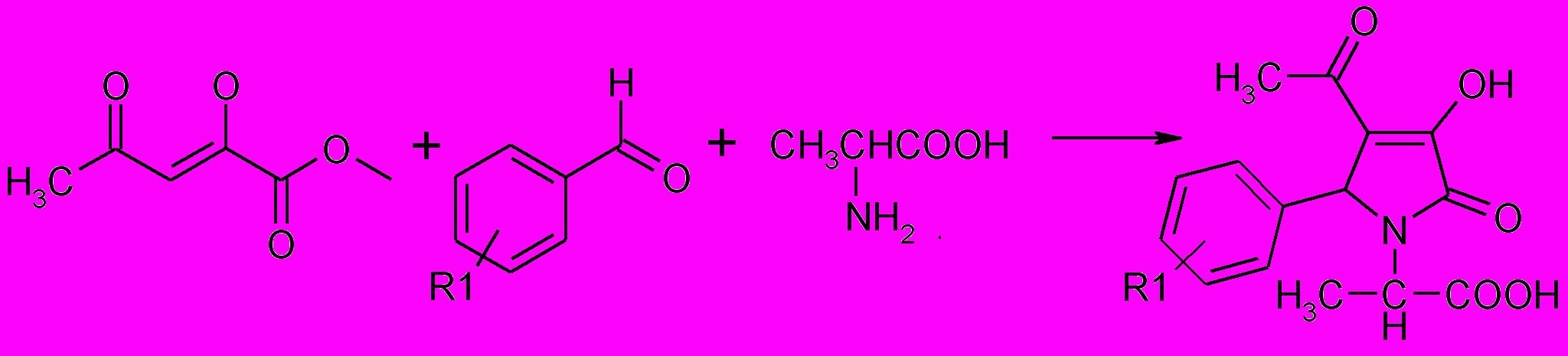 13а-в
13а-вR1= 4-Br (a), 4-Cl (б), 4-NO2 (в)
Для введения в положение 1 гетероцикла функциональных производных аминокислот, таких как эфиры, амиды и нитрилы были использованы метиловый и этиловый эфир гликокола, его амид и нитрил. При взаимодействии метилового эфира ацетилпировиноградной кислоты со смесью ароматического альдегида и эфира гликокола, его амида или нитрила с хорошим выходом образуются соответствующие 1-метоксикарбонилметил- (18а-з), 1-аминокарбонилметил- (19а-г) или 5-арил-4-ацетил-1-цианометил-3-гидрокси-3-пирролин-2-оны (19д-к).
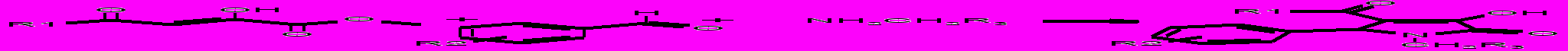
18,19
R3=COOCH3 (18а-в), COOC2H5(18г-з), CONH2 (19а-г), CN (19д-к)
18а-з: R1 = СН3; R2=H (а), 4-CH3OOC (б), 4-C2H5 (в), 4-Br (г), H (д), 4-NO2 (е), 4-I (ж), 4-CH3O (з)
19а-г: R1 = СН3 (а,б), С6Н5 (в,г); R2= 4-Br (а), H (б,в), 2-F (г)
19д-к: R1 = СН3 (д-з), С6Н5 (и,к); R2= Н (д), 4-СН3 (е), 4-СН3О (ж), 2-тиофенил (з), 3,4-(СН3О)2 (и), 2-пиридил (к)
1.4. Синтез 3-бензоилметилен-5-арилметиленпиперазин-2,6-дионов
Реакция глицинамида с ароматическим альдегидом и метиловым эфиром бензоилпировиноградной кислоты протекает неоднозначно и, за исключе-нием двух случаев (19в,г), приводит к образованию других продуктов – 3-бензоилметилен-5-арилметиленпиперазин-2,6-дионов (20 а-и).

20а-и
R=4-Cl (a), 4-F (б), 4-Br (в), 3-NO2 (г), 2-NO2 (д), 4-NO2 (е), 2,4-(CH3O)2 (ж), 2,4-(CH3O)2 (з), 3,4-(CH3O)2 (и)
1.5. Синтез 1-гетерил-3-гидрокси-3-пирролин-2-онов
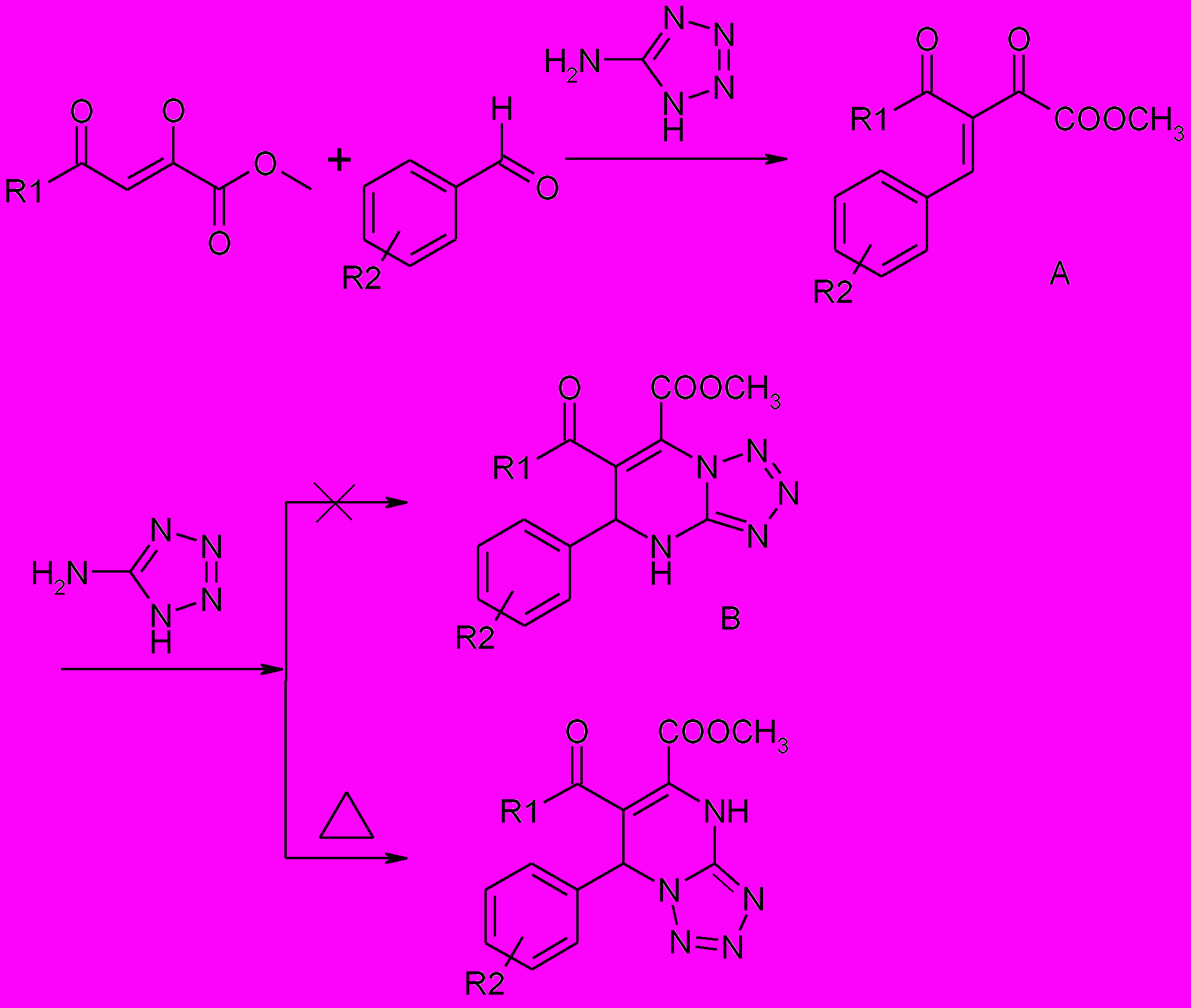
С целью расширения возможностей синтеза потенциально биологически активных гетероциклических систем представляло интерес разработать способы получения 3-пирролин-2-онов, содержащих в положении 1 гетерильный заместитель. Для этого в качестве аминокомпоненты были взяты аминозамещенные гетероциклы, содержащие один, два или несколько гетероатомов, такие как 2-аминопиридин и 5-бром-2-аминопиридин, 3-аминопиридин, 4-аминопиридин, 2-аминотиазол, 5-аминотетразол. Реакция c
2-аминопиридином, 5-бром-2-аминопиридином, 3-аминопиридином, 2-аминотиазол протекает при кратковременном нагревании реагентов в уксусной кислоте с образованием 1-гетерил-3-гидрокси-3-пирролин-2-онов.
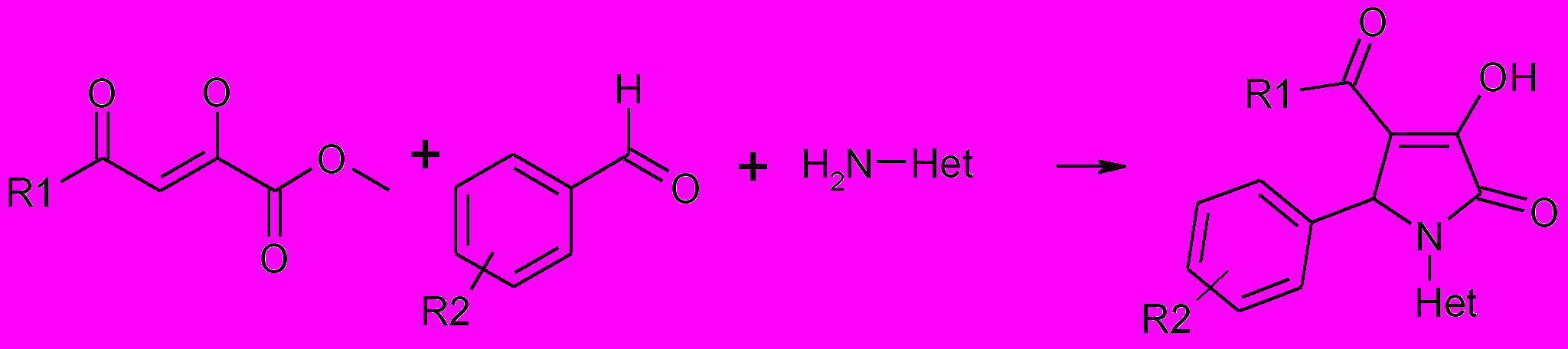
21, 22,23
Het=2-пиридил (21), 5-бром-2-пиридил (22), 3-пиридил (23), 2-аминотиазол (26)
21а-ш: R1=CH3 (а-г), С6Н5 (д-м), 4-ClС6Н4 (н,т,у,ш), 4-BrС6Н4 (о,ц,ч), 4-NO2С6Н4 (п), 4-CH3С6Н4 (р,х), 4-CH3ОС6Н4 (с,ф); R 2=4-Br (а,е,у,ф), 4-CH3O (б,и,т), 4-NO2 (в,з,х), 3-NO2 (г,ч), H (д,н-с), 4-Cl (ж,ц,ш), 4-F (к), 3-F (л), 3,4-(CH3O)2 (м)
22а-м: R1=CH3 (а-г), С6Н5 (д-ж), 4-BrС6Н4 (з), 4-NO2С6Н4 (и), 4-ClС6Н4 (к-м);
R 2=4-NO2 (а,м), 3-NO2 (б,е), 4-CH3O (в,к), 4-Br (г,з), H (д,и,л), 4-(CH3 )2 N (ж)
23а-п: R1=CH3 (а-е), С6Н5 (ж-п); R 2=4-F (а), 2,4-(CH3O)2 (б), 2-F (в,о), 3-F (г,и), 4-Cl (д), ), 3,4-(CH3O)2 (е), H (ж), 4-CH3O (з), 4-Br (к), 4-(CH3 )2 N (л), 4-CH3 (м), 3-NO2 (н), 4-NO2 (п)
26а-х: R1=CH3 (а-е), С6Н5 (ж-к), 4-FС6Н4 (л), 4-ClС6Н4 (м-п,с-х), 4-NO2С6Н4 (р); R 2= H (а,ж,п), 4-Br (б,х), 4-F (в,з,р), 2-F (г,к,у), 3,4-(CH3O)2 (д), 4-(CH3 )2 N (е), 4-CH3(и), 4-NO2 (л,ф), 2-NO2 (м), 4-Cl (н), 3-CH3O-4-OH (о), 4-CH3O (с), 3-NO2 (т)
При введении в трехкомпонентную реакцию 4-аминопиридина только в одном случае был получен 3-гидрокси-3-пирролин-2-он (24), в реакции метилового эфира ацетилпировиноградной кислоты, 4-фторбензальдегида и 4-аминопиридина.
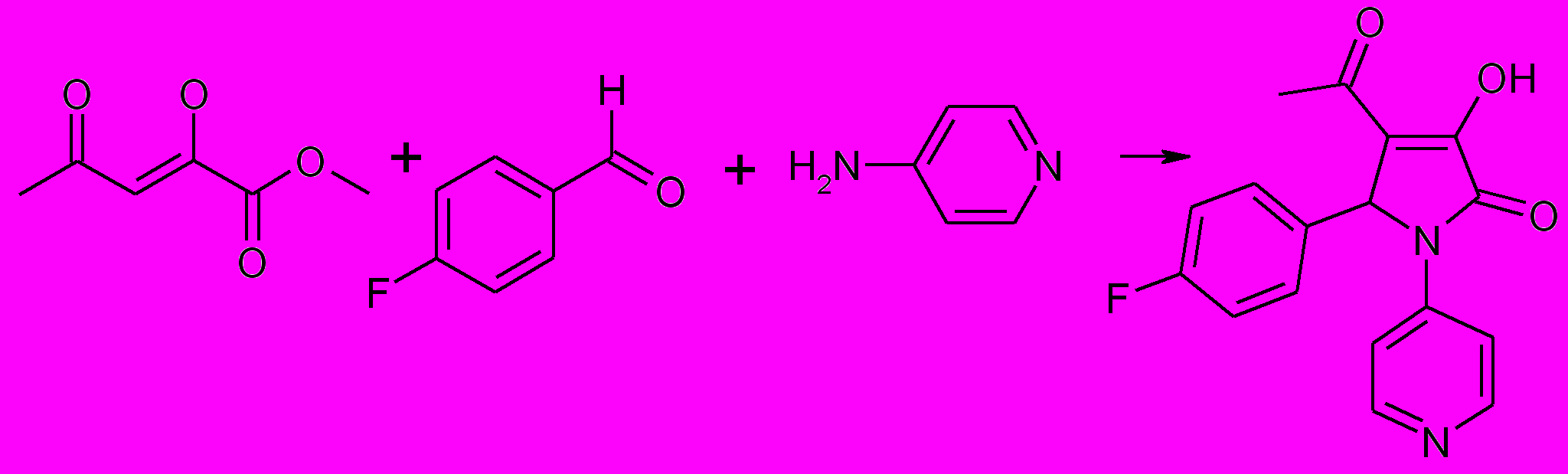
24
С метиловыми эфирами ароилпировиноградных кислот в аналогичной реакции образуются 5-арил-4-ацил-тетрагидрофуран-2-оны (25а-д). Такое нетипичное поведение 4-аминопиридина, по-видимому, обусловлено его более высокой основностью по сравнению с основностью 2- и 3- аминопиридинов, что обуславливает его участие в реакции лишь в качестве
катализатора.
25а-д
R1=С6Н5 (а-в), 4-ClС6Н4 (г,д); R 2=H (а,г), 4-F (б), 4-CH3O (в), 4-Br (д)
1.6. Взаимодействие эфиров ацилпировиноградных кислот со смесью
ароматического альдегида и 5-аминотетразола
Как показали исследования, сплавление смеси эфира ацилпировино-градных кислот, ароматического альдегида и 5-аминотетразола приводит к образованию 7-арил-6-ацил-5-метоксикарбонил-4,7-дигидротетразоло[1,5-a]пиримидинов (27а-д). Реакция протекает аналогично и при длительном нагревании реакционной смеси в уксусной кислоте.
27а-д
R1=CH3 (а,б), С6Н5 (в,г), 4-BrС6Н4 (д);
R 2= H (а), 4-(CH3)3С (б), 4-Br (в), 2-NO2 (г), 4-CH3O (д)
1.7. Синтез 1,5-диарил-4-(2-гетероил)-3-гидрокси-3-пирролин-2-онов
Для введения в положение 4 гетероцикла гетероильного заместителя по известной методике были получены эфиры тиеноил- и фураноилпировино-градной кислоты. Как показали исследования при взаимодействии реагентов с хорошим выходом образуются 1,5-диарил-4-(2-тиеноил)-3-гидрокси-3-пирролин-2-оны (28а-у) или 1,5-диарил-4-(2-фураноил)-3-гидрокси-3-пирролин-2-оны (29а-р).
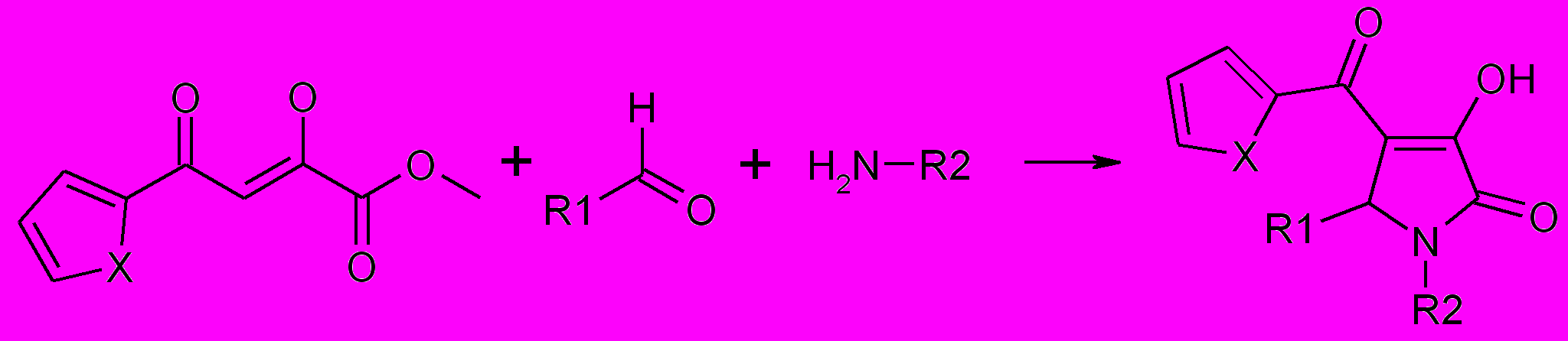
28а-у, 29а-р
R1=4-ClС6Н4 (28 а, 29б), С6Н5 (28 б,н-п, 29а,м-о), 4-CH3С6Н4 (28 в,29в), 4-CH3ОС6Н4 (28г, 29г), 4-NO2С6Н4 (28д,29д), 4-BrС6Н4 (28е, 29е),
4-(CH3 )2СНС6Н4 (28ж, 29ж), 4-(CH3)3СС6Н4 (28з, 29з), 4-FС6Н4 (28и, 29и),
3-NO2С6Н4 (28к,29к), 2-ClС6Н4 (28л, 29л), 2-CH3ОС6Н4 (28м), 2-тиенил (28р-т, 29п), 3-пиридил (28у, 29р); R2=С6Н5 (28 а-м, р,у, 29 а-л,п,р), 4-CH3 (28н, 29м), 3-CH3 (28о, 29н), 2-тиазолил (28п,т, 29о), 2-пиридил (28с)
1.8. Синтез 1-замещенных 5-диарил-3-гидрокси-4- метилсульфонил- -3-пирролин-2-онов
Продолжая синтез 4-замещенных пирролидин-2,3-дионов представляло интерес ввести в положение 4 гетероцикла метилсульфонильную группу и оценить ее влияние на химические свойства и биологическую активность продуктов. С этой целью были использованы этиловый эфир метилсульфонилпировиноградной кислоты или его натриевая соль.
Установлено, что реакция натриевой соли этилового эфира метилсульфонилпировиноградной кислоты (метод А) или этилового эфира метилсульфонилпировиноградной кислоты (метод В) со смесью ароматического альдегида и ариламина приводит к солям пирролинов (30 ж-м) и (31а-е, н-т) соответственно, при гидролизе которых были выделены 1,5-диарил-3-гидрокси-4-метилсульфонил-3-пирролин-2-оны (32а-т).
Ранее было установлено, что пирролин-2-оны, содержащие в положении 1 гетероцикла гидроксиалкильный или карбоксиалкильный заместитель, проявляют ноотропную активность. С целью синтеза потенциально биологически активных соединений в реакции с эфирами метилсульфонилпировиноградной кислоты были использованы различным образом функционализированные алифатические амины, такие как этаноламин, γ-аминомасляная кислота, ε-аминокапроновая кислота, а также метиламин, бензиламин, при этом были получены 1-алкил-5-арил-3-гидрокси-4-метилсульфонил-3-пирролин-2-оны (32у-я).
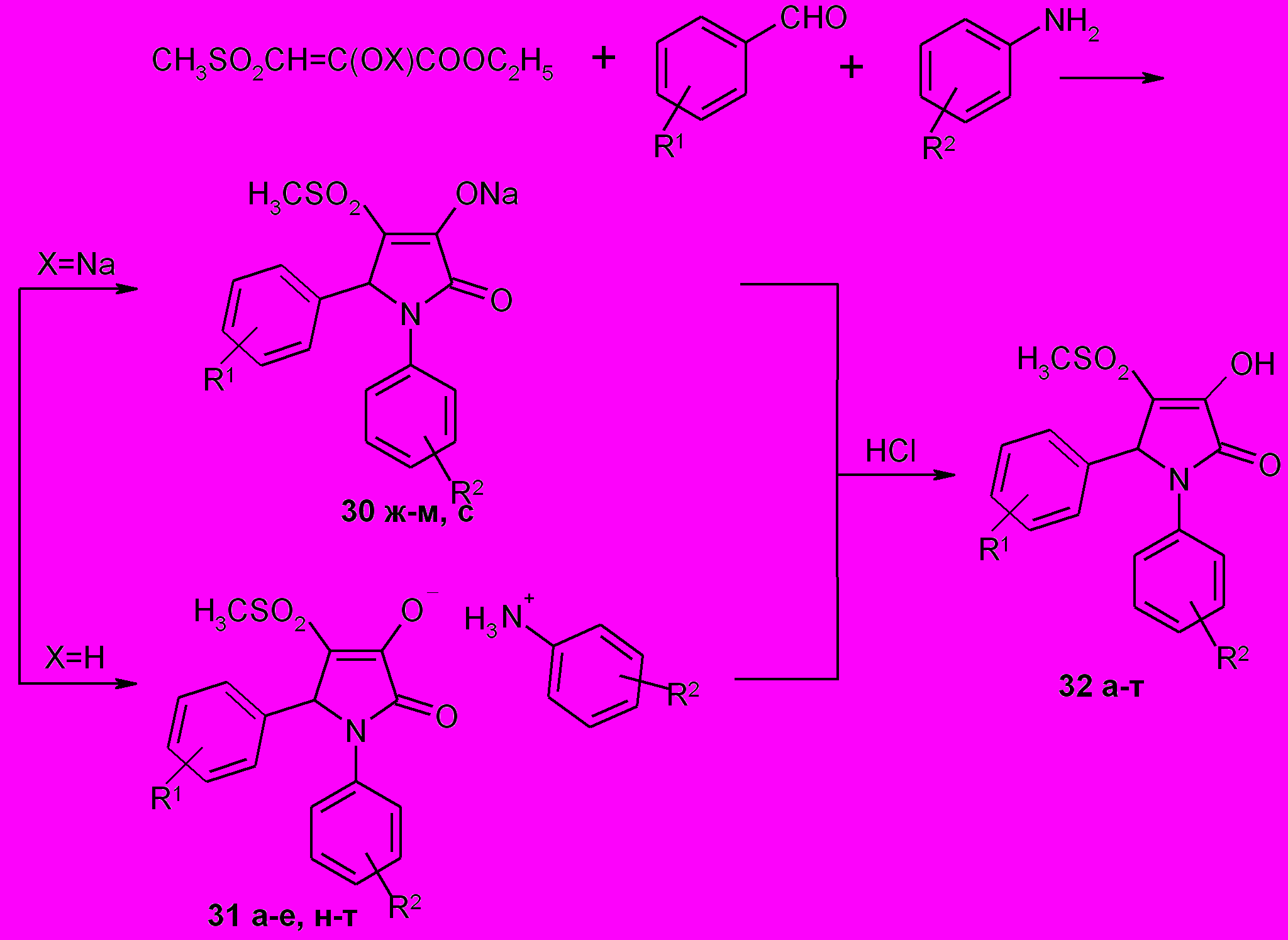 R1= 4-F (31,32а), 4-CH3(31,32б), 3,4-(CH3O)2 (31,32в), 4-Cl (31,32г), 4-NO2 (31,32д), 4-CH3O (31,32е), H (30,31,32ж, 30,31,32з,30,32и,к,л,м,31,32н,о,п,р, 31,32т), 4-Br (30,32с); R2=H (31,32а,б,в,г,д,е,30,31,32ж,30,32с), 4-CH3O (30,31,32з), 4-CH3(30,32и), 4-CH3NHCO(30,32к), 4-C2H5OOC(30,32л), 3-CF3(30,32м), 4-Br(31,32н), 4-I(31,32о), 4-NO2(31,32п), 4-NH2SO2(31,32р), 4-ОН (31,32т)
R1= 4-F (31,32а), 4-CH3(31,32б), 3,4-(CH3O)2 (31,32в), 4-Cl (31,32г), 4-NO2 (31,32д), 4-CH3O (31,32е), H (30,31,32ж, 30,31,32з,30,32и,к,л,м,31,32н,о,п,р, 31,32т), 4-Br (30,32с); R2=H (31,32а,б,в,г,д,е,30,31,32ж,30,32с), 4-CH3O (30,31,32з), 4-CH3(30,32и), 4-CH3NHCO(30,32к), 4-C2H5OOC(30,32л), 3-CF3(30,32м), 4-Br(31,32н), 4-I(31,32о), 4-NO2(31,32п), 4-NH2SO2(31,32р), 4-ОН (31,32т) Для решения вопроса о пространственном строении полученных соединений было проведено рентгеноструктурное исследование кристаллов соединения 32ж, полученных медленной кристаллизацией из спиртового раствора. Элементарная ячейка содержит две кристаллографически независимые, в общих чертах близкие по строению, молекулы А и В.
Строение молекул в проекции на плоскость гетероцикла показано на рисунке 1. Наблюдается некоторое различие в ориентации заместителей: молекуле В фенильный заместитель при атоме С(11) расположен в плоскости, перпендикулярной плоскости пирролидинового цикла, а плоскость фенильного заместителя при N(6) образует с последней угол 36°. В молекуле А аналогичные углы между плоскостями составляют 99.4 и 48°. Наиболее существенно отличие в ориентации гидроксильных групп в двух независимых молекулах. В молекуле А атом водорода енольного гидроксила ориентирован в сторону сульфонильной группы, в то время как в молекуле В – в сторону карбонильного фрагмента. Обе молекулы в кристалле существуют в виде димерных центросимметричных ассоциатов, связанных достаточно прочными водородными связями. В димерном ассоциате из молекул А водородная связь образована между гидроксильной группой и атомом кислорода О(5) сульфонильной группы. Димерные ассоциаты из молекул В образуются межмолекулярными водородными связями О(3’) – Н(3’)…О(2’) с участием карбонильной группы. Молекулы В связаны в димерные ассоциаты более прочными водородными связями.
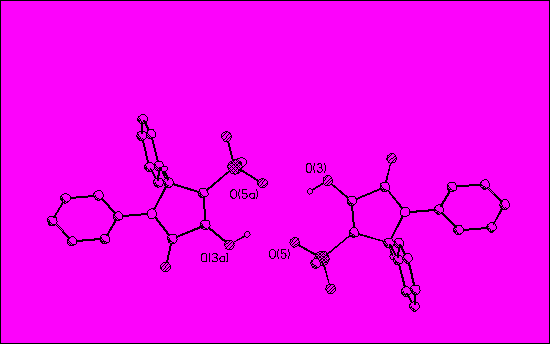
Молекула А
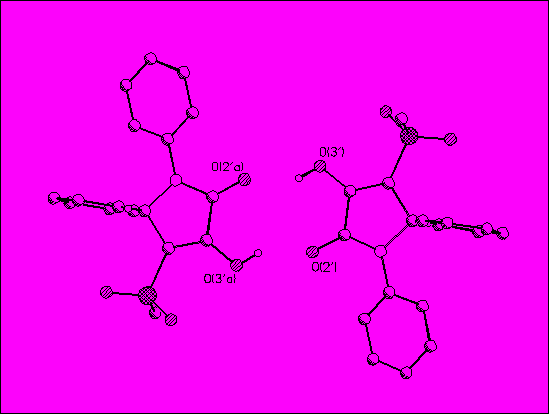
Молекула В Рис.1. Кристаллическая структура соединения 32ж
1.9. Синтез 5-замещенных 1-арилпирролидин-2,3-дионов
Продолжая поиск биологически активных соединений среди 3-пирролин-2-онов, представляло интерес получить соединения, не имеющие заместителей в положении 4 гетероцикла. 4-Незамещенные пирролидин-2,3-дионы могут быть использованы для введения в положение 4 гетероциклической системы различных заместителей, содержащих фармакофорные фрагменты.
Взаимодействие этилпирувата со смесью ароматического альдегида и ариламина в соотношении 1:1:2 в диоксане при комнатной температуре протекает с образованием 3-ариламино-1,5-диарил-3-пирролидин-2-онов (33а-э), гидролизом которых в кислой среде получены 1,5-диарилпирролидин-2,3-дионы (35 а-д).
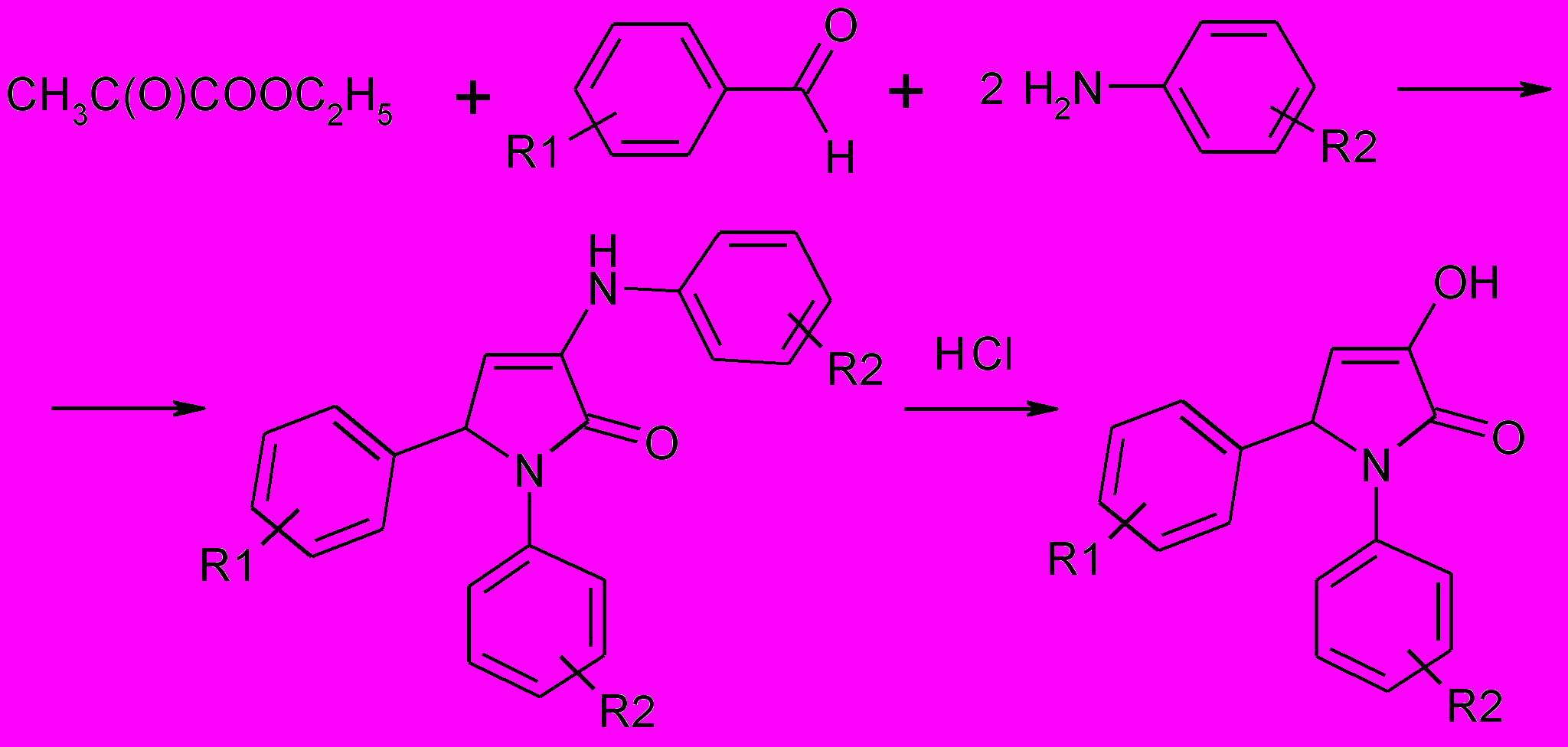
33а-э 35а-д
33а-э: R1=2-CH3O (а,е), 3-CH3O (б), 3,4-(CH3O)2 (в,ж,к,н), 3-CH3O,4-OH (г,з,л,х), 4-Cl (д,т,ч); 3-NO2 (и), 4-NO2 (м,о,ф), H (п,с), 2,4-(CH3O)2 (р), 2-Cl (у,ц ); 4-C2H5O (щ), 2,4-Cl2 (ш); ), 3-F (э)
R2=H (а-д), 4-CH3 (е-и), 3-CH3 (к-м), 4-Cl (н); 3-CF3 (о), 4-C4H9 (п,р), 4-COOH (с-ф), 4-COOC2H5 (х-э)
35а-в: R1= H (а,в), 4-CH3O (б), R2= H (а,б), 4-CH3O (в)
Взаимодействием этилового эфира пировиноградной кислоты с различными ариламинами были получены 1-арил-3-ариламино-5-метил-5-этоксикарбонил-3-пирролин-2-оны (34а-к), при гидролизе последних образуются 1-арил-5-метил-5-этоксикарбонилпирролидин-2,3-дионы (36 а-д).
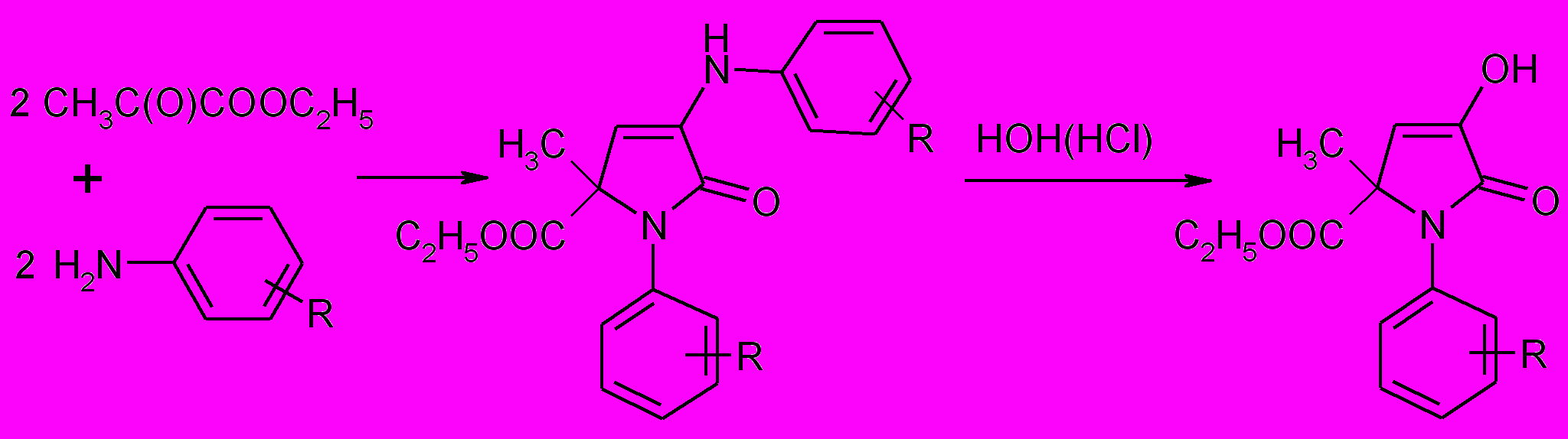
34а-к 36а-д
34а-к: R= 4-CH3 (а), H (б), 3-Cl (в); 4-Br (г), 4-Cl (д); 3-Br (е), 4-C4H9 (ж), 4-COOC2H5 (з), 4-COOCH3 (и), 4-COOH (к) 36а-д: R=4-CH3 (а), H (б), 4-Br (в), 4-Сl (г), 4-F (д)
Соединения (35) и (36) могут существовать в двух таутомерных формах (кетонной – А и енольной – В), при этом равновесие сдвинуто в сторону кетонной формы. Электронодонорные заместители в пара-положении бензольного кольца соединений (36) способствуют образованию енольной формы.
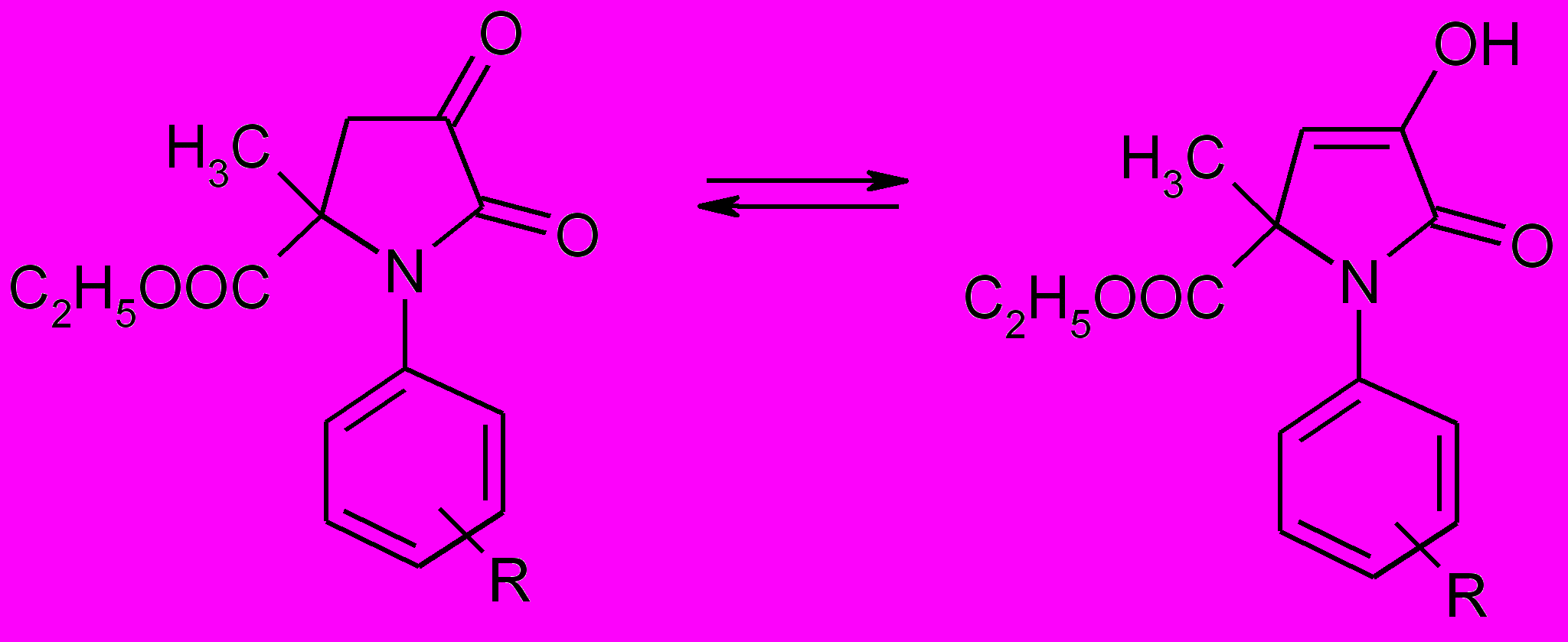
А В
1.10. Синтез спиросоединений, производных фурана и пиррола
При дальнейшем изучении трех компонентной реакции эфиров ацилпировиноградных кислот со смесью ароматического альдегида и амина представляло интерес заменить ароматический альдегид кетоном, содержащим карбонильную группу с высокой реакционной способностью, таким как нингидрин, изатин. При взаимодействии эквивалентных количеств метилового эфира ацетилпировиноградной кислоты, нингидрина и метиламина образуется 4-ацетил-2,1’,3’-триоксоспиро[2,5-дигидрофуран-5,2’-индан]-3-олат метиламмония (37).

37
Для подтверждения структуры спиросоединения 37 было проведено рентгеноструктурное исследование его кристаллов (рис. 2). Кристаллы соли C14H8NO6 . CH3NH2 принадлежат к моноклинной сингонии. Установлено, что кристаллы соединения 37 построены из анионов 4-ацетил-2,1’,3’-триоксо-спиро[2.5-дигидрофуран-5,2’-индан]-3-олата и катионов метиламмония.
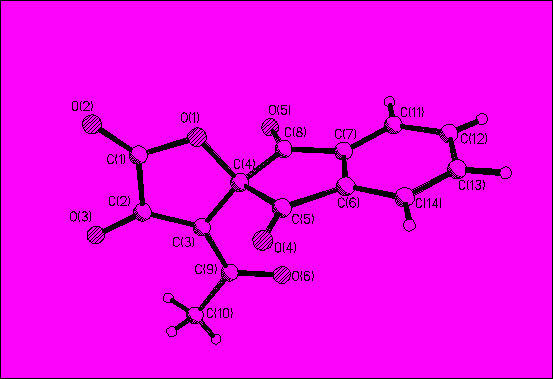
Рис. 2. Структура аниона соединения 37.
При обработке соли метиламмония 37 хлороводородной кислотой был выделен 4-ацетил-2,1’,3’-триоксоспиро[2.5-дигидрофуран-5,2’-индан] (38а).
Спиросоединения, производные фурана, содержащие в положении 5 остаток нингидрина образуются по известной методике. Однако, в данной публикации описан синтез только на основе метилового эфира ацетил- и бензоилпировиноградной кислот. Для выяснения влияния характера заместителя в эфире ацилпировиноградной кислоты на протекание данной реакции нами была изучена реакция серии эфиров ароилпировиноградной кислот. Взаимодействие метиловых эфиров ацилпировиноградных кислот с нингидрином приводит к 4-ацил-3-гидроксиспиро-[2.5-дигидрофуран-5,2’-индан]- 2,1’,3’-трионам (38а-п).
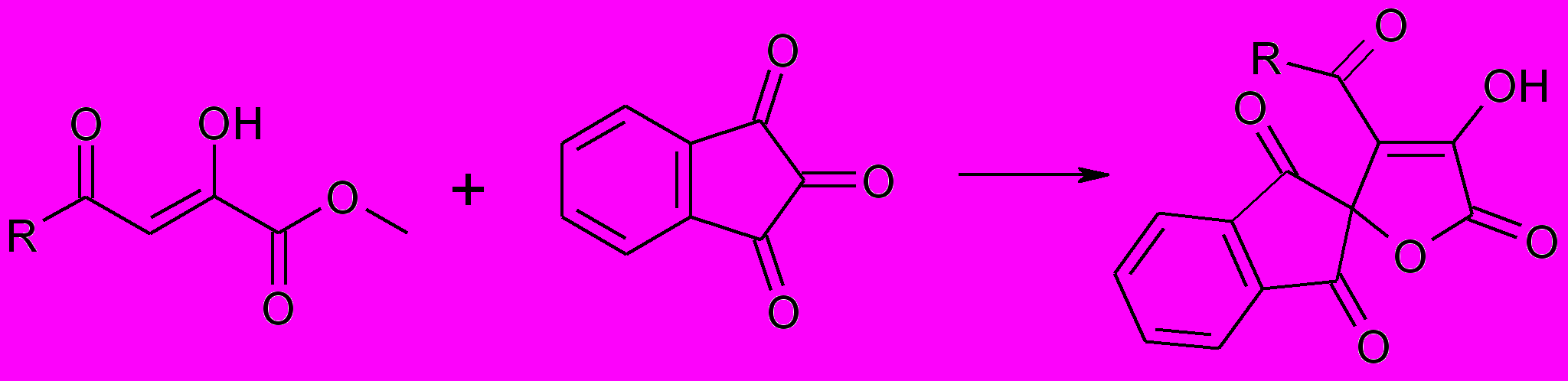
38а-п
R=CH3 (а), С6H5 (б), 4-FС6H4 (в), 4-ClС6H4 (г), 4-CH3С6H4 (д), 3-NO2С6H4 (е), 4-CH3OС6H4 (ж), С6H5CH=CH (з), 4-NO2С6H4 (и), 3-CH3OС6H4 (к), 2-фурил (л), 4-BrС6H4 (м), 3-BrС6H4 (н), 2-тиенил (о), 2,4,6,-(CH3)3С6H2 (п)
При нагревании метилового эфира ацетилпировиноградной кислоты, алифатического амина (метиламина, триптамина) и изатина образуются
1-замещенные 4-ацетил-3-гидроксиспиро-[2,5-дигидропиррол-5,3’-индол]-2,2’-дионы (39 а,б).
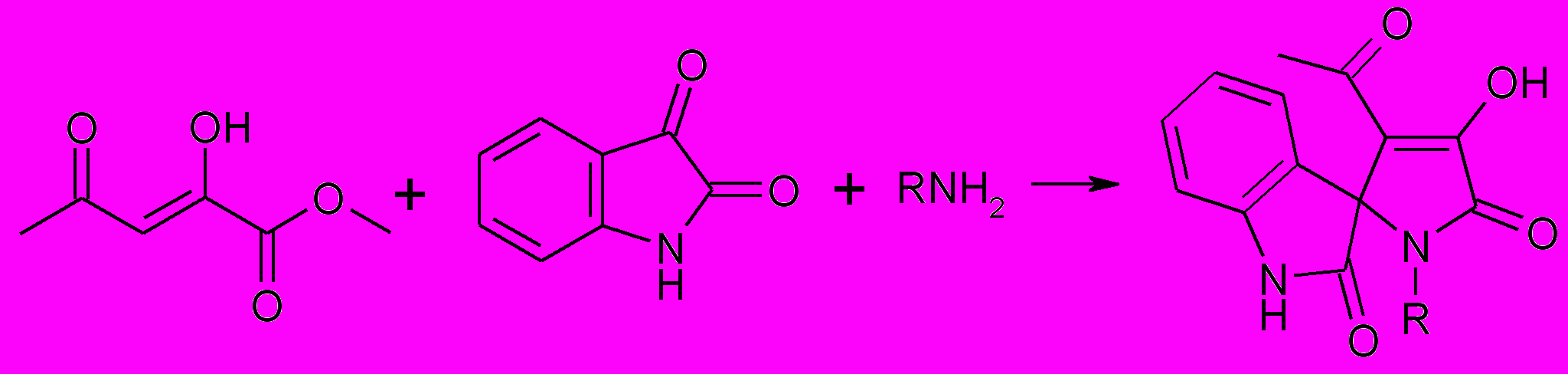
39 а,б
R=CH3 (a), CH2CH2индол-3-ил (б)
При взаимодействии метилового эфира 3-метоксибензоилпировино-градной кислоты и изатина в присутствии тетраметилгуанидина образуется спиросоединение – аддукт 3-гидрокси-4-(3-метоксибензоил)- спиро[2.5-дигидрофуран-5,3’-индол]- 2,2’-диона с тетраметилгуанидином (ТМG) (40).
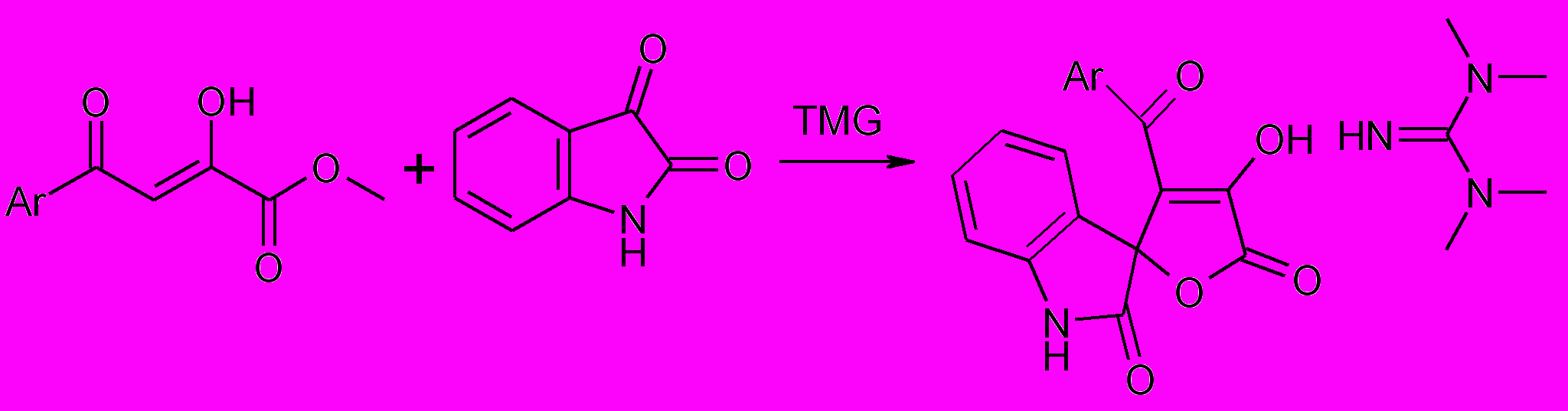
40
Ar=3-CH3OC6H4
Все 3-гидрокси-3-пирролин-2-оны дают положительную реакцию с хлоридом железа (III) на енольный гидроксил, что наряду с данными спектров свидетельствует о существовании их в енольной форме.
2. Свойства замещенных 3-гидрокси-3-пирролин-2-онов
