Синтез соединений на основе химических превращений производных α- оксокарбоновых кислот и их биологическая активность 15. 00. 02 фармацевтическая химия, фармакогнозия
| Вид материала | Автореферат диссертации |
- Синтез, свойства, биологическая активность n-гетериламидов α-оксокислот и продуктов, 367.21kb.
- Синтез, свойства и биологическая активность енаминоамидов ацилпировиноградных кислот, 439.81kb.
- Синтез и свойства новых производных 2 (1,2,4 триазолил 5 тио)уксусных кислот 15. 00., 240.9kb.
- Синтез, химические свойства и биологическая активность 1,4-дизамещенных 5-арил-3-гидрокси-3-пирролин-2-онов, 667.95kb.
- Синтез и биологическая активность карбо- и гетероциклов на основе тетрацианоэтилена, 673.64kb.
- Синтез, свойства и биологическая активность продуктов взаимодействия 1,2,4-триазолов, 669.98kb.
- Синтез, свойства и биологическая активность производных 2-хлорникотинонитрилов, 264.36kb.
- Реферат Синтез и превращения азотпроизводных карбоновых кислот, 346.86kb.
- Синтез и строение N,o- содержащих гетероциклических соединений на основе несимметричных, 201.05kb.
- Синтез, строение и реакции тиенилсодержащих кросс-сопряженных диеноновых производных, 287.71kb.
4.4. Антигипоксическая активность
Антигипоксическую активность бутеноатов 20 и гидразона 13г изучали на белых беспородных мышах на модели гипоксии с гиперкапнией. Животных поодиночке помещали в герметически закрытый сосуд (емкостью 350 мл, без поглощения СО2). Об устойчивости животных к гипоксии судили по увеличению продолжительности жизни животных, по сравнению с контролем. Исследуемые соединения вводили в дозе 50 мг/кг в/б в виде суспензии в 2% крахмальном растворе.
Установлено, что в ряду солей 20 выраженную активность проявляют вещества, содержащие атом галогена в ароилпирувоильном фрагменте, за исключением соединения 20л. Введение электронодонорных заместителей резко снижает антигипоксический эффект. Выявлено, что гидразон 13г не активен. Наибольшей активностью обладает соединение 20к, увеличившее время жизни животных на 77%.
4.5. Гипогликемическая активность
Гипогликемическую активность изучали на модели аллоксанового диабета в опытах на белых беспородных крысах. Экспериментальную гипергликемию моделировали подкожным введением аллоксана в дозе 170 мг/кг. Соединения вводили п/о в дозе 50 мг/ кг в виде взвеси в 2% крахмальном растворе. Концентрацию глюкозы в крови животных определяли глюкозооксидазным методом до введения соединений, а также через 30 и 120 мин. после него. Препарат сравнения – метформин (50 мг/кг). Из 40 изученных соединений 32 проявили активность в различной степени.
В ряду N-гетериламидов АрПК 2 установлено, что при увеличении алкильной цепи в 5 положении 1,3,4-тиадиазола их активность снижается. Введение заместителя в арильный радикал приводит также к уменьшению действия. Наибольшей активностью обладает гетериламид 2э, не уступающий метформину через 30 мин. после введения.
Выявлено, что перспективной группой соединений являются бутеноаты 20, сочетающие два фармакофорных фрагмента. Все изученные вещества обладают выраженным действием, а соединение 20ч показало наибольшие результаты во все сроки наблюдения. В ряду гидразонопроизводных 36, 37 прослеживается зависимость наибольшего влияния на активность флуоренилиденгидразонового фрагмента. Гипогликемическое действие комплексных соединений 39-41 зависит, в первую очередь, от характера металла и строения гетероциклического фрагмента. Как показали исследования, лидируют по изучаемой активности цинковые комплексы, среди них наиболее активен хелат 40в, имеющий в молекуле 2-(5-бромпиридил).
В таблице 2 приведены сводные данные по наиболее активным изученным соединениям. Для дальнейших углубленных исследований в качестве потенциальных гипогликемических веществ предлагаются бутеноат 20ч и цинковый хелат 40в. Помимо высокой активности и низкой токсичности, достоинством соединения 20ч является его водорастворимость, а соединение 40в обладает также высокой АА и имеет в структуре микроэлемент цинк, как известно, участвующий в функционировании различных ферментов и гормонов, в том числе инсулина поджелудочной железы.
Таблица 2
Потенциальные гипогликемические вещества
| Соединение | Острая токсичность (ЛД50 , мг/кг) | Доза от ЛД50 | | |
| % торможения гипергликемии | ||||
| 30 мин | 120 мин | |||
| 20ч | >1500 | 0,03 | 54,3***1 | 63,8***1 |
| 20аб | >1500 | 0,03 | 39,8***1 | 63,9***1 |
| 40в | >1500 | 0,03 | 67,6***1 ***2 | 70,6***1 ***2 |
| 40г | >1500 | 0,03 | 55,4***1 | 63,5***1 |
| 41а | 2000 | 0,025 | 67,0***1 ***2 | 71,4***1 ***2 |
| 41з | 3100 | 0,016 | 49,4***1 | 54,4***1 |
| метформин | 1266 | 0,04 | 43,7***1 | 54,5***1 |
Примечание: *** = p < 0,001; 1− по сравнению с контролем; 2 – по сравнению с метформином.
4.6. Антикоагулянтная и гемостатическая активность
Исследования проводили с помощью коагулометра «Минилаб 701» с использованием цитратной (3.8 %) крови собаки (9:1). Соединения вводили в концентрации 1 мг/мл. Препараты сравнения – этамзилат (1мг/мл) и раствор гепарина в концентрации 1 ЕД/мл крови. Испытания показали, что изученные водорастворимые соли 20, 43 и натриевые феноляты 50 не оказывают существенного влияния на свертывание крови.
4.7. Противомикробная активность
Противомикробную активность (ПМА) более 250 соединений по отношению к тест-культурам микроорганизмов (м/о) St. aureus АТСС 6538-Р и E. coli АТСС 25922 определяли методом двукратных серийных разведений в жидкой питательной среде.
Таблица 3
Противомикробная активность некоторых комплексных соединений по отношению к фармакопейным штаммам микроорганизмов
| Соединение | МИК, мкг/мл | Соединение | МИК, мкг/мл |
| St. aureus / Е.coli | St. aureus / Е.coli | ||
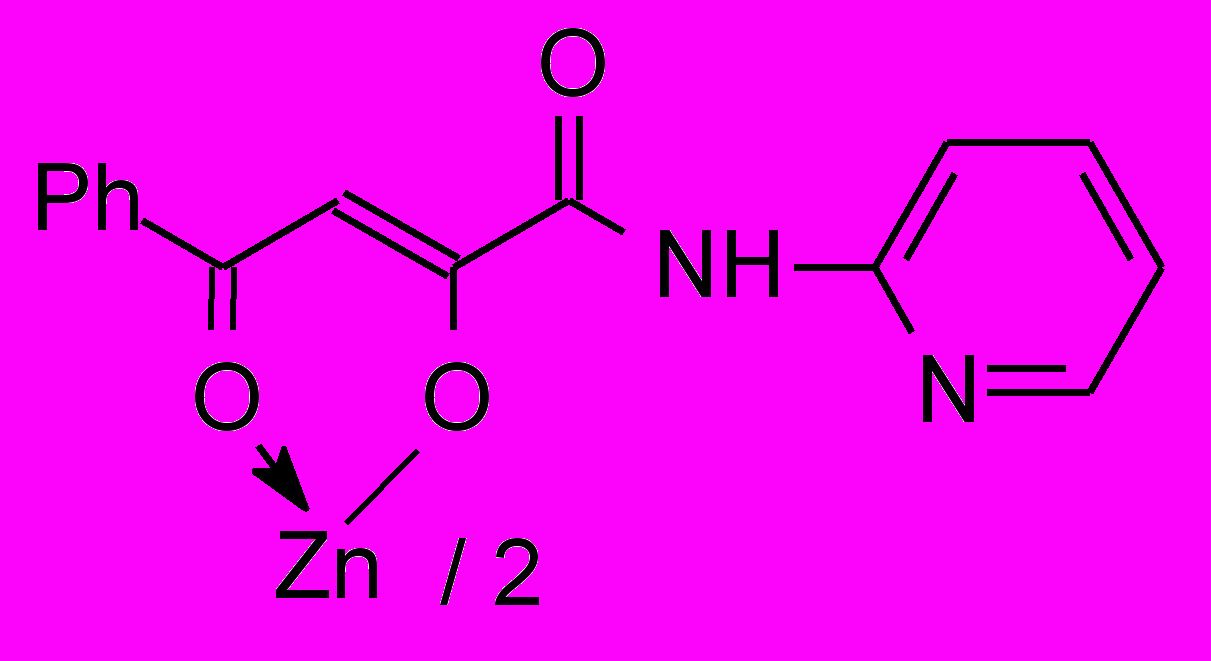 40а 40а | 31,0/3,9 | 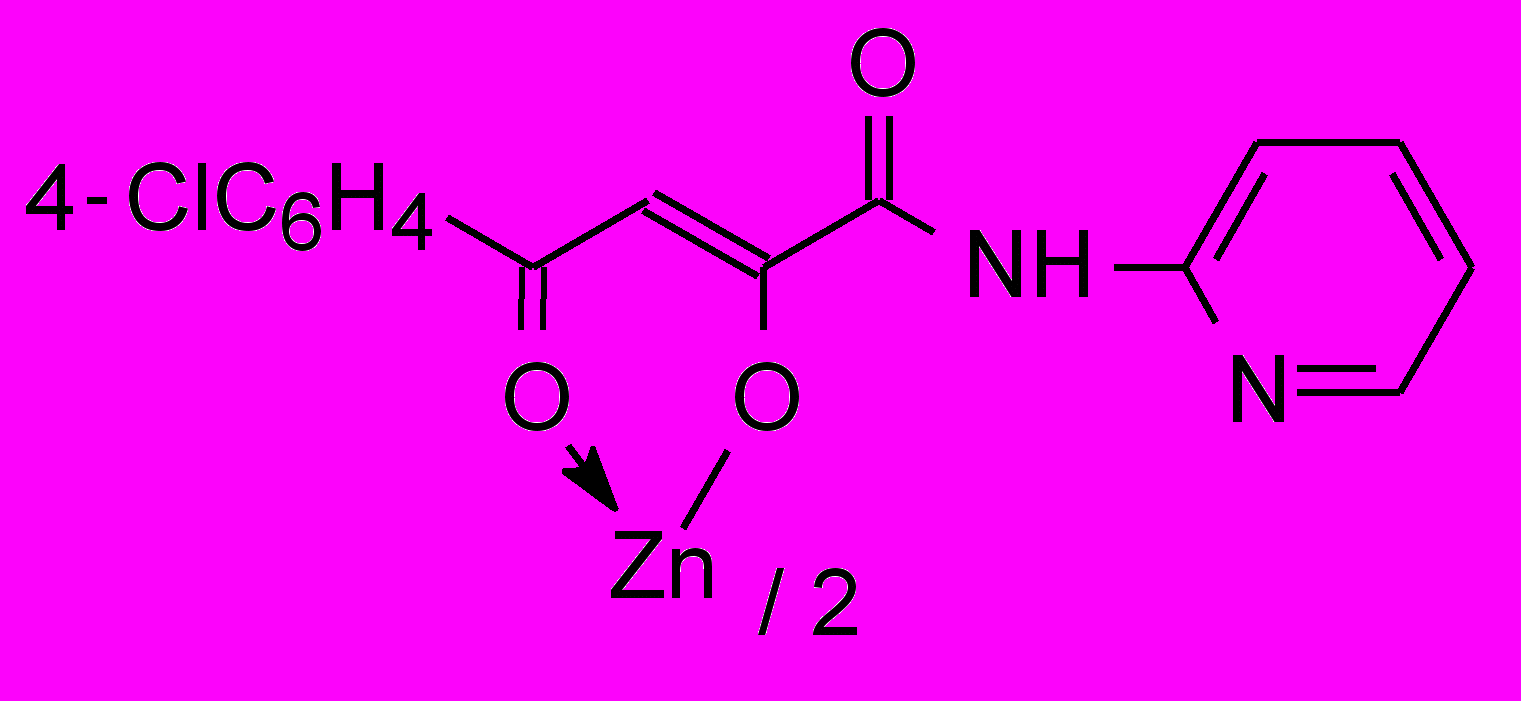 40б 40б | 31,0/62,0 |
 41а 41а | 2,0/2,0 | 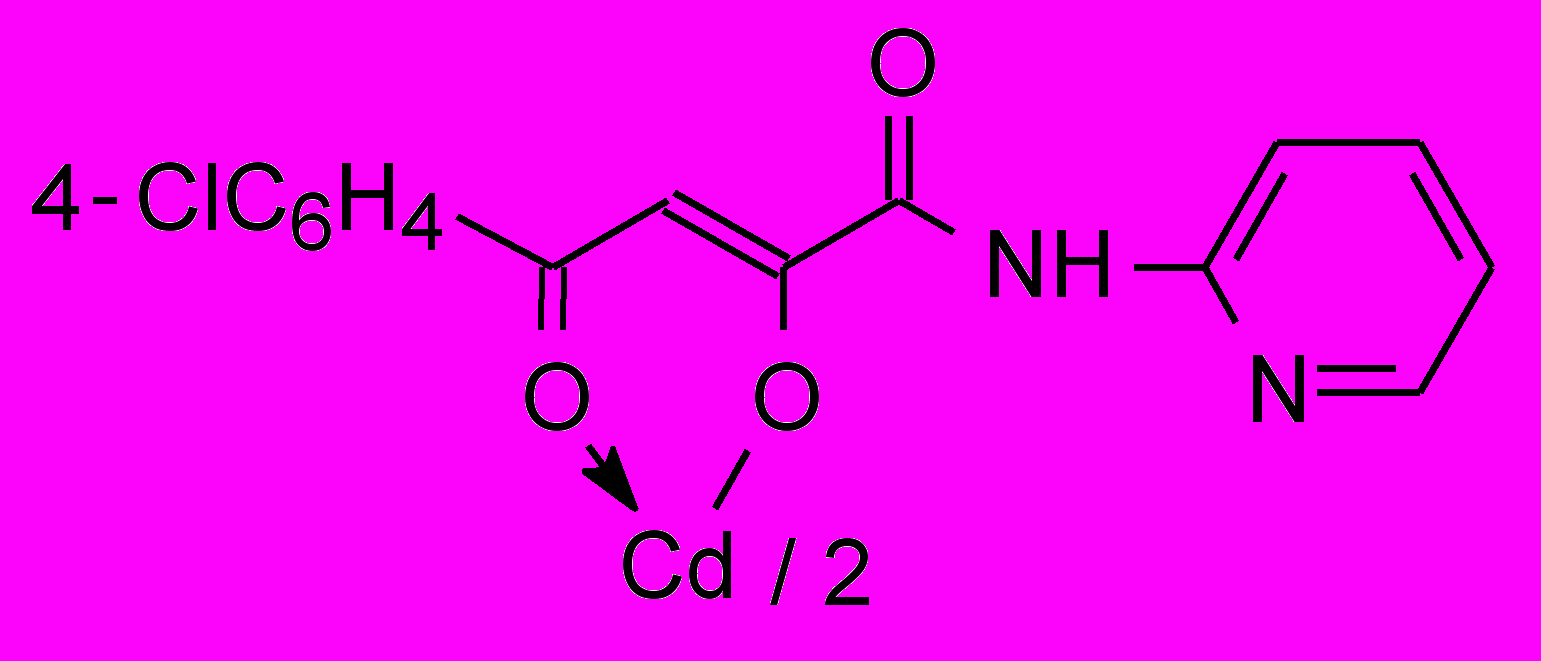 41б 41б | 250/31,0 |
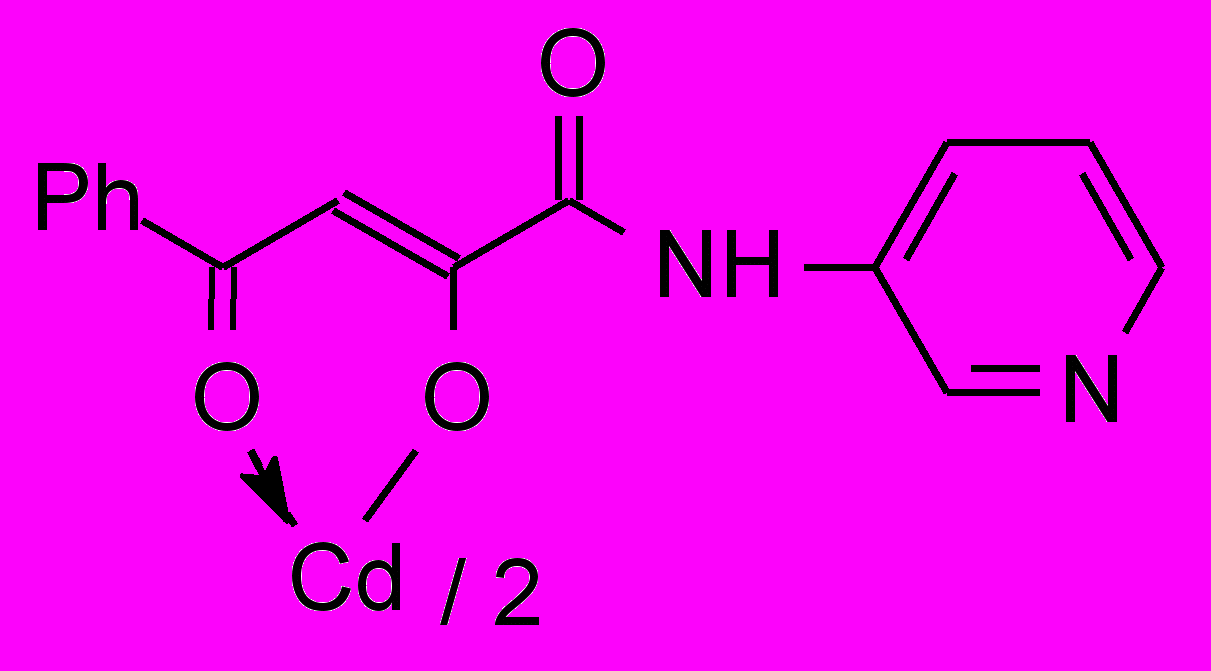 41в 41в | 15,6/62,0 | 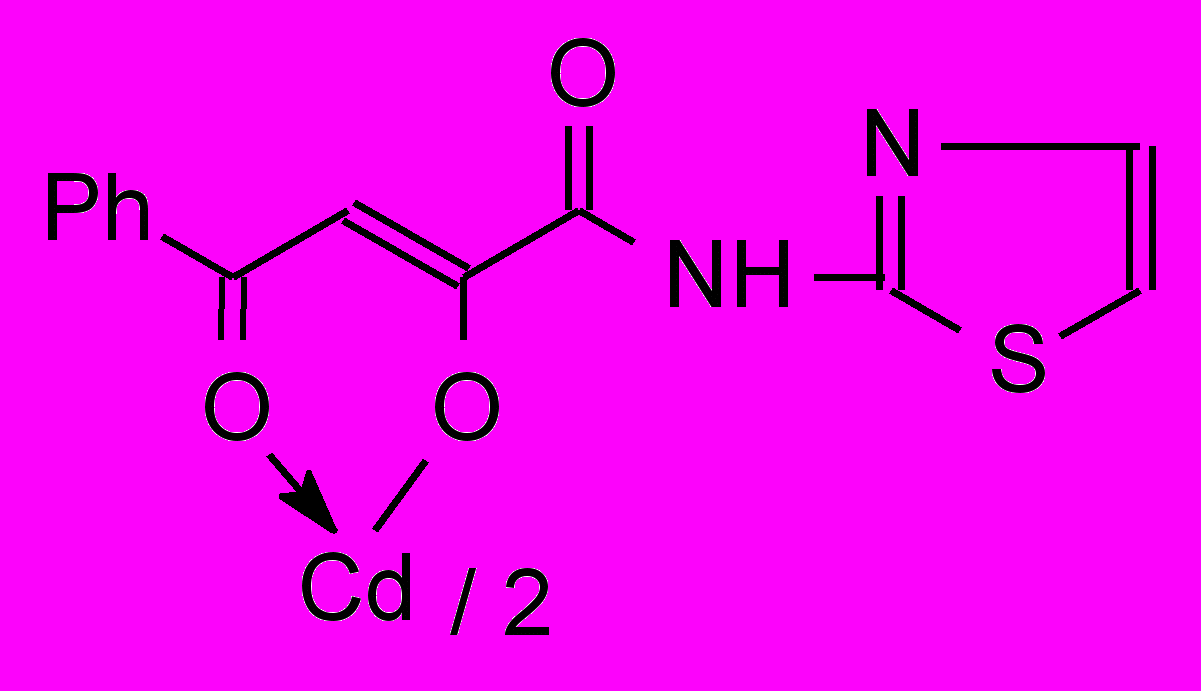 41д 41д | 2,0/3,9 |
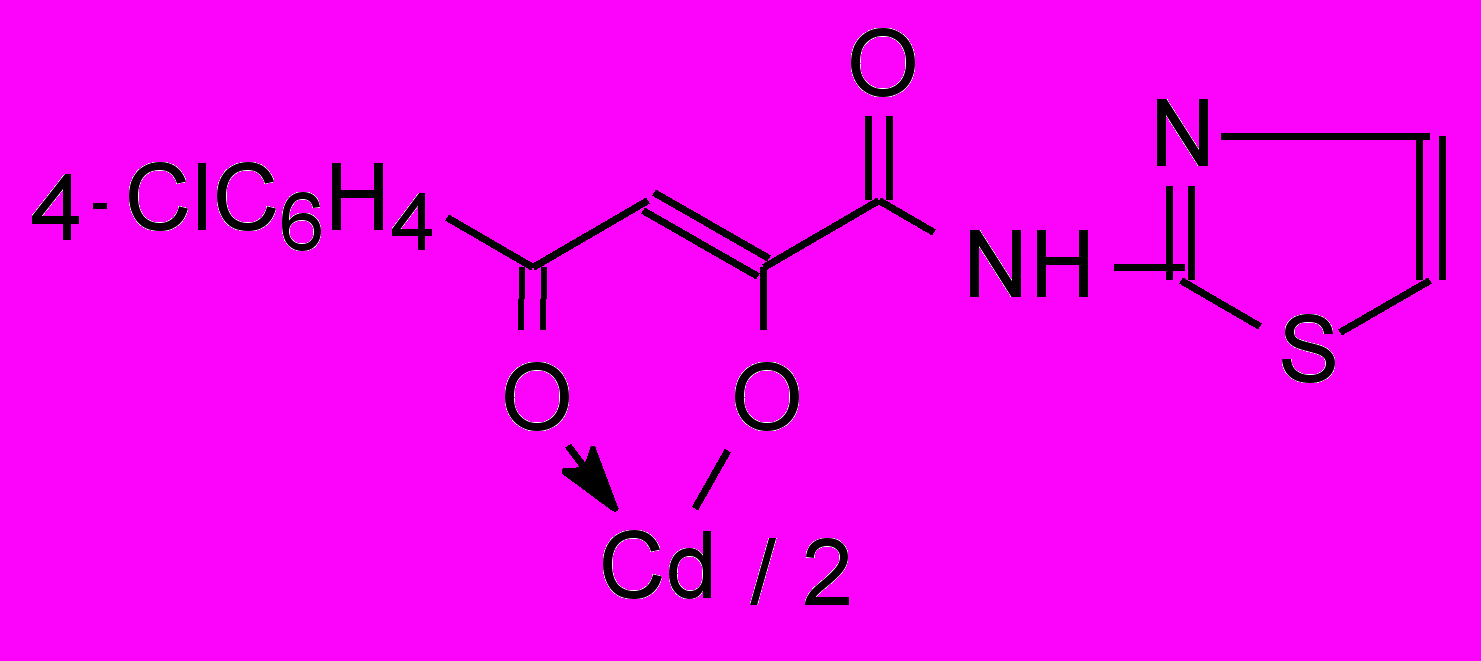 41е 41е | 1,0/1,0 | 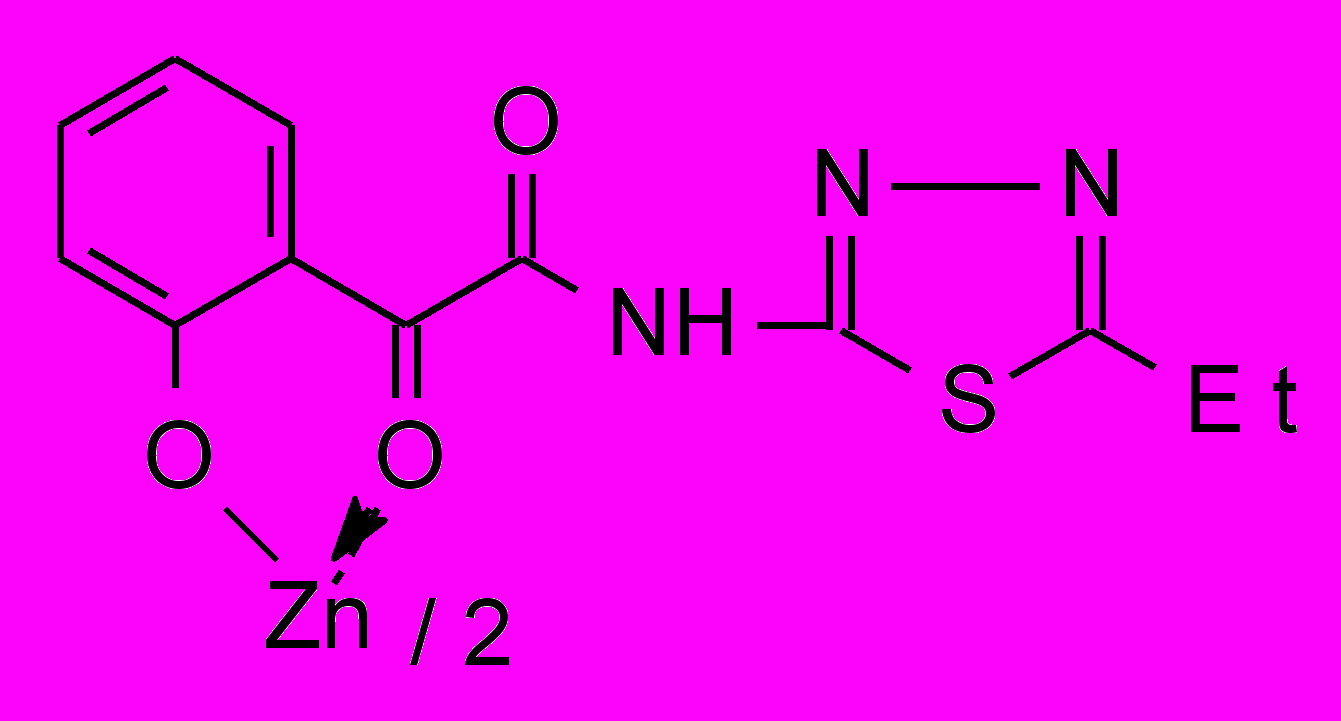 51а 51а | 125/62,0 |
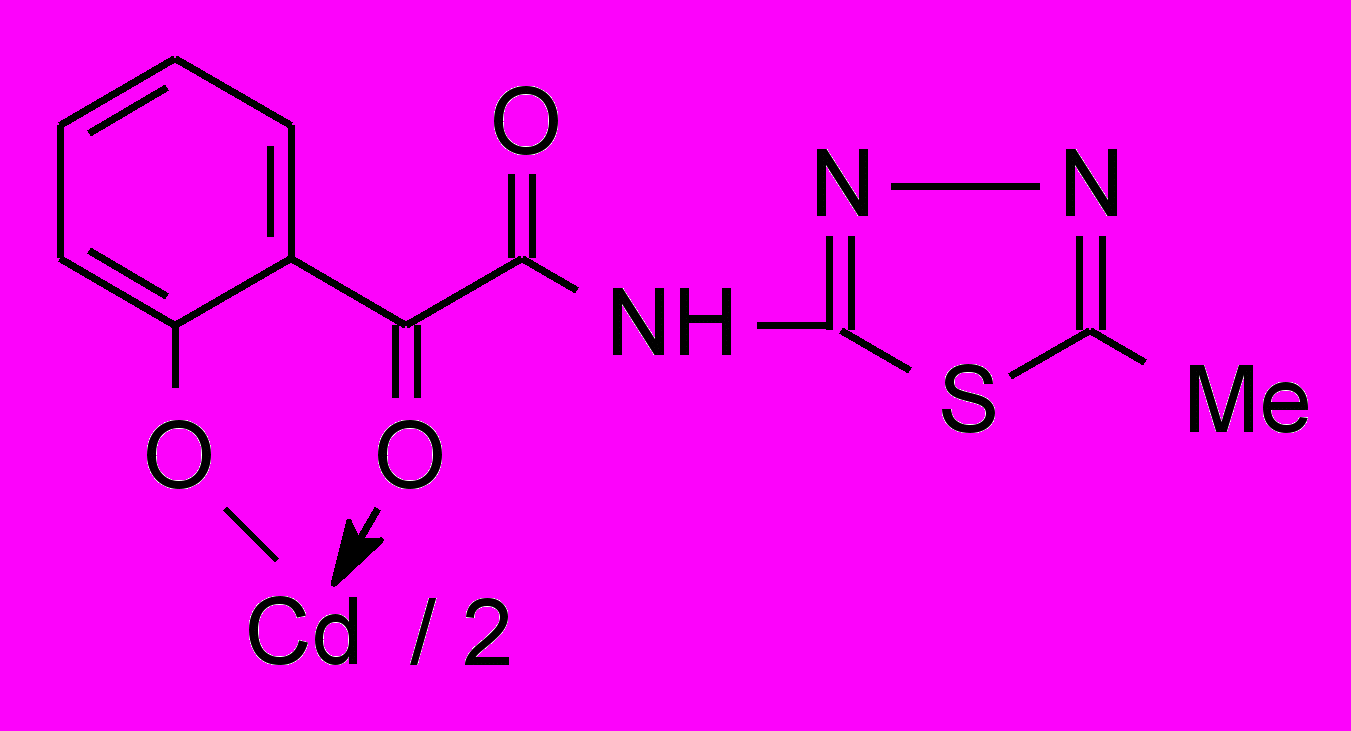 51в 51в | 2,0/3,9 | 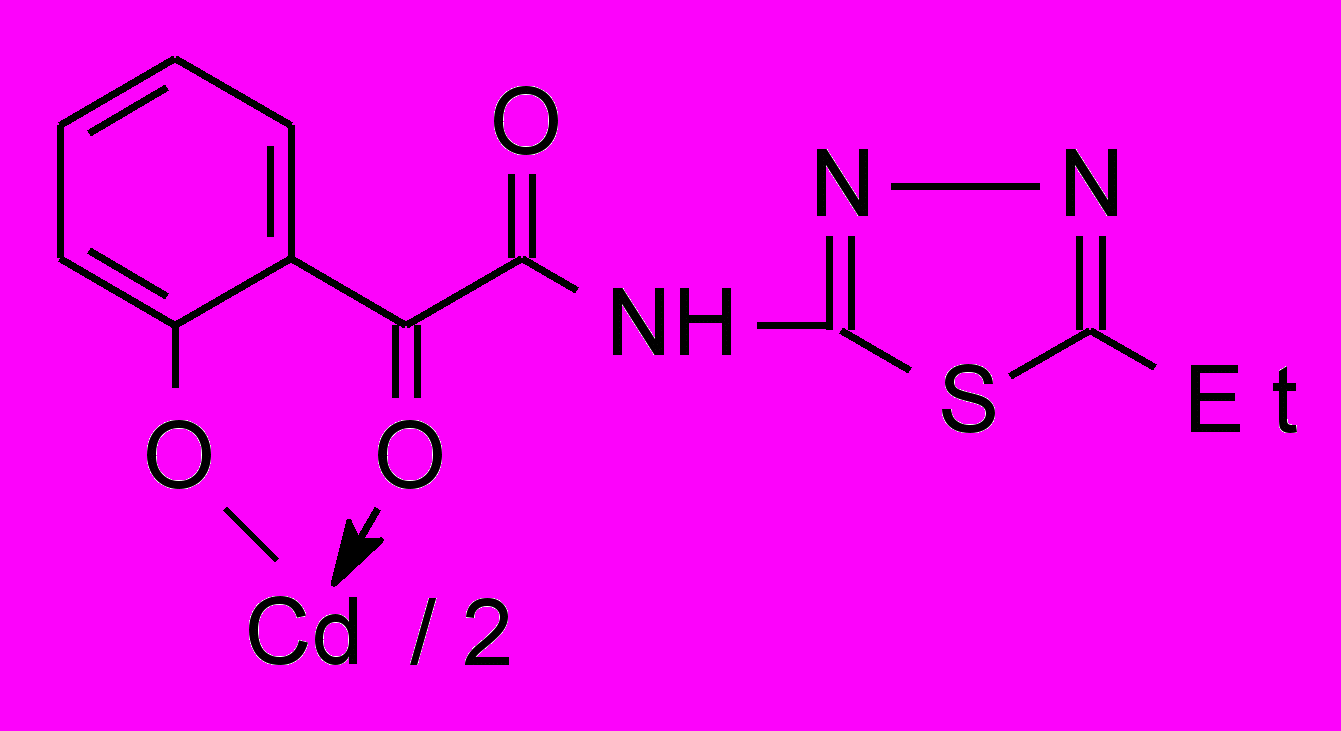 51г 51г | 2,0/3,9 |
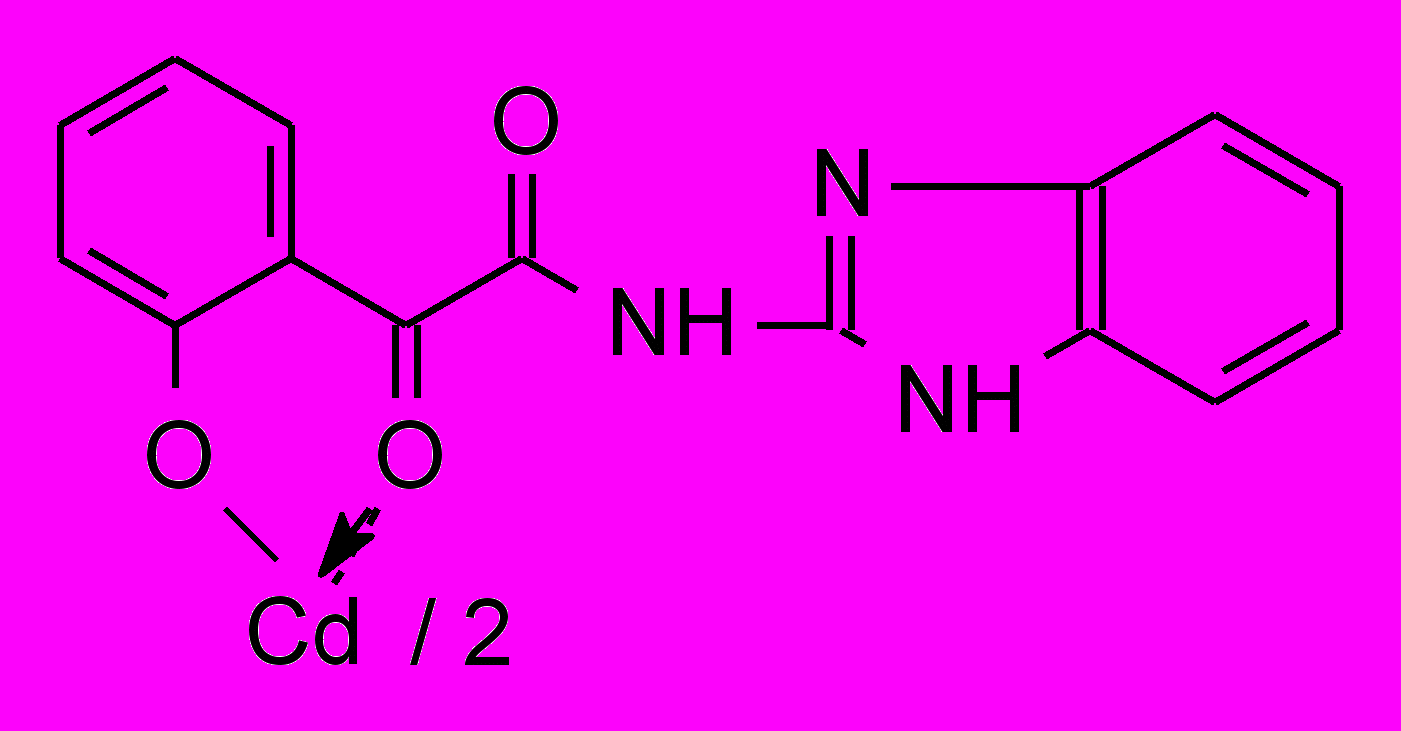 51д 51д | 2,0/3,9 | ZnCl2 CdCl2 | 250/250 125/125 |
| Хлоргексидин | 125/125 | Диоксидин | 62,0/62,0 |
Для всех исследуемых соединений определяли минимальные ингибирующие концентрации (МИК) в мкг/мл. Препаратами сравнения служили хлоргексидин и диоксидин. Результаты наиболее активных веществ представлены в таблице 3.
Кроме того, у 7 высокоактивных хелатов определено их действие по отношению к 6 тест-культурам Всероссийского музея патогенных м/о (табл. 4). Эти соединения были также испытаны на клинических штаммах м/о (табл. 5).
Противотрепонемная активность некоторых N-гетериламидов 2, пиридазинов 16, бутеноатов 20 изучена на взвеси трепонем (патогенном штамме Никольс) по стандартной методике. Выявлено, что выраженной активностью здесь обладают гетериламид 2л и бутеноаты 20 з,л, содержащие в своей структуре атом брома.
Установлено, что большинство изученных соединений показали активность на уровне хлоргексидина или ему уступали по отношению к стандартным тест-культурам м/о. Высокоактивных производных α-оксокарбоновых кислот, за исключением хелатов 40, 41, 51, нами не обнаружено. Химическая модификация N-гетериламидов АрПК 2 и о-ГФГК 6 до комплексных соединений приводит к значительному увеличению ПМА, зависящую, в первую очередь, от природы металла и характера гетероцикла (табл. 3). Медные хелаты 39 активны на уровне хлоргексидина. При переходе к цинковым производным 40 получены высокоактивное соединение 40а и среднеактивное 40б, при этом, в структуре хелатов 40 наибольший вклад в ПМА вносит 2-пиридильный заместитель. Прослеживается лидирующая роль кадмия на силу ПМА, по сравнению с медью и цинком в хелатах, что согласуется с данными по активности соответствующих хлоридов металлов. Однако следует отметить значительный рост активности при переходе от хлорида кадмия к хелатам 41 лишь при введении в структуру 2-тиазолила, 2-пиридила и, в меньшей степени, 3-пиридила. При изучении металлокомплексов 51 обнаружено, что наибольшую ПМА проявили кадмиевые хелаты 51б-г, не зависящую от строения гетероцикла и значительно превышающую диоксидин. Таблица 4
Противомикробная активность комплексных соединений по отношению
к музейным штаммам микроорганизмов
| № | Штамм м/о | МИК соединения, мкг/мл | ||||||
| 40а | 41а | 41д | 41е | 51в | 51г | 51д | ||
| 1 | St. epidermidis АТСС 14990 | 62 | 15.6 | 15.6 | 7.8 | 7.8 | 7.8 | 7.8 |
| 2 | P. aeruginosa АТСС 9027 | 500 | 125 | 250 | 125 | 125 | 62 | 125 |
| 3 | C. albicans АТСС 885-653 | 62 | 15.6 | 15.6 | 7.8 | 62 | 62 | 62 |
| 4 | B. subtilis АТСС 6633 | 62 | 7.8 | 7.8 | 3.9 | 3.9 | 3.9 | 3.9 |
| 5 | B. cereus АТСС 8035 | 62 | 7.8 | 15.6 | 3.9 | 3.9 | 3.9 | 3.9 |
| 6 | B. anthracis АТСС 010021 | 62 | 15.6 | 62 | 3.9 | 7.8 | 7.8 | 7.8 |
При испытании 7 активных хелатов по отношению к музейным штаммам м/о выявлено, что они обладают широким спектром ПМА, в том числе, противогрибковым действием. Несомненный интерес представляют также данные о высокой активности хелатов в отношении спорообразующих палочек рода Bacillus, т.к. неорганические соли металлов не обладают спороцидным действием.
Таблица 5
Противомикробная активность комплексных соединений по отношению к
клиническим штаммам микроорганизмов
| № | Штамм м/о | МИК соединения, мкг/мл | |||||||
| 40а | 41а | 41д | 41е | 51в | 51г | 51д | 1% р-р Хлоргек-сидина | ||
| 1 | St. aureus MRSA | 1000 | 62 | 62 | 31 | 62 | 62 | 62 | 125 |
| 2 | St. aureus MSSA | 500 | 31 | 31 | 15.6 | 31 | 31 | 62 | - |
| 3 | St. haemolyticus MRSH | 1000 | 62 | 31 | 31 | 31 | 62 | 62 | 250 |
| 4 | St. haemolyticus MSSH | 500 | 15.6 | 31 | 31 | 15.6 | 31 | 31 | - |
| 5 | St. maltophilia VS | 500 | 15.6 | 15.6 | 7.8 | 15.6 | 15.6 | 31 | >1000 |
| 6 | St. maltophilia VR | 500 | 15.6 | 15.6 | 7.8 | 15.6 | 15.6 | 15.6 | - |
| 7 | St. penicillinasa | 1000 | 31 | 31 | 15.6 | 15.6 | 15.6 | 62 | 1000 |
| 8 | St. epidermidis MS | 1000 | 31 | 15.6 | 15.6 | 31 | 31 | 62 | 125 |
| 9 | P. aeruginosa | 1000 | 1000 | 500 | 500 | 1000 | 125 | 1000 | 1000 |
| 10 | K. pneumonia | 125 | 62 | 62 | 31 | 62 | 31 | 62 | >1000 |
| 11 | K.ozaena | 125 | 31 | 31 | 31 | 62 | 31 | 62 | >1000 |
| 12 | P. mirabilis ER | 1000 | 500 | 500 | 125 | 31 | 31 | 31 | 1000 |
Изучение их ПМА по отношению к некоторым клиническим штаммам м/о показало, что они по силе действия значительно превосходят хлоргексидин, кроме цинкового хелата 40а. При сопоставлении данных по активности, представленных в табл. 3-5, установлено, что наиболее активным веществом является соединение 41е.
В целом, проведенный фармакологический скрининг синтезированных соединений позволяет считать перспективным синтез и поиск БАВ среди производных α-оксокарбоновых кислот и продуктов их химических превращений.
Выводы
В результате проведенных исследований разработаны препаративные методы синтеза более 40 типов новых соединений, установлены основные закономерности «структура-биологическая активность», создана теоретическая и экспериментальная основа получения высокоэффективных, малотоксичных БАВ в ряду производных α-оксокарбоновых кислот и продуктов их химических превращений.
- Реакцией дециклизации КД и 5-АФД под действием N-гетериламинов, гидразинов, гидразонов получены соответствующие N-гетериламиды и N2-замещенные гидразиды, содержащие фармакофорные группировки. Показано наличие тион-тиольной и амино-иминной прототропной таутомерии у производных, содержащих 5-R-1,3,4-тиадиазол. Впервые разработан двухстадийный метод синтеза N2-замещенных гидразидов о-ГФГК через реакцию Штаудингера и последующий кислотный гидролиз, позволяющий получать ранее недоступные соединения.
- Ароилацетилированием фталимидо-α-диазокетонов и ароилдиазометанов ароилкетенами получены 1,5-дизамещенные 2-диазо-1,3,5-пентантрионы. Показано, что выходы и состав продуктов зависят от характера заместителя в ароилкетене и нуклеофильности атома углерода при диазогруппе. Установлено, что диазопентантрионы существуют в растворах в енольной и β-дикетонной формах, что, в свою очередь, обуславливает особенности их химического поведения в реакциях внутримолекулярной циклизации.
- Впервые установлено влияние заместителей в гетерильной части N-[5(6)-R-2-пиридил]амидов и N-(5-R-2-тиазолил)амидов АрПК, а также степени нуклеофильности диазосоединения на состав и строение конечных продуктов реакции. В реакциях N-[5(6)-R-2-пиридил]амидов АрПК с диазометаном, диазоэтаном, арилдиазометанами и 9-диазофлуореном могут быть получены α-О-алкильные производные, продукты 1,3-диполярного циклоприсоединения диазонуклеофила по кратной связи С2=С3 амида и производные имидазо[1,2-a]пиридинов. Гетероциклизация N-(5-R-2-тиазолил)амидов АрПК в производные имидазо[2,1-b]тиазолов осуществляется только под действием диазометана и диазоэтана, а с дифенилдиазометаном образуются продукты β-С-алкилирования. Взаимодействие бензоилметиленгидразидов АрПК с диазометаном региоселективно и приводит к α-О-метильным производным.
- Установлено, что АрПК, их эфиры и амиды взаимодействуют с трифенилфосфазинами и гидразонами кетонов по карбонильной группе в положении 2 с образованием соответствующих 2-метиленгидразинопроизводных, существующих в растворах в трех таутомерных формах. В то же время, в реакции N-гетериламидов АрПК с этиловым эфиром гидразинэтановой кислоты осуществляется замыкание цикла с образованием амидов 5-арил-1-этоксикарбонил-1Н-пиразол-3-карбоновых кислот.
- Предложены способы синтеза водорастворимых БАВ с повышенной биологической доступностью на основе реакции α-оксокарбоновых кислот с гетероциклическими аминами, а также взаимодействия N-гетериламидов о-ГФГК с натрия карбонатом.
- Впервые разработан препаративный метод синтеза комплексных соединений на основе N-гетериламидов и N2-замещенных гидразидов α-оксокарбоновых кислот с дихлоридами меди, цинка, кадмия и подтверждено, в том числе, квантово-химическими расчетами, что исходные реагенты координируются металлами как бидентатные О-О лиганды.
- Проведен широкий фармакологический скрининг более 250 синтезированных соединений. Наиболее важными являются результаты по противовоспалительной, анальгетической, жаропонижающей, противомикробной и гипогликемической активности, позволившие выявить связь действия веществ с их строением и определить фармакофорные фрагменты молекул.
- Для проведения доклинических исследований предложены высокоэффективные и малотоксичные соединения: N-[2-(5-этил-1,3,4-тиадиазолил)]амид 2-(2-гидроксифенил)-2-оксоэтановой кислоты и 2-(1,2-дифенил-2-оксоэтилиденгидразино)-4-(4-метоксифенил)-4-оксо-2-бутеновая кислота, обладающие противовоспалительным, анальгетическим и жаропонижающим действием, а также 2-гидрокси-4-оксо-4-фенил-2-бутеноат 5-метил-1,3,4-тиадиазолиламмония и бис{3-(4-хлорфенил)-1-[N-(5-бром-2-пиридил)]карбоксамидо-1,3-пропандионато}цинк, проявляющие гипогликемическую активность.
