Синтез и биологическая активность карбо- и гетероциклов на основе тетрацианоэтилена 15. 00. 02 Фармацевтическая химия, фармакогнозия
| Вид материала | Автореферат |
- Синтез соединений на основе химических превращений производных α- оксокарбоновых кислот, 643.93kb.
- Синтез, свойства и биологическая активность енаминоамидов ацилпировиноградных кислот, 439.81kb.
- Синтез, свойства, биологическая активность n-гетериламидов α-оксокислот и продуктов, 367.21kb.
- Синтез, химические свойства и биологическая активность 1,4-дизамещенных 5-арил-3-гидрокси-3-пирролин-2-онов, 667.95kb.
- Синтез, свойства и биологическая активность продуктов взаимодействия 1,2,4-триазолов, 669.98kb.
- Синтез и свойства новых производных 2 (1,2,4 триазолил 5 тио)уксусных кислот 15. 00., 240.9kb.
- Примерная программа рекомендуется для направления подготовки (специальности) 111801, 717.4kb.
- Исследование по стандартизации и разработке лекарственных средств на основе листьев, 475.51kb.
- Исследования по разработке и стандартизации комбинированного антимикробного и регенерирующего, 405.42kb.
- «Фармацевтическая химия» специальность – 111201 Ветеринарный врач специализация Ветеринарная, 77.44kb.
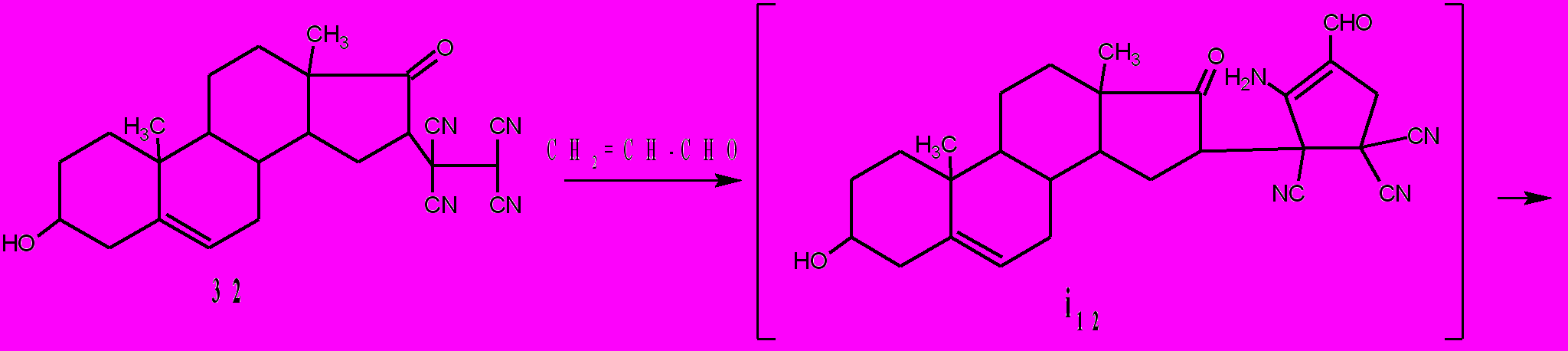
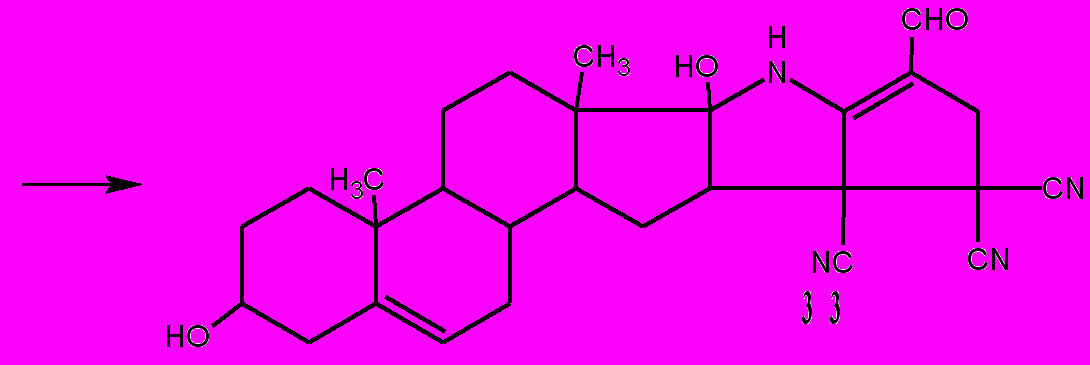
Для того, чтобы циклопентены 30 выделить в кристаллическом состоянии, реакционную смесь выдерживают при комнатной температуре в течение 12-24 ч. Соединения 30 получены с выходами 65-92%. Также как и пираны 29, циклопентены 30 хорошо кристаллизуются и легко выделяются из реакционных смесей. Результаты рентгеноструктурных исследований и ЯМР1Н спектров соединений 30 свидетельствуют о наличии водородных связей между кето- и аминогруппами. По данным РСА соединения 30а расстояния между карбонильной и аминогруппой равно 2,535Ǻ. Таким образом, в циклопентенах 30 имеет место взаимодействие R2C=O и NH2 групп. Вероятно, это взаимодействие еще более сильно выражено у гипотетических 2-замещенных 3-амино-4-формил-3-циклопентен-1,1,2-трикарбонитрилов i11 и i12, у которых в положении 2 расположены более объемные заместители, чем у соединений 30. Это подтверждается тем, что реакция 1-(2-оксоцикло-додецил)-1,1,2,2-этантетракарбонитрила и тетрацианодигидроэпиандро-стерона 32 с акролеином не останавливается на стадии формирования 3-амино-4-формил-3-циклопентен-1,1,2-трикарбонитрилов i11 и i12, а образуются 1-азапенталены 31 и 33.
Схема 14.
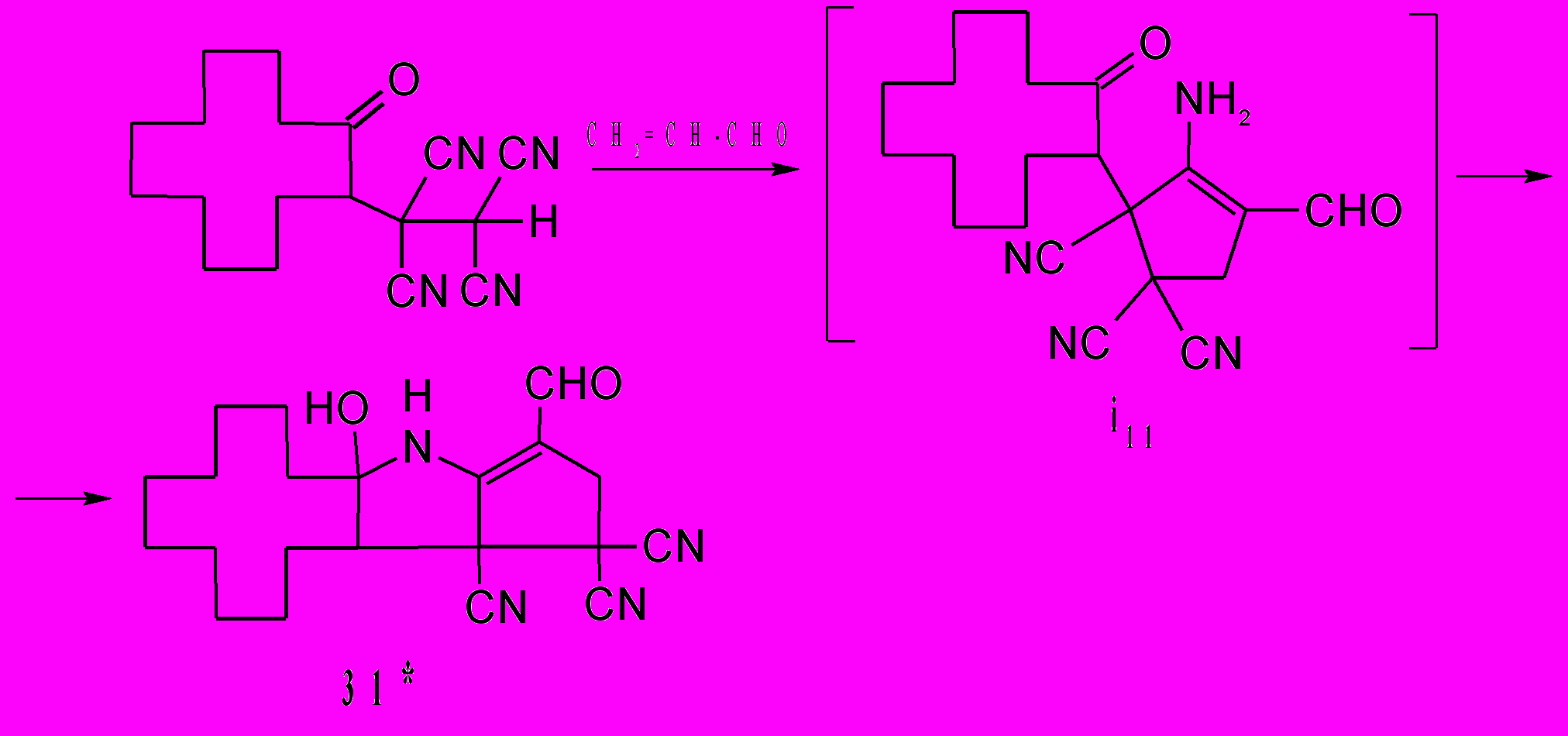
Компьютерные расчеты показывают, что расстояния между амино- и кетогруппами H2N···C=O в интермедиатах i11 и i12 равны соответственно 1,88Å и 1,94Å. Это значительно меньше чем тоже расстояние по данным РСА у соединения 30а.
Схема 15.
- Взаимодействие 4-оксоалкан-1,1,2,2-тетракарбонитрилов с аммиаком
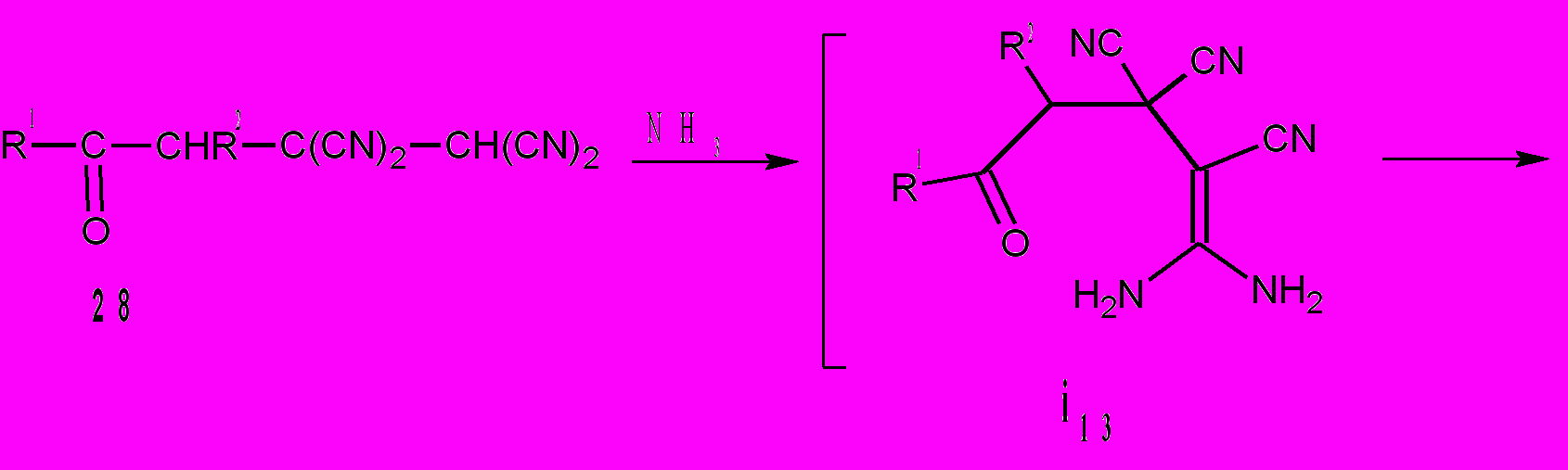
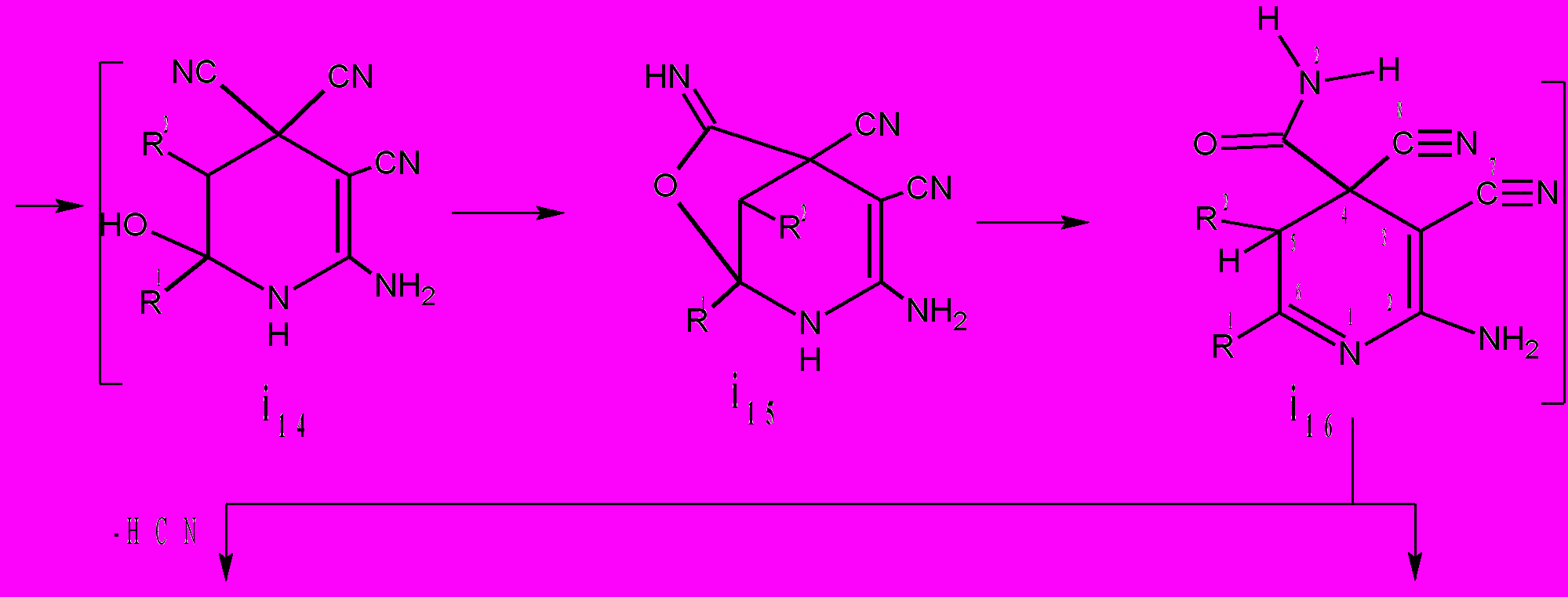
Осуществленные нами превращения ОАТ в гетероциклы обусловлены внутримолекулярными взаимодействиями нуклеофильных (СОNH2, ОН) и цианогрупп. Кроме того, в качестве источника азота для замыкания пиридинового цикла мы использовали аммиак. При этом обнаружены сложные, многостадийные превращения. Так, при взаимодействии тетрацианоалканонов 28 с водным раствором аммиака в течение 24-48 ч образуются два различных класса соединений: бициклы 34а-в и пиридины 35а-в. На направление реакции влияет характер заместителей R1 и R2 в тетрацианоалканонах 28. Наличие объемных заместителей приводит к бициклам 34а-в. Если R1 и R2 менее объемные, то образуются пиридины 35а-в.
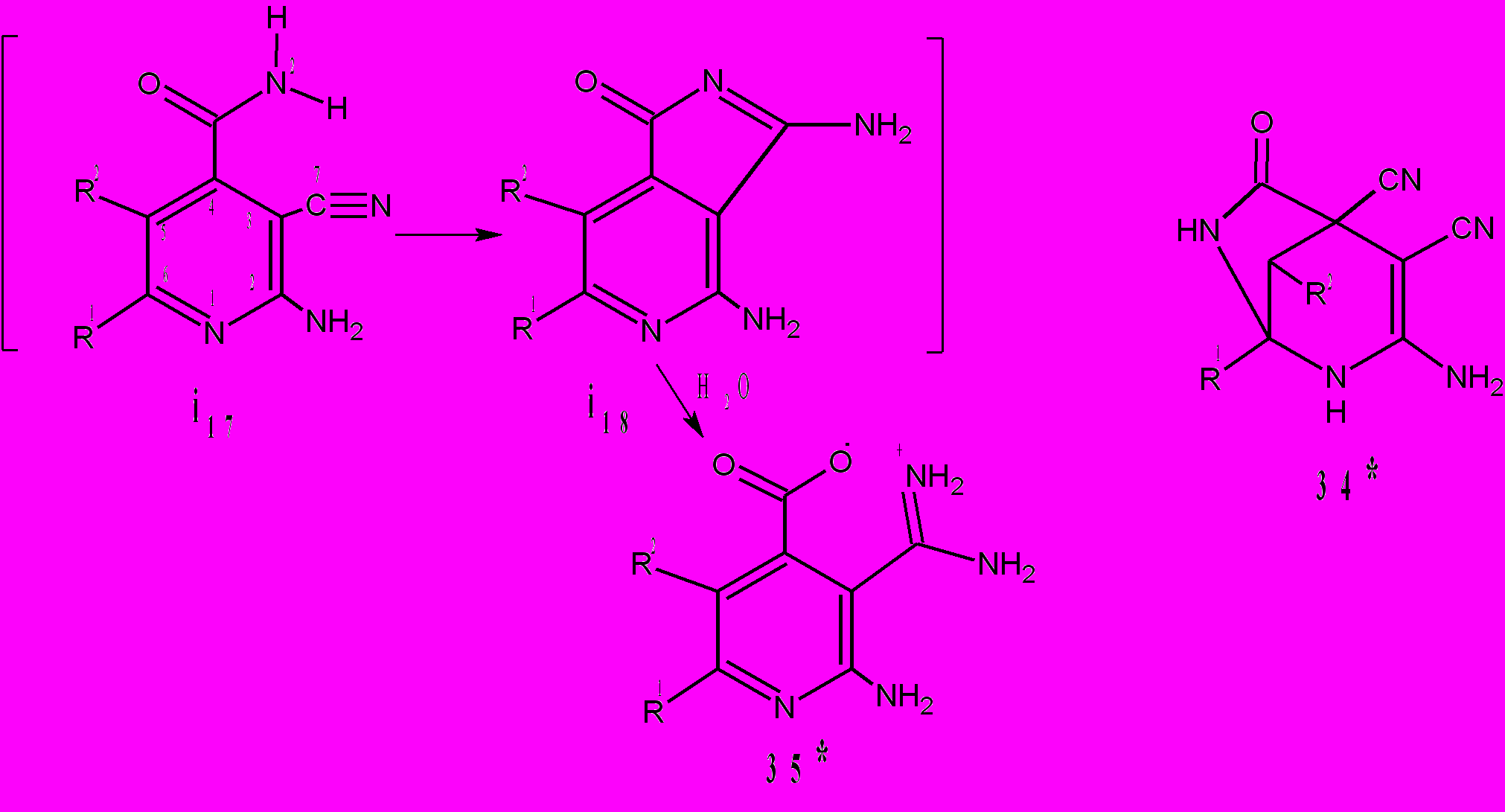
Вероятно, начальные стадии для этих реакций общие: происходит присоединение аммиака к цианогруппе, расположенной в γ-положении кетонов 28, с образованием интермедиата i13. Последний циклизуется в 6-гидрокси-тетрагидропиридин i14, который затем превращается в бицикл i15. Дециклизация интермедиата i15 приводит к дигидропиридин-4-карбоксамиду i16. Эту последовательность стадий подтверждает взаимодействие ОАТ с 1,3,5-триарил-2,4-диаза-1,4-пентадиенами в котором получению 3,4,4-трициано-2,3,4,5-тетрагидропиридин-4-карбоксамидов предшествует образование цианозамещенных аминоалканона и 6-гидроксипиперидина. Впоследствии на дальнейший ход процессов начинают влиять стерические факторы. В случае объемных заместителей [R1 + R2 = (CH2)n, n = 3,4] в интермедиате i16 происходит взаимодействие карбоксамидной группы с C=N связью пиридинового цикла и образуются 4,6-диазабицикло[3.2.1]окт-2-ен-7-оны 34а-в.
Схема 16.
34 : R1 + R2 = (CH2)3 (а); R1 + R2 = (CH2)4 (б)*;
35 : R1 = CH3, R2 = H (а)*; R1 = R2 = CH3 (б); R1 = C2H5, R2 = H (в);
Интермедиат i16 с менее объемными заместителями [R1 = CH3 (а,б), C2H5 (в); R2 = H (а,в), CH3(б)] претерпевает превращения по другому направлению – с дегидроцианированием до пиридина i17, который, в результате внутримолекулярного взаимодействия карбоксамидной и цианогруппы образует бицикл i18. Последняя стадия, по нашему мнению, – это гидролиз лактамного цикла интермедиата i18, приводящий к 3-амидинио-2-аминопиридин-4-карбоксилатам 35а-в. Расчет межатомных расстояний N2-C6, N2-C7 интермедиатов i16(I) [R1 + R2 = (CH2)3] и i16(II) [R1 = CH3, R2 = H] показывает, что они не отличаются друг от друга и равны 2,8-2,9Å. При таких значениях образование σ-связей N2-C6 и N2-C7 равновероятно. Различия в направлениях i16(I) → 34 и i16(II) → 35 (схема 16) обусловлены, как мы полагаем, влиянием стерических факторов R1 и R2. Так, для процесса i16(II) → 35, в сравнении с превращением i16(I) → 34 наиболее вероятно дегидроцианирование и образование пиридина i17. Компьютерные расчеты торсионных углов С8-С4-С5-Н свидетельствуют в пользу этой точки зрения. Для интермедиата i16(I), где R1 + R2 = (CH2)3 угол С8-С4-С5-Н равен 52,5º и, следовательно, дегидроцианирование маловероятно. Иная ситуация у интермедиата i16(II), где R1 = CH3, R2 = H, – угол С8-С4-С5-Н равен – 170,1º, что способствует дегидроцианированию и образованию интермедиата i17. У 4-карбоксамидо-3-цианопиридина i17 рассчитанные межатомные расстояния N2-C6 и N2-C7 равны соответственно 4,76 и 2,83 Å. Таким образом, для него наиболее вероятен процесс циклизации CONH2∙∙∙CN до лактама i18. Реакция 28→35 представляет собой первый случай, когда в тетрацианоалканонах вовлечены в различные взаимодействия и превращения все четыре цианогруппы. Это новый синтетический подход к производным изоникотиновой кислоты.
2. Исследование реакционной способности 1-замещенных 2,2,3,3-тетрацианоциклоалканов
Анализируя литературные данные других авторов и полученные нами результаты можно сделать вывод, что широкие синтетические возможности ТЦЭ наиболее ярко проявляются в реакциях с карбонильными соединениями. Известные ранее превращения ТЦЭ с кислотами, основаниями, алкенами, диенами и ароматическими соединениями менее разнообразны. Тетрацианоэтилирование кетонов до тетрацианоалканонов создает условия для легкого превращения их в цианозамещенные карбо- и гетероциклы. Полагаем, что циклические аналоги тетрацианоалканонов – соответствующие тетрацианоциклоалканы также должны иметь высокий синтетический потенциал. Синтезированные нами полицианосодержащие алициклы использованы в качестве синтонов для получения в мягких условиях сложных потенциально биологически активных соединений.
- Реакционная способность 1-замещенных 2,2,3,3-тетрациано-циклопропанов и циклобутанов
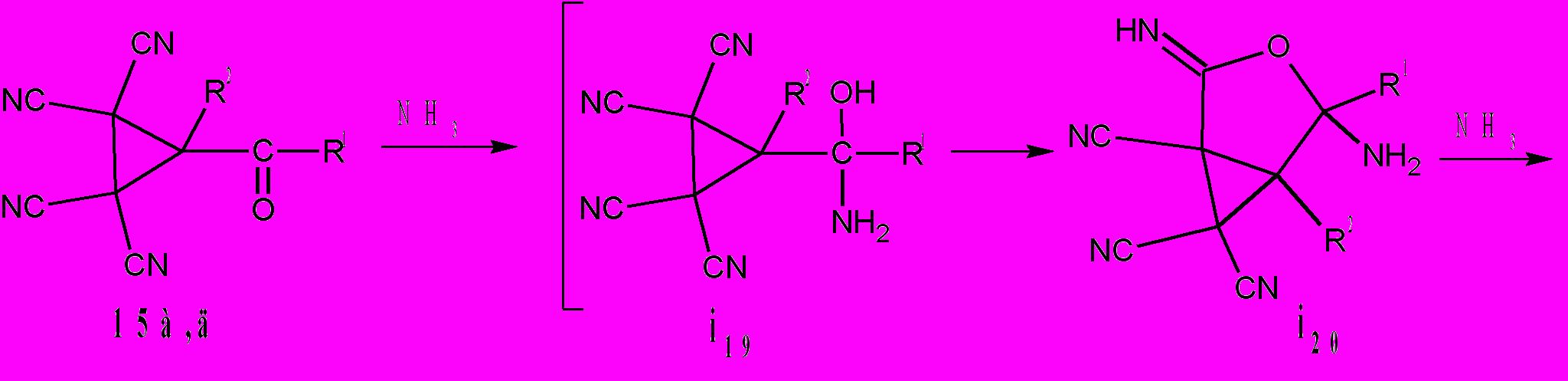
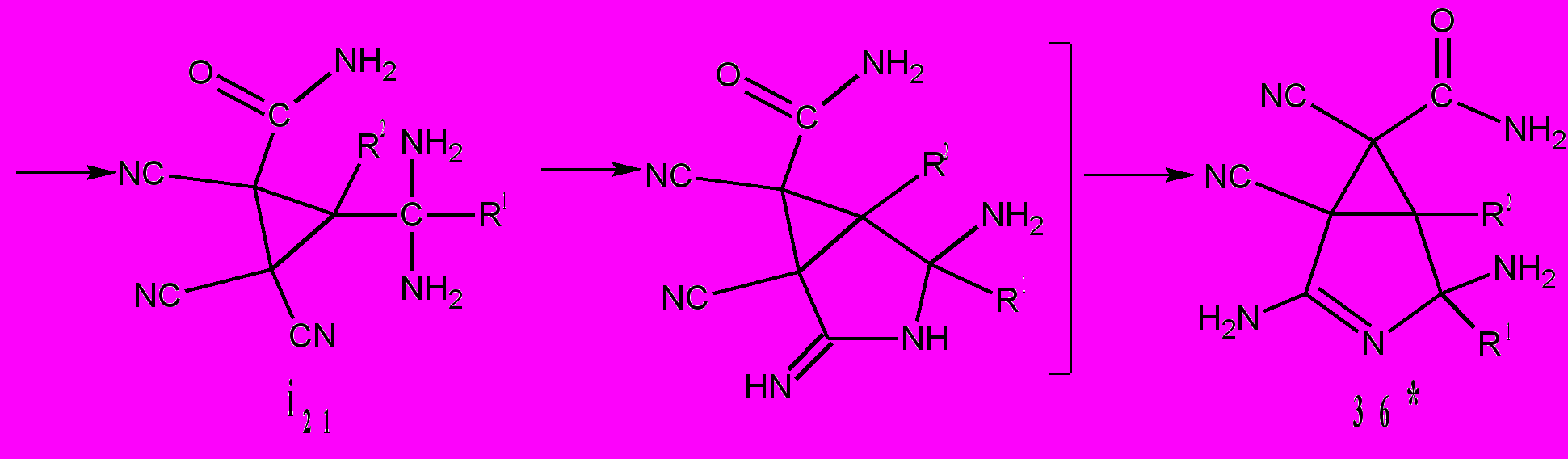
Одни из наиболее отличительных особенностей протекания некоторых реакций ТЦУ – это мягкие условия и быстротечность. Они идут с высокими выходами и легко могут быть воспроизведены в заводских условиях и внедрены в производство. Проведение технологичиских процессов в мягких условиях и за несколько минут или секунд не требуют больших энергозатрат, и как правило, не сопровождается выделением побочных продуктов. Мы считаем, что нахождение синтонов, позволяющих быстро и с высокими выходами осуществлять сложные химические процессы – одна из главных задач современного органического синтеза. Данного типа превращения обнаружены нами при взаимодействии (2,2,3,3-тетрацианоцикло-пропил)кетонов 15а,е с водным аммиаком: за 30 сек с выходами 72-82% происходит образование 2,4-диамино-1,6-дициано-3-азабицикло[3,1,0]гекс-2-ен-6-карбоксамидов 36. В процессах образования бициклов 36 имеет место присоединение к молекуле циклопропанов 15 двух молекул аммиака, что приводит к формированию пирролинового цикла и трансформации одной из цианогрупп в карбоксамидную. Синтез соединений 36 представляет собой новый способ аннелирования пирролинового цикла к тетрацианоциклопропанам и получения новых конденсированных структур, в которых один из фрагментов содержит несколько электроноакцепторных, а другой электронодонорных заместителей.
Схема 17.
36: R1 = CH3; R2 = H(a); R1+ R2=(CH2)3(б)*.
Поскольку в результате реакции образуется только одна карбоксамидная группа, то этот процесс, вероятно, протекает внутримолекулярно. На основании того, что реагируют цианогруппы, расположенные по одну сторону от циклопентанового кольца в направлении связи С=О (рис. 3,4), мы полагаем, что первоначально происходит присоединение только одной молекулы аммиака до образования i19, далее внутримолекулярное взаим
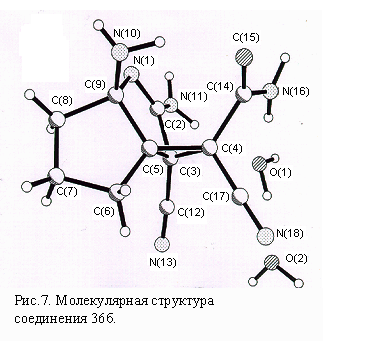 одействие НО∙∙∙CN, приводит к интермедиату i20 (сх. 17). Среди пяти теоретически возможных вариантов присоединения аммиака к кратным связям С≡N и С=О, взаимодействие с С=О группой и образование i19, по расчетам, энергетически наиболее выгодно. Четыре гипотетических варианта структуры 15д с фрагментом H2N-C=NH и
одействие НО∙∙∙CN, приводит к интермедиату i20 (сх. 17). Среди пяти теоретически возможных вариантов присоединения аммиака к кратным связям С≡N и С=О, взаимодействие с С=О группой и образование i19, по расчетам, энергетически наиболее выгодно. Четыре гипотетических варианта структуры 15д с фрагментом H2N-C=NH и Рис. 4. Молекулярная структура соединения 36б.
меют энергии 40-42 ккал/моль, а интермедиат i 19 – 35 ккал/моль. Затем, вероятно, присоединяется вторая молекула аммиака и образуется интермедиат i21. Формирование пирролинового цикла и соединений 36а,б происходит в результате взаимодействия амино- и цианогрупп в интермедиате i21. Другие циклические производные тетрацианоалканонов – 1-ацетонил-2,2,3,3-тетрациано-циклобутаны 17 с нуклеофилами (R3N, RSH, ROH) при комнатной температуре не взаимодействуют. Нагревание реакционных смесей приводит к полимеризации. Однако, при 40-45°С циклобутан 17б с 2,4-динитрофенил-гидразином в спирте с выходом 95% образует хорошо кристаллизующийся гидразон 37.
Схема 18.
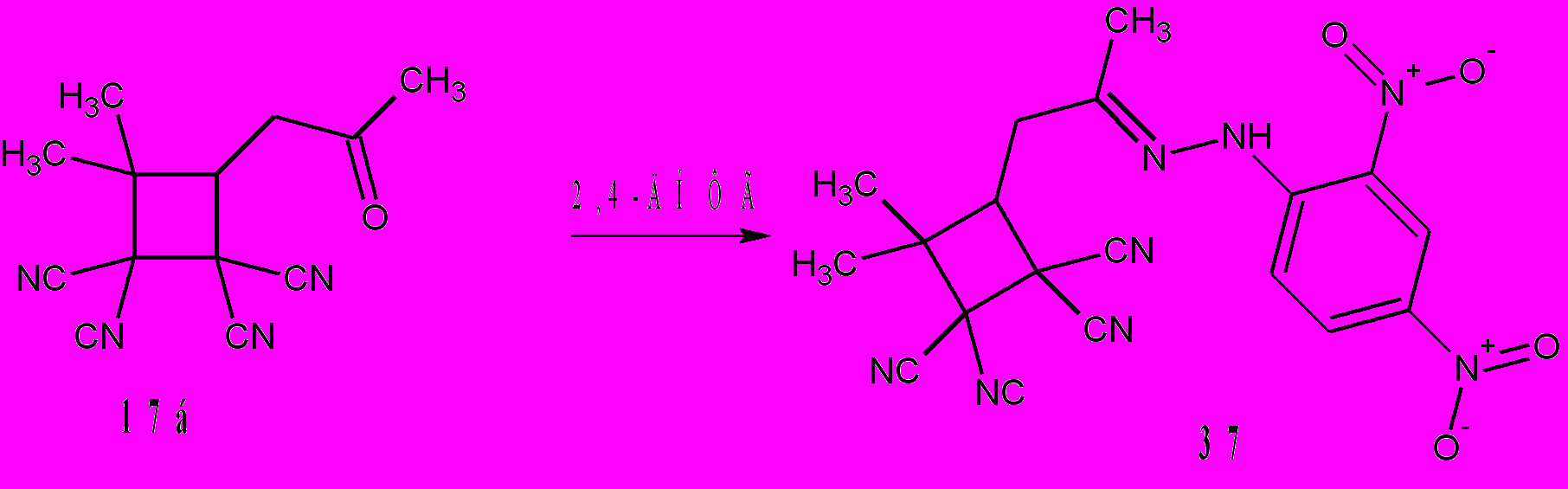
Основная часть опубликованных реакций тетрацианоциклобутанов связана с разрывом σ-связи цикла между тетрацианоэтановым фрагментом и электронодонорным заместителем. Например, 1-этокси-2,2,3,3-тетрацианоциклобутан дециклизуется даже при растворении его в полярных растворителях. Образующийся при этом цвиттер-ионный интермедиат стабилизирован этокси- и цианогруппами.
Циклобутаны 17 такой способностью не обладают, что связано с отсутствием стабилизирующего положительный заряд эффекта ацетонильной группы при дециклизации по связи С1-С2. В развитие исследований процессов дециклизации цианоциклоалканов значительный вклад внесло изучение химии ЭТК, легко получаемого восстановлением ТЦЭ диметилфосфитом. Благодаря высокой реакционной способности ЭТК осуществлен синтез уникальных циклопентанов 38, содержащих близко расположенные сильные электронодонорные и электроноакцепторную группы – соответственно диалкилгидразинный и тетрацианоэтильный фрагменты.
- Реакции 1-(2,2-диалкилгидразино)-2,2,3,3-тетрацианоциклопентанов
1-(2,2-Диалкилгидразино)-2,2,3,3-тетрацианоциклопентаны 38 были получены при взаимодействии ЭТК с диалкилгидразонами α,β-непредельных альдегидов с выходами 40-80%. Они проявляют высокую реакционную способность благодаря аномально легкому разрыву σ-связи С1-С2. Эта связь разрывается даже при растворении тетрацианоциклопентанов 38 в органических растворителях (данные РСА, дебаеграмм, ЯМР-спектроскопии). Кроме того, дециклизация циклопентана 38а по связи С1-С2 была доказана путем смешения его с эквимольным количеством триэтиламина или триэтаноламина в диоксане. При этом образуется соль 39, ИК и ЯМР13С спектры которой указывают на следующие группы: 2130, 2190 см-1 -С(СN)2, 1590 см-1 (С=N); 150 м.д. (СH=N).
Схема 19.

Синтезированные нами на основе циклопентанов 38 карбо- и гетероциклы проявили широкий спектр биологической активности, поэтому представляло интерес изучить не только разнообразные превращения соединений 38, но и влияние различных реагентов на выходы продуктов реакций. Мы обнаружили, что нагревание циклопентанов 38 в диоксане с аминами (триэтиламин, триэтаноламин, диэтиламин, этиламин, аммиак) при соотношении в молях 38: NR3 = 1:0,0005-0,0007 приводит к циклопентенам 40. Реакции, вероятно, протекают через стадии образования интермедиатов i22, i23 и циклизации последних в циклопентены 40. Время протекания процесса 38→40 5-7мин. Лучшими катализаторами являются триэтиламин и триэтаноламин (выходы 33-47%). Использование других аминов снижает выходы циклопентенов 40: при применении диэтиламина выходы 25-38%, этиламина– 9-24%, аммиака – 21-33%. О широких синтетических возможностях, заложенных в тетрацианоциклопентанах 38, благодаря найденному эффекту свидетельствует также взаимодействие тетрацианоциклопентанов 38 с избытком триэтиламина в среде 2-пропанол – вода (3,5:1). При нагревании смеси до кипения направление процесса кардинальным образом меняется – с выходами 30-42% образуются пирролидины 41.
Схема 20.

40 : R = CH3 (а)*, R = C6H5 (б), 2-Fu (в);
41 : R = CH3 (а)*, R = C6H5 (б), C3H7 (в);
Скорее всего, избыток амина и вода связывают в реакционной смеси выделяющуюся синильную кислоту, присоединение которой к С=N связи интермедиата i23 приводит к лабильным соединениям i24, которые циклизуются в пирролидины 41. Кроме триэтиламина в этой реакции можно использовать диэтиламин и аммиак (27-51%). Наиболее приемлемым способом выделения соединений 40 и 41, обеспечивающим их полную кристаллизацию и высокую степень чистоты, является добавление воды к прореагировавшей смеси до начала помутнения раствора. Необычность тетрацианоциклопентанов обусловлена прежде всего их способностью к дециклизации и образованию азотистых производных оксоалкан-1,1,2,2-тетракарбонитрилов 39 и i22. Они имеют те же структурные элементы что и ОАТ (тетрацианоэтильные фрагменты и кратные С=Х связи, где Х = О, N). Продолжая изучение свойств тетрацианоциклопентанов 38 мы обнаружили, что при действии на них окислителей образуются 1-(2,2-диалкилгидразоно)-2,2,3,3-тетрацианоциклопентаны 42 и 1-диалкиламино-5,5,6,6-тетрацианопиперидин-2-оны 43. Гидразоны 42 получены при действии на гидразины 38 перманганата калия в серно- или уксуснокислой среде. Пиперидоны 43 синтезированы нами путем действия гипогалогенидов на гидразины 38.
Схема 21.

42 : R1 = R2 = CH3 (а); R1 = CH3, R2 = C2H5 (б)*; R1 = C6H5, R2 = CH3 (в);
43 : R1 = R2 = CH3 (а)*; R1 = CH3, R2 = C2H5 (б); R1 = C3H7, R2 = CH3 (в); Х = Cl, Br.
Полагаем, что превращение 42→43 начинается с электрофильной атаки – через стадию присоединения катиона Х+ к связи C=N гидразонного фрагмента. Вероятно, механизм дециклизации интермедиатов i25 до соединений i26 аналогичен процессам, идущим с разрывом связи С1-С2 у 1-(2,2-диалкилгидразино)- и 1-гидрокси-2,2,3,3-тетрацианоциклопентанов (ДАН РФ, 1994, Т.334, №2, С. 187-189). Последующий процесс внутримолекулярной циклизации завершает реакцию – образуются пиперидоны 43. Превращение 38→42→43 с использованием H2SO4, HCl, HBr проводили в отсутствие каких-либо органических растворителей путем добавления раствора KMnO4 к подкисленному водному раствору циклопентанов 38. Выходы полученных пиперидонов 43 40-79%. Соединения 42, 43 прекрасно кристаллизуются из 2-пропанола с образованием крупных, устойчивых при хранении кристаллов, не содержащих по данным масс-, ЯМР-спектроскопии и хроматографии каких-либо примесей.
- Синтез 5-амино-1-(диметиламино)-4-метил-3,4-дигидро- 1Н-пирроло[3,4-b]пиридин-4а,7а(2Н,7Н)-дикарбонитрилов
Исследования биологической активности соединений 40-43 показали перспективность их дальнейших испытаний. Наивысшей активностью обладают тетрацианозамещенные 42, 43. Для изучения биологической активности их производных мы синтезировали бициклы 44, 45. Бицикл 44 образуется за 10-20 с при нагревании пиперидона 43а в уксусной кислоте в присутствии воды и катализатора. Реакция пиперидона 43а с метанолом в присутствии основания протекает при комнатной температуре за 1-3 мин и приводит к соединению 45.
Схема 22.
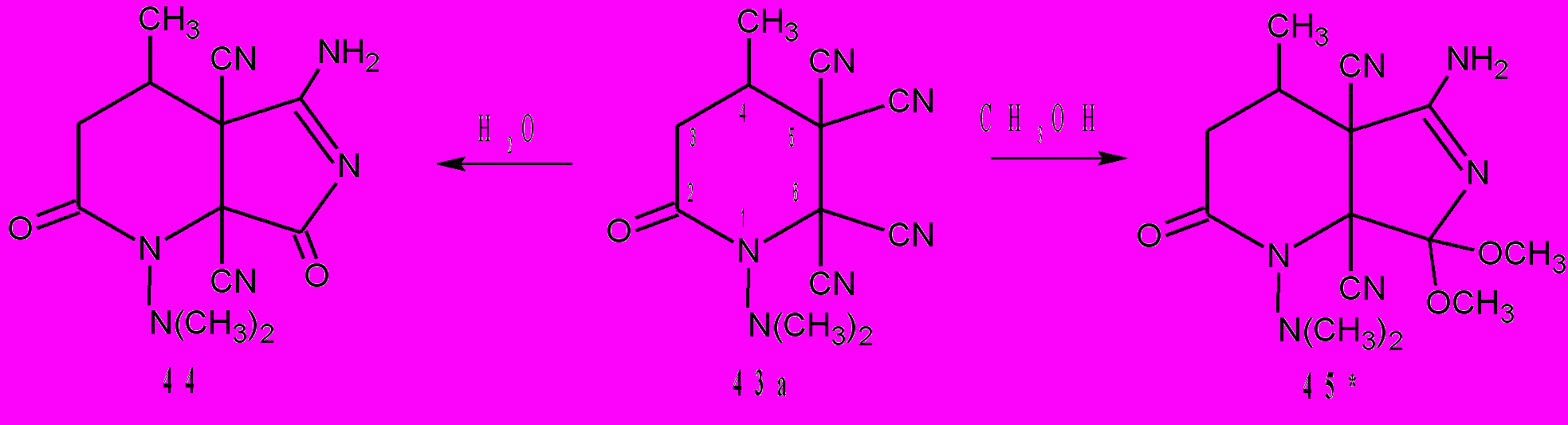
После добавления к суспензии пиперидона 43а в метаноле каталитических количеств основания (пиперидин, диэтиламин и др.) происходит его растворение, затем через 1-3 мин выделяется более мелкий кристаллический осадок соединения 45. Такое протекание реакции с образованием осадка другой кристаллической структуры может служить качественным методом определения пиперидона 43а и его аналогов. По данным РСА у пиперидона 43а более предпочтительной для присоединения нуклеофилов является цианогруппа, расположенная в положении 6 пиперидонового цикла. Соединения 44 и 45 образуются с выходами 90-95%. Для бицикла 45 Е=68,45 ккал/моль. Присоединение метанола по цианогруппе в положение 5 привело бы к гипотетическому изомеру, у которого рассчитанная Е=71,61 ккал/моль. Аналогично и для соединения 44 – энергия гипотетического и реального продуктов реакции равны соответственно 67,28 и 62,22 ккал/моль.
2.3. Превращения 3,4-R1,R2-5-оксо-1,1,2,2-циклогексан- тетракарбонитрилов
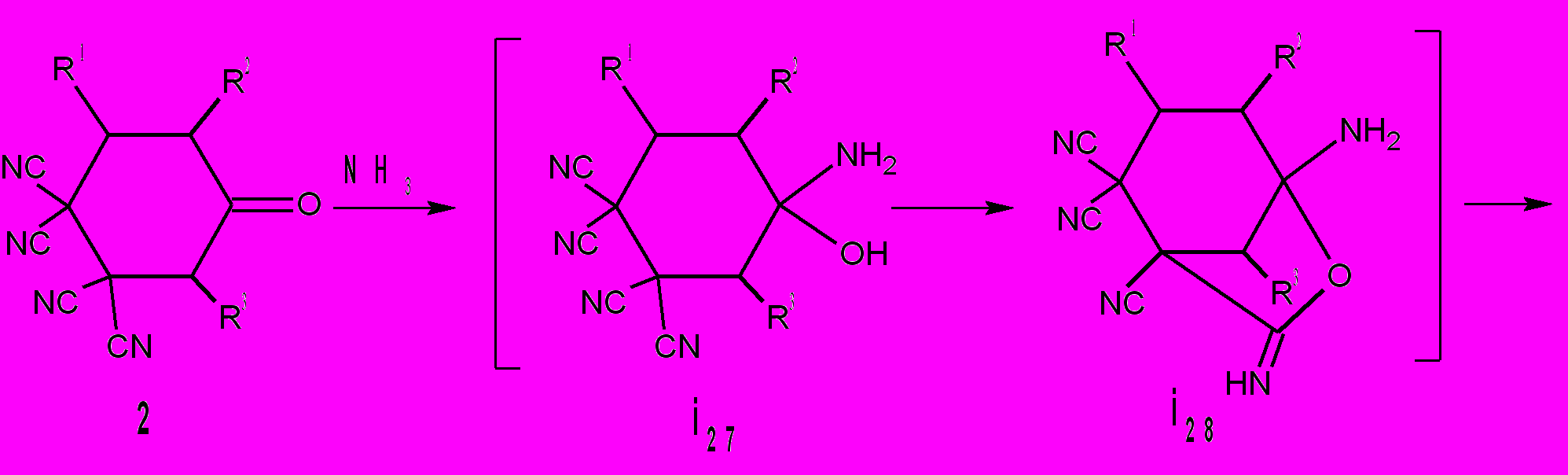
В ряду известных замещенных тетрацианоциклогексанов синтезированные нами 3,4-R1,R2-5-оксо-1,1,2,2-циклогексантетракарбонитрилы являются первыми представителями циклогексанонов с четырьмя нитрильными группами. Уникальное сочетание в гексановом цикле одной карбонильной и четырех цианогрупп необычным образом сказывается на их реакционной способности. Циклогексаноны 2 легко гидратируются до диолов 11, гидролизуются до амидов 12 и циклизуются в азабициклы 13. Аналогичные процессы формирования азабицикло[3.2.1]октановой структуры происходят при взаимодействии циклогексанонов 2 с аммиаком. Полагаем, что реакция начинается с присоединения аммиака к карбонильной группе циклогексанонов 2 и образования интермедиата i27. Последующие процессы циклизации i27 до i28, дециклизации i28 до i29 и циклизация последнего приводят к аминопирролидинонам 46 с выходами 92-95%
Несколько иначе протекает взаимодействие циклогексанонов 2 с гидразинами: с выходами 69-81% образуются аминопирролиноны 47. Вероятно, превращение циклогексанонов 2 в интермедиат i30 аналогично процессам протекающим при взаимодействии их с аммиаком до стадии образования интермедиата i29.
Схема 23.
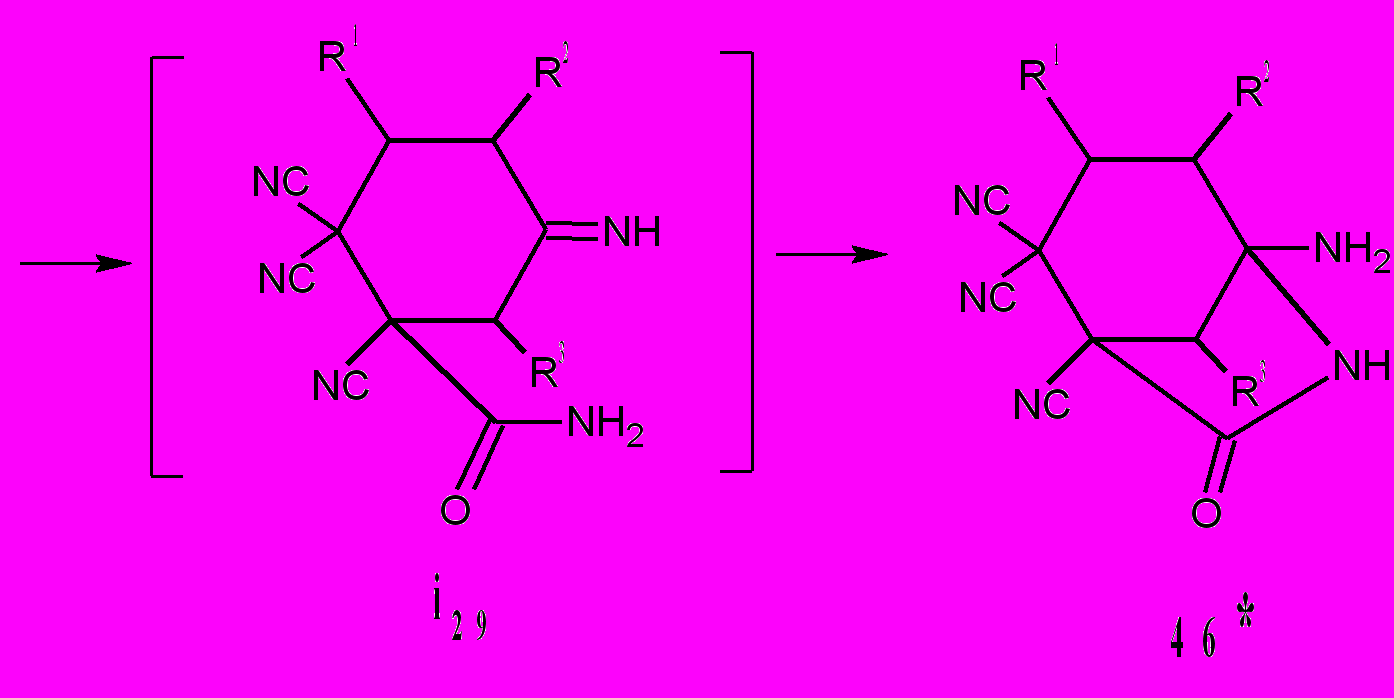
R1 = Ph, R2 = C3H7, R3 = H(а); R1 = Ph, R2 = H, R3 = CH3 (б)*;
R1 = 4-MeOC6H4, R2 = C3H7, R3 = H (в); R1 = Ph, R2 = R3 = CH3 (г);
Формирование пирролинонового цикла у интермедиата
