Синтез и биологическая активность карбо- и гетероциклов на основе тетрацианоэтилена 15. 00. 02 Фармацевтическая химия, фармакогнозия
| Вид материала | Автореферат |
- Синтез соединений на основе химических превращений производных α- оксокарбоновых кислот, 643.93kb.
- Синтез, свойства и биологическая активность енаминоамидов ацилпировиноградных кислот, 439.81kb.
- Синтез, свойства, биологическая активность n-гетериламидов α-оксокислот и продуктов, 367.21kb.
- Синтез, химические свойства и биологическая активность 1,4-дизамещенных 5-арил-3-гидрокси-3-пирролин-2-онов, 667.95kb.
- Синтез, свойства и биологическая активность продуктов взаимодействия 1,2,4-триазолов, 669.98kb.
- Синтез и свойства новых производных 2 (1,2,4 триазолил 5 тио)уксусных кислот 15. 00., 240.9kb.
- Примерная программа рекомендуется для направления подготовки (специальности) 111801, 717.4kb.
- Исследование по стандартизации и разработке лекарственных средств на основе листьев, 475.51kb.
- Исследования по разработке и стандартизации комбинированного антимикробного и регенерирующего, 405.42kb.
- «Фармацевтическая химия» специальность – 111201 Ветеринарный врач специализация Ветеринарная, 77.44kb.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Для получения карбо- и гетероциклов проводились реакции в основе которых лежат внутримолекулярные взаимодействия с одной стороны С-Н, NH2, OH, CONH2 и с другой C≡N, C=NH, C=O, C=C групп. В качестве исходных полицианосодержащих реагентов использовали ТЦЭ, ОАТ и ТЦЦА. Для ответа на вопрос: является ли образование того или иного соединения энергетически более выгодным из гаммы альтернативных структур был использован метод расчета энергии молекул и гипотетических интермедиатов с помощью программы «CS Chem 3D Рro», методом ММ2. Расчетные данные были уточнены с помощью рентгеноструктурного анализа (РСА).
-
Синтез и свойства 4-оксоалкан-1,1,2,2-тетракарбонитрилов
Точкой отсчета начала интенсивного развития химии органических полинитрилов можно считать публикацию сотрудников фирмы DuPont в JACS (1958) препаративного способа получения ТЦЭ. Тогда же было сообщено о синтезе ЭТК и ОАТ. Наша лаборатория внесла значительный вклад в это направление прежде всего тем, что разработала более простые методы синтеза ЭТК – восстановлением ТЦЭ диметилфосфитом и ОАТ - присоединением кетонов к ТЦЭ катализируемым спиртами и кислотами.
Полагаем, что среди рассматриваемых нами ТЦУ наиболее активны функционально более насыщенные ОАТ.
В настоящее время, вероятно, исследования по изучению реакций ТЦЭ с кетонами являются одними из наиболее перспективных.
- Реакции тетрацианоэтилена с α,β-непредельными кетонами
Нами впервые были исследованы реакции ТЦЭ с α,β-непредельными кетонами. Процессы тетрацианоэтилирования α,β-непредельных кетонов и дальнейшие их превращения представляли значительный интерес.
- Синтез 3,4-R1,R2-5-оксо-1,1,2,2-циклогексантетракарбонитрилов
Ранее в качестве основного метода синтеза шестичленных тетрацианозамещенных карбоциклов использовалась реакция [4+2] циклоприсоединения диенов с ТЦЭ (Миддлетон, 1958). Мы нашли новый подход к этим соединениям взаимодействием ТЦЭ с α,β-непредельными кетонами 1. При этом образуются циклогексаноны 2 с выходами 48-89 %.
Схема 1.
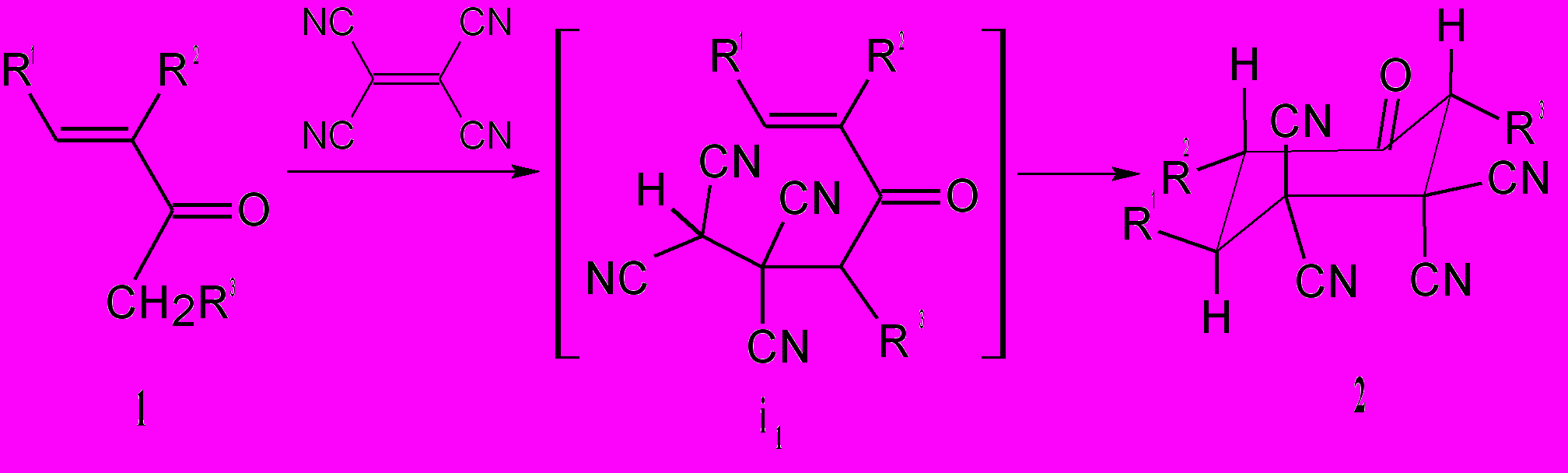 Табл. 1.
Табл. 1.| Соединение | R1 | R2 | R3 | *τр,час | Выход, % |
| 2а | C3H7 | C3H7 | H | 8 | 64 |
| 2б | Ph | C3H7 | H | 6 | 82 |
| 2в | 4-CH3OC6H4 | C3H7 | H | 6 | 79 |
| 2г | 4-CH3OC6H4 | CH3 | CH3 | 6 | 73 |
| 2д | 4-CH3OC6H4 | H | i-C3H7 | 6 | 89 |
| 2е | 2-Fu | H | H | 3 | 68 |
| 2ж | i-C3H7 | H | H | 12 | 68 |
| 2з | Ph | H | H | 6 | 48 |
| 2и | Ph | H | CH3 | 6 | 77 |
| 2к | 4-CH3OC6H4 | H | CH3 | 3 | 61 |
*τр – время реакции
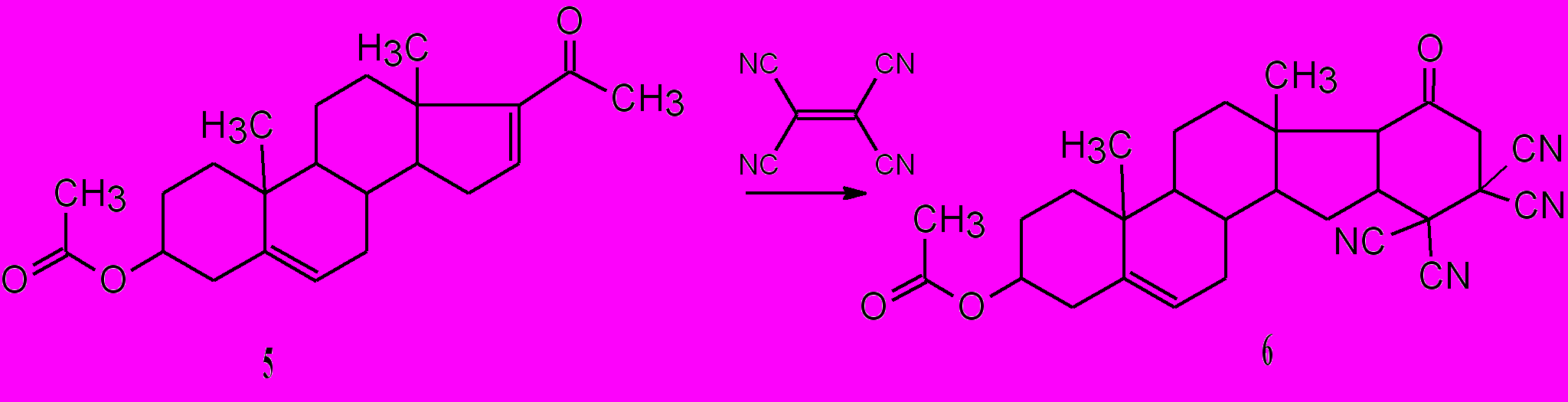
Реакции, вероятно, начинаются, как и в случае взаимодействия ТЦЭ с предельными алканонами, с образования тетрацианоэтилированных кетонов i1. Это общее направление взаимодействия карбонильных соединений с α,β-непредельными нитрилами рассматривается как присоединение α-углеродного атома кетона к активированной двойной связи нитрила (Шаранин Ю.А., Гончаренко М.П., Литвинов В.П., 1998). Следующая стадия – это внутримолекулярная циклизация. Процессы носят общий характер, что иллюстрируется вовлечением таких сложных аналогов как ацетат 16-дигидропрегненолона 5 с образованием 17-ацетокси-5,5,6,6-тетрациано-10,14-диметил-8-оксопентацикло[11.8.0.02,10.04,9.014,19]генэйкоз-19-ена 6. По аналогичной схеме с ТЦЭ реагируют и циклические α,β-непредельные кетоны 3 – образуются циклогексаноны 4.
Схема 2.
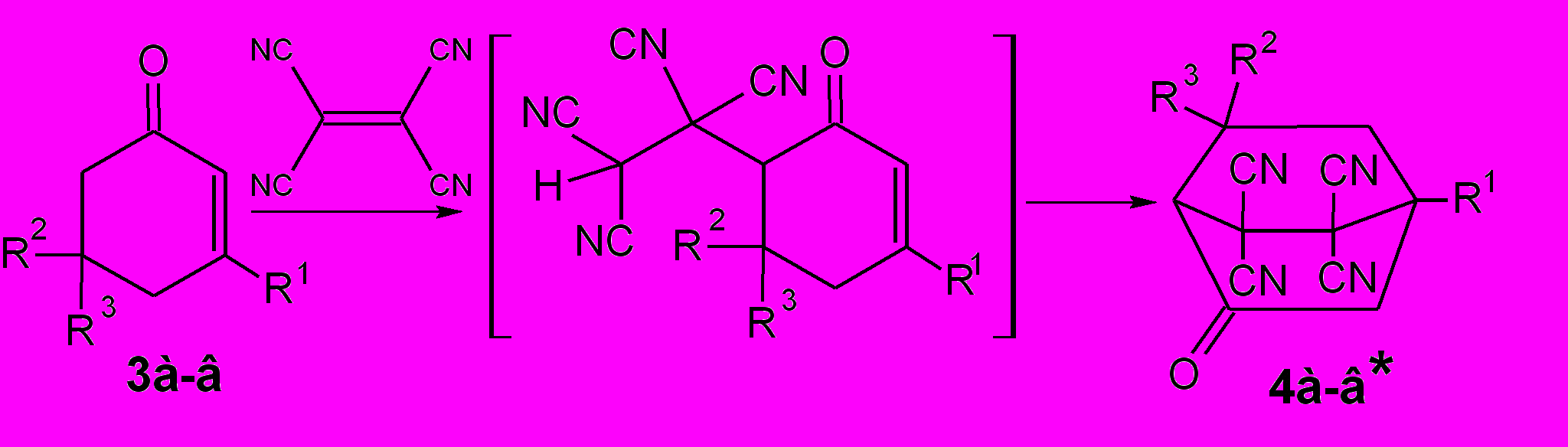
Схема 3.
Взаимодействие ТЦЭ с непредельными кетонами 7, содержащими в α-положении электроноакцепторные заместители COOEt и C(O)CH3 приводит к циклогексенолам 8.
Схема 4.
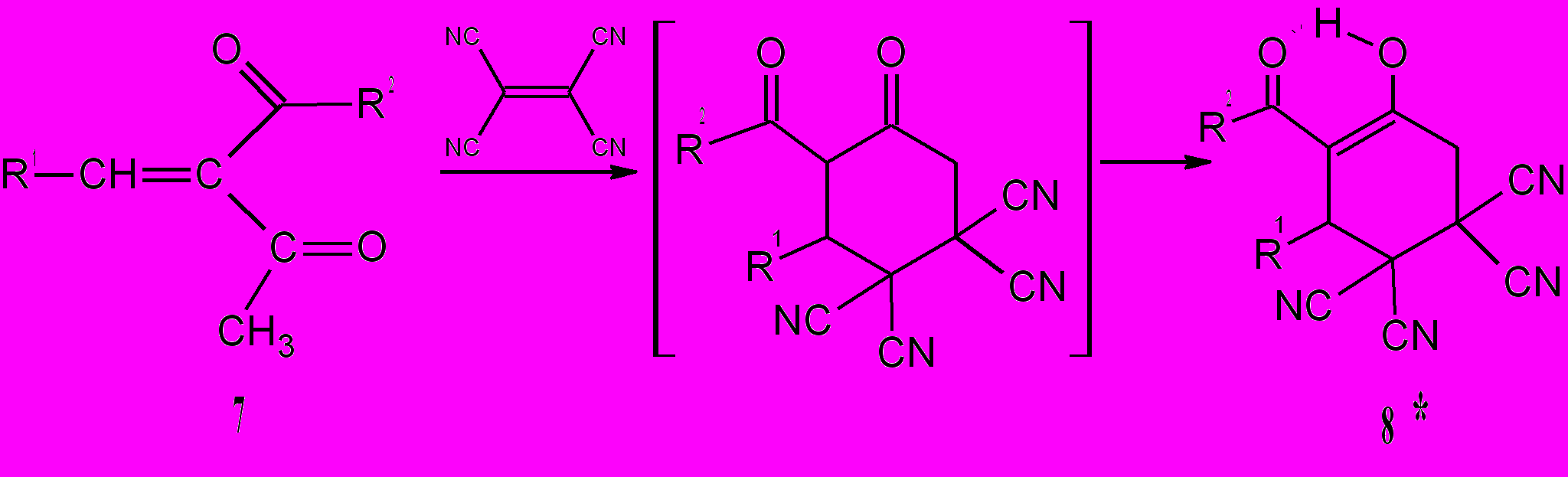
Табл. 2.
| Соединение | R1 | R2 | R3 | τр,час | Выход, % |
| 4а | H | H | H | 12 | 91 |
| 4б | CH3 | CH3 | CH3 | 12 | 89 |
| 4в* | CH3 | H | 4-CH3OC6H4 | 12 | 95 |
| 6 | - | - | - | 48 | 84 |
| 8а* | C6H5 | OC2H5 | - | 48 | 52 |
| 8б | CH3 | OC2H5 | - | 48 | 37 |
| 8в | 4-CH3OC6H4 | OC2H5 | - | 48 | 78 |
| 8г | Ph | CH3 | - | 12 | 81 |
| 8д | i-C3H7 | CH3 | - | 12 | 57 |
| 8е | 4-CH3OC6H4 | CH3 | - | 12 | 84 |
* Структура определена методом РСА
П
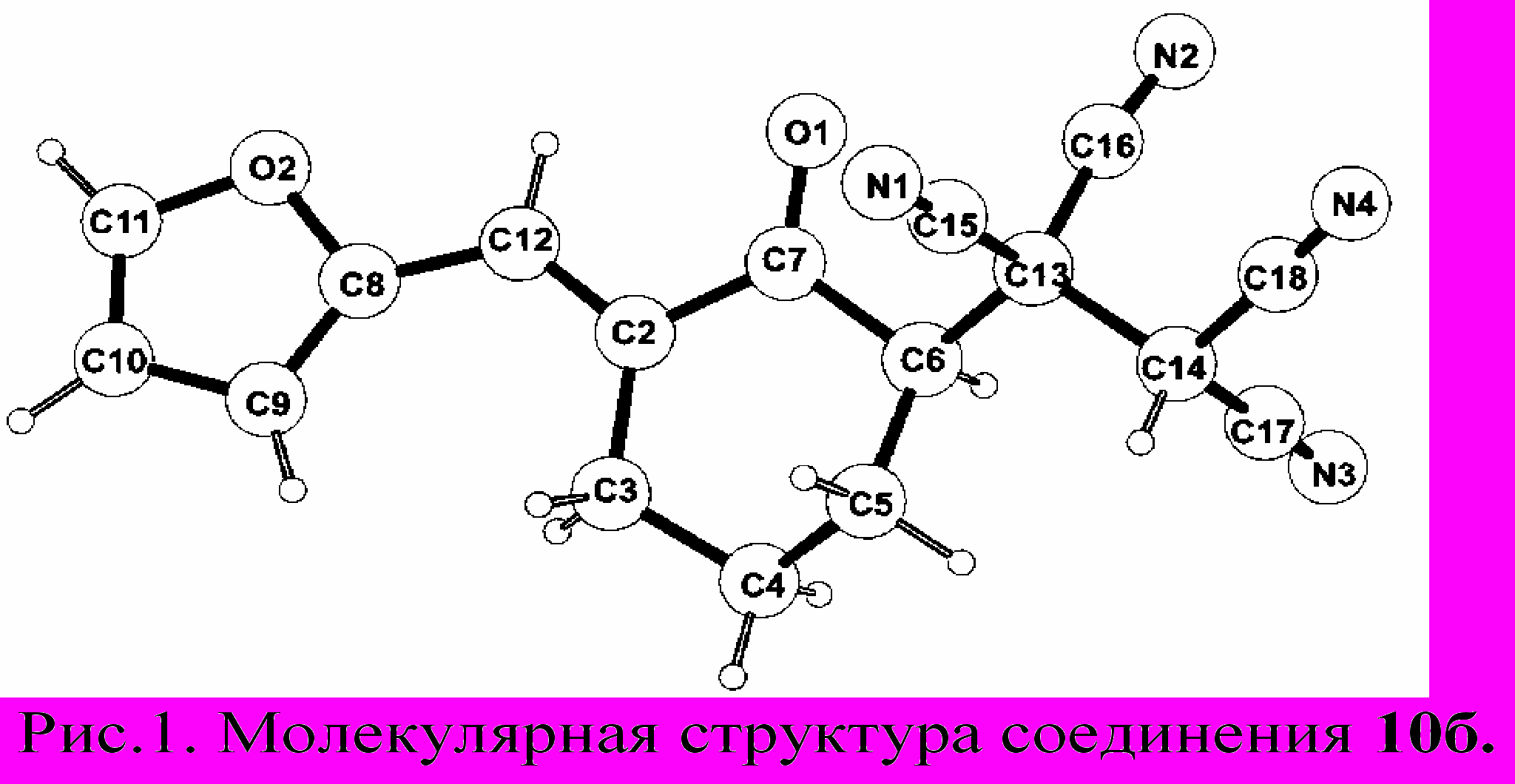
оследовательность превращений, предложенных на схеме 1, подтверждается реакциями ТЦЭ с кетонами 9. При смешении реагентов в диоксане, в присутствии катализатора (конц. НCl) образуются тетрацианокетоны 10. Как показано на рис. 1 внутримолекулярная циклизация кетона 10б и его циклических аналогов по Михаэлю невозможна. Это можно объяснить жесткой фиксацией α-углеродных атомов по отношению к карбонильной группе. Соединения 10а,е,ж не циклизуются в циклогексаноны вследствие более предпочтительной для них S-cis конформации, что согласуется с расчетными энергиями для 10a: S-cis 47,24 ккал/моль, S-trans 51,26 ккал/моль.
Схема 5.
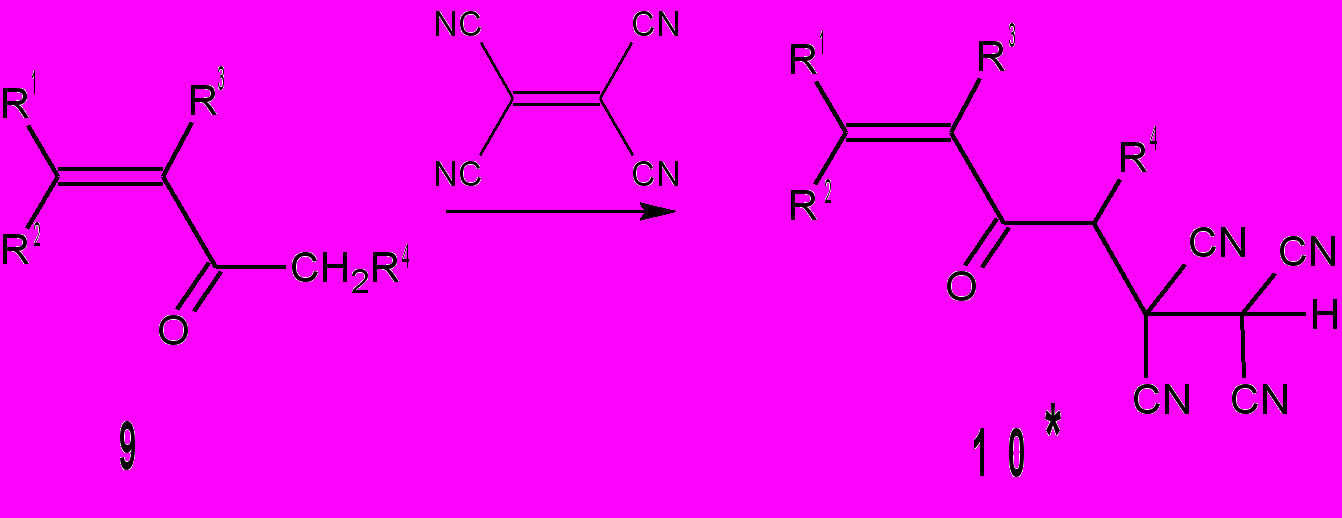
Табл. 3.
| Соединение | R1 | R2 | R3 | R4 | τр | Выход, % |
| 10а | CH3 | CH3 | H | H | 10 мин | 81 |
| 10б* | 2-Fu | H | (CH2)3 | 5 мин | 89 | |
| 10в | 2-Fu | H | (CH2)2 | 5 мин | 97 | |
| 10г | Ph | H | (CH2)3 | 10 мин | 94 | |
| 10д | 4-CH3OC6H4 | H | (CH2)3 | 10 мин | 84 | |
| 10е | 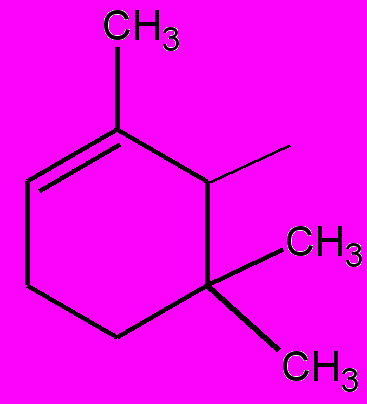 | Н | Н | Н | 6 ч | 65 |
| 10ж | 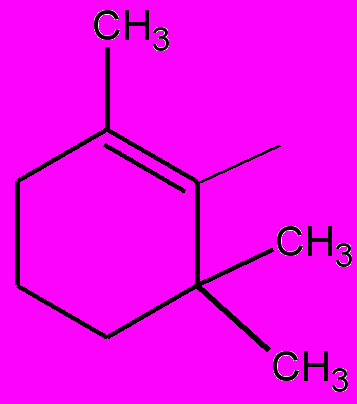 | Н | Н | Н | 6 ч | 68 |
1.1.2. Образование 3-R1-4-R2-8-R3-5-гидрокси-7-оксо-6-азабицикло[3.2.1]октан-1 , 2 ,2-трикарбонитрилов
Условия, при которых образуются циклогексаноны 2 а-д и 2 е-к различны. Для синтеза соединений 2 а-д можно использовать неабсолютированные растворители.
Схема 6.

Табл. 4.
| Соединение | R1 | R2 | R3 | τр | Выход,% % |
| 11е | 2-Fu | H | H | 2 ча | 67 |
| 11ж* | i-C3H7 | H | H | 12 ча | 41 |
| 12е | 2-Fu | H | H | 5 минб | 95 |
| 12ж | i-C3H7 | H | H | 10 минб | 92 |
| 13а | C3H7 | C3H7 | H | 7 мина | 89а |
| 13б | Ph | C3H7 | H | 10 мина | 98а |
| 13в | 4-CH3OC6H4 | C3H7 | H | 5 мина | 97а |
| 13г | 4-CH3OC6H4 | CH3 | CH3 | 5 мина | 98а |
| 13д | 4-CH3OC6H4 | H | i-C3H7 | 5 мина | 80а |
| 13е | 2-Fu | H | H | 3 ч, 5 мина | 84, 94а |
| 13ж* | i-C3H7 | H | H | 12 ч, 5 мина | 69, 81а |
| 13з | Ph | H | H | 8 ч, 5 мина | 82, 92а |
| 13и | Ph | H | CH3 | 6 ч, 10 мина | 74, 95а |
| 13к | 4-CH3OC6H4 | H | CH3 | 3 ч, 5 мина | 69, 96а |
| 13л | CH3 | H | H | 12 ч | 73 |
| 13м | C2H5 | H | H | 12 ч | 81 |
| 13н | C3H7 | H | H | 12ч | 78 |
| 13о | C5H11 | H | H | 12 ч | 78 |
| 13п | 4-CH3OC6H4 | H | H | 6 ч | 64 |
| 13р* | Ph | CH3 | H | 4 ч | 83 |
| 13с | Ph | Br | Н | 3-4 дня | 75 |
| 13т | 4-CH3OC6H4 | CH3 | H | 1 ч | 79 |
