«Пермская государственная медицинская академия имени академика Е. А. Вагнера Федерального агентства по здравоохранению и социальному развитию»
| Вид материала | Автореферат |
- «Пермская государственная медицинская академия имени академии Е. А. Вагнера Федерального, 315.55kb.
- Язвах желудка и двенадцатиперстной кишки, 264.69kb.
- Язвах желудка и двенадцатиперстной кишки, 265.88kb.
- Оптимизация диагностики и хирургической тактики при экссудативном плеврите 14. 00., 254.78kb.
- Комплекс клинико-лабораторных симптомов и сопротивление дыхательных путей при рецидивирующем, 241.6kb.
- Скрябин владимир Леонидович новые углеродные материалы в реконструктивной хирургии, 418.36kb.
- Идиопатической тромбоцитопенической, 250.8kb.
- На правах рукописи, 721.93kb.
- Клинико-лабораторное обоснование диагностики бактериальных гнойных менингитов различной, 392.51kb.
- Оптимизация методов лечения хронических форм апикального периодонтита 14. 01. 14. Стоматология, 269.87kb.
Смешанные инфекции


Неспецифический вульвовагинит+ «истинный» вульвовагинальный кандидоз
Бактериальный вагиноз+ «истинный» вульвовагинальный кандидоз
Бактериальный вагиноз+ неспецифический вульвовагинит
Схема. Классификация неспецифических инфекционных заболеваний влагалища
Т а б л и ц а
Сравнительный анализ данных бактериологического исследования вагинальной микрофлоры здоровых и пациенток, страдающих бактериальным вагинозом
| Показатели | I группа (n=42) | III группа (n=112) | P | ||||||
| lgКОЕ/мл (M±σ) | Сумма особей вида /рода | Индекс доминирования (d) | Индекс Симпсона (C) | lgКОЕ/мл (M±σ) | Сумма особей вида /рода | Индекс доминирования (d) | Индекс Симпсона (C) | ||
| Lactobacillus sp. | 6,8±0,40 | 379000000 | 99,85015 | 0,99701 | 1,0±1,48 | 99000 | 0,00002 | 0 | <0,05 |
| Bifidobacterium sp. | 1,4±1,92 | 261000 | 0,06876 | 0 | 0,5±1,06 | 14600 | 0 | 0 | <0,05 |
| E. coli | 0,8±1,50 | 83000 | 0,02187 | 0 | 0,6±1,11 | 13400 | 0 | 0 | >0,05 |
| Enterobacteriaceae (прочие) | 0,4±1,09 | 13000 | 0,00342 | 0 | 0,4±0,97 | 11300 | 0 | 0 | >0,05 |
| S.aureus | 0,9±1,51 | 33000 | 0,00869 | 0 | 0,3±0,83 | 7800 | 0 | 0 | <0,05 |
| S.epidermidis | 0,5±1,17 | 16500 | 0,00435 | 0 | 0,4±0,95 | 10500 | 0 | 0 | >0,05 |
| Staphylococcus spp. (haem+) | 0 | 0 | 0 | 0 | 1,0±1,26 | 20200 | 0 | 0 | <0,05 |
| St.acidophylus | 0,7±1,35 | 19600 | 0,00516 | 0 | 0 | 0 | 0 | 0 | <0,05 |
| Streptococcus sp. (haem+) | 0,4±1,11 | 14400 | 0,00379 | 0 | 1,6±1,41 | 63300 | 0,00001 | 0 | >0,05 |
| Streptococcus sp. (haem-) | 0,8±1,45 | 24000 | 0,00632 | 0 | 0,3±0,89 | 8800 | 0 | 0 | >0,05 |
| Corynebacterium spp. | 1,8±1,75 | 68700 | 0,01810 | 0 | 0,6±1,09 | 17000 | 0 | 0 | <0,05 |
| Bacteroides sp. | 0,9±1,39 | 17800 | 0,00469 | 0 | 2,8±3,22 | 2602414070 | 0,49547 | 0,00002 | <0,05 |
| Mobiluncus sp. | 0,4±0,96 | 3900 | 0,00103 | 0 | 4,0±4,33 | 189621700000 | 36,10172 | 0,13033 | <0,05 |
| Gardnerella sp. | 0,8±1,31 | 12700 | 0,00335 | 0 | 4,4±4,14 | 332963462000 | 63,39229 | 0,40186 | <0,05 |
| Peptococcus sp. | 0 | 0 | 0 | 0 | 1,6±1,93 | 1369600 | 0,00026 | 0 | <0,05 |
| Peptostreptococcus sp. | 0 | 0 | 0 | 0 | 0,7±1,54 | 1112200 | 0,00021 | 0 | <0,05 |
| U. urealyticum | 0,2±0,62 | 500 | 0,00013 | 0 | 0,8±1,89 | 25910000 | 0,00493 | 0 | <0,05 |
| M. hominis | 0,3±0,70 | 700 | 0,00018 | 0 | 1,1±2,05 | 26562000 | 0,00506 | 0 | <0,05 |
| Candida spp. | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| C. albicans | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| C. glabrata | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| C. tropicalis | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| C. parapsilosis | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| C. krusei | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |

пкг/мл
пкг/мл

Рис. 5. Содержание цитокинов во Рис. 6. Содержание цитокинов во
влагалищном отделяемом при влагалищном отделяемом при
бактериальном вагинозе неспецифическом вульвовагините
Повышение активности IL-4 наблюдали при кандидозной инфекции (рис. 7, 8), преобладание Th2 эффектов становится более выраженным при хронической форме, что приводит к нарушениям антителообразования (IgA – 0,21±0,035 г/л, IgG – 0,31±0,127 г/л, p1-6<0,05) и фунгицидной активности макрофагов (здоровые: количество макрофагов - 391,8±98,16 абс. число клеток в мкл., ФП - 34,7%, ФЧ – 0,6±0,06, ФИ – 1,7±0,17; хронический ВВК: количество макрофагов - 2197,1±205,63 абс. число клеток в мкл., ФП – 19,9±1,24, ФЧ – 0,3±0,05, ФИ – 1,4±0,24).
При аэробно-грибковых ассоциациях отмечен выраженный дисбаланс цитокинов: достоверное повышение уровня IL-4, IL-6 при уменьшении количества IL-1, IL-2, TNF-α, INFγ (рис. 9). Такие изменения цитокинового каскада сочетаются с изменением выраженности воспалительной реакции (количество нейтрофилов: БВ+кандидоинфекция – 7623,1±215,13, НВВ+кандидоинфекция – 16148,4±164,96 клеток в мкл; количество макрофагов: БВ+кандидоинфекция – 1676,2±277,36, НВВ+кандидоинфекция – 2302,6±337,44 клеток в мкл) и снижением активности лизоцима (0,27±0,074 у.е. и 0,25±0,056 у.е. соответственно).
Смешанная аэробно-анаэробная инфекция сопровождалась значительными нарушениями системы локального иммунитета. Активный синтез провоспалительных цитокинов, сочетающийся с депрессией противовоспалительного звена (рис. 10), сопровождается снижением количества и поглотительной активности фагоцитов (количество нейтрофилов – 11801,2±1309,90 клеток в мкл., ФП – 22,0±4,84%, ФЧ – 0,3±0,06, ФИ – 1,2±0,44), уменьшением количества IgA, IgM по сравнению с НВВ. Отмечается выраженное снижение активности факторов неспецифической защиты (количество лизоцима – 0,22±0,041 у.е.).


Рис. 7. Содержание цитокинов Рис. 8. Содержание цитокинов
во влагалищном отделяемом во влагалищном отделяемом
при остром ВВК при хроническом ВВК
Проводимые исследования по изучению инфекционной патологии зачастую неоднозначны, т.е. рассматривают либо качественные и количественные характеристики микрофлоры, либо оценивают состояние макроорганизма, что не ведет к формированию целостной картины этиопатогенеза заболевания. Кроме того, при изучении взаимодействия макро- и микроорганизма, наряду с определением видовой принадлежности, необходимо особое внимание уделять степени патогенности возбудителя. В настоящее время уже недопустимо основывать диагностику генитальных инфекций на использовании только одного метода и только по результатам выявления какого-либо одного микроорганизма, который потенциально может быть причиной воспалительного процесса.


Рис. 9. Содержание цитокинов Рис. 10. Содержание цитокинов
во влагалищном отделяемом при во влагалищном отделяемом при
сочетании НВВ и кандидоинфекции сочетании БВ иНВВ
Нами была установлена связь между клинико-лабораторными особенностями изученных состояний и биологическими свойствами штаммов C. albicans, выделенных от разных пациенток. Наряду со сравнительным анализом морфологических и культуральных характеристик грибковых культур, особый интерес представляло определение их фосфолипазной активности (ФЛА), которая рассматривается как основной, коррелирующий с другими, фактор патогенности C. аlbicans. Отмечено, что в тех случаях, когда можно было предполагать участие C. аlbicans в инфекционном процессе в качестве моновозбудителя либо сочлена паразитоценоза, регистрировали достоверно значимое увеличение степени их вирулентности. Размеры клеток варьировали, но чаще были ниже средних величин. Коэффициент вирулентности, коррелирующий с уровнем фосфолипазной активности, колебался в пределах 0,3-0,9 и, как правило, превышал 0,5. Отмечена также зависимость от температурного фактора: скорость роста «вирулентных» вариантов при комнатной температуре значительно замедлялась, либо рост вообще отсутствовал, что типично для возбудителей инфекционно-воспалительнных заболеваний. В тех же случаях, когда кандиды обнаруживали у практически здоровых женщин либо в качестве "случайных", транзиторных компонентов на фоне неспецифического вагинита или бактериального вагиноза, коэффициент вирулентности выделенных штаммов был всегда ниже 0,3, прослеживалась тенденция к увеличению размеров клеток, при этом культуры одинаково хорошо росли и при комнатной температуре, и при 370С. Очевидно, что при уточнении диагноза, для дифференциации состояний, связанных с инфицированием C. аlbicans, и оценки их вклада в инфекционный процесс, наряду с традиционными клинико-лабораторными тестами, целесообразно изучение перечисленных свойств выделяемых микробных культур.
Полагаем, что применение такого подхода целесообразно и при других НИЗВ, поскольку это способствует расшифровке этиологической значимости изолируемых УПМ.
При возникновении и развитии патологических процессов во влагалище существенное значение имеет рН вагинального секрета, уровень которого может влиять и на состояние микрофлоры, и на фармакологические свойства применяемых препаратов. В норме рН влагалищной среды 3,8-4,2, что сдерживает рост и размножение "нежелательных" транзиторных видов микроорганизмов, регистрируемых в вагинальном биотопе. Нарушения в составе микрофлоры, связанные с избыточным ростом аэробных и факультативно анаэробных бактерий, проявляющиеся, как правило, клиникой неспецифического вагинита, сопровождаются изменением рН в щелочную сторону. Еще более выраженное защелачивание отмечается во влагалище при интенсивном размножении анаэробных бактерий, ассоциированных с БВ, что приводит не только к изменению свойств C. аlbicans, но и оказывает влияние на антимикотическое действие препаратов, как непосредственно (за счет изменения их фунгицидной активности), так и опосредованно (в силу изменения морфо-функционального состояния клеток возбудителя). Использование компьютерной микроскопии и морфометрии при изучении биологических характеристик ряда микробных культур способствует не только более объективному изучению свойств изолятов в динамике на фоне проводимого лечения, но и в определенной степени позволяет дифференцировать носительство УПМ от обусловленного ими инфекционного процесса. Такой подход обеспечивает повышение эффективности лабораторной диагностики и адекватность терапии оппортунистических инфекций.
Эффективность терапии, особенно при локальных инфекционных процессах, зависит не только от состояния макро- и микроорганизма, но и свойств лекарственного препарата. Изучение фармакокинетики антимикотических препаратов (итраконазол, флуконазол) с использованием высокоэффективной жидкостной хроматографии позволило оценить их возможный терапевтический эффект. Установленные фармакокинетические особенности, очевидно, связаны с тем, что флуконазол, как гидрофильный препарат, свободно проникает во влагалищный секрет, в то время как итраконазол, вследствие его липофильности, задерживается в тканях. Учитывая результаты исследования, можно ожидать высокой эффективности монотерапии флуконазолом, в то время как итраконазол, накапливаясь в тканях, препятствует инвазии грибков с поверхностных в более глубокие слои эпителия, но его фунгицидный эффект на «просветные» формы не может реализоваться, что требует дополнительного использования антимикотических препаратов местного действия.
Разработка способов изучения вагинальной жидкости при различных гинекологических заболеваниях представляет в настоящее время несомненную актуальность. Установление диагноза вагиноза или вагинита базируется на оценке анамнестических данных, анализе субъективных и объективных клинических признаков, результатов бактериоскопического и бактериологического исследования, что не позволяет оценить состояние ВЖ как индикатора изменений макроорганизма. Понятие «функциональная морфология» является новым в биологии и медицине. Функциональная морфология биологических жидкостей – научное направление, отличающееся принципиальной новизной по своим теоретическим основам и методике исследования. Достоинством данного направления является получение объективных и высоко значимых клинико-диагностических данных, позволяющих выявлять патологические отклонения на самых ранних этапах и контролировать изменения в динамике заболевания. Еще одним преимуществом является неинвазивность метода, так как травматизация на фоне воспаления может приводить к инвазии возбудителя в ткани, а также провоцировать восходящее инфицирование. Любые, как физиологические, так и патологические процессы, протекающие в живом организме, имеют в своей основе специфические белки и другие органические молекулы, которые при самоорганизации БЖ формируют «мозаичные» структуры макроуровня, доступные для визуального анализа (В.Н. Шаболин, С.Н. Шатохина, 2001; А.Ю. Аликина, 2006; С.Н. Разумова, 2007).
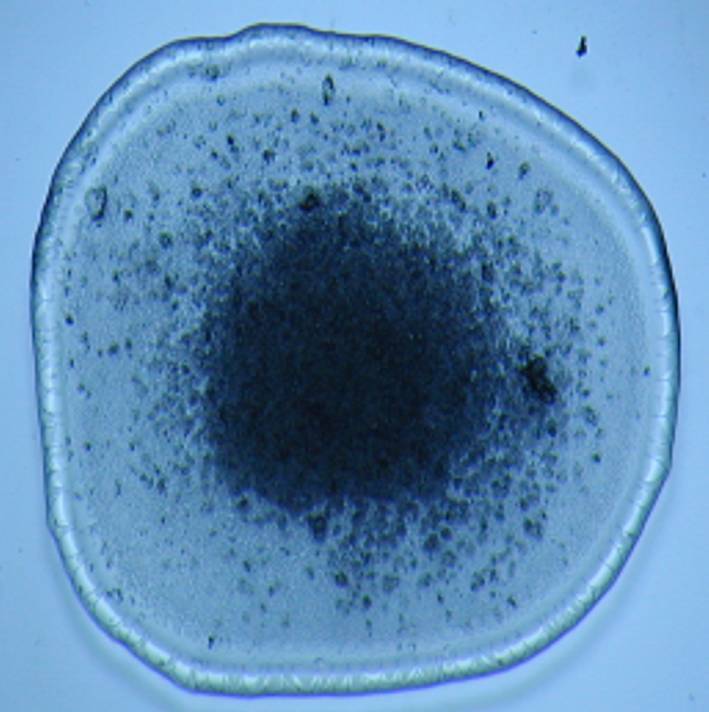


Периферическая зона
Центральная зона
Промежуточная зона
Рис. 11. Кристаллограмма влагалищной жидкости при нормоценозе у здоровой женщины
Изучение влагалищного содержимого является как фундаментальным, так и прикладным направлением в медицине. Это определяется рядом положений. Во-первых, ВЖ может быть рассмотрена как интегральная среда, по составу которой прямо или косвенно можно судить о состоянии всех отделов женской репродуктивной системы. Во-вторых, находящиеся во влагалище микроорганизмы в результате своей жизнедеятельности продуцируют ряд метаболитов, по содержанию которых можно судить о состоянии биоценоза и прогнозировать развитие и исход воспалительных заболеваний. В-третьих, по ряду некоторых биохимических и биофизических показателей возможно понимание закономерностей формирования патологических процессов (Е.Ф. Кира, 2001).
Исследование феноменов, происходящих при высушивании (драинге) ВЖ, позволило определить изменения кристаллографической картины, характерной для различных НИЗВ (рис. 11-14). В этой связи, кристаллографическое исследование, в том числе и ВЖ, может считаться одним из перспективных направлений современной лабораторной диагностики, т.к. обладает рядом преимуществ: является простым в исполнении, отличается высокой информативностью, позволяет документировать полученные результаты и проводить сравнительную оценку данных до и после лечения.
Применение кристаллографии в практике врача акушера-гинеколога в сочетании с клиническим и бактериоскопическими методами позволяет получать целостное представление о состоянии вагинальной экосистемы, проводить дифференциальную диагностику вагиноза и вагинита, отслеживать течение инфекционного процесса и эффективность его лечения.
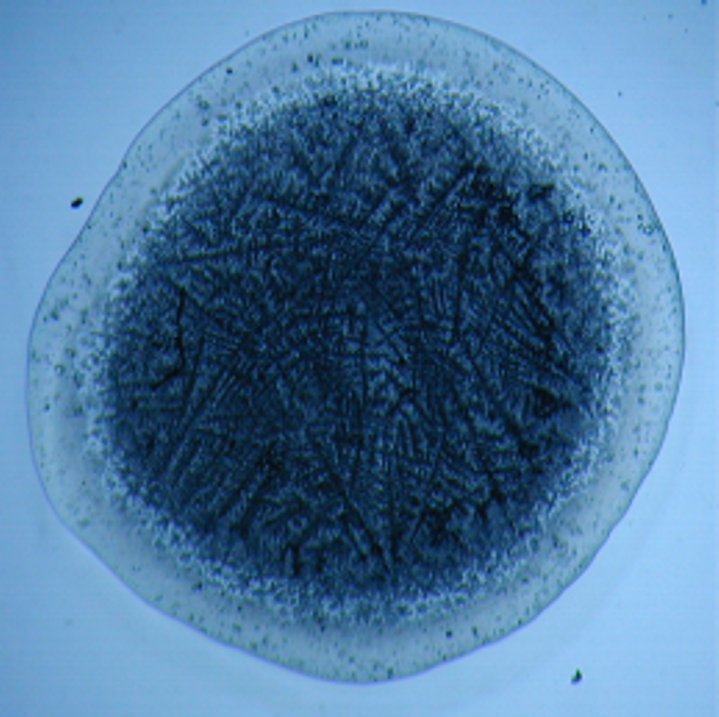
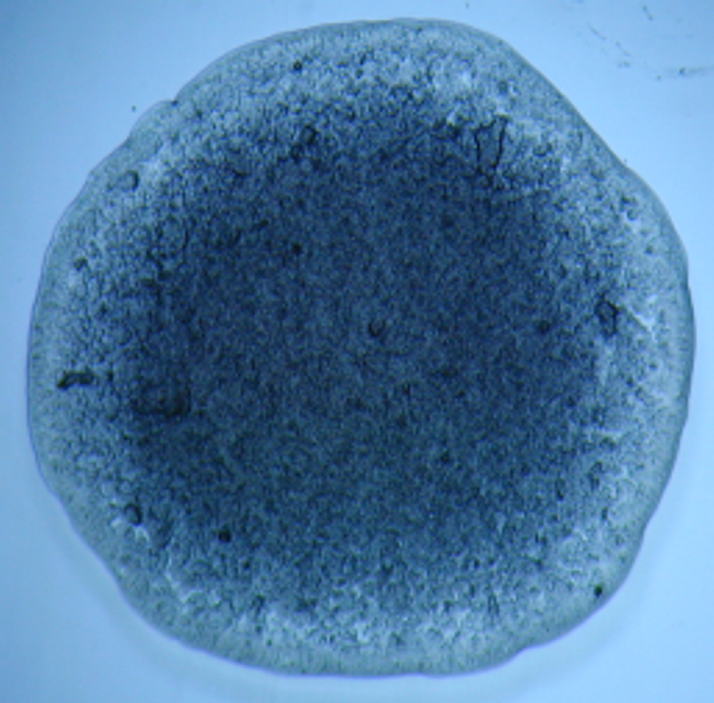
Рис. 12. Кристаллограмма влагалищной Рис. 13. Кристаллограмма влагалищной
жидкости при бактериальном вагинозе жидкости при неспецифическом
вульвовагините
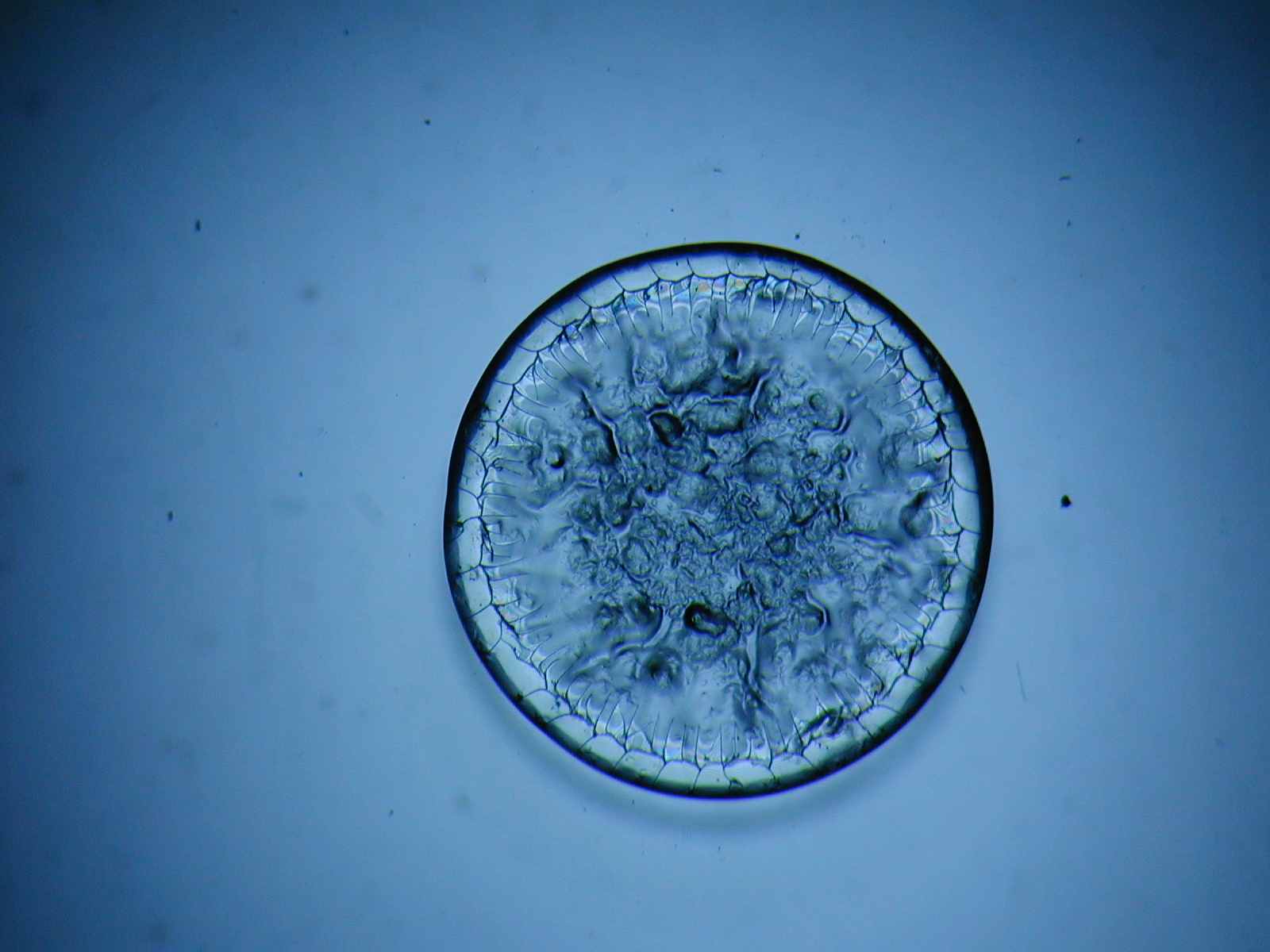
Рис. 14. Кристаллограмма влагалищной
жидкости при остром кандидозном вульвовагините
Таким образом, только комплексное разноплановое изучение процессов, происходящих при НИЗВ, позволяет сформировать интегральную картину, характеризующую различные аспекты этой проблемы, определить роль и место данной патологии в сохранении репродуктивного здоровья, выработать новые подходы к совершенствованию оказания акушерско-гинекологической помощи на амбулаторном этапе, повысить эффективность диагностического этапа, индивидуализировать схемы терапевтического лечения и разработать систему профилактических мер, обеспечивающих беспрепятственную реализацию репродуктивной функции.
