Саидов ёр умарович кардиоваскулярная патология при ревматоидном артрите 14. 01. 04 – внутренние болезни автореферат диссертации на соискание ученой степени доктора медицинских наук Душанбе 2010
| Вид материала | Автореферат диссертации |
- Автореферат диссертации на соискание ученой степени, 634.76kb.
- Автореферат диссертации на соискание ученой степени, 645.65kb.
- Автореферат диссертации на соискание ученой степени, 378.33kb.
- Автореферат диссертации на соискание ученой степени, 267.76kb.
- Автореферат диссертации на соискание учёной степени, 846.35kb.
- Автореферат диссертации на соискание ученой степени доктора медицинских наук, 637.8kb.
- Автореферат диссертации на соискание ученой степени, 678.39kb.
- Гнойно-септические заболевания послеродового периода: комплексная диагностика, лечение, 659.23kb.
- Генезис и самоорганизация полифункциональной системы и нравственного содержания сознания, 885.44kb.
- Автореферат диссертации на соискание ученой степени, 423.64kb.
Оценка функционального состояния, качество жизни и уровень тревожности у больных ревматоидным артритом
У пациентов с РА в основной группы функция суставов оценивалась при каждом обследовании больного, в первую очередь, с помощью определения ФК согласно новой классификации РА (Насонов Е.Л. и соавт., 2008). Установлено, что у обследованных пациентов наиболее часто встречаются ФК 11 и 111, которые были обнаружены соответственно у 49 и 40 больных основной группы.
С целью более точной оценки характера функциональных нарушений в повседневной жизни больных РА, мы применяли Станфордский индекс HAQ. Анкетирование пациентов проводилось дважды – первый раз при включении больного в исследование и второй раз при завершении работы, в основном, во время стационарного лечения. Всего анкеты заполнили 78 пациентов.
При оценке изменений индекса HAQ у пациентов с РА нами было установлено достоверное его повышение по сравнению с больными группы РРА (соответственно: 1,48±42 и 0,44±18; p<0,05). Анализ динамичного изменения индекса HAQ показал быстрое его повышение в первые 5 лет болезни.
Таким образом, при анализе функциональных нарушений и изменения индекса HAQ у больных РА, нами выявлена отчетливая тенденция к прогрессивному ухудшению изучаемых параметров, особенно в первые 5 лет болезни (Каратеев Д.Е., 2003).
В последние годы наблюдается возрастающий интерес к изучению КЖ больных РА В соответствии с новой концепцией клинической медицины КЖ пациента является либо главной, либо дополнительной, либо единственной целью при лечении пациента в инкурабельной стадии заболевания. В настоящее время снижение КЖ признано одним из важнейших показателей, характеризующих ущерб, нанесенный болезнью пациенту (Амирджанова В.Н., 2007).
У пациентов основной группы КЖ к моменту начала наблюдения, затем в период его завершения исследовалось с помощью опросника RAQoL, специально созданного для использования при РА.
Средний балл по шкале RAQoL у пациентов с РА составил 21,6±4,8 (от 4 до 30 баллов; p<0,01) из 30 возможных, что в целом соответствует данным литературы (Каратеев Д.Е., 2003).
Известно, что ФК пациентов РА увеличивается с 1 по 1У по мере усугубления нарушений жизнедеятельности.
Большинство пациентов относились ко II (33,7%) и III (46,6%) ФК, и 8,1% потеряли способность к самообслуживанию.
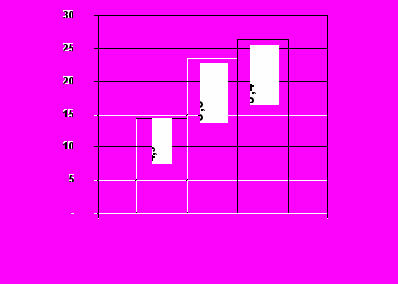
На рис.3 представлено распределение пациентов I- IV ФК по степени выраженности нарушения КЖ.

I II III IV I II III
Рис.3. Рапределение больных РА (n=86) Рис.4. Оценка КЖ пациентов (по шкале RAQoL)
с I – IV ФК по степени нарушения КЖ в зависимости от степени активности (I,II,III) РА
Как видно из рис.3, по мере нарастания степени ФК у пациентов РА достоверно (p<0,05) определяется прогрессивное ухудшение КЖ по шкале RAQoL.
Нами был проведен анализ показателей КЖ по шкале RAQoL в зависимости от степени активности РА. На рис.4 представлено распределение пациентов I–III степени активности РА и уровень нарушения КЖ.
Данные, представленные на рис.4 показывают, что у пациентов с РА, параллельно с нарастанием степени активности заболевания, наблюдается прогрессивное ухудшение КЖ. Следовательно, предположение о том, что КЖ больных РА ухудшается с увеличением активности заболевания, нашло подтверждение.
Среди обследованных пациентов снижение КЖ более чем в 1,5 раза установлено у женщин, чем у мужчин, что обусловлено в первую очередь повышением уровня тревожности.
Таким образом, у пациентов с РА существенный вклад в ухудшение КЖ вносят активность заболевания, степень выраженности функциональных нарушений, а также женский пол и уровень тревожности, что согласуется с наблюдениями других исследователей (Каратеев Д.Е., 2003; Балабанова Р.М. и соавт., 2005; Амирджанова В.Н., 2007, 2008).
Известно, что РА приводит не только к физическим страданиям вследствие хронической боли и нарушения функции суставов, но также существенно изменяет психологическое состояние пациентов. Психические нарушения у пациентов с РА, а также с другими хроническими ревматическими заболеваниями часто не распознают и поэтому их и не лечат. Наиболее частыми психическими нарушениями при РА считаются расстройства тревожно–депрессивного спектра (Бабак Г.А., 2005; Уланова Е.А.,2005).
С целью оценки уровня тревожности с помощью шкалы Тейлора, всего было протестировано 104 (81,5%) пациента от общего числа больных основной группы – 9 мужчин и 95 женщин, средний возраст которых составил 58,6±9,4 года, средняя продолжительность РА 9,2±5,4 (от 1,5 до 28) года.
У обследованных пациентов с РА, средний балл по шкале Тейлора в целом по группе (n=104) составил 28,2±7,6 (от 9 до 45 баллов), что соответствует высокому уровню тревожности. Следует отметить, что среднее значение по дополнительной шкале лжи было 5,2±1,4 балла из 10 возможных, что указывает на относительно невысокую степень демонстративности у большинства больных.
Суммарная оценка уровня тревожности по шкале Тейлора у пациентов РА представлена в табл.12.
Таблица 12
Суммарная оценка уровня тревожности по шкале Тейлора у пациентов РА
| Уровень тревожности по шкале Тейлора, баллы | Число больных n=104 | % |
| Низкий (0 -5) | - | - |
| Средний с тенденцией к низкому (5 – 15) | 14 | 10,5 |
| Средний с тенденцией к высокому (15 - 25) | 33 | 31,7 |
| Высокий (25 - 40) | 52 | 50,0 |
| Очень высокий (40 – 50) | 5 | 4,8 |
Представленные в табл.12 показывают, что у обследованных пациентов высокий (более 25 баллов по шкале Тейлора) и очень высокий (более 40 баллов) уровень тревожности имел место более чем у половины (54,2%) больных, средний с тенденцией к высокому уровень тревожности – у 31,7% больных. В тоже время, если средний с тенденцией к низкому уровню тревожности отмечался лишь у 10,5% больных, то лица с низким уровнем тревожности среди обследованных пациентов вовсе отсутствовали.
Таким образом, повышенная тревожность является практически постоянным спутником и характерной чертой больных РА, независимо от продолжительности и активности, а также других клинических особенностей заболевания (Каратеев Д.Е., 2003; Уланова Е.А., 2005; Лисицына Т.А. и соавт., 2009).
Продолжительность заболевания у больных РА, безусловно, оказывает существенное влияние на многочисленные клинические параметры, характеризующие РА, в том числе на уровень тревожности. В этой связи представляет несомненный интерес изучение характера изменения уровня тревожности в динамике у больных РА в зависимости от продолжительности заболевания. Полученные результаты показывает, что уровень тревожности наиболее быстрым темпом нарастает в первые два года заболевания, далее наблюдается некоторое его снижение и стабилизация. Вторая волна его повышения обычно наблюдается спустя 10 и более лет с момента начала РА.
Результаты данного исследования показывают, что тревожность при РА является достаточно распространенным сопутствующим состоянием, и повышение уровня тревожности по шкале Тейлора достоверно ассоциируется с давностью и степенью активности заболевания, а также с женским полом и присутствием АГ и других КВП у пациентов данной категории.
Таким образом, высокая частота встречаемости тревожности у пациентов, особенно при коморбидности РА с АГ и КВП, требует своевременной диагностики и указывает на необходимость проведения соответствующей психофармакотерапии. Пациенты данной категории, безусловно, составляют группу очень высокого риска развития серьезных кардиоваскулярных осложнений, что создает условия для поиска интегративных мер диагностики, терапии и профилактики.
Обобщая результаты собственного исследования нами, были выявлены основные факторы, способствующие кардиоваскулярным нарушениям при РА (рис.5)

Вопросы лечения кардиоваскулярной патологии при ревматоидном артрите и подходы к интенсификации терапии
С целью изучения и оценки влияния эналаприла на АД и другие гемодинамические показателели, а также на состояние свертывающей системы крови, липидного обмена и МЦ кровотока, 59 больным РА проводилось обследование до и через 6 и 12 месяцев после лечения.
Все пациенты (59) в зависимости от наличия или отсутствия АГ были разделены на две рандомизированные по полу, возрасту и основным клиническим показателям группы. В I группу вошли 31 пациентов РА без сопутствующей АГ, которые принимали симптоматическое и базисное лечение без эналаприла., во II-28 больных РА с АГ, получавших эналаприл на фоне базисного лечения и приема симптоматических противовоспалительных препаратов (НПВП).
В процессе исследования всем пациентам I и II группы до и после лечения проведена клинико-инструментальная оценка состояния КВС и определены морфофункциональные особенности левых отделов сердц.
В процессе наблюдения и лечения у всех обследованных лиц, помимо оценки состояния КВС до и через 6 и 12 мес от начала терапии, оценивался клинико-лабораторный эффект лечения; при отсутствии положительного ответа производилась коррекция терапии (увеличение дозы). До начала и через 12 мес после терапии у всех пациентов I и II групп проводилась сравнительная оценка характера изменений показателей свертывающей системы крови, липидного обмена, МЦ кровотока, функционального состояния больных, КЖ и уровня тревожности на фоне длительного приема МТ в сочетании с НПВП, ГК и эналаприлом.
В группе РА с АГ у всех пациентов АД измерялось 6 раз в сутки с равными промежутками в первую и последнюю неделю приема НПВП, а остальное время АД регистрировалось 4 раза в сутки, каждые 4 ч с момента пробуждения больного. Вычислялись средние величины АД.
У обследованных больных каждые 6 мес оценивалось влияние терапии на проявления рентгенологического прогрессирования, выраженность и характер системных проявлений РА, уровень клинико–лабораторных и иммунологических параметров активности заболевания (ВАШ, СОЭ, СРБ, РФ, иммуноглобулины, ИТ, индекс DAS28).
Общая эффективность терапии у пациентов с РА I и II групп на этапах исследования оценивалась в соответствии с критериями АКР (1995).
В нашем исследовании лечение больных РА проводилось по одинаковым принципам. На момент первичного обследования всем пациентам назначались С-НПВП (целебрекс, нимесулид) в терапевтических дозах (все пациенты I и II группы до госпитализации в нашей клинике получали в основном Н-НПВП, чаще всего – диклофенак и индометацин), при наличии показаний проводились внутрисуставные введения ГК, как правило, в один сустав. После всестороннего анализа и оценки суставного синдрома, характера системных проявлений РА с учетом соответствующих показаний и противопоказанияй больным назначались БПВП (в основном МТ).
Системно ГК (преднизолон 5 – 7,5 мг/сут в качестве «бридж терапии» или метипред в аналогичной дозе) назначались тем пациентам, которые до этого данные препараты не принимали. Однако количество таких пациентов было небольшое – всего 18 (8 и 10 соответственно в I и II группах). Подавляющее большинство больных – 23 (74,2%) в I группы и 18 (64,3%) во II группе поступали в клинику с уже назначенными на амбулаторном этапе ГК.
В отдельных случаях, при наличии признаков генерализованного васкулита (фебрильная лихорадка, массивное похудание, нарастание признаков дигитального васкулита), некоторым пациентам (всего 8) в первые 3 месяца терапии суточная доза ГК нами увеличивалась до 10-20 мг/сут. В дальнейшем у всех пациентов в зависимости от ответа к терапии производилась соответствующая коррекция суточной дозы ГК, вплоть до их отмены.
Всем пациентам с РА I и II групп был назначен МТ перорально в первоначальной дозе 7,5 мг/нед (по 2,5 мг с интервалом в 12 ч). Спустя 4 нед при нормальной переносимости препарата и наличии соответствующих показаний, некоторым больным дозу метотрексата увеличивали на 2,5 мг в нед до 15 мг/нед, и в итоге 15, 26, 12 и 6 пациентов получали соответственно 7,5, 10, 12,5 и 15 мг/нед метотрексата в течение 12 мес. Параллельно с началом приема МТ и преднизолона всем обследованным больным осуществлена смена Н-НПВП на селективные НПВП (апонил или целебрекс). В дни, свободные от приёма МТ, пациенты принимали фолиевую кислоту в дозе 5 мг/нед.
Больным РА с АГ на фоне симптоматического (С-НПВП) и базисного (МТ) лечения дополнительно назначался эналаприл в индивидуально подобранной дозе от 5 до 20 мг/сут в зависимости от суточного АД-контроля (до достижения целевого уровня АД < 140/90 мм рт. ст.). В итоге 14, 9 и 5 пациентов получали соответственно 5, 10 и 15 мг/сут эналаприл в течение 12 мес.
У обследованных больных I и II групп оценка эффективности терапии в зависимости от характера изменений основных клинико-лабораторных показателей активности РА первоначально проводилась спустя 3 мес, затем через 6 и 12 мес от начала терапии (табл. 13 ).
На фоне проводимой терапии через 3 мес от её начала у пациентов с РА I и II групп все клинические проявления суставного синдрома и лабораторные показатели активности воспалительного процесса у подавляющего большинства больных (57,6%) претерпели положительную динамику и большинство из них достоверно отличались от исходных данных (табл.13, рис.6, 7). При этом положительные сдвиги клинико-лабораторных показателей активности РА у пациентов I и II группы (n=59) носили строго однонаправленный характер (рис.5).
 У обследованных пациентов с РА I и II групп первым лабораторным тестом, который претерпел достоверное снижение по отношению к исходным данным являлся уровень СРБ. Через 12 мес терапии МТ у значительной части пациентов (34%) уровень СРБ (рис.6) соответствовал данным контроля. Если учесть тесную корреляцию между клиническими и лабораторными проявлениями активности РА и СРБ у обследованных пациентов, то роль данного теста как в оценке степени активности заболевания, так и для мониторирования и оценки эффективности терапии приобретает особую значимость.
У обследованных пациентов с РА I и II групп первым лабораторным тестом, который претерпел достоверное снижение по отношению к исходным данным являлся уровень СРБ. Через 12 мес терапии МТ у значительной части пациентов (34%) уровень СРБ (рис.6) соответствовал данным контроля. Если учесть тесную корреляцию между клиническими и лабораторными проявлениями активности РА и СРБ у обследованных пациентов, то роль данного теста как в оценке степени активности заболевания, так и для мониторирования и оценки эффективности терапии приобретает особую значимость.Рис.6. Уровень СРБ у больных РА (n=59) до и через 12 мес лечения МТ
Таблица 13
Динамика клинических и лабораторных показателей активности воспаления у больных РА I и II группы (n=59) через 6 и 12 мес лечения метотрексатом
| Показатель | Исходно | Через 3 мес | Через 6 мес | Через 12 мес |
| ВАШ (0–100 мм) | 75,4 ± 5,8 | 45,6 ± 3,6*** | 34,2 ± 2,4*** | 15,6 ± 1,4*** |
| УС, мин. | 152,7 ± 8,6 | 90,4 ± 7,6*** | 60,2 ± 5,4*** | 30,4 ± 2,5*** |
| Индекс Ричи, б. | 18,6 ± 1,6 | 10,4 ± 0,8*** | 8, 2 ± 0,6*** | 8,0 ± 0,4*** |
| ЧБС | 16,4 ± 1,3 | 8,2 ± 1,4*** | 6,4 ± 0,3*** | 4,2 ± 0,2*** |
| ЧВС | 12,6 ± 1,4 | 6,4 ± 0,4*** | 4,2 ± 0,4*** | 3,4 ± 0,8*** |
| СОЭ, мм/час | 45,5 ± 3,2 | 34,5 ± 2,6* | 30,2 ± 2,4*** | 24,8 ± 1,6*** |
| СРБ, мг/л | 24,5 ± 1,6 | 8,2 ± 1,4*** | 6,0 ± 0,4*** | 4,6 ± 0,02*** |
| Серомукоид, ед. | 0,54 ± 0,03 | 0,42 ± 0,04* | 0,28 ± 0,03*** | 0,22 ± 0,04*** |
Примечание: **-р<0,01; ***-р<0,001 достоверность различий по сравнению с исходными данными:)
У наших пациентов быстрое снижение концентрации СРБ на самых ранних этапах терапии, как показали дальнейшие наблюдения, часто ассоциировалось с хорошим эффектом лечения и развитием ремиссии у больных.
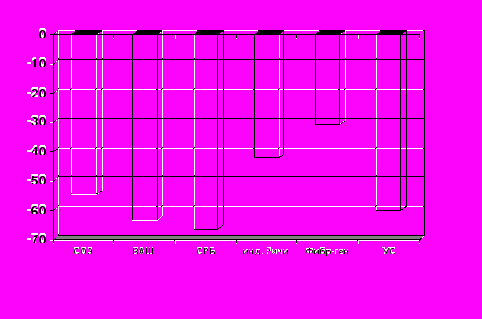
Рис.7. Процент снижения основных клинико-лабораторных показателей активности через 12 мес лечения МТ у больных РА (n=59)
Через 3 мес от начала лечения, на фоне достигнутой положительной динамикои основных клинико-лабораторных показателей активности заболевания, а также устойчивая тенденция системных проявлений РА к обратному развитию у всех пациентов (n=18), которым ГК были назначены впервые в качестве «бридж терапии», удалось прекратить их прием. Пациентам (n=41), которым ГК назначались на амбулаторном этапе (до первой госпитализации), в дальнейшем на фоне базисной терапии МТ у большинства из них – 28 (47,5%) удалось уменьшить суточную дозу препарата (минимально до ½ таблетки) или вовсе отменить прием ГК -13 (22,1%).
В первые 6 мес. терапии также удалось у части пациентов – 14 (23,7%) отменить прием НПВП, а остальные продолжали прием этих препаратов в поддерживающей дозе или периодически по потребности, что, безусловно, является важным лечебным эффектом при коморбидности РА с КВП.
Из НПВП пациенты принимали целебрекс (30,5%) и нимесулид (69,5%) в рекомендуемых терапевтических дозах. Оба препарата показали хорошую эффективности и переносимости, даже у пациентов с многочисленными ФР сердечно-сосудистой патологии. Кроме того, эти препараты хорошо сочетались как с приемом МТ, так и эналаприлом. В группе больных РА с АГ уровень АД за период наблюдения практически оставался стабильным и очень редко требовал коррекции проводимой терапии.
Большинство пациентов хорошо переносили целебрекс и нимесулид, серьезных побочных эффектов нами не было отмечено, лишь были отмечены у 8 (13,6%) больных нежелательные реакции, но они были выражены незначительно и не потребовали отмены препаратов.
Начиная с 3 мес. терапии у большинства (57,6 %) обследованных пациентов I и II групп наблюдалась дальнейшая положительная динамика изучаемых клинико-лабораторных показателей активности РА. Как видно из табл. 13, рис.6 и 7 после 12 мес терапии нами было выявлено достоверное (p<0,001) снижение основных клинико-лабораторных показателей активности РА. Однако средние значения СОЭ и серомукоида к концу наблюдения оставались повышенными и заметно превышали данные контроля.
Наряду с положительными сдвигами основных показателей активности РА, у большинства пациентов I и II группы нами было верифицирована устойчивая тенденция внесуставных проявлений РА к обратному развитию. В целом, системные проявления заболевания у пациентов РА I и II групп были многочисленными и в основном они ассоциировались с активностью и давностью РА. Среди системных проявлений РА, так называемые, общие симптомы, связанные с активностью заболевания – лихорадка, слабость, потеря аппетита, похудание и лимфоаденопатия, легко подавались противовоспалительной терапии и к окончанию срока наблюдения они практически были ликвидированы. Другие системные проявления болезни, носивших более специфических и часто органический характер – серозиты, РУ, дигитальный артериит, аутоиммунная анемия, кордит, кожный васкулит, сохраняли положительную динамику.
В целом, через 12 мес. терапии у значительной части пациентов I группы – 12 (38,7%) и II группы – 14 (50%), по результатам комплексного анализа и оценки показателей активности РА в соответствии с критериями АКР, нами было зафиксировано состояние клинической ремиссии. Данные рис.8 показывают, что если состояние клинической ремиссии у больных РРА и РА на фоне терапии МТ было верифицировано соответственно – у 70,4 и 38 % обследованных лиц, то в подгруппе пациентов с РА, не получивших МТ, состояние клинической ремиссии выявлялась в единичных случаях.
На данном этапе лечения хороший эффект терапии, по мнению врача имел место у 14 (23,8%) обследованных больных РА I и II групп в целом (n=59), удовлетворительный – у 30 (52,4%) пациентов и отсутствие эффекта – у 6 (11,5%) больных.
При оценке пациента хороший, удовлетворительный и отсутствие эффекта отмечалось соответственно в 23 (40,6%), 31 (54,2%) и 7 (13,8%) случаях.
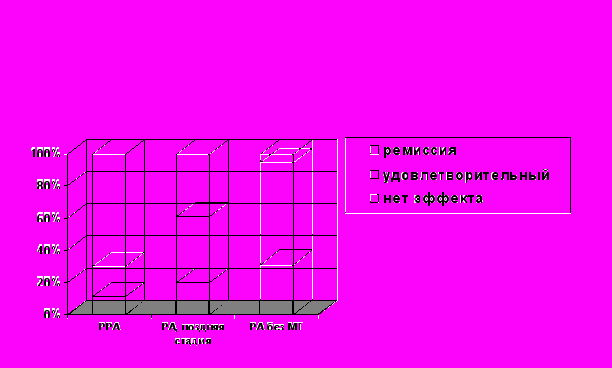
Рис.8. Число ремиссии (%) у больных ранним и поздним РА через 12 мес лечения МТ по сравнению с пациентами не получивших МТ
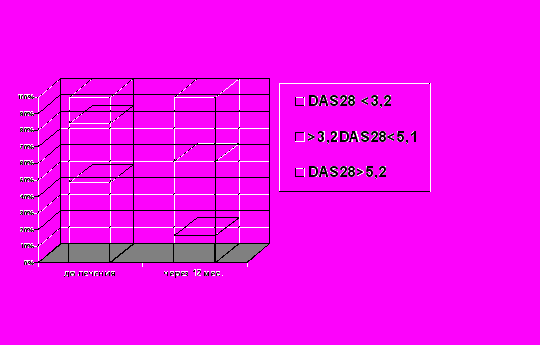
Индекс DAS28 у обследованных больных после курса терапии снизился с исходного уровня 7,2±0,6 до 3,6±0,2 (p<0,01) у пациентов I группы и с 7,6±0,8 до 3,4±0,3 (p<0,01) у больных II группы и к этому сроку наблюдения индекс DAS28 у значительной части пациенов I и II группы (n=59) находился в дапазоне <3,2 (рис.9).
 Переносимость МТ у большинства больных (91,5%) была удовлетворительной. У 5 больных препарат был отменен на самых ранних этапах лечения из-за стойких побочных реакций со стороны желудочно-кишечного такта, в связи с чем эти пациенты были исключены из дальнейшего наблюдения. Доза МТ была уменьшена только в 4-х случаях.
Переносимость МТ у большинства больных (91,5%) была удовлетворительной. У 5 больных препарат был отменен на самых ранних этапах лечения из-за стойких побочных реакций со стороны желудочно-кишечного такта, в связи с чем эти пациенты были исключены из дальнейшего наблюдения. Доза МТ была уменьшена только в 4-х случаях. Рис.9 Количество больных с различными значениями активности РА по индексу DAS28 до и через 12 мес лечения МТ
На фоне длительного приема эналаприла (12 мес) общее состояние и самочувствие больных II группы прогрессивно улучшалось при хорошей переносимости препарата. Продолжительный прием эналаприла практически привел к ликвидации таких субъективных симптомов КВП, как одышка, сердцебиение и боли в загрудинной области по типу стенокардии, положительная динамика которых у пациентов в 1 группы имела не ярко выраженный характер. К концу курса терапии у всех пациентов РА с АГ нормализовалось АД.
С целью изучения влияния эналаприла на морфо-функциональные параметры левых отделов сердца и показатели внутрисердечной и центральной гемодинамики всем пациентам I и II групп проводилась ЭхоКГ. По результатам ЭКГ и ЭхоКГ- оценки состояния КВС патология сердца обнаружена у 14 (45,2%) больных I и у 24 (85,7%) – II группы.
Проведенные исследования показали, что в конце наблюдения у пациентов в I группы такие морфо-функциональные параметры ЛЖ, как КДР, КДО, КСО хотя на фоне активной противовоспалительной терапии приобрели положительную тенденцию, однако достоверно не отличались от контроля (p>0,05). У данной группы больных показатели центральной и внутрисердечной гемодинамики (УО, МОК, ФВ) к концу курса терапии также существенно не изменились. Индекс ММЛЖ у пациентов I группы имел тенденцию к снижению, и на этом фоне наблюдалось некоторое улучшение показателей диастолической функции ЛЖ (склонность к увеличению соотношения Ve/Va mitr; p>0,05).
Толщина МЖП и ЗСЛЖ в диастоле у пациентов I группы в конце наблюдения также имела тенденцию к снижению, но эти сдвиги не были достоверными (p>0,05). Полученные нами результаты позволяют предположить об определенном вкладе противоспалительной терапии в положительные сдвиги морфо-функиональных параметров ЛЖ
Полученные результаты показывают, что у пациентов с РА II группы через 12 мес комбинированной терапии МТ и эналаприлом, также как у пациентов 1 группы, несмотря на наличие положительных сдвигов, существенного изменения размеров (КДР, КСР) и объемов (КСО, КДО) ЛЖ не было выявлено. В то же время у пациентов II группы через 12 мес лечения достоверно уменьшились толщина МЖП и ЗСЛЖ в диастолу (p<0,05). Индекс ММЛЖ также имел устойчивую тенденцию к снижению (p>0,05). Одновременно со снижением степени гипертрофии ЛЖ, у пациентов II группы наблюдалось и улучшение его диастолической функции, что проявилось в появлении тенденции к увеличению соотношения Ve/Va mitr (p>0,05) и снижению IVRT (p<0,05). У пациентов с РА II группы существенных различий по показателям, характеризующим состояние центральной и внутрисердечной гемодинамики (УО, МОК, ФВ), не было обнаружен.
Таким образом, проведение исследования показывают, что комбинированное лечение эналаприлом и МТ в течение 12 мес практически способствует ликвидации большинства субъективных симптомов КВП у больных РА, нормализует АД, снижает выраженность ГЛЖ и улучшает его диастолическую функцию.
У пациентов с РА I и II групп изучалось влияние терапии МТ и эналаприлом на состояние свертывающей системы крови, липидного обмена и МЦ кровотока.
Полученные в этом плане результаты показывают, что до начала терапии МТ и эналаприлом выявленные сдвиги со стороны показателей свертывающей системы крови у пациентов I и II групп свидетельствуют о развитии гиперкоагуляции у пациентов данной категории. На фоне терапии через 12 мес было выявлена положительная тенденция изучаемых параметров в сторону снижения степени гиперкоагуляции. Однако эти сдвиги, за исключением уровня фибриногена (p<0,05) достоверностью не отличались и преимущественно наблюдались у пациентов II группы.
У этих же пациентов (I и II группы) произведена оценка влияния терапии на состояние липидного обмена крови. В I группе отмечена тенденция к снижению концентрации ОХС и ТГ в сыворотке крови, однако эти сдвиги так же были недостоверными (p>0,05). У пациентов же II группы аналогичные сдвиги показателей липидного обмена были выражены больше и снижение уровня ОХС достоверно (p<0,05) отличилось от контроля.
Таким образом, при изучении динамики показателей липидного спектра крови на фоне терапии МТ и эналаприлом к моменту завершения наблюдения, тенденция к значительному улучшению изучаемых параметров сохранялась в обеих группах, и к этому сроку исследования лишь снижение концентрации ОХС у пациентов II группы было достоверно меньше, чем в контроле.
При изучении влияния терапии на показатели МЦ кровотока у пациентов РА I и II группы по данным биомикроскопии сосудов бульбарной конъюнктивы выявлено благоприятное влияние терапии на микроциркуляцию. У пациентов I группы через 12 мес лечения произошло недостоверное снижение СКИ и ОКИ (р >0,05). В группе больных РА с АГ, получавших МТ и эналаприл в течение 12 мес, установлено достоверное снижение СКИ (p<0,05) и ОКИ ( p < 0,05).
Схематично обоснование целесообразности применения эналаприла у больных РА, на основании полученных нами результатов и данных литературы представлено на рис.10, где показан характер влияния препарата на основные гемодинамические нарушения, а также механизмы его терапевтического действия.
Применение метотрексата с быстрой эскалацией дозы препарата до 15-20 мг/нед в сочетании с низкими дозами (< 10 мг/сут) преднизолона (в качестве «бридж-терапии») у пациентов с ранним ревматоидным артритом в диапазоне «окно возможности», по сравнению с больными с поздними стадиями заболевания, эффективно контролирует течение болезни. При этом препарат демонстрирует яркий противовоспалительный и иммуномоделирующий эффект, и у подавляющего большинства больных (70,4% против 38,2%) индуцирует состояние клинической ремиссии в соответствии с критериями АКР (1995г.). Полученные результаты позволяют предположить, что своевременное назначение метотрексата в адекватной дозе, вероятно, способствует улучшению отдаленного прогноза заболевания, являясь как бы своего рода профилактической мерой в отношении риска развития сердечно-сосудистих событий, связанных с атеросклерозом.
Комбинированное применение эналаприла и метотрексата у пациентов с ревматоидным артритом с субклиническими и клиническими проявлениями кардиоваскулярной патологии, наряду с противовоспалительным эффектом, приводит к нормализации АД, вызывает
 регрессию гипертрофии левого желудочка, улучшает его диастолическую функцию, положительно влияет на гемокоагуляционные показатели, состояние микроциркуляции и липидного обмена крови. Полученные результаты позволяют включить ревматоидный артрит с характерной для него полисиндромностью в число показаний для назначения ИАПФ, в частности, эналаприла.
регрессию гипертрофии левого желудочка, улучшает его диастолическую функцию, положительно влияет на гемокоагуляционные показатели, состояние микроциркуляции и липидного обмена крови. Полученные результаты позволяют включить ревматоидный артрит с характерной для него полисиндромностью в число показаний для назначения ИАПФ, в частности, эналаприла.