Саидов ёр умарович кардиоваскулярная патология при ревматоидном артрите 14. 01. 04 – внутренние болезни автореферат диссертации на соискание ученой степени доктора медицинских наук Душанбе 2010
| Вид материала | Автореферат диссертации |
| Результаты собственных исследований и их обсуждение Киническое значение факторов риска и С-реактивного белка в раннем развитии атеросклероза у больных ревматоидным артритом |
- Автореферат диссертации на соискание ученой степени, 634.76kb.
- Автореферат диссертации на соискание ученой степени, 645.65kb.
- Автореферат диссертации на соискание ученой степени, 378.33kb.
- Автореферат диссертации на соискание ученой степени, 267.76kb.
- Автореферат диссертации на соискание учёной степени, 846.35kb.
- Автореферат диссертации на соискание ученой степени доктора медицинских наук, 637.8kb.
- Автореферат диссертации на соискание ученой степени, 678.39kb.
- Гнойно-септические заболевания послеродового периода: комплексная диагностика, лечение, 659.23kb.
- Генезис и самоорганизация полифункциональной системы и нравственного содержания сознания, 885.44kb.
- Автореферат диссертации на соискание ученой степени, 423.64kb.
РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
Клинико-электрокардиографические изменения и оценка морфо-функциональных особенностей левых отделов сердца у больных ревматоидным артритом
При клиническом исследовании состояния КВС у пациентов с РА в основной группе обращала на себя внимание скудность субъективной симптоматики, и подавляющее большинство обследованных больных (86,6%) активно не предъявляли жалоб, свидетельствующих о поражении КВС. Однако при целенаправленном расспросе и объективном исследовании у значительной части больных (у 32,4%), были выявлены те или иные симптомы, указывающие на наличие КВП у пациентов с РА.
В целом у обследованных пациентов наиболее частыми клиническими симптомами свидетельствующие о возможности КВП у больных РА были типичные загрудинные боли по типу стенокардии (у 13,4%), сердцебиение и одышка при физической нагрузке (у 31,6%), ослабление тонов сердца (у 34,5%) и систолический шум на верхушечной области сердца (у 41,2%).
Результаты исследования прежде всего показывают скудность и малочисленность субъективной симптоматики поражения КВС при РА, что согласуется с данными других исследователей (Козлова Л.К., 2003; Гавва Т.Н., 2006). По всей вероятности, тяжелое прогрессирующее поражение суставов (с постоянным болевым синдромом) и других внутренних органов, с одной стороны, а с другой, - активная и практически постоянная противовоспалительная терапия, включающая весь арсенал современных НПВП, ГК, нередко и центральных анальгетиков, в определенной степени могут маскировать клинические симптомы поражения КВС у пациентов с РА, о чем сообщают и другие исследователи (Якушева В.А., 2006). На наш взгляд, другим немаловажным моментом в гиподиагностики клинических симптомов КВП у пациентов с РА является недостаточное внимание к необходимости поиска этих симптомов, как со стороны врачей, так и самых больных, что было отмечено ранее и другими авторами (Насонов Е.Л. и соавт, 2008; Новикова Д.С. и соавт, 2009).
Известно, что при АГ риск развития кардиоваскулярных осложнений (КВО) напрямую связан с уровнем АД, повышение которого является одним из важнейших симптомом КВП (Ивлева А.Я., 2007; Беленков Ю.Н. и соавт., 2007).
Результаты настоящего исследования показывают, что, наряду с другими кардиоваскулярными проявлениями, повышение АД является довольно распространенным симптомом у больных РА. В целом, АГ к началу нашего наблюдения имела место у 43,7% пациентов основной группы. Группа больных РА с АГ объединяла в себя 52 пациентов, преимущественно женщин (88,5%), страдающих высокоактивным серопозитивным РА (причем у большинства из них – 59,6% имели место высокие титры РФ), у которых АГ присоединилась спустя 2,5 – 3 года, и средняя продолжительность АГ у обследованных составляла 5,2±1,6 лет. Наиболее отличительными особенностями пациентов данной категории являлись: большая длительность РА (>10 лет), наличие многочисленных системных проявлений болезни, высокие значения индекс тяжести РА (>10), концентрации СРБ (p<0,001), уровень тревожности по шкале Тейлора (p<0,001), наличие ярко выраженной гиперкоагуляции с ухудшением МЦ кровотока по данным конъюнктивальной биомикроскопии, постоянный и бесконтрольный прием НПВП и ГК (в 65,4% случаев в больших кумулятивных дозах).
Понимание роли воспаления в патогенезе и дестабилизации АГ (Дмитриев В.А. и соавт., 2006; Шилкина Н.П., и соавт., 2009), с одной стороны, а с другой, - значительное продление жизни пациентов с РА в связи с разработкой современных и высокоэффективных БПВП (Насонов Е.Л. и соавт., 2008-2009) и прогипертензивный эффект большинства антиревматических препаратов, прежде всего НПВП и ГК (МареевВ.Ю. 2003; Насонов Е.Л. и соавт., 2006, 2008), еще больше актуализируют проблему коморбидности РА и АГ.
Таким образом, тесная ассоциация АГ с активностью (СРБ, DAS28) и системными проявлениями РА, его продолжительностью, уровнями индекса тяжести заболевания, титром РФ и приемом антиревматических препаратов позволяет нам предположить, что формирование АГ у данного контингента больных в определенной степени взаимосвязанно с особенностями иммунопатологических нарушений, характерных для РА, и отчасти со способами его терапии, о чем сообщают и другие авторы (Саморядова О.С. и соавт., 1994, Зверева К.В., 1997; Шилкина Н.П. и соавт., 2009).
В то же время не вызывает сомнения, что АГ в свою очередь вносит существенный вклад в формирование большинства КВО у пациентов с РА.
У пациентов в основной группе ЭКГ в различных вариациях были обнаружены у 66 больных (55,4%), носили многочисленный и разнонаправленный характер, и, в основном, были представлены признаками гипертрофии левого желудочка (ГЛЖ – 47,3%), желудочковые (15,9%) и предсердные (10,9%) экстрасистолии, нарушение внутрижелудочковой проводимости (преимущественно по правой ножки пучка Гиса) (28,6%), безболевые ишемии миокарда (БИМ – 31,9%), диффузное снижение процессов реполяризации (43,7%). Признаки нарушения коронарной гемодинамики, мерцательная аритмия и суправентрикулярные пароксизмальные тахикардии являлись редкими ЭКГ находками и были выявлены соответственно у 12,6%, 3,4% и 4,2% пациентов основной группы.
Смещение сегмента SТ ишемического характера (при отсутствием болевых ощущением в области сердца), как правило, было зарегистрировано в период обострения суставного синдрома при проведении проб с физической нагрузкой (велоэргометрии) у 31,9% пациентов. Подобные изменения на ЭКГ у больных РА можно трактовать как эпизоды БИМ, которые, в основном, наблюдались у пациентов с тяжелыми высокоактивными формами РА с многочисленными системными проявлениями и длительным анамнезом. В подгруппе больных РА с БИМ среднее содержание СРБ в 1,5 раза превышала этот показатель у пациентов с РА без БИМ, что может свидетельствовать определенном вкладе системного воспаления в развитие ишемии миокарда у данной категории больных (Стрюк Р.И. и соавт., 2009).
У 5 (4,2%) больных РА в основной группе в процессе наблюдения, по результатам динамического ЭКГ исследования и консультации кардиологов, был установлен диагноз интрамуральный ИМ. Помимо этого, у 10 пациентов на основе динамического изучения были выявлены очаговые изменения, идентичные таковым, как при постинфарктном кардиосклерозе.
Анализ клинико-инструментальной характеристики больных РА, результаты лабораторного исследования, а также особенности течения ИМ позволили нам определить общие черты пациентов данной подгруппы: поздняя диагностика РА, высокая активность заболевания с многочисленными системными проявлениями, присутствие основных ФР атеросклероза, ярко выраженные гиперкоагуляционные сдвиги в крови, высокий уровень тревожности, гормонозависимость (без приема БПВП), систематический прием НПВП, безболевое течение ИБС и его хронологическая связь с суставным синдромом.
Полученные нами результаты о возможности развития ИМ и особенности его течения у больных РА с высокоактивными и тяжелыми формами заболевания совпадают с данными других исследователей (Махныр Е.Ф., 2005).
В целом, выяснение истинных причин ЭКГ изменений с учетом их многофакторности у пациентов с РА является непростой задачей и представляет большие трудности. По всей вероятности, в генезе большинства ЭКГ изменений у пациентов с РА, помимо текущего воспалительного процесса в миокарде, определенную роль играют и другие патологические факторы, которые часто сопутствуют РА. К таким факторам можно отнести: ГЛЖ, аутоиммунную анемию, ТДР и АГ (Леонова Е.А., 2006).
Помимо этого, при выяснении причин ЭКГ изменений у больных РА мы ориентировались на наличие хронологической взаимосвязи их появления с развитием и динамикой суставного синдрома, обратным развитием данных изменений (а также других системных проявлений заболевания) под влиянием активной противовоспалительной терапии и исключением других заболеваний, сопровождающихся поражением КВС. Результаты настоящего исследования показали, что на фоне активной противовоспалительной терапии с применением БПВП (метотрексат) подавляющее большинства ЭКГ изменений, так и других висцеропатий у больных РА получили устойчивую тенденцию к обратному развитию. На наш взгляд, в процессе изучения генеза ЭКГ изменений у пациентов с РА синхронность течения данных изменений и суставного синдрома на фоне адекватной противовоспалительной терапии является весьма важным аргументом (Munro R. et al., 1997; Стрюк Р.И. и соавт., 2009).
Наши исследования свидетельствуют, что наиболее частыми ЭхоКГ изменениями, характеризующими морфо-функциональные особенности левых отделов сердца у пациентов с РА, являлись: ГЛЖ, ДДЛЖ, эндокардит и адгезивный перикардит, которые были выявлены соответственно: у 44 (36,9%), 35 (29,4%), 18 (15,1%) и 19 (15,9%) пациентов от общего числа обследованных больных основной группы. Аналогичные результаты при оценке морфо-функциональных особенностей ЛЖ у больных РА получали и другие исследователи (Махныр Е.Ф., 2005; Колотова Г.Б. и соавт., 2007; Мясоедов Е.Е. и соавт., 2007). Проведенные исследования показали определенную взаимосвязь между показателями активности РА (DAS28, СРБ), уровнем АД и некоторыми ЭхоКГ-параметрами (ГЛЖ, ДДЛЖ и др.). Это дает основание утверждать, что активность РА и АГ играют ключевую роль в генезе большинства ЭхоКГ-изменений у пациентов данной категории, о чем сообщают и другие авторы (Шостак Н.А. и соавт, 2005; Хусаинов Д.К. и соавт., 2006; Шилкина Н.П. и соавт., 2009).
У больных РА без и с АГ были изучены и анализированы показатели, характеризующие морфо-функциональные особенности левых отделов сердца (табл.2).
Анализ полученных результатов показывает, что у обследованных больных независимо от наличия АГ, размеры ЛЖ (КДР) и относительная толщина МЖП и ЗСЛЖ в диастоле имели тенденцию к увеличению и достоверно отличались от контроля (p<0,001), а КДО ЛЖ оказался достоверно выше (p<0,05) только в группе больных РА с АГ.
Таблица 2
Морфо-функциональные показатели левых отделов сердца у больных РА без и с АГ
| Показатель | Группа контроля (n=40) | Больные РА без АГ (n=32) | Больные РА с АГ (n=28) |
| КДР, см | 4,32 ± 0,04 | 4,68 ± 0,03*** | 4,86 ± 0,04*** |
| КДО, мл | 104 ± 7,5 | 107,3 ± 6,8 | 126,2 ± 7,3* |
| КСО, мл | 42,4 ± 2,8 | 34,1 ± 2,3* | 36,4 ± 2,5 |
| ОТ МЖП, (д), см | 1,21 ± 0,02 | 1,39 ± 0,03*** | 1,58 ± 0,04*** |
| ОТ ЗСЛЖ, (д), см | 1,32 ± 0,03 | 1,61 ± 0,04*** | 1,74 ± 0,02*** |
| ИММЛЖ, г/м2 | 98,6 ± 5,4 | 112,6 ± 6,1 | 123,4 ± 6,3** |
Примечание: *- p<0,05; **-p<0,01; ***-p<0,001 достоверность различий по сравнению с контрольными данными
Обращает на себя внимание тот факт (табл.2), что ИММЛЖ у пациентов РА с АГ оказался выше (p<0,05), чем при РА без АГ (123,4±6,3 и 112,6±6,1 г/м2). При этом у подавляющего большинства больных РА без АГ (64,5%) ИММЛЖ соответствовал критериям ГЛЖ и ассоциировался с большей долей пациентов с максимальной активностью РА (DAS28>6,3) в этой группе – 64,7% против 28,6% при РА с АГ (p<0,05).
Наряду с оценкой морфо-функциональных особенностей левых отделов сердца у больных РА без и с АГ в основной группе нами было изучено состояние центральной и внутрисердечной гемодинамики (табл. 3).
Таблица 3
Показатели центральной и внутрисердечной гемодинамики у больных РА без и с АГ
| Показатель | Группа контроля (n=40) | Больные РА без АГ (n=32) | Больные РА с АГ (n=28) |
| УО, мл | 75,4±5,8 | 78,12 ± 6,16 | 91,10 ± 7,4 |
| МОК, л/мин | 4,4 ± 0,22 | 5,64 ± 0,23*** | 7,12 ± 0,14*** |
| ФВ, % | 71,2 ± 5,7 | 72, 44 ± 5,9 | 72, 68 ± 6,2 |
| СИ, л/мин/м2 | 2,78 ± 0,12 | 3,64 ± 0,24** | 4,82 ± 0,32*** |
Примечание: **- p<0,01; ***- p<0,001; достоверность различий по сравнению с контрольными данными
При анализе показателей ФВ и оценке систолической функции ЛЖ у наблюдаемых больных РА без и с АГ нарушений систолической функции ЛЖ (СДЛЖ) не было выявлено, показатели ФВ во всех случаев превышали 60%. В группе больных РА с АГ, УО оказался выше и достоверно (p<0,05) отличался от контроля. В то же время показатели центральной гемодинамики – МОК и СИ имели тенденцию к повышению, однако достоверно не отличались от контроля (p>0,05) как в группе РА без АГ, так и в присутствии АГ.
При оценки состояния систолической функции ЛЖ у наблюдаемых больных РА в основной группе, СДЛЖ в целом были выявлены у 10 пациентов (8,4%) из 119 обследованных, у которых ФВ стойко не превышала 45%. У пациентов данной подгруппы клинически также был верифицирован ряд симптомов (одышка, сердцебиение, периферические отеки и увеличение печени). Это согласуется с данными других исследователей, утверждающих, что систолическая функция ЛЖ у больных с РА длительное время остается в сохранности, о чем свидетельствуют нормальные показатели ФВ (Козлова Л.К., 2003; Колотова Г.Б. и соавт., 2007).
Если нарушения систолической функции ЛЖ среди пациентов с РА основной группы встречались довольно редко (у 8,4%), то частота встречаемости ДДЛЖ была значительно больше, и в целом ДДЛЖ выявлено у 35 (29,4%) обследованных. В подгруппе больных РА с ДДЛЖ наряду с высокой степенью активности заболевания (DAS28 >5,2 у 62,8% обследованных) присутствовали: АГ – у 20 (57,1%), ГЛЖ – у 22 (62,7%), аутоиммунная анемия – у 33 (94,2%), диффузно-дистрофические изменения в миокарде – у 32 (91,4%), нарушение внутрижелудочковой проводимости – у 12 (34,2%) пациентов.
Анализ полученных данных, характеризующих диастолическую функцию ЛЖ у пациентов с РА, выявил нарушение процесса активного расслабления миокарда ЛЖ, о чем свидетельствует достоверное нарастание по сравнению с контролем ВИР (p<0,001), а также снижение скорости Е (p<0,05). Отношение интеграла А/интеграла Е и интеграл А/общий интеграл трансмитрального потока также значимо возросли у пациентов с РА при сопоставлении с контролем (p<0,001), что свидетельствует о нарастании активности предсердного вклада в наполнение ЛЖ у данной категории больных.
Анализ полученных результатов показывает, что развитие ДДЛЖ при РА по всей вероятности, имеет мультифакторный характер, в формирование которого, наряду с активностью заболевания и АГ, определенный вклад могут внести такие сопутствующие факторы, как анемия, дистрофические изменения в миокарде и нарушения внутрижелудочковой проводимости (Иванов Д.С. и соавт., 2004; Колотова Г.Б. и соавт., 2007; Мясоедов Е.Е. и соавт., 2008).
Киническое значение факторов риска и С-реактивного белка в раннем развитии атеросклероза у больных ревматоидным артритом
С целью оценки распространенности традиционных ФР АС, клинических и субклинических проявлений КВЗ у пациентов основной и контрольной групп анализировали классические ФР, проводили ультразвуковое сканирование сонных артерий с измерением толщины КИМ и изучали роль иммуновоспалительного компонента (СРБ) в атерогенезе при РА.
Классические кардиоваскулярные ФР (один и более) наблюдались у 102 из 119 (85,7%) пациентов При этом преобладающими являлись дислипидемия (у 78% больных), в основном за счет повышения ОХС и ТГ (64% и 68%). В контрольной группе классические ФР наблюдались в 68% случаев (p>0,05).
Анализ полученных результатов (табл. 4) показывает, что пациенты с РА по сравнению с контрольной группой были моложе (45 и 53 года соответственно; p<0,01). Однако, несмотря на это, у пациентов в основной группе чаще выявлялась АГ (43,4 и 22,6% соответственно; p<0,01), имели место более высокий уровень ТГ (1,44 и 0,48 ммоль/л соответственно; p<0,05) и ОХС (6,1 и 4,5 ммоль/л соответственно; p<0,05). Как видно из табл.4, частота других кардиоваскулярных ФР и значение СКР у пациентов с РА и лиц контрольной группы не различались. В то же время частота КВЗ (стенокардия, ИМ, инсульт) была достоверно более высокой у больных РА, чем в контрольной группе (13,4 и 0,8% соответственно; p<0,001).
Таблица 4
Сравнительная характеристика традиционных факторов риска и частоты встречаемости атеросклероза у больных РА
| Показатель | Больные РА (n =119) | Контроль (n =40) |
| Возраст, годы Частота гиперлипидемии,% ОХС, ммоль/л ТГ, ммоль/л В-липопротеиды, ед. Частота АГ,% Процент случаев: -отягощенной наследственности по КВЗ -курения -сахарного диабета -ИМТ >25 кг/м2 -процент больных с СКР >20% Кардиоваскулярные нарушения, n/%: -стенокардия -ИМ -инсульт -очаговый кардиосклероз -любые из выше перечисленных | 45,4±3.2 6,1±0,4 1,44±0,08 65 ±5,2 43 31 ,9 21 2,5 26 30 13/10,9 5/4,2 3/2,5 10/8,4 26/21,8 | 53,6±4,8 * 4,5±0,6* 0,48±0,12* 55,4,8 ед. 22* 30 27,5 5 25 24 1/2,5 1/2,5* |
Примечание: *- p<0,05
У больных в основной группе (табл.5) уровень концентрации СРБ непосредственно зависел от степени воспалительной активности, и в целом, средний уровень СРБ составил 18,6 + 2,4 мг/л и был достоверно выше, чем в контроле (p<0,001).
Таблица 5
Уровень С–реактивного белка и толщина КИМ сонных артерий у больных РА и в контроле
| Показатель | Больные РА (n =119) | Группа контроля (n =40) | p |
| Концентрация СРБ, мг/л: Основная группа (n = 119) РА, активность 1 (n = 25) РА, активность 11 (n = 39) РА, активность 111 (n = 55) Толщина КИМ, мм: средняя максимальная Процент больных с: толщиной КИМ > 0,70 < 0,90 мм АТБ (КИМ > 0,90 мм) | 18,6±2,4 12,2±1,4 14,6±1,8 24,6±2,2 0,80±0,06 0,92±0,08 64,7±4,4 23,6±3,2 | 5,8±1,6 5,8±1,6 5,8±1,6 5,8±1,6 0,68±0,04 0,79±0,06 13,6±1,2 4,8±0,6 | <0,01 <0,05 <0,01 <0,001 <0,05 <0,05 <0,001 <0,001 |
При этом установлена положительная корреляция между концентрацией СРБ и активностью болезни по индексам DAS28 (r=0,3; p<0,001), величиной СОЭ (r=0,4; p<0,001), уровнем ОХС (r=0,2; p<0,05) и значением КИМ (r=0,2; p<0,01). В контрольной группе корреляция между уровнями СРБ и традиционными ФР, клиническими проявлениями КВЗ и толщиной КИМ не выявлена (p>0,05) во всех случаях.
При разделении пациентов на группы со значением СРБ менее и более 18 мг/л также получены статистически значимые различия между клиническими и субклиническими проявлениями АС (табл.6).
Таблица 6
Связь между концентрацией СРБ, частотой КВЗ и толщиной КИМ (n=119)
| Показатель | Концентрация СРБ, мг/л | p | |
| < 18мг/л (n = 64) | > 18 мг/л (n =55) | ||
| КВЗ, n (%) | 7 (10,9±1,3) | 19 (34,5±2,6) | < 0,01 |
| ИБС, n (%) | 9 (14,1±1,2) | 14 (25,4±1,8) | < 0,05 |
| Утолщение КИМ + АТБ, n (%) | 28 (43,8±3,4) | 46 (83,6±4,1) | < 0,001 |
| КИМ средняя, мм | 0,72±0,04 | 0,88±0,04 | < 0,05 |
| КИМ макс., мм | 0,80±0,06 | 1,2±0,08 | < 0,01 |
Таким образом, полученные нами результаты свидетельствуют о выраженной корреляции между уровнем СРБ и атеросклеротическим поражением сосудов при РА. Анализ и интерпретация результатов нашего исследования и данных литературы (Александрова Е.Н и соавт., 2007; Кухарчук В.В. и соавт., 2009; Шилкина Н.П. и соавт., 2009;) показывают, что уровень СРБ является наиболее чувствительным лабораторным параметром РА и, дополняя традиционные ФР, одновременно является прогностическим маркером в отношении риска развития КВЗ и их осложнений у пациентов с РА.
При ультразвуковом сканировании сонных артерий, увеличение толщины КИМ определялось у 65% пациентов в основной группы (p<0,01), при этом АТБ имели место у 34% обследованных (табл.6). При сопоставлении по возрасту пациентов основной группы и группы контроля установлено, что пациенты группы контроля до 40 лет не имели субклинических признаков АС. В то же время, в основной группе у больных моложе 30 лет в 18% случаев уже выявлялось утолщение КИМ, а в возрасте до 40 лет у 38% обследованных имело место увеличение толщины КИМ и АТБ.
Таким образом, полученные результаты свидетельствуют об ускоренном развитии АС в исследуемой группе больных РА, что было отмечено ранее и другими авторами (Насонов Е.Л., 2004; Полякова С.А. и соавт, 2006; Мясоедов Е.Е. и соавт., 2008).
В процессе всестороннего исследования и комплексной оценки состояния КВС у 26 больных основной группы были выявлены клинические проявления КВЗ (инсульт – у 3, стенокардия – у 13, из них у 5 развился ИМ, очаговый кардиосклероз – у10) (табл.7).
Особенностью данной группы больных РА является более молодой возраст по сравнению с контрольной группой (47 и 53 года соответственно; p<0,01), поздняя диагностика (у 94,7%?) и большая длительность болезни (>10 лет), наличие многочисленных системных проявлений РА ( в том числе серозиты и васкулит), высокая частота АГ и гиперлипидемия, гиперкоагуляции и высокий уровень тревожности и концентрации СРБ (28,4 +2,2; p<0,001). Все пациенты данной подгруппы длительно (годами) получали преднизолон в больших кумулятивных дозах и НПВП без БПВП.
Полученные результаты показывают, что пациенты с РА и с клиническими проявлениями КВП отличались от контрольной группы только по уровню АД и липидов (ОХС, ТГ, в-липопротеиды). Однако, несмотря на скудность традиционных ФР осложнения КВЗ, связанные с АС (ИМ, очаговый кардиосклероз, инсульт) у пациентов с РА встречались достоверно чаще, чем в контрольной группе. Кроме того, проявления атеросклеротического поражения сосудов у больных РА выявлялись в значительно молодом возрасте и тесно ассоциировались с уровнем СРБ (p<0,01). Это дает основание предполагать, что ФР обусловленные самим заболеванием и его лечением, безусловно играли существенный роль в раннем развитии АС и КВО у больных РА (рис.1) (Насонов Е.Л., 2004; Попкова Т.В. и соавт., 2009).
Таблица 7
Характеристика больных РА в основной группы, имеющих клинические проявления кардиоваскулярной патологии (n = 26)
| Показатель | Значение показателя |
| Возраст, годы Длительность болезни, годы Активность РА по индексу DAS28, баллы Системные проявления, n /%: - РУ - анемия - ревматоидный васкулит - лихорадка - полиамиотрофия - серозиты Терапия глюкокортикоидами: - длительность приема, годы - кумулятивная доза, г. - доза преднизолона на момент обследования, мг Традиционные факторы риска КВЗ, n /%: - АГ - гиперлипидемия Толщина КИМ, мм: (КИМ 0,9 > мм) Число больных с АТБ (КИМ > 1,2 мм), п/% СКР > 20,% | 45 (20-64) 11 (5-25) 5,4 (3,3 -7,6) 12 (46,1) 18 (69,2) 8 (30,8) 5 (19,2) 21 (80,7) 3 (11,5) 2 -5; 21 (80,7%) 38,6 (22,5 -55,4) 10 (5-12,5) 22 (84,6) 24 (92,3) 16 (61,5) 12 (46,1) 23 (88,5) |
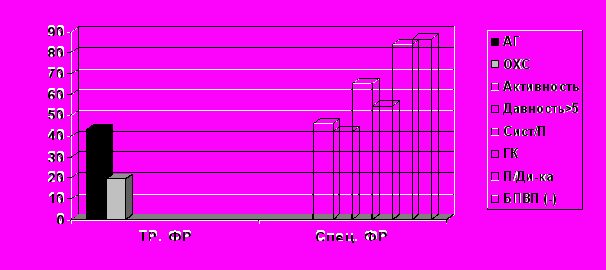
Рис.1. Частота встречаемости традиционных и специфических ФР развития КВЗ у больных РА
Таким образом, частота развития КВО, связанных с атеросклеротическим поражением сосудов при РА по сравнению с контролем, с учетом скудности накопления традиционных ФР развития КВЗ подтверждает существенный вклад ревматоидного воспаления и, так называемых, специфических (болезньсвязанных) ФР в формировании сосудистых осложнений, что позволяет рассматривать РА и способы его терапии в целом, как дополнительные ФР развития КВО (Насонов Е.Л., 2004; Никитина Н.М. и соавт., 2009; Попкова Т.В. и соавт., 2009).
При анализе специфических ФР обращают на себя внимание высокие средние уровни СРБ, фибриногена, значительно превышающие нормальные показатели. Уровень СРБ >18 мг/л, рассматривающийся в последние годы в качестве одного из основных ФР развития КВЗ, отмечено у 68,6% больных РА в основной группе. Это вполне закономерно ввиду воспалительной концепции АС (Насонов Е.Л., 2003; Шилкина Н.П. и соавт., 2008; Цурко В.В. и соавт., 2009).
