Заседание 7 «Интеграция дисциплин как способ формирования ключевых компетенций учащихся»
| Вид материала | Заседание |
| Конспект интегрированного урока в 10 классе “Электрический ток в жидкости” ( химия и физика) Сивкова Л.Н., учитель химии МОУ СОШ |
- Интеграция учебных дисциплин как способ формирования компетенций учащихся на уроках, 171.62kb.
- Проектная деятельность как способ формирования ключевых компетенций учащихся на уроках, 165.96kb.
- Заседание гип «Ключевые компетенции» Тема: «Новые подходы к контрольно-оценочной деятельности, 129.86kb.
- А. Печчеи Высшей целью педагогического процесса в техникуме является формирование самостоятельно, 263.78kb.
- Участие в проектной деятельности, как способ формирования ключевых компетенций учащихся, 151.12kb.
- Мусихина Светлана Юрьевна, учитель биологии школы №97 г. Ижевска реферат, 827.64kb.
- Формирование ключевых компетенций учащихся через их проектную деятельность на уроках, 72.8kb.
- Ктивно работать, эффективно сотрудничать, адекватно оценивать себя и свои достижения,, 313.83kb.
- Доклад к педсовету, 240.45kb.
- В. С. Выготский Современное общество требует смещение акцентов со знаниево-ориентированного, 108.9kb.
Конспект интегрированного урока в 10 классе “Электрический ток в жидкости”
( химия и физика)
Сивкова Л.Н., учитель химии МОУ СОШ №11;
Тюрин Б.С., учитель физики МОУ СОШ №11
Вид урока: Интегрированный урок с исследовательской деятельностью учащихся
Цель обучения:
1.Обеспечить усвоение учащимися электрохимических процессов при электролизе, используя знания по физике и химии
2.Добиться усвоения учащимися понятий: Электролиз, гальваностегия, гальванопластика, рафинирование
3.Обобщить и систематизировать знания учащихся об электрическом токе в жидклстях
Цель развития:
1.Развитие познавательных умений (умение выделять главное, вести конспект, наблюдать, делать опыты)
2.Развитие мышления (аналитического, развития умения классифицировать, делать обобщающие выводы)
3.Развитие общетрудовых и политехнических умений
Цель воспитания:
1.Воспитания мотивов учения, положительного отношения к знаниям
2.Воспитание характера на пути достижения цели при проведении опыта
Методическая цель:
1.Используя сотрудничество учителя физики и учителя химии, добиться создания но уроке атмосферы деловой заинтересованности в изучении темы
Оборудование:
Источник тока, электроды, стакан с раствором, соли, сахара, дисстилированной воды, провода, ключ, лампочка.
Аппаратное обеспечение:
Компьютер, проектор, экран.
План урока:
1.Организационный момент
2.Актуализация знаний
3.Постановка цели и задач урока
4.Самостоятельная работа учащихся при проведении эксперимента
5.Работа с классом. Эвристическая беседа
6.Эксперимент
7.Вывод закона электролиза
8.Решение задач.
9.Заключение домашнее задание
Электрический ток в жидкостях
Из курса физики нам известно, что одни вещества могут проводить электрический ток, например металлы, а другие вещества не могут проводить электрический ток, например, неметаллы - сера, фосфор и др. Это касается и растворов веществ. Растворы одних веществ способны проводить Эл. Ток, а другие нет. Чтобы опытным путем проверить эту способность у растворов различных веществ, воспользуемся прибором для определения электропроводности растворов. Он состоит из стакана, в который наливают раствор исследуемого вещества. На стакан ставят пластинку из эбонита с вмонтированными в нее двумя электродами (угольными или металлическими), к клеммам к которым присоединены провода. Один из них соединен с лампочкой, выходной контакт от лампочки и другой провод идет к источнику электрического тока. Если раствор, налитый в стакан, проводит электрический ток, то лампочка загорается. Исследуем поочередно растворы дистиллированной воды, раствор соли, раствор кислоты и раствор сахара.
И объяснимы результаты испытаний:
Вопрос: что наблюдаем при опускании в раствор дистиллированной воды электроды, вмонтированного в пластинку и замыкаем цепь?
Ответ: лампочка не загорается.
Вывод: дистиллированная вода не проводит электрический ток.
Вопрос: что наблюдаем при исследовании раствора поваренной соли?
Ответ: раствор поваренной соли проводит Эл. Ток, т.к лампочка загорелась.
Вопрос: какие выводы можно сделать при исследовании растворов кислоты и щелочи?
Ответ: лампочка загорелась. Раствор кислот и щелочей проводит электрический ток.
Вопрос: что наблюдаем при исследовании раствора сахара?
Ответ: лампочка не загорается. Раствор сахара не проводит Эл. Ток.
Т.о результаты исследований таковы, что все вещества можно по электропроводности разделить на 2 группы: растворы веществ, проводят Эл. Ток и растворы веществ не проводят Эл. Ток. Вспомните, как называется каждая группа веществ.
Ответ: вещества, растворы которых проводят Эл. Ток, называются- электролитами.
Назовите группы веществ электролитов.
Ответ: растворы кислот, щелочей и солей.
Даем определение 2ой группе. Вещества, растворы которых не проводят Эл.ток называются не электролитами. Назовите их: дистиллированная вода, раствор сахара в воде.
Вопрос: как обьяснить электропроводность растворов электролитов с точки зрения физики?
Эл. Ток- это направленное движение заряженных частиц.
Вывод: в растворе электролита тоже содержатся заряженные частицы, которые образовались в результате распада электролита.
Т.к кислоты, соли, щелочи состоят из ионов, заряженными частицами в растворе будут ионы-положительно и отрицательно заряженными.
Вопрос: как называется процесс распада электролита на ионы?
Ответ: процесс распада на ионы называется элетролитической диссоциацией.
3. попытаемся ответить на вопрос: почему электролиты распадаются на ионы именно при растворении их в воде. Ответ на этот вопрос кроется в строении молекулы воды.
Молекулы воды представляют собой диполи, т.е. имеют два полюса + и - , т.к. атомы водорода расположены под углом 104,5 0 . Молекулы имеют угловую форму
Т.к. кислород более ЭО элемент электрон полностью смещается в сторону кислорода в результате на одном полюсе молекулы воды сосредотачивается отрицательный заряд, а на другом полюсе положительный заряд. Рассмотрим действие диполей воды на вещество с ионной связью и ионной кристаллической решеткой – поваренную соль. При растворении поваренной соли в воде , диполи воды ориентируются противоположно заряженными концами вокруг положительных и отрицательных ионов электролитов. Между диполями воды и ионами электролита возникают силы взаимного притяжения. В результате химическая связь ослабевает в 81 раз – диэлектрическая постоянная воды и происходит переход ионов кристалла в раствор. Т.е. происходит распад эл-та на ионы – электрическая диссоциация. В растворе ионы окружены водной оболочкой и называются гидратированными ионами. Появление в растворе электролита заряженных частиц ионов и является причиной электропроводности растворов. Процесс диссоциации поваренной соли: NaCL Na+ + CL-
Выясним, как ведут себя ионы в электрическом поле опыт с движением окрашенных ионов.
Вопрос: куда движутся положительно заряженные ионы? Отрицательно заряженные ионы?
Ответ: в отрицательно заряженному электроду катоду. К положительно заряженному электроду аноду.
Какие процессы происходят с ионами на катоде и аноде?
Ответ: положительно заряженные ионы на катоде принимают электроны и превращаются в атомы. Идет процесс восстановления.
Отрицательно заряженные ионы отдают электроны аноду и тоже превращаются в электронейтральные атомы. Идет процесс окисления.
Вывод: окислительно-восстановительные реакции, происходящие в растворах электролитов называются электролизом.
Итак, мы подошли к определению темы, что такое электролиз. Рассмотрим электролиз с точки зрения физики.
Выведем закон электролиза ещё раз, отметим, что электрический ток представляет направленное упорядоченное движение положительных и отрицательных ионов. Это движение связано с переносом вещества. С точки
Зрения электронной и молекулярно-кинетической теории следует:
В: как можно выразить массу переносимого вещества?
Ответ: можно вычислить по формуле:
1)m=m0i*N, где m0i-масса иона , N- количество ионов.
В:как можно выразить заряд, переносимый ионами?
Ответ: Заряд пропорционален заряда одного иона и их количеству.
2)q=q0i*N
В: Как можно выразить заряд одного иона?
Ответ: Заряд иона пропорционален валентности и электронному заряду:
3) q0i=N*e.
В:каким образом можно вычислить массу иона вещества?
Ответ:
4) m0i=
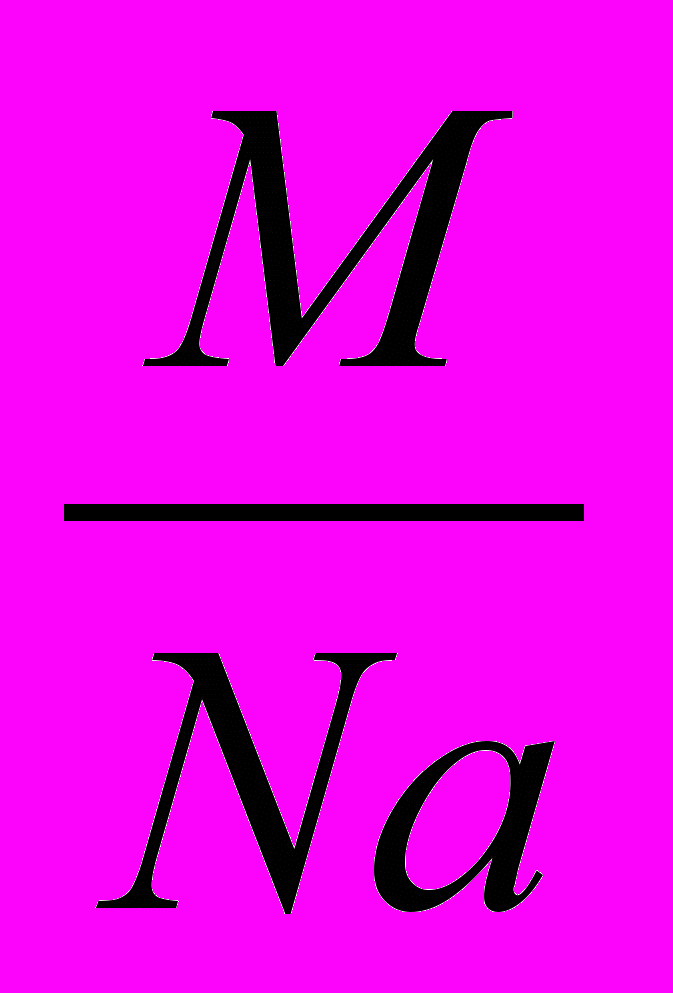 ; М-молярная масса вещества, Na-число Авогадро.
; М-молярная масса вещества, Na-число Авогадро.Решим теперь систему полученных уравнений относительно массы выделившегося вещества на электроде.
Из второго выразим N=
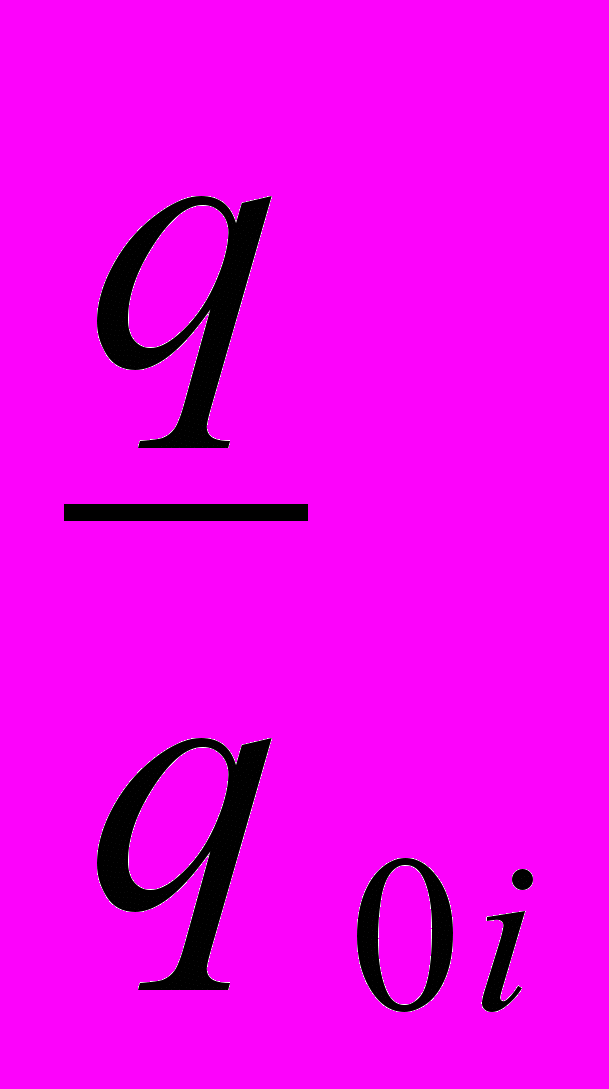 ;
;Из третьего подставим q0i, тогда N=
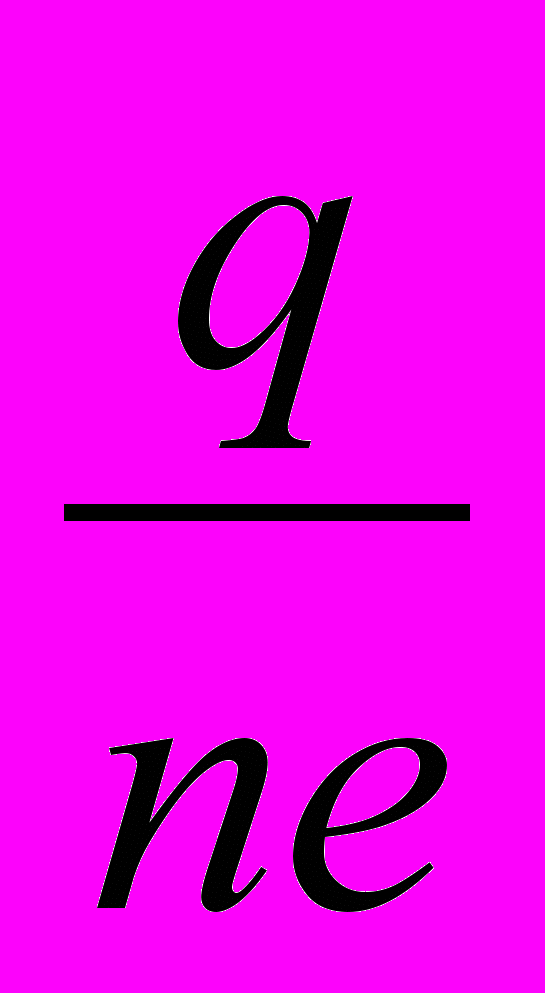 ;
;Поллеченное выражение подставим в первое уравнение .
Имеем m= m0*
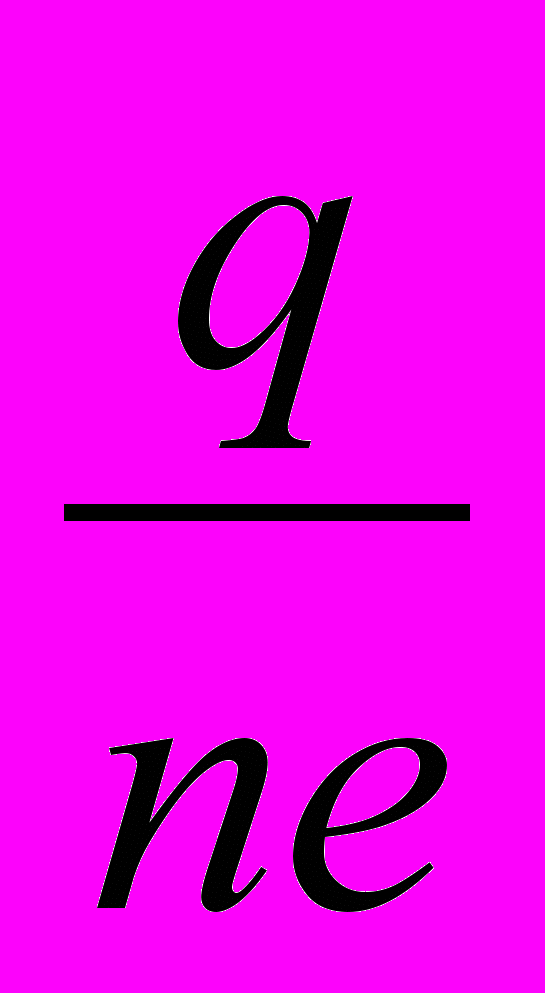 ; и из четвёртого уравнения подставим m0 в последнее
; и из четвёртого уравнения подставим m0 в последнее m=
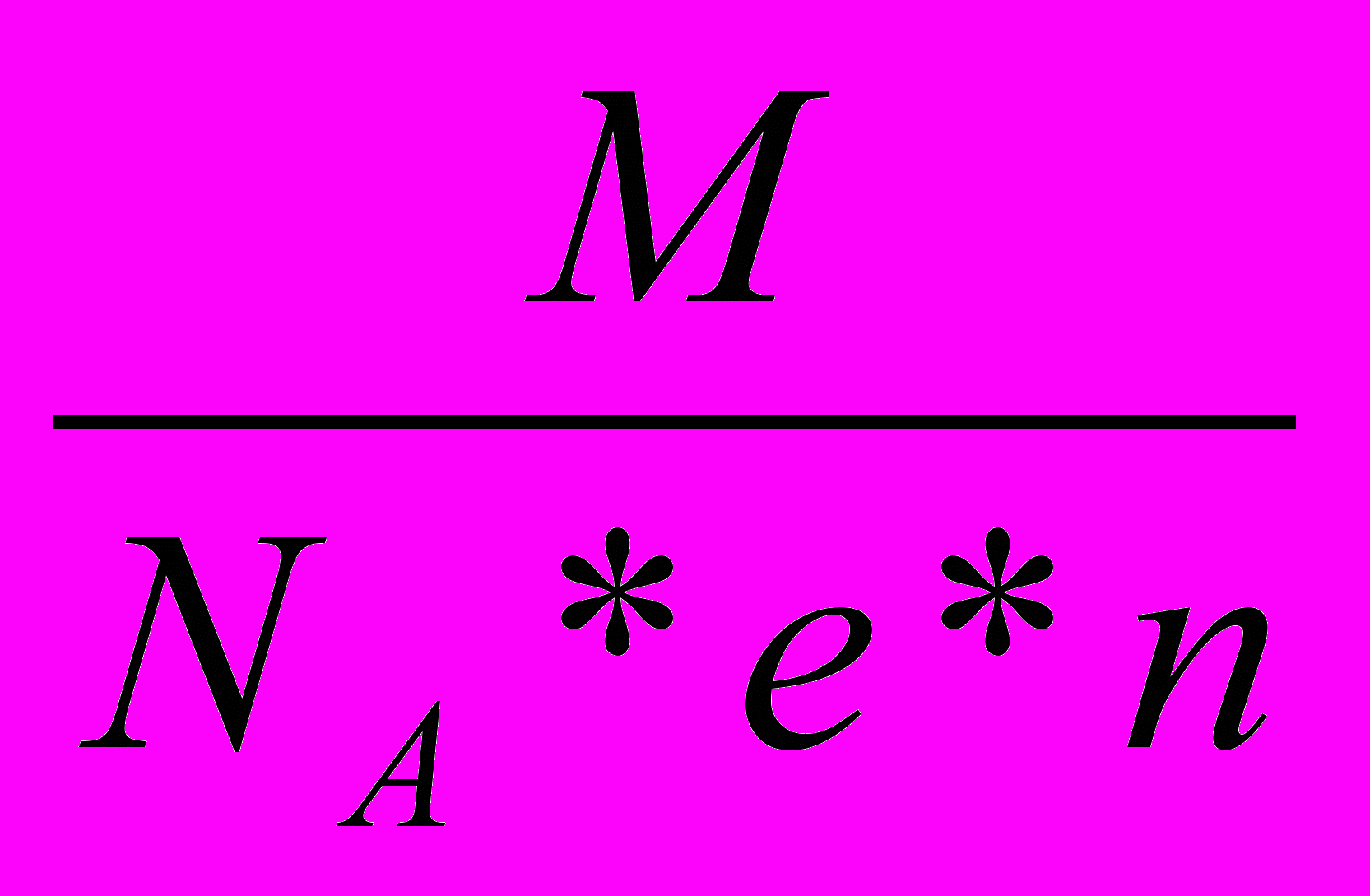 *q дробь-есть постоянная величина
*q дробь-есть постоянная величина K=
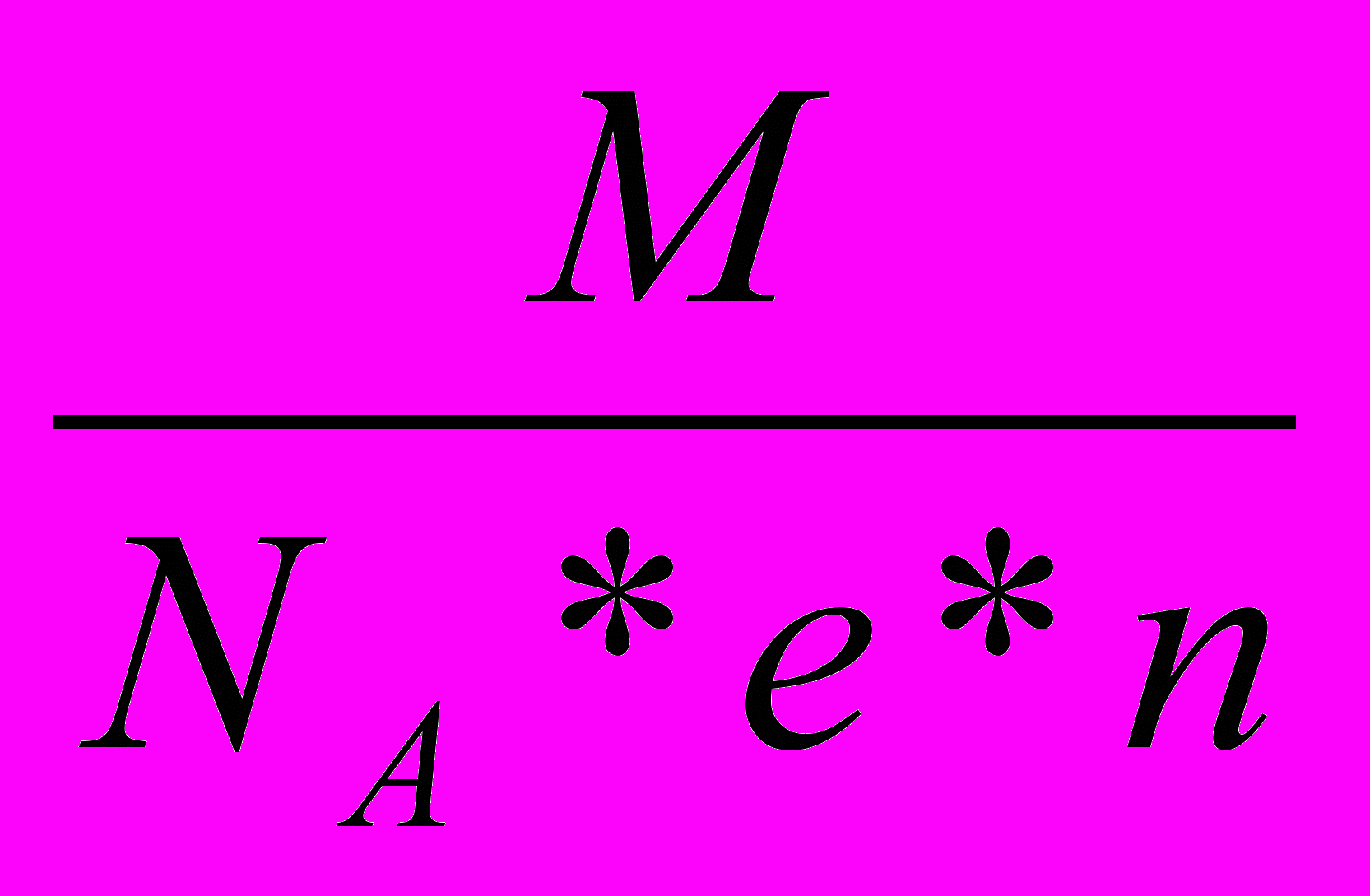 , тогда m=kq
, тогда m=kqm~q масса выделившегося вещества на электроде~заряду ,протекшему через электролит .
q=It, то m=kIt-закон электролиза.
Задачи!
1.При электролизе раствора серной кислоты расходуется мощность 37Вт. Определить сопротивление электролита, если за 50 минут выделяется 0.3 г водорода.
| Дано P=37 BT T= 50 мин= 3000 с m=0.3Г =3*10-6кг k=0,0104*10-6кг/Кл | Р  ешение: ешение:1) P=J2*R  M=kJt J=m/kt M=kJt J=m/kt P=m2/k2*t2*R R=P*k2*t2/m2 P=m2/k2*t2*R R=P*k2*t2/m2Вычисления: R=37*(1,04)2*(10-8)2:9*106/9*10-8 = 0,4(Oм) |
| R-? | R=0,4Ом |
2.При электролизе воды через ванну в течение 25 мин. шел ток 20А.Какова температура выделившегося кислорода, если он находится в объеме 10-3 м3 под давлением 2*105Па?
| Дано: t=25 мин =1500с I=20А V=10-3 м3 P=2*105 Па k=0,083*10-6 кг/кл M=32*10-3 кг/моль R=8,31 Дж/моль*Кл | Решение: 1) 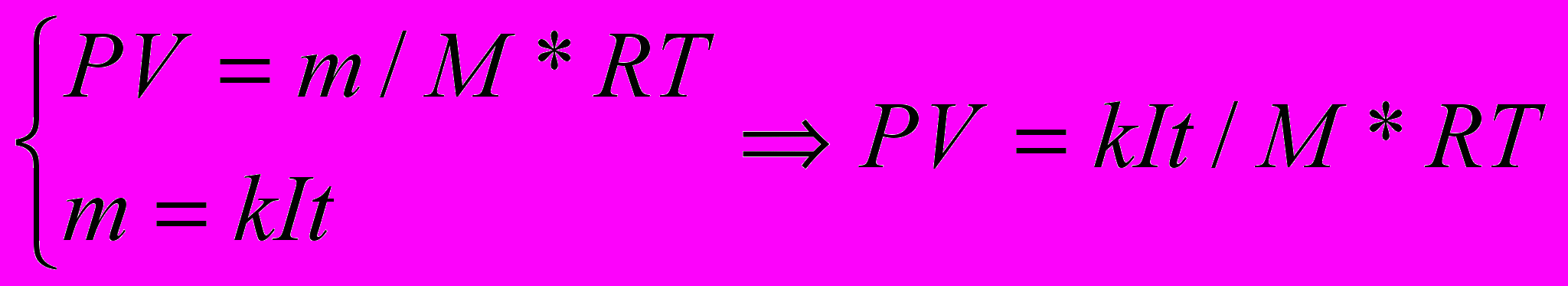 2) T=PVM/kIt*R T=2*105*10-3*32*10-3/8,3*10-8*20*1500*8,31=32*104/8,3*15*8,31=3200*102/1034,595=3,09*102=309K [T]=(Па*м3*кг/моль)/(кг/кл * А*с *Дж/моль*К)=0K |
| T-? | T=309К |
Задача №3.
При электролизе раствора серной кислоты с сопротивлением 0,4 Ом в течение 1 ч. выделилось 3,3л водорода при нормальных условиях. Определить израсходованные энергию и мощность.
| Дано Rc=0,4Oм T=50мин=3000с V=3,3л=3,3*10-3м3 P0=105Па T0=273К Rг=8,31Дж/моль* К k’=1,04*10-8кг/Кл M=2-10-3кг/моль | Решение   m=kJt J=m/kt m=kJt J=m/kt  PV=m/M*RгT m=PVM/k2*t2*Rг2*T2=P2*V2M2*Rс /k2*Rг2*T2*t PV=m/M*RгT m=PVM/k2*t2*Rг2*T2=P2*V2M2*Rс /k2*Rг2*T2*tA=1010*(3,3)2*10-6*4*10-6*0,4/(1,04)2*10-16*(8,31)2*(273)29*106=104*103Дж P=104*103/3000=35Вт |
| A-? P-? | A=104*103Дж Р=35Вт |
Домашнее Задание
§121,122 №890,899(Р)
