Отчет о научно-исследовательской работе
| Вид материала | Отчет |
- Реферат отчет о научно-исследовательской работе состоит, 61.67kb.
- Отчёт о научно-исследовательской работе за 2011 год, 1208.93kb.
- Отчёт о научно-исследовательской работе за 2009 год, 851.3kb.
- Отчёт онаучно-исследовательской работе гу нии но ур за 2010 год, 997.69kb.
- Отчет о научно-исследовательской работе профессорско-преподавательского состава, 617.56kb.
- Отчет о научно-исследовательской работе; пояснительная записка к опытно-конструкторской, 14.47kb.
- Отчет о научно-исследовательской работе (итоговый), 2484.06kb.
- Отчет о научно-исследовательской работе, 2473.27kb.
- Отчет о научно-исследовательской работе, 392.92kb.
- Задачи секции: широкое привлечение учеников к участию в научно исследовательской работе;, 67.94kb.
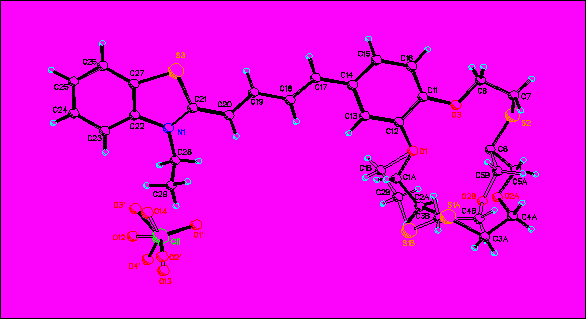 |
| Рисунок 23 - Структура соединения № 7 в кристаллах. |
Приготовление раствора краун-эфира № 1 в хлороформе. Навеску 0,00172 г ОМС №1 растворяли в 2,6 мл хлороформа и получали раствор ОМС №1 с концентрацией 1 ммоль/л. ( ММ=658). Для полного растворения навески добавляют 14 капель метанола, при этом получали прозрачный раствор красного цвета.
Приготовление раствора краун-эфира № 7 в ацетонитриле. Навеску 0,00082 г ОМС №7 растворяют в 1,0 мл ацетонитрила и получают раствор ОМС №7 с концентрацией 1 ммоль/л. (ММ=818). В процессе растворения ОМС в ацетонитриле получается прозрачный раствор желтого цвета.
Проверка совместимости растворов полимера и краун-эфира.
Далее необходимо было проверить совместимость раствора полимера с раствором красителя. Для этого в пробирку помещали небольшое количество смеси исследуемых растворов и наблюдали за возможным выпадением осадка. Если ни осадка, ни помутнения растворов в пробирке не отмечалось, растворы полимера и красителя совмещаются хорошо. В полимерный носитель вводили 1% красителя от массы полимера и отливали тонкие пленки описанным выше методом.
Спектральная характеристика образцов.
Важно отметить, что одним их важнейших критериев для выбора оптимальной композиции является величина сдвига () максимума полосы в спектре поглощения и флуоресценции МКС.
Для снятия спектров поглощения и флуоресценции использовали тонкие пленки, отлитые на кварцевых подложках. Исследования проводили на спектрофотометрах HITACHI 850, HELLIOS и флуориметре SHIMADZU 3100 с использованием кварцевых кювет и стекол. Получали спектры поглощения полимера с добавлением красителя в области 300-700 нм. В пленке с иммобилизованным красителем имело место появление характерного выраженного пика, максимум которого наблюдался при определенной длине волны.
Затем пленки, содержащие краситель, подвергали воздействию водных растворов аналитов (перхлоратов ртути и серебра с концентрацией 10-3, 10-4, 10-5 , 10-6 и 10-7 моль/л.) в течение 90 мин. После этого воздействия пленки «промокали» фильтровальной бумагой и снимали их спектры поглощения; при этом наблюдали изменения интенсивности и сдвиги максимума поглощения и флуоресценции.
Методика измерения спектров поглощения.
- Измерение спектров поглощения образцов производится спектрофотометром HITACHI 850 (ЦФ РАН) и HELLIOS.
- Измерения производятся на сухой пленке, находящейся в кювете для спектрофотометрии с длиной оптического пути 10 мм и высотой 45 мм и закрытой сверху крышкой, фторопластовой пробкой.
- В кювету сравнения помещается образец сенсорного материала (пленка полимера, содержащая краун-эфир).
- Кювета с образцом и кювета сравнения помещаются в соответствующие кюветные отделения спектрофотометра.
- Измерение спектра производится в спектральном диапазоне 300-700 нм с шагом 1 нм в соответствии с техническим описанием спектрофотометра.
- Спектр записывается на электронном носителе в текстовом формате и в виде графического файла в формате Origin, также предоставляются параметры записи спектров.
- Пункты 2-6 выполняются дважды: один раз без аналита, а второй раз в присутствии аналита.
Для этого пленки помещаются в раствор аналита, налитый в чашку Петри, закрытую сверху листами фольги для предотвращения воздействия света на образец. Время воздействия аналита 90 мин. Затем пленку вынимают из раствора, промокают фильтровальной бумагой, просушивают в течение нескольких минут на воздухе, помещают в кювету и заново измеряют спектр как описано выше.
Методика измерения спектров флуоресценции
- Измерение спектров флюоресценции (Emission) образцов производится спектрофлуориметром SHIMADZU 3100.
- Измерения производятся на сухой пленке или на образце, помещенном в кювету для флуорометрии с длиной оптического пути 10 мм и высотой 45 мм, заполненную раствором аналита и закрытую фторопластовой пробкой.
- Образец помещается в кюветное отделение спектрофлуориметра.
- Измерение спектра производится в спектральном диапазоне 300-700 нм с шагом 1 нм в соответствии с техническим описанием спектрофотометра.
- Спектр записывается на электронном носителе в текстовом формате и в виде графического файла в формате Origin, также предоставляются параметры записи спектров.
- Пункты 2-5 выполняются дважды: один раз без аналита, а второй раз в присутствии аналита (время воздействия аналита 90 мин).
Для этого пленки помещаются в раствор аналита, налитый в чашку Петри, закрытую сверху листами фольги для предотвращения воздействия света на образец. Время воздействия аналита 90 мин. Затем пленку вынимают из раствора, промокают фильтровальной бумагой, просушивают в течение нескольких минут на воздухе, помещают в кювету и заново измеряют спектр как описано выше. Графики строятся с помощью программы OriginPro7.0.
Статистическая обработка результатов
Приборная ошибка при снятии спектров поглощения составляет 1%.
Ошибка измерения длины волны максимума поглощения, вычисленная по результатам экспериментов, составляет 3 нм (0,7%). Ошибка измерения интенсивности поглощения, вычисленная по результатам экспериментов, составляет 0,043 (0,7%).Пример расчета ошибки приведен ниже.
Таблица 53 - Ошибка измерений длины волны поглощения
| № | Xi, нм | 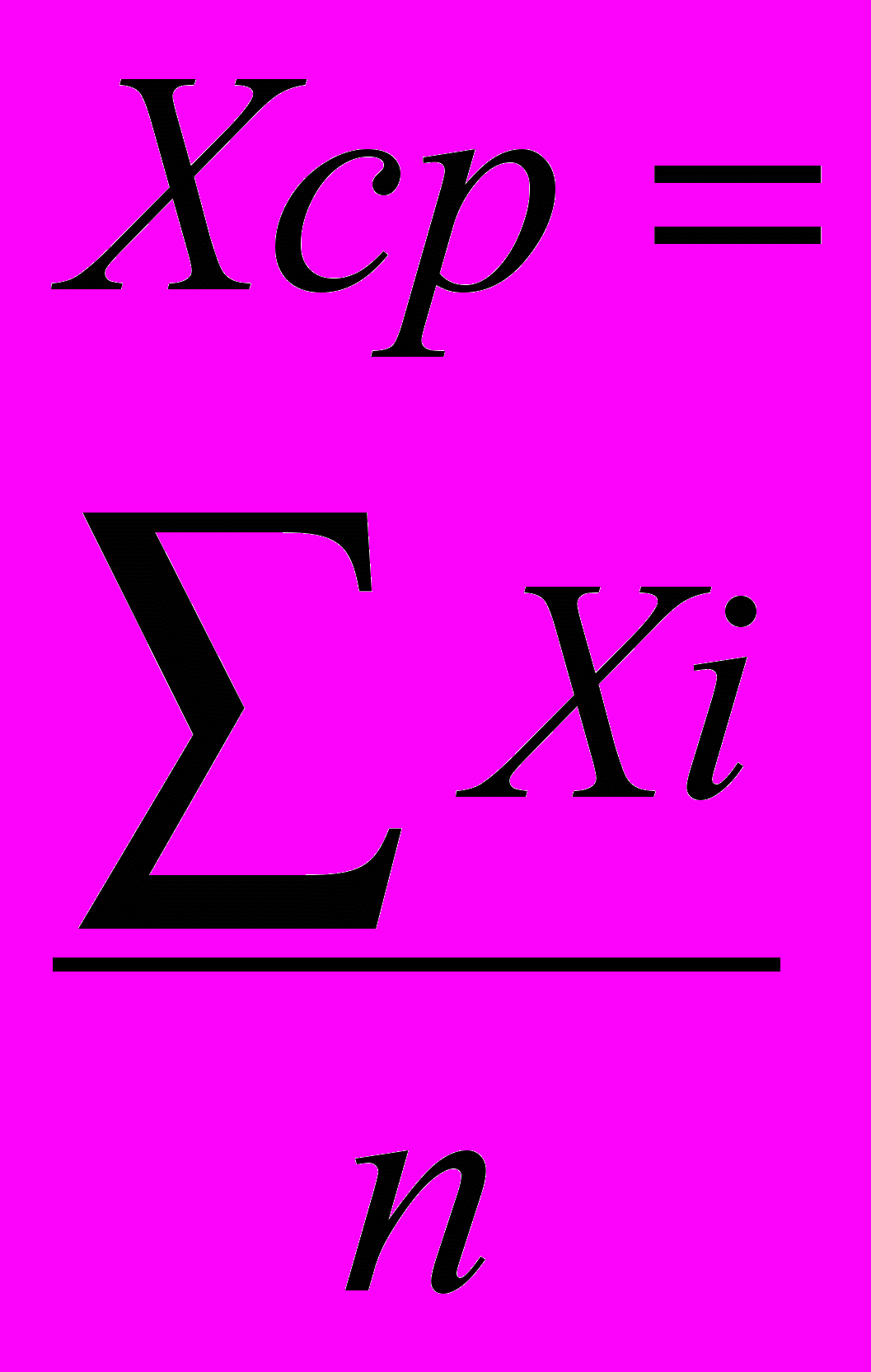 | 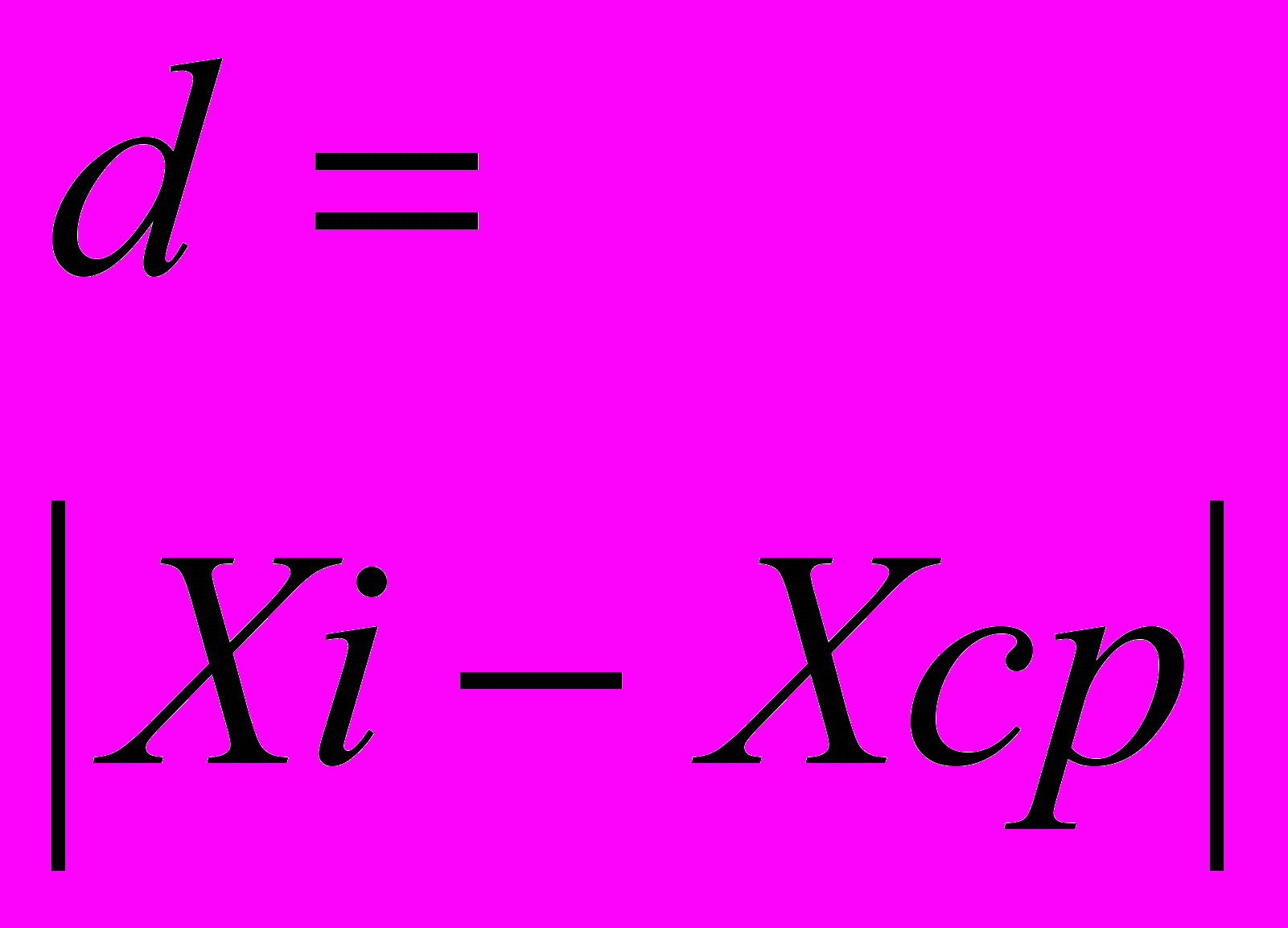 | 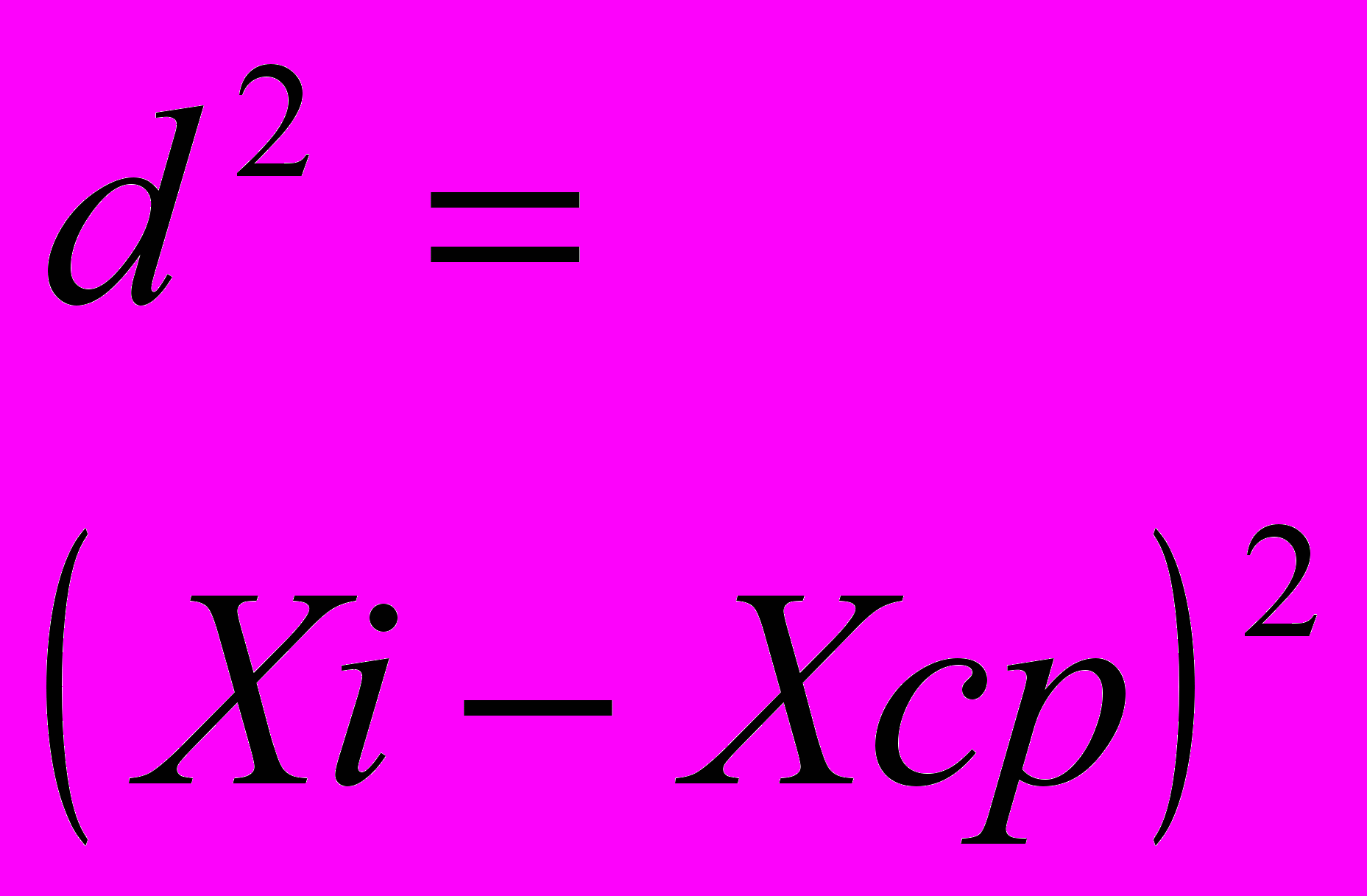 | 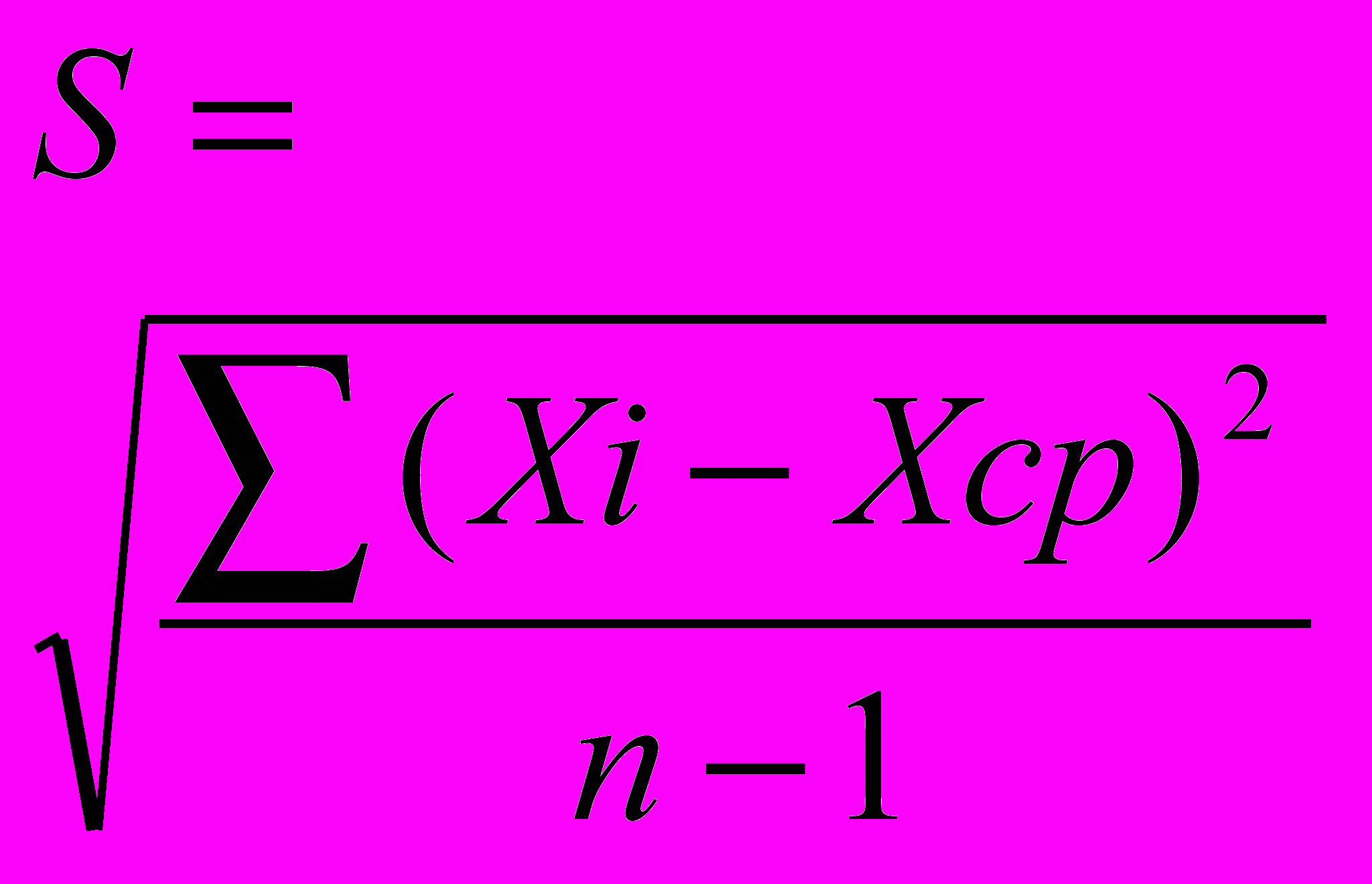 | 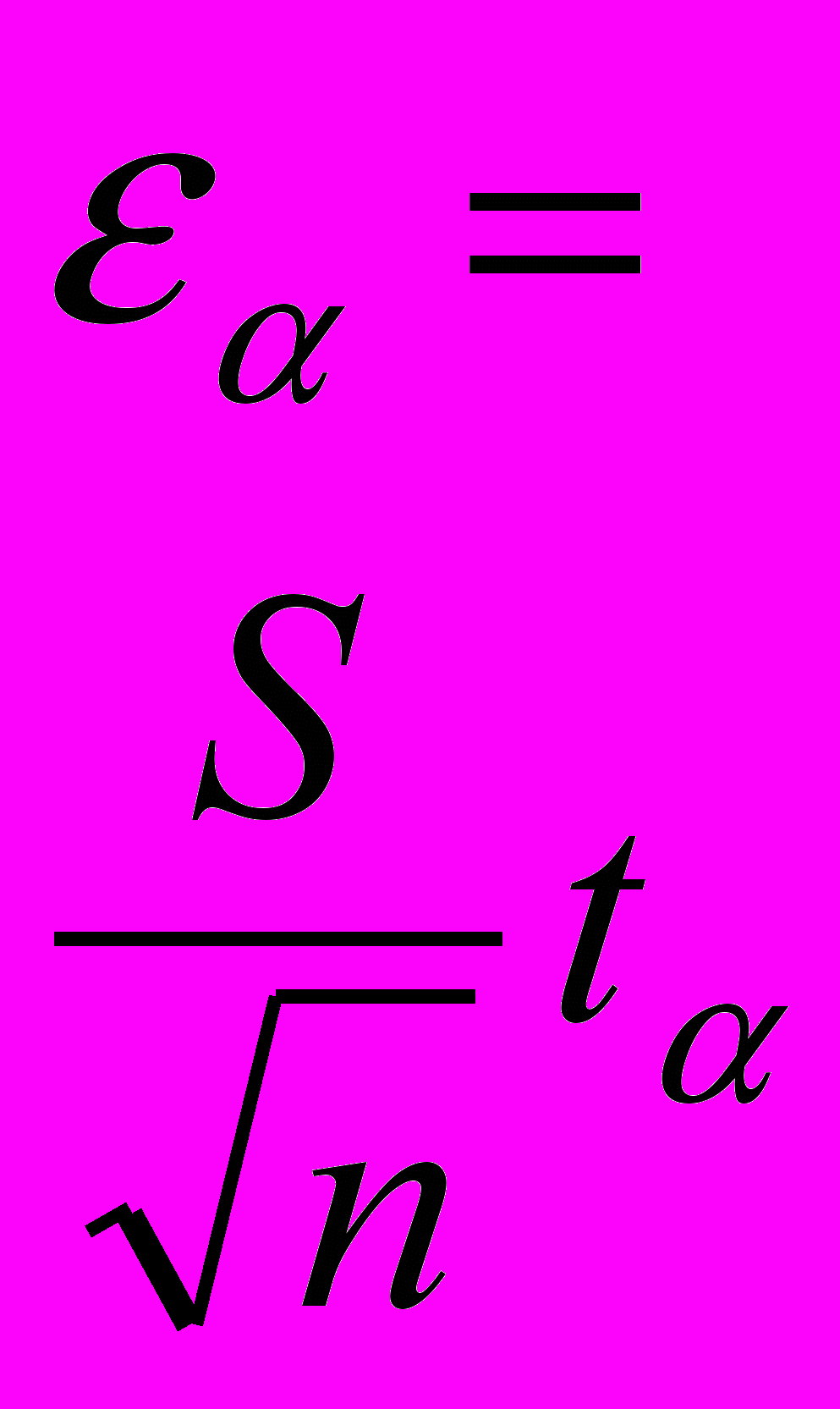 | Результат, нм n=5 α=0,95 tα=2,78 |
| 1 | 438 | 440 | 2 | 4 | 2 | 3 | 440±3 |
| 2 | 438 | 2 | 4 | ||||
| 3 | 442 | 2 | 4 | ||||
| 4 | 438 | 2 | 4 | ||||
| 5 | 442 | 2 | 4 |
Таблица 54 - Ошибка измерений интенсивности поглощения
| № | Xi, ед. | 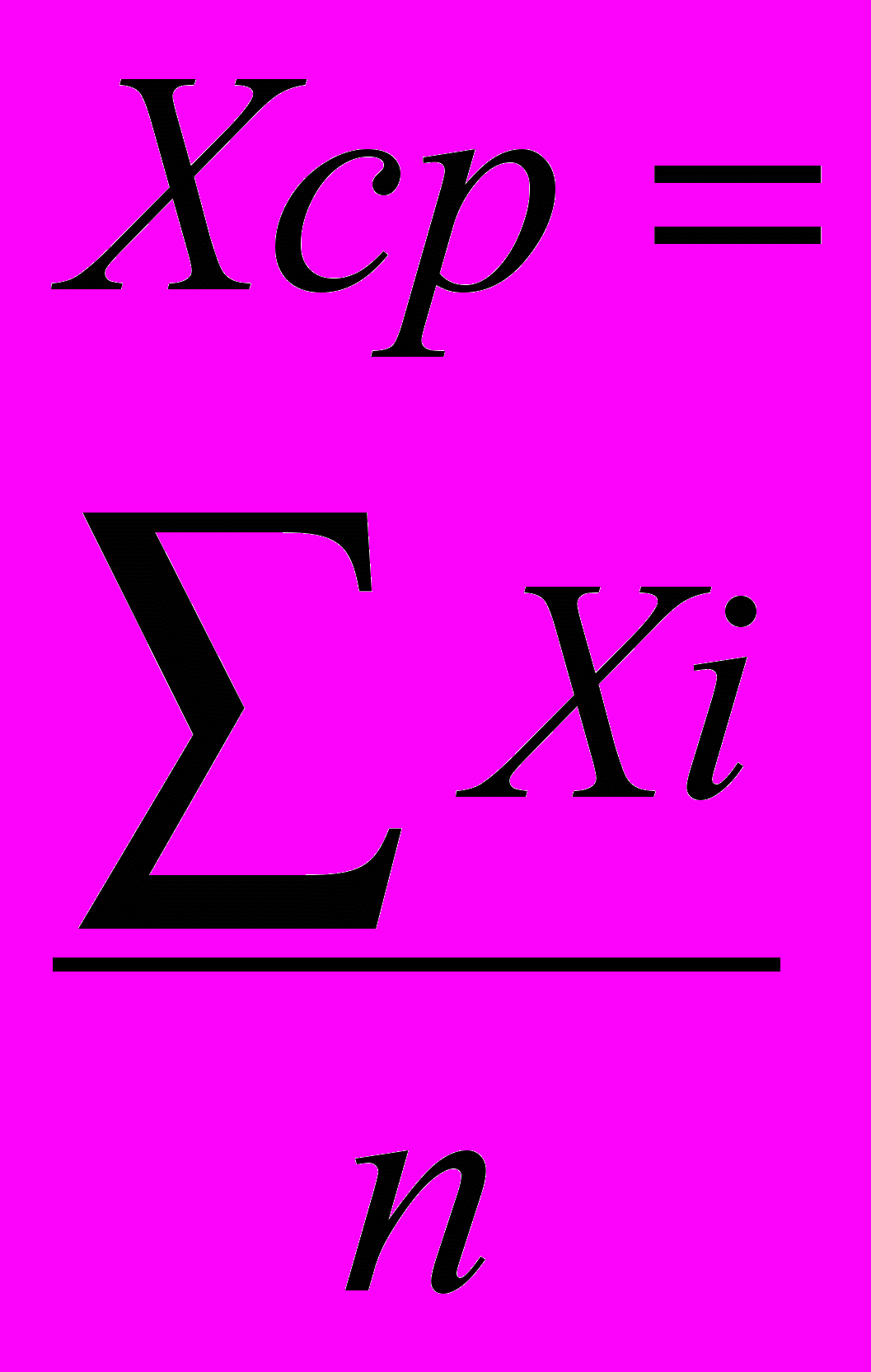 | 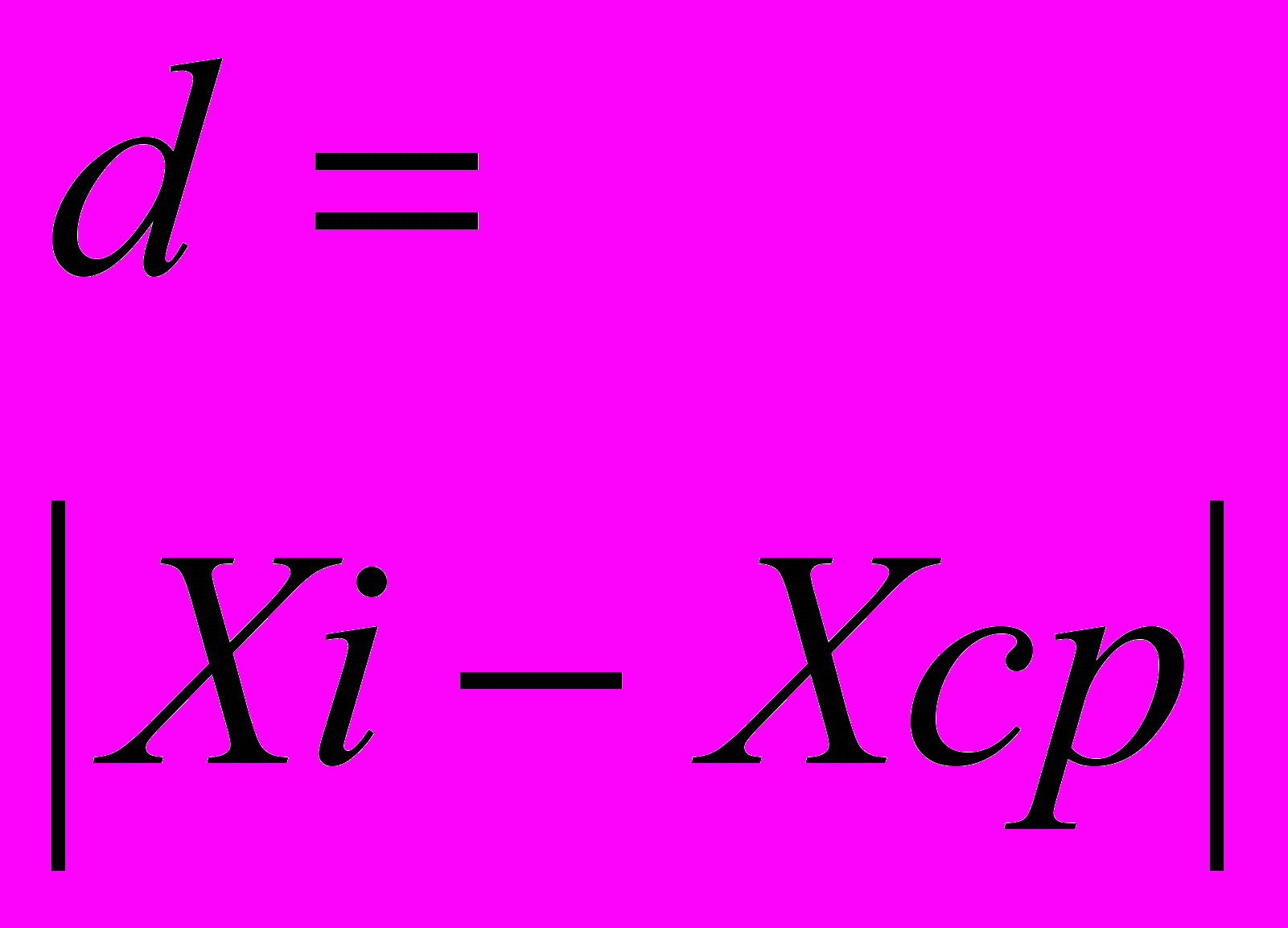 | 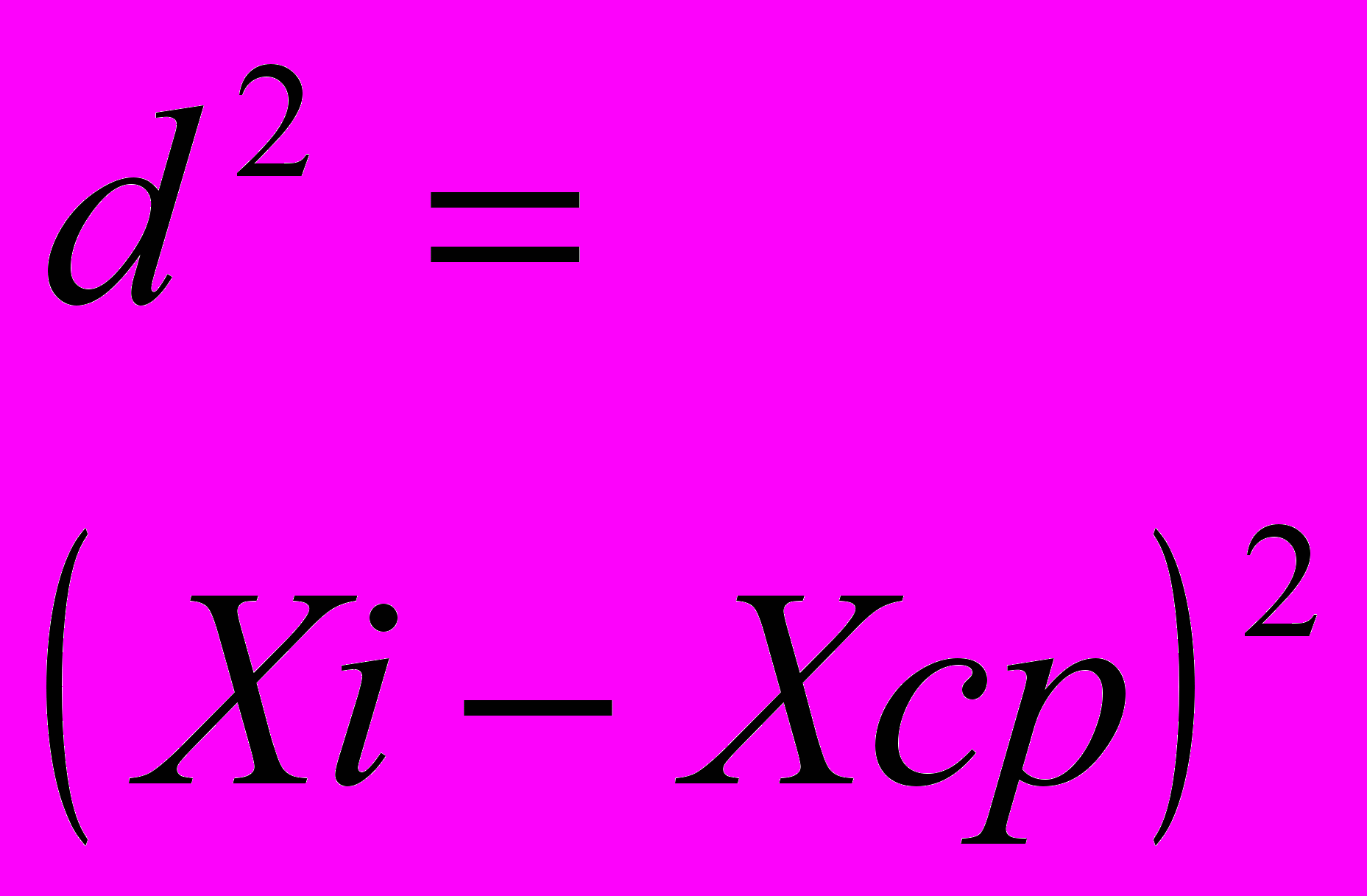 | 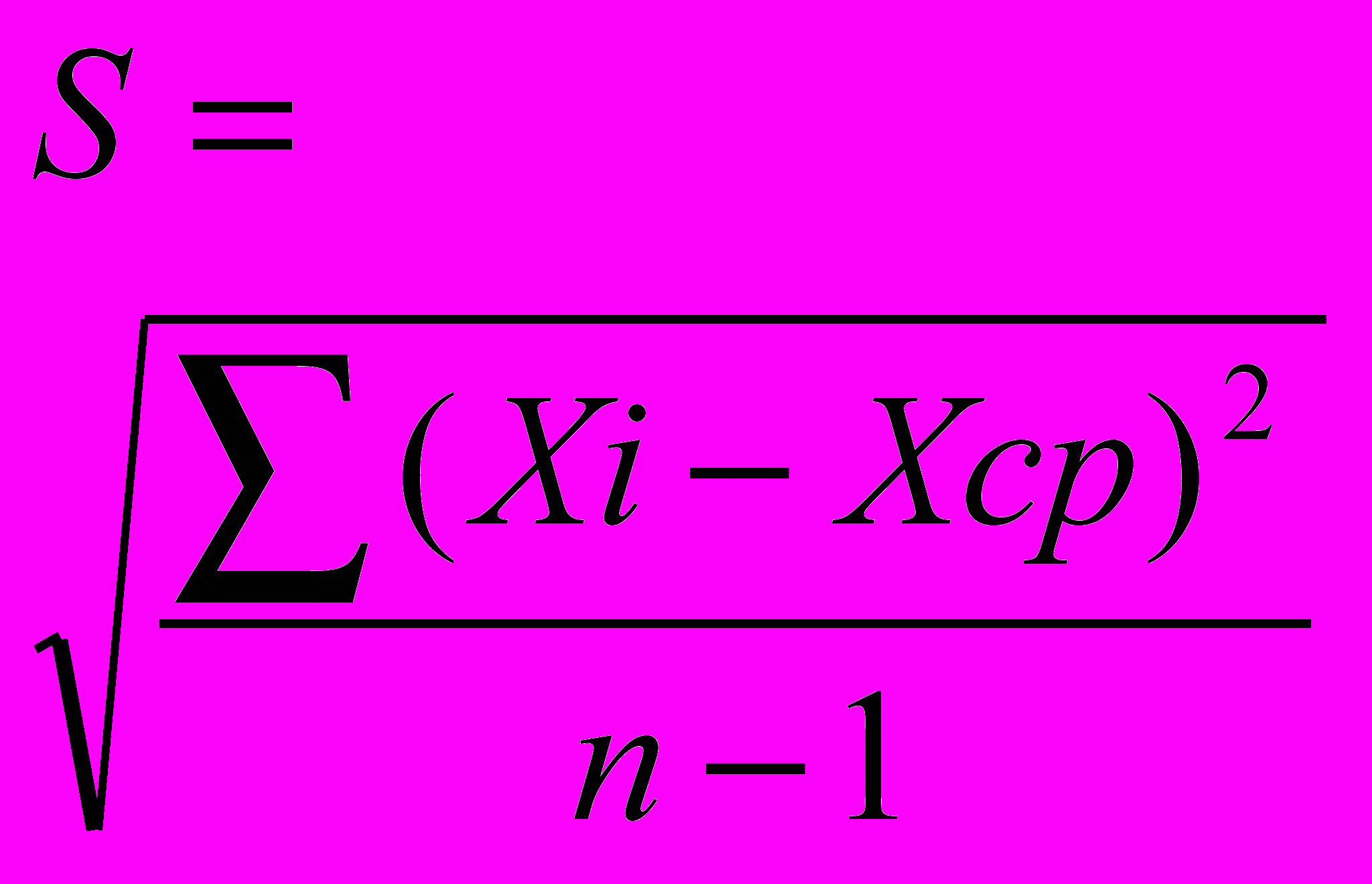 | 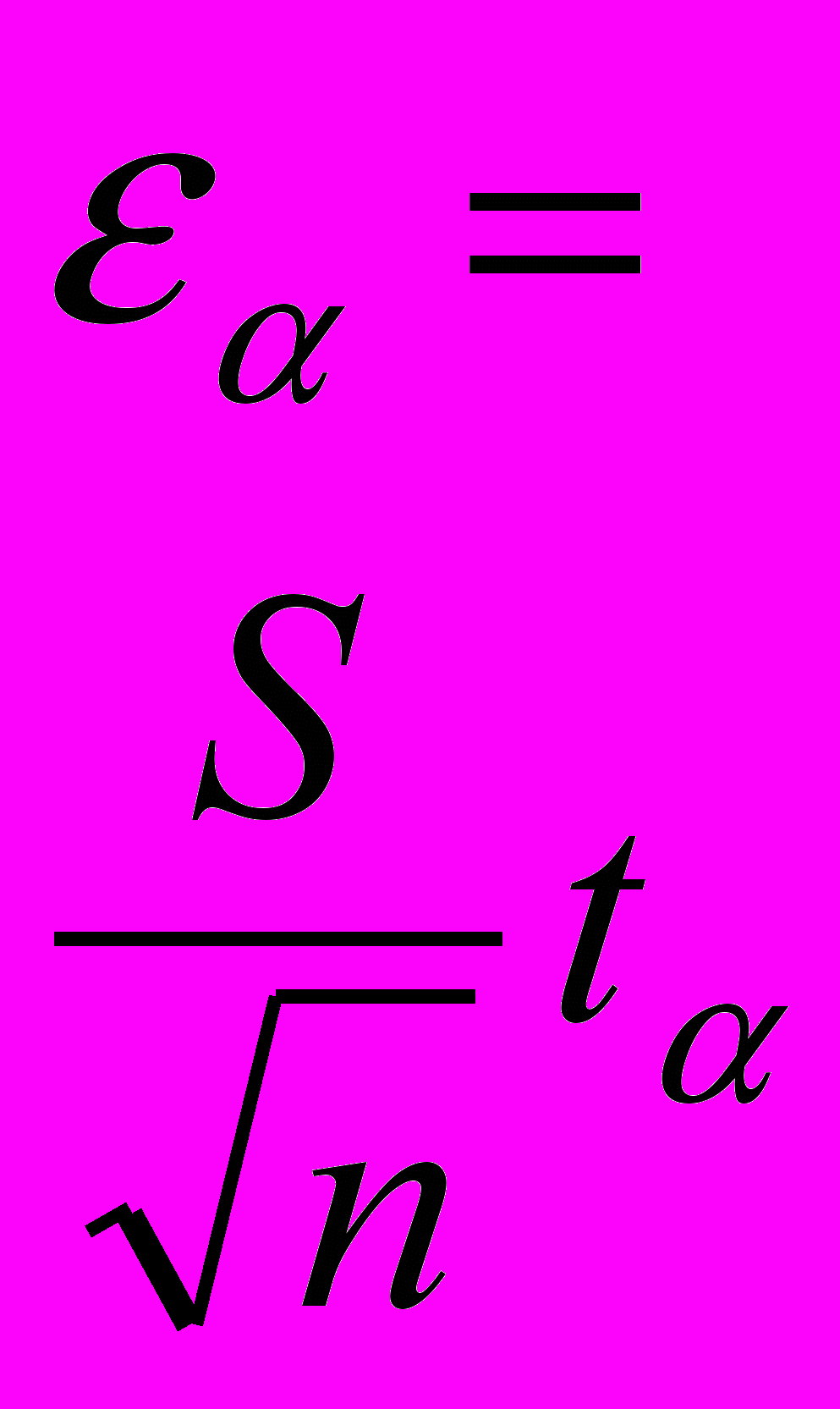 | Результат, ед. n=5 α=0,95 tα=2,78 |
| 1 | 2,021 | 2,047 | 0,026 | 0,000676 | 0,016 | 0,020 | 2,047±0,043 |
| 2 | 2,061 | 0,014 | 0,000196 | ||||
| 3 | 2,045 | 0,002 | 0,000004 | ||||
| 4 | 2,059 | 0,012 | 0,000144 | ||||
| 5 | 2,049 | 0,002 | 0,000001 |
Приборная ошибка при снятии спектров флуоресценции составляет 0,1%. Ошибка измерения длины волны максимума флуоресценции, вычисленная по результатам экспериментов, составляет 0,6 нм (0,1%). Ошибка измерения интенсивности флуоресценции, вычисленная по результатам экспериментов, составляет 0,6 (0,1%).Пример расчета процента ошибки приведен ниже.
Таблица 55 - Ошибка измерений длины волны флуоресценции.
| № | Xi, ед. | 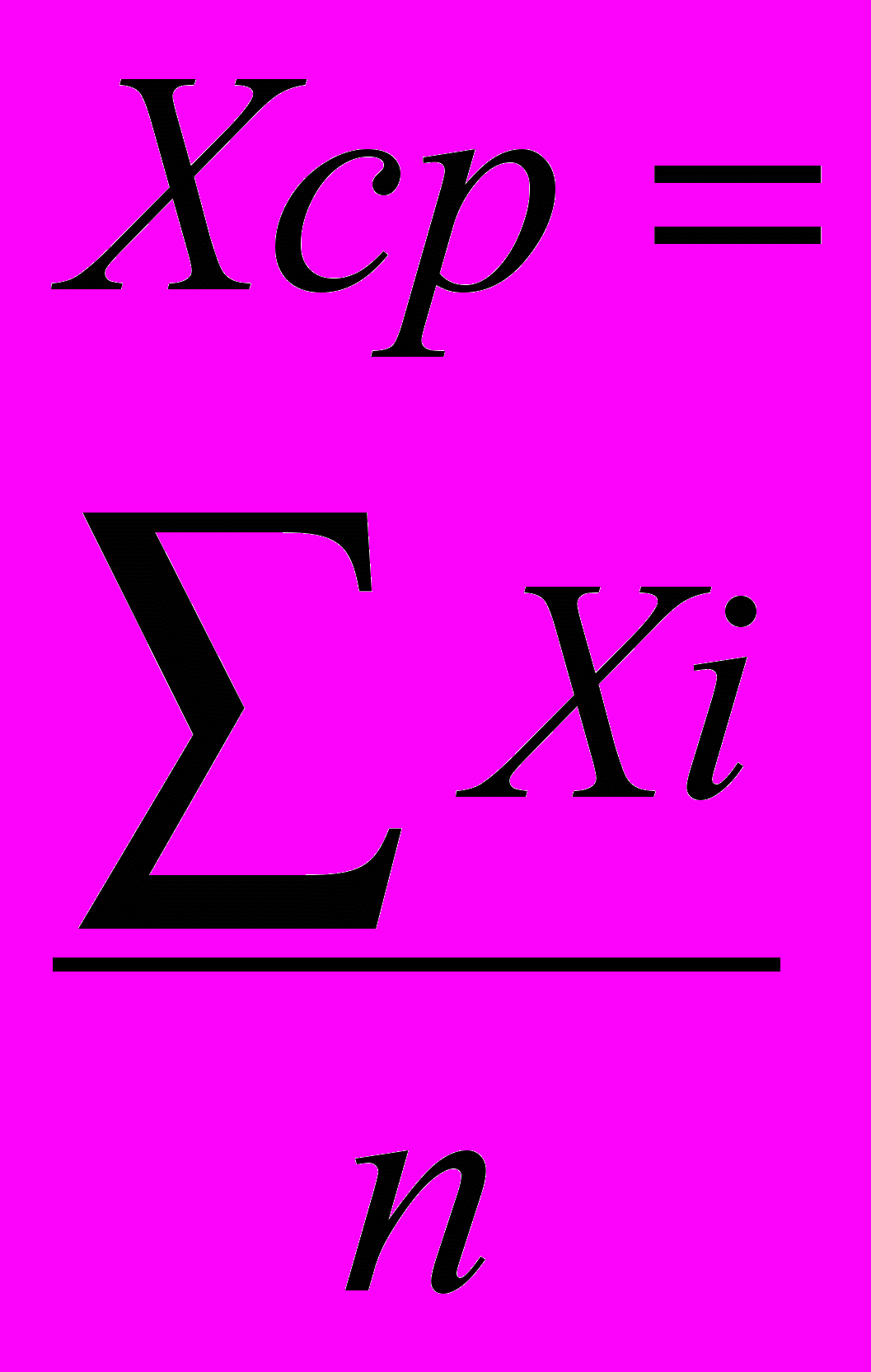 | 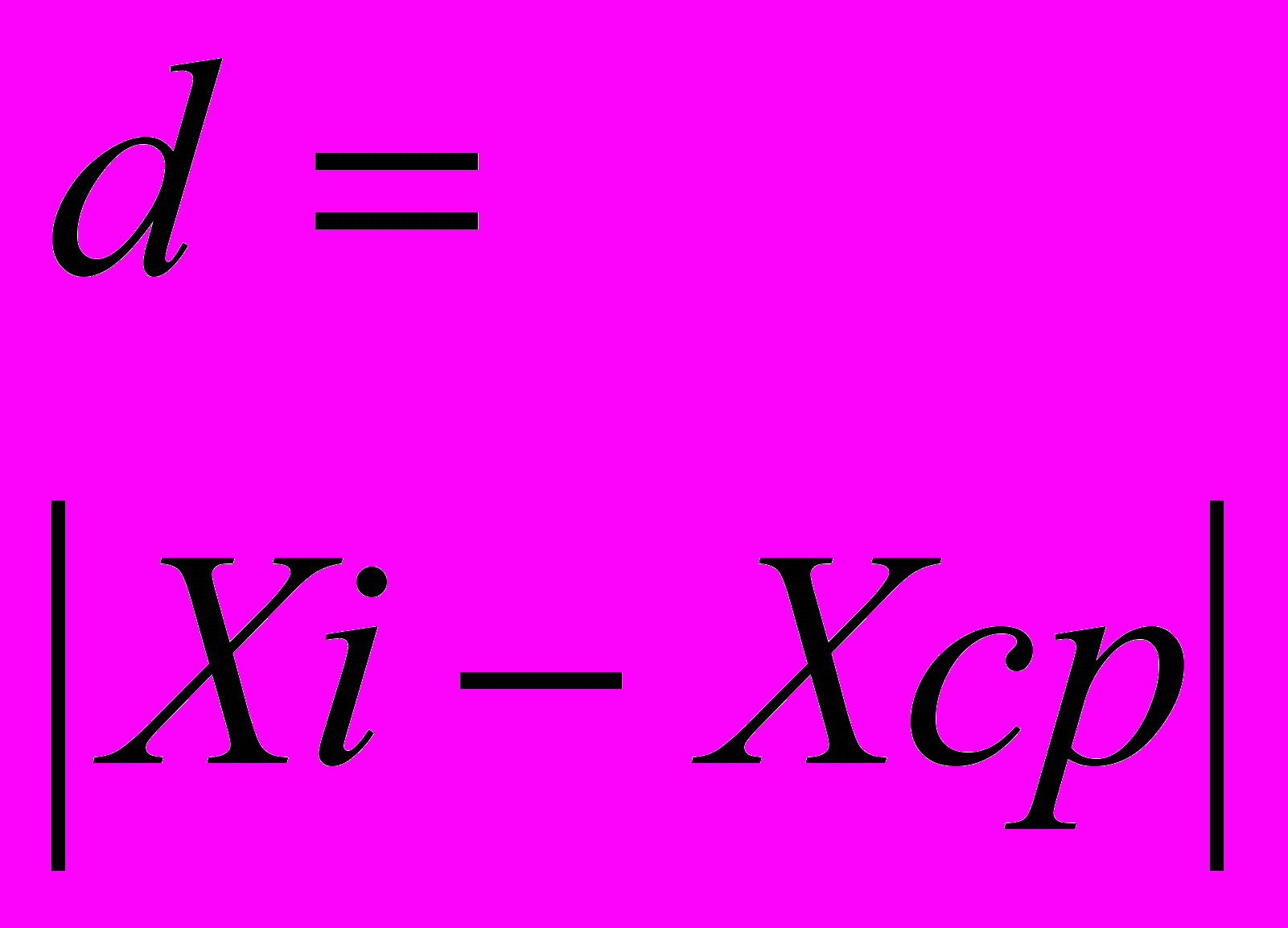 | 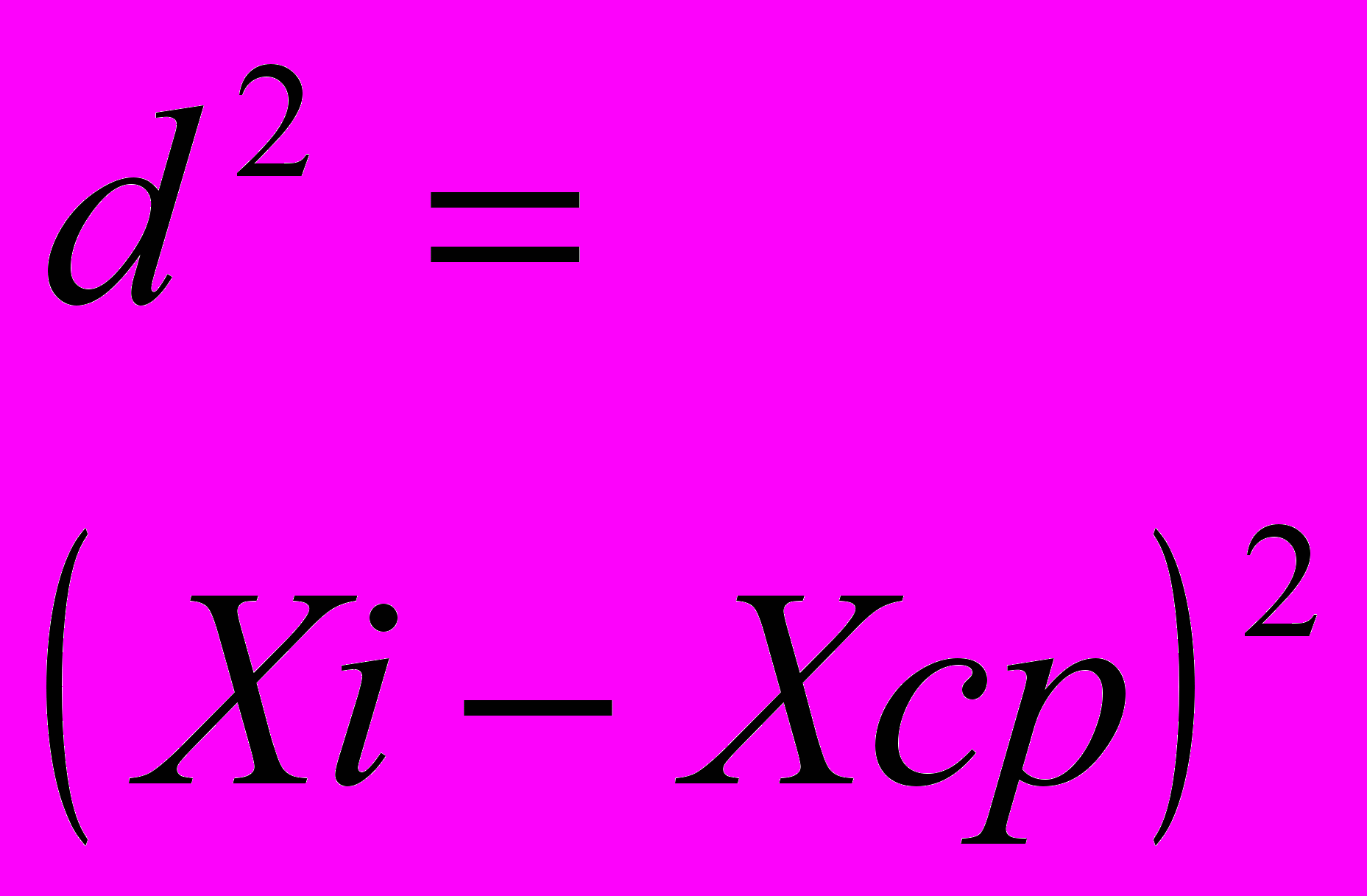 | 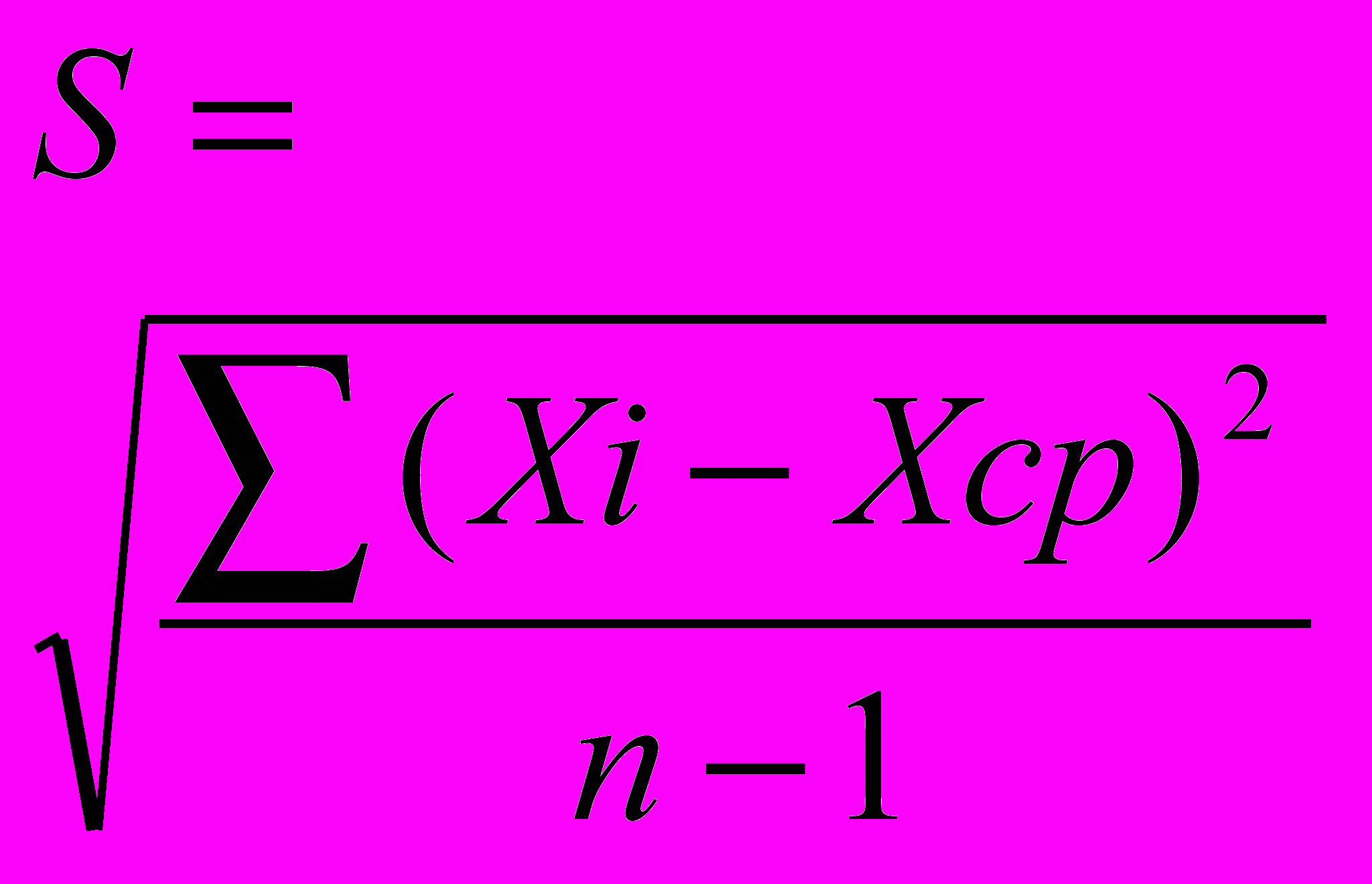 | 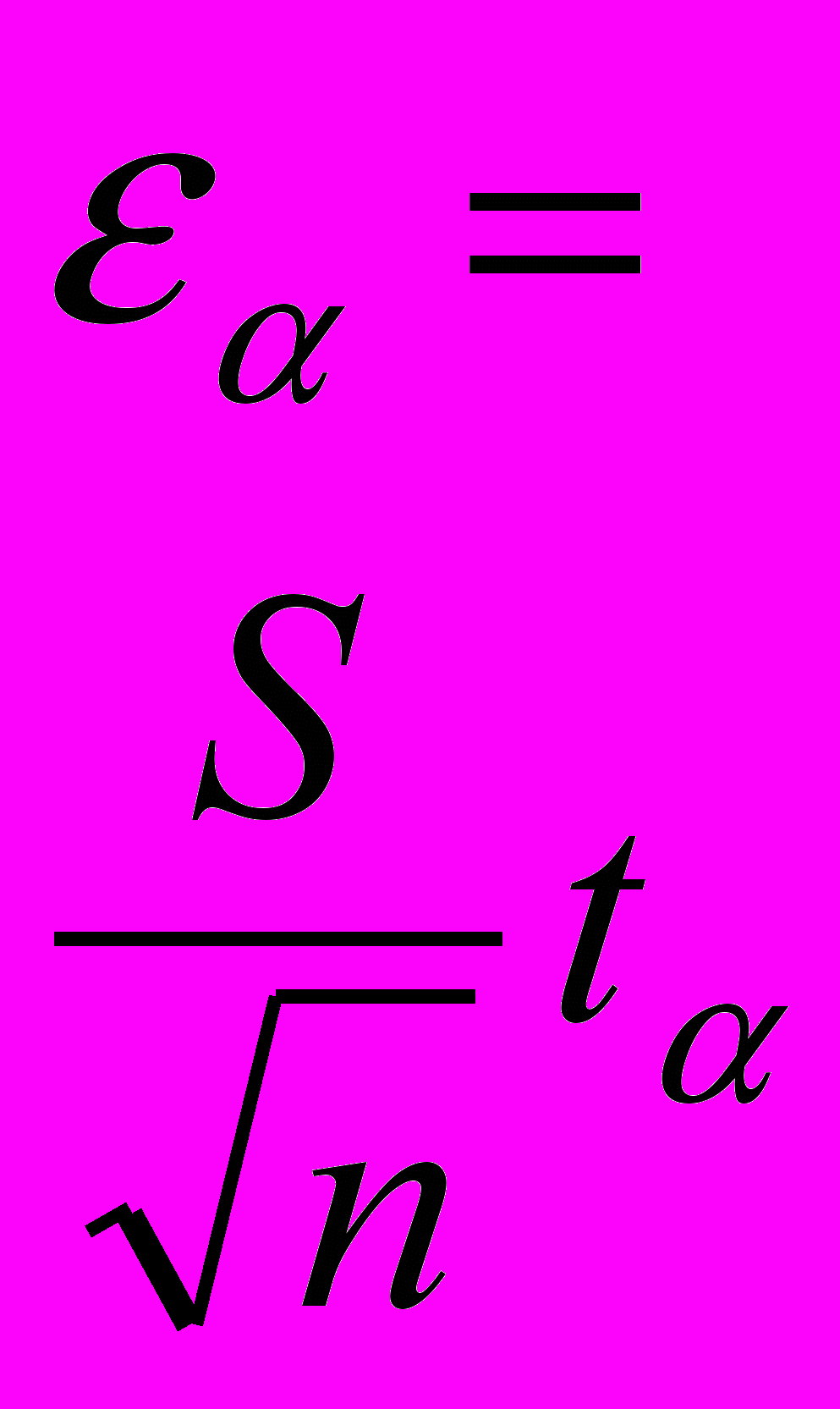 | Результат, ед. n=5 α=0,95 tα=2,78 |
| 1 | 542 | 542 | 0 | 0 | 0,5 | 0,6 | 542±1 |
| 2 | 542 | 0 | 0 | ||||
| 3 | 542 | 0 | 0 | ||||
| 4 | 541 | 1 | 1 | ||||
| 5 | 542 | 0 | 0 |
Таблица 56 - Ошибка измерений интенсивности флуоресценции.
| № | Xi, ед. | 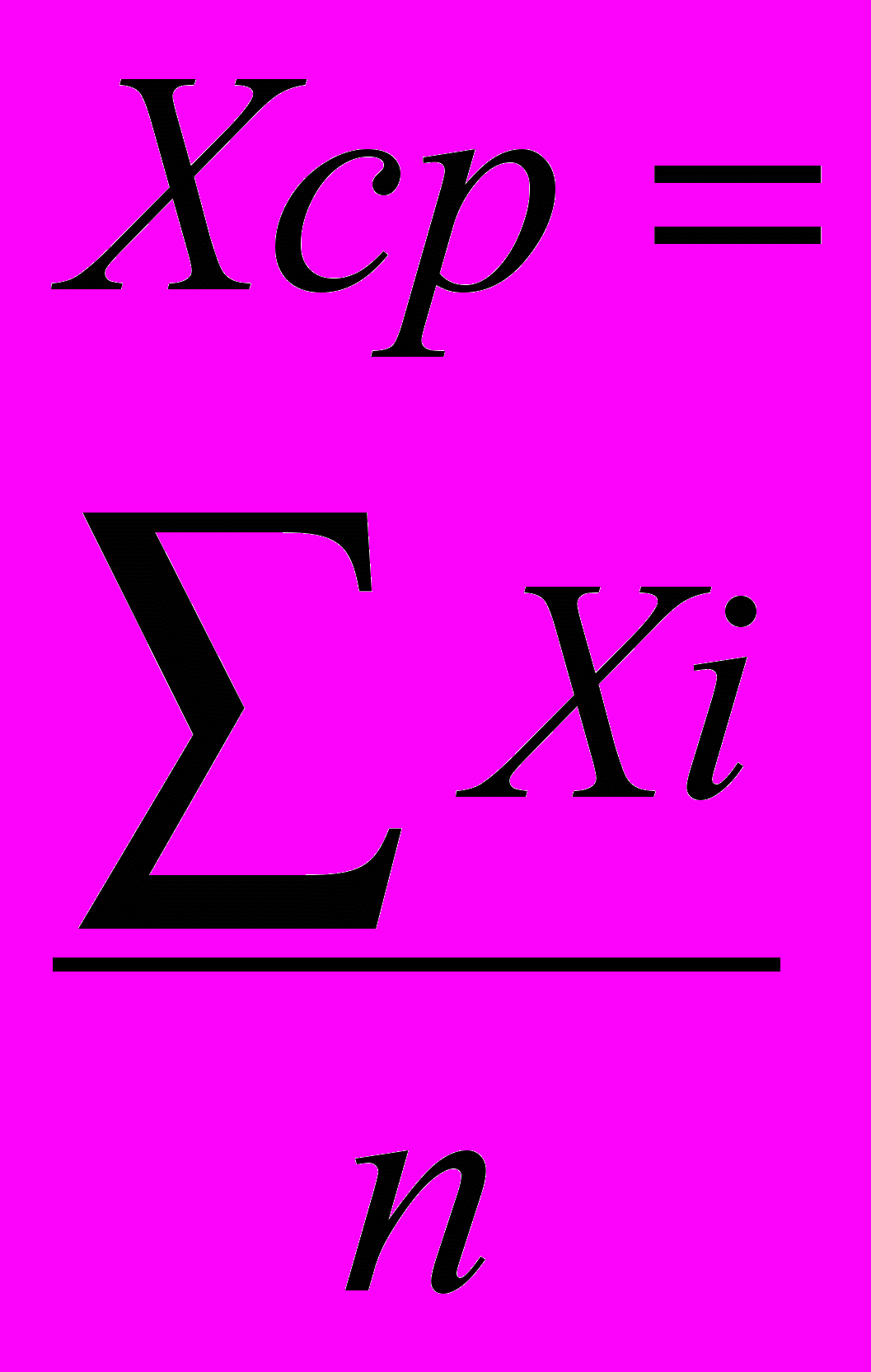 | 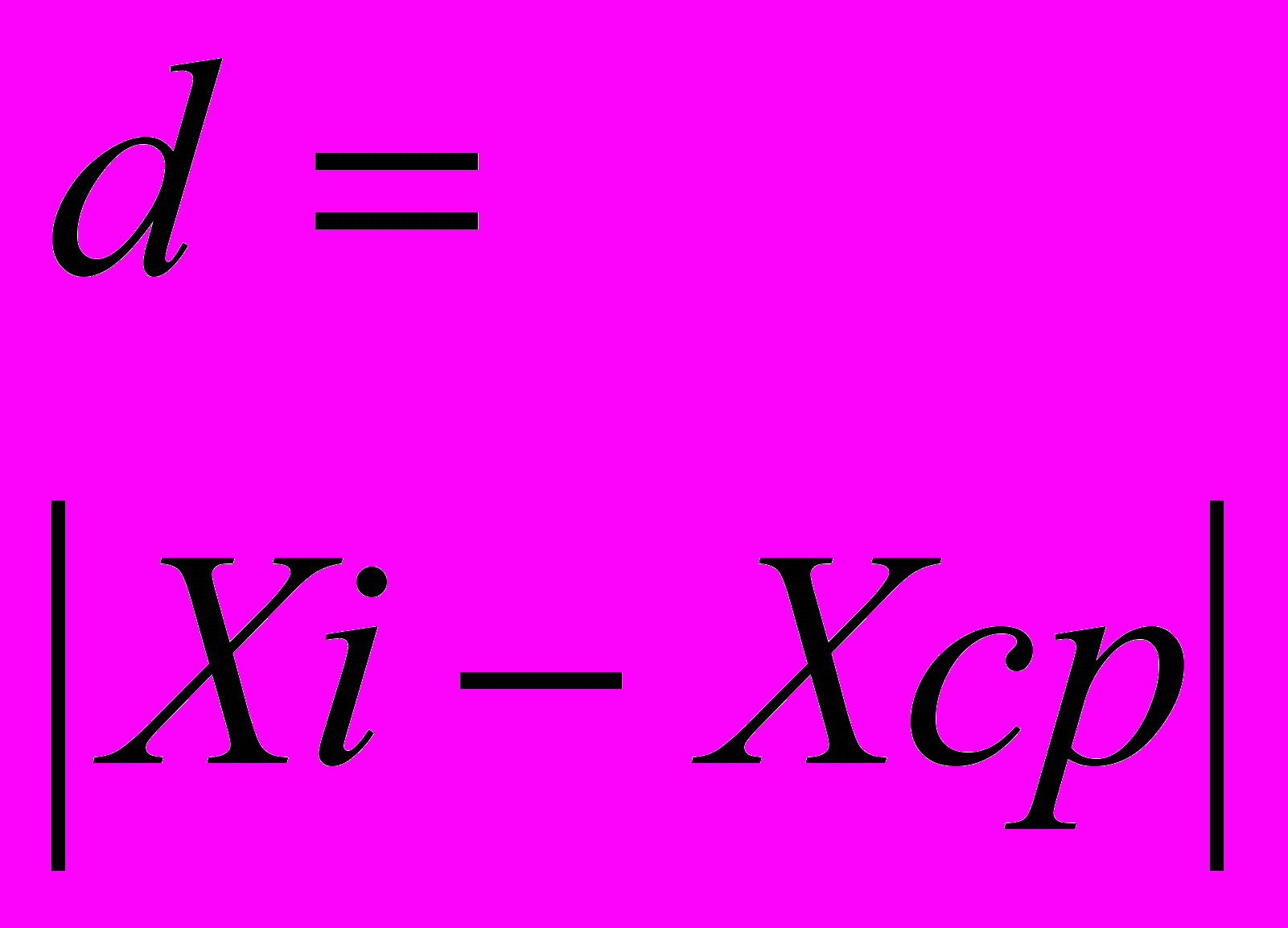 | 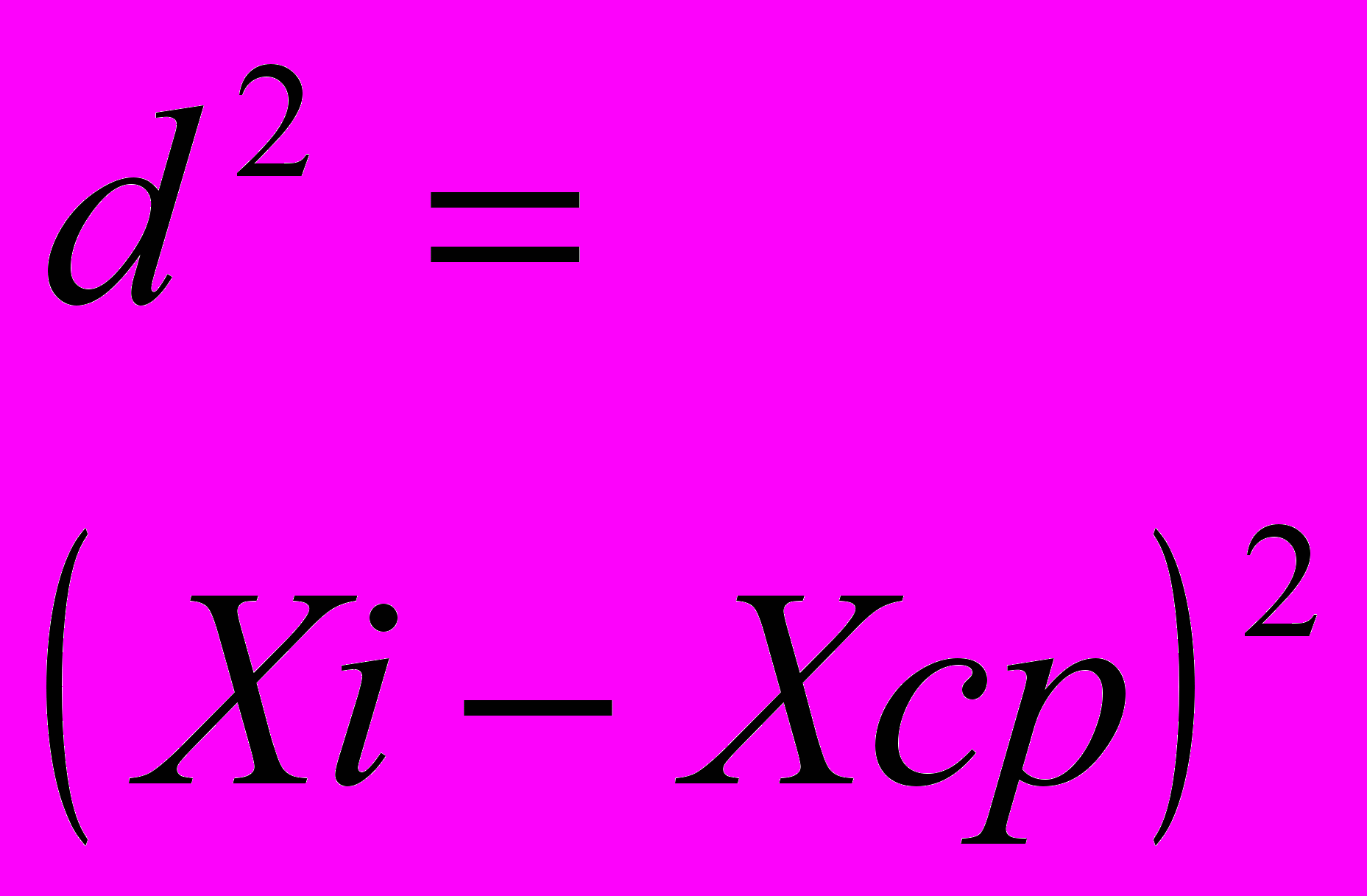 | 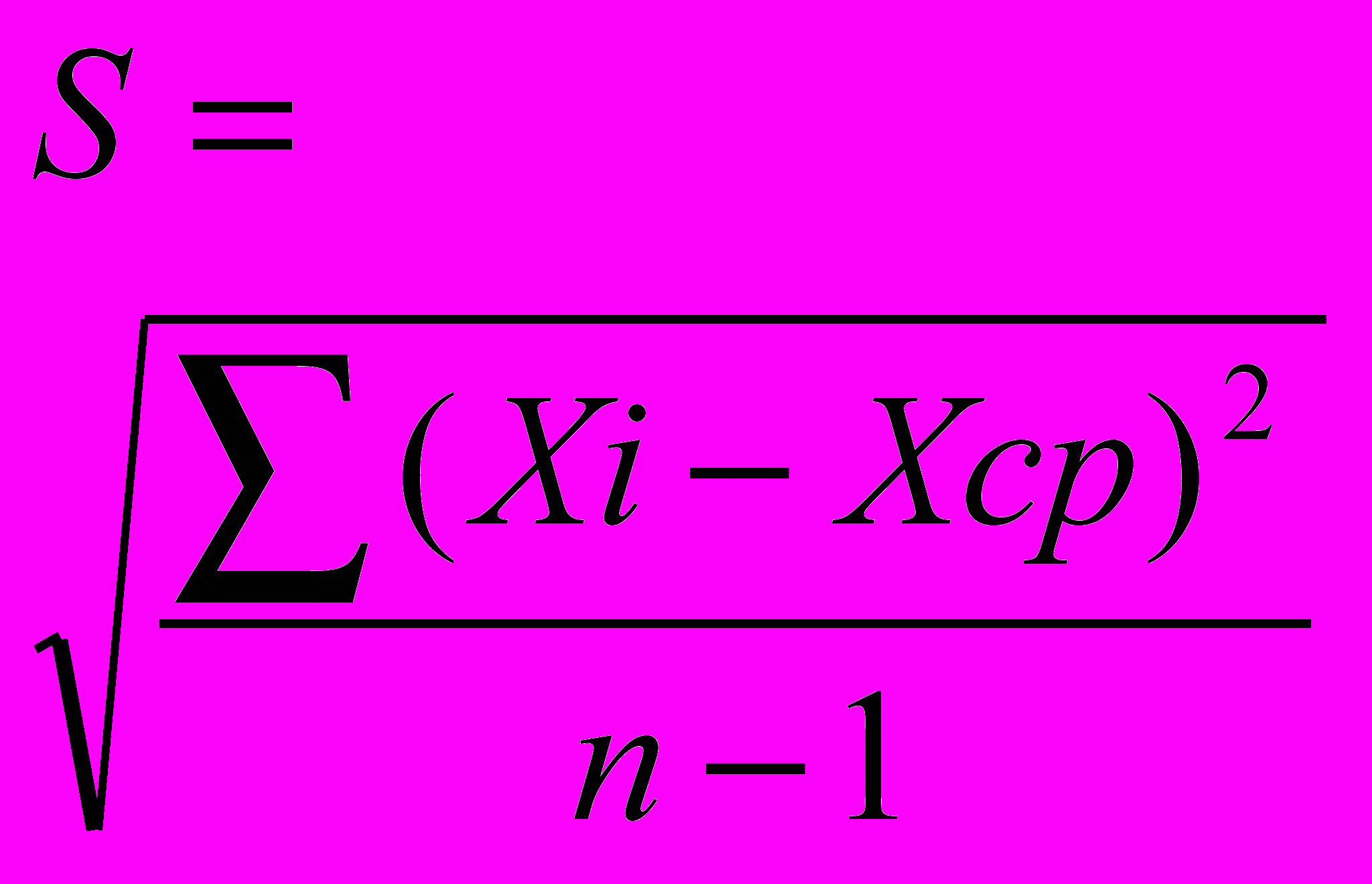 | 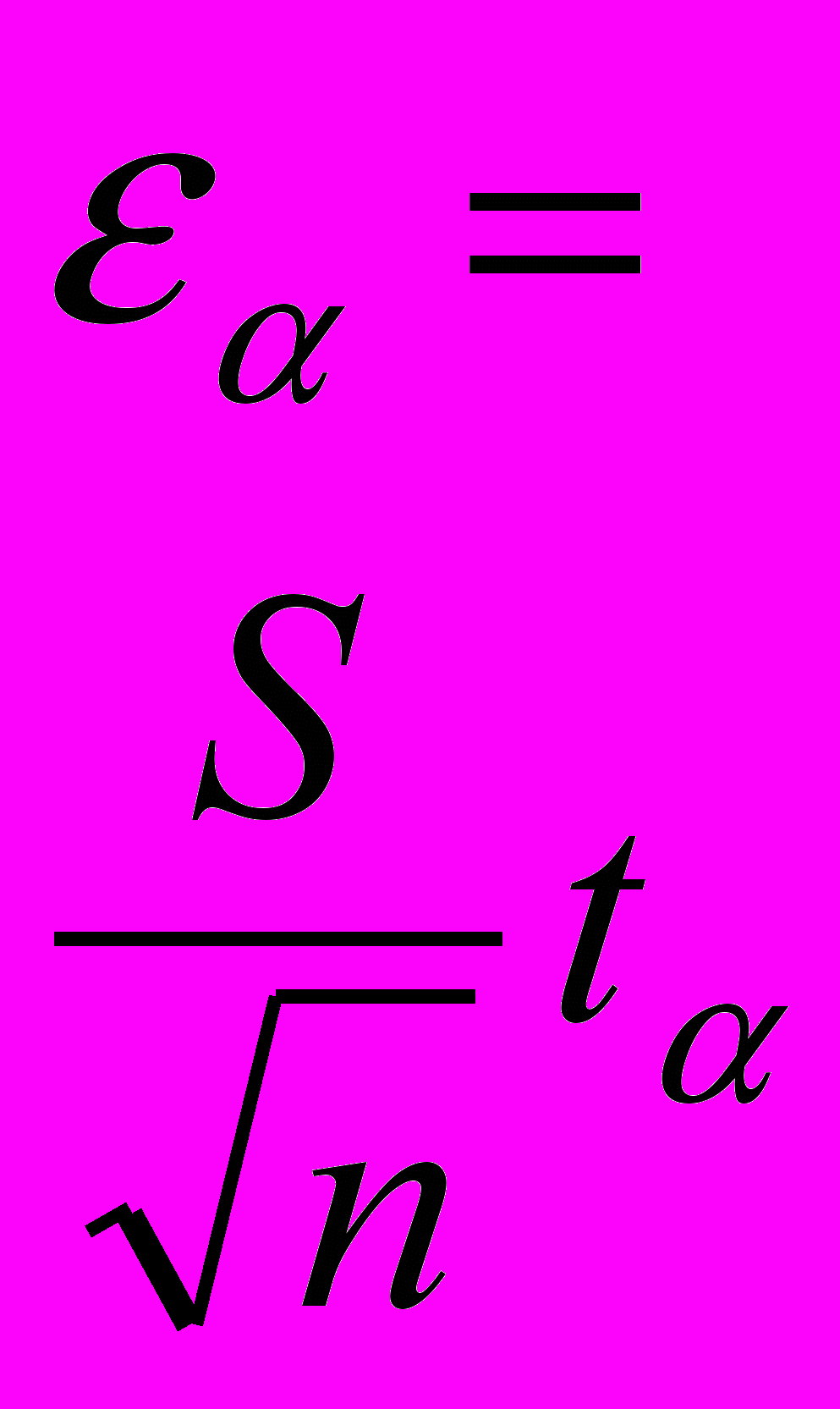 | Результат, ед. n=5 α=0,95 tα=2,78 |
| 1 | 409 | 409 | 0 | 0 | 0,5 | 0,6 | 409±1 |
| 2 | 409 | 0 | 0 | ||||
| 3 | 409 | 0 | 0 | ||||
| 4 | 408 | 1 | 1 | ||||
| 5 | 409 | 0 | 0 |
3.5.2. Сравнительный анализ спектров поглощения и флуоресценции хемосенсорных материалов на основе МКС
Спектральные характеристики соединения №1, иммобилизованного в полимерную матрицу ПВБ.
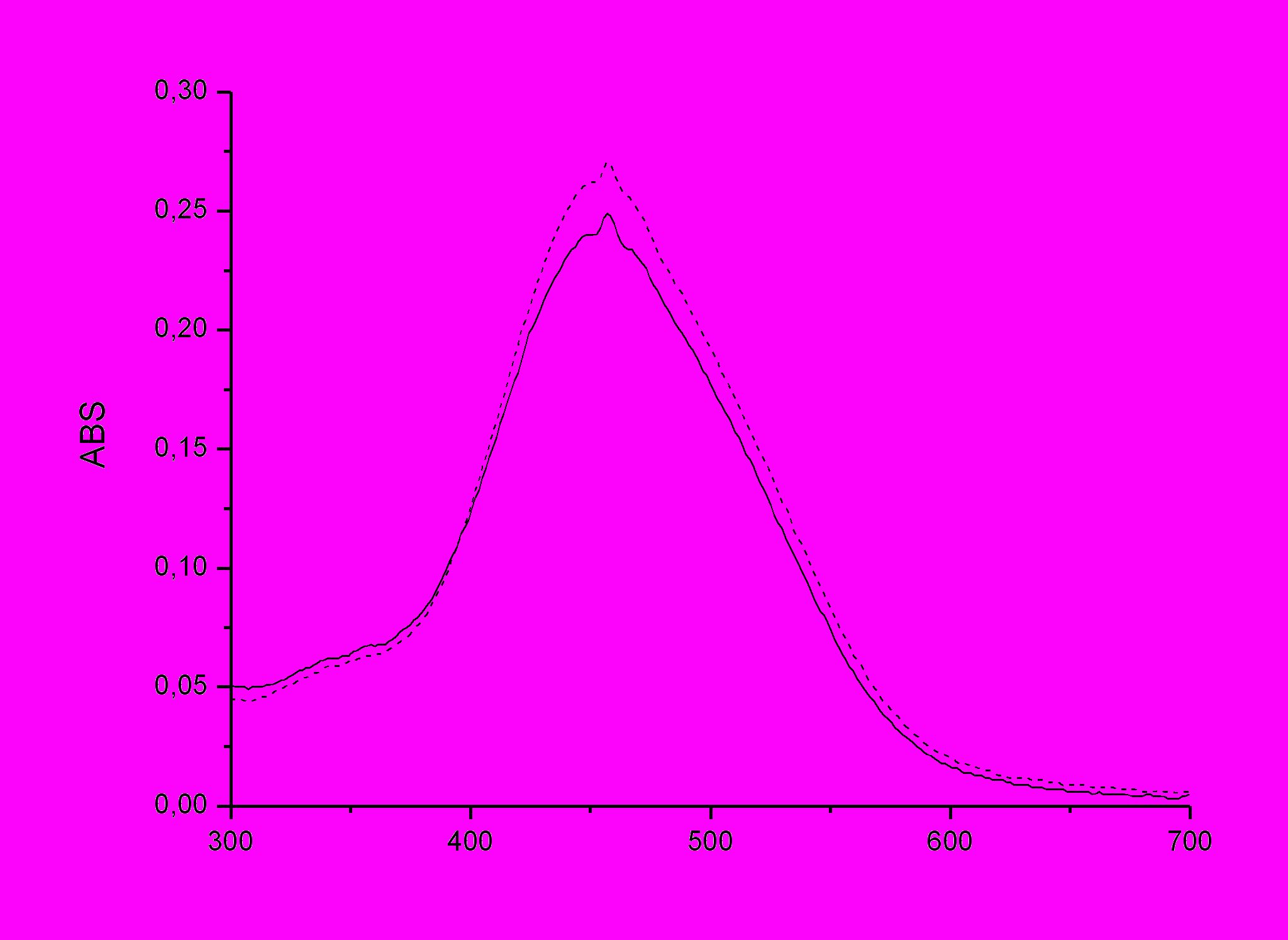
Впервые получены полимерные материалы с иммобилизованным соединением № 1. Проведены исследования фоточувствительных свойств соединения №1 в полимерных пленках на основе ПВБ (толщина пленки 10 мкм) до и после воздействия на них растворов аналитов (водные растворы перхлоратов ртути и серебра с концентрациями 10-3, 10-5 и 10-7 моль/л). Исследовали спектры поглощения и флуоресценции полимера с добавлением ОМС № 1 до и после выдерживания в растворе аналита в области 300-700 нм. По изменению интенсивности поглощения и флуоресценции, а также по сдвигу λ максимума можно судить об образовании супрамолекулярных комплексов краун-эфира и катиона металла. В пленке ПВБ максимум поглощения соединения №1 наблюдается в области 463 нм при интенсивности 0,270 ед. После воздействия растворов перхлоратов ртути и серебра с концентрациями 10-3 и 10-5 моль/л сдвигов не наблюдалось. Интенсивность поглощения снижается незначительно (на 0,010).
 , нм  |
| Рисунок 24 - Спектр поглощения ОМС №1 в пленке ПВБ до (пунктирная линия) и после (сплошная линия) пропитки в растворе перхлората ртути с концентрацией 10-3 моль/л. |
Таблица 57 - Поглощение в полимерных пленках на основе ПВБ с иммобилизованным соединением № 1, до и после пропитки раствором перхлората ртути.
| полимер + ОМС | 0, нм | I0, ед. (до пропитки) | Hg2+ моль/л | , нм | I, ед. (после пропитки) | сдвиг , нм | ΔΙ/I0 % |
| ПВБ + 1 | 463±3 | 0.254±0,043 | 10-3 | 463±3 | 0.227±0,043 | 0 | -11 |
| ПВБ + 1 | 463±3 | 0.273±0,043 | 10-5 | 463±3 | 0.262±0,043 | 0 | -4 |
| ПВБ + 1 | 463±3 | 0.259±0,043 | 10-7 | 463±3 | 0.232±0,043 | 0 | -10 |
 , нм  |
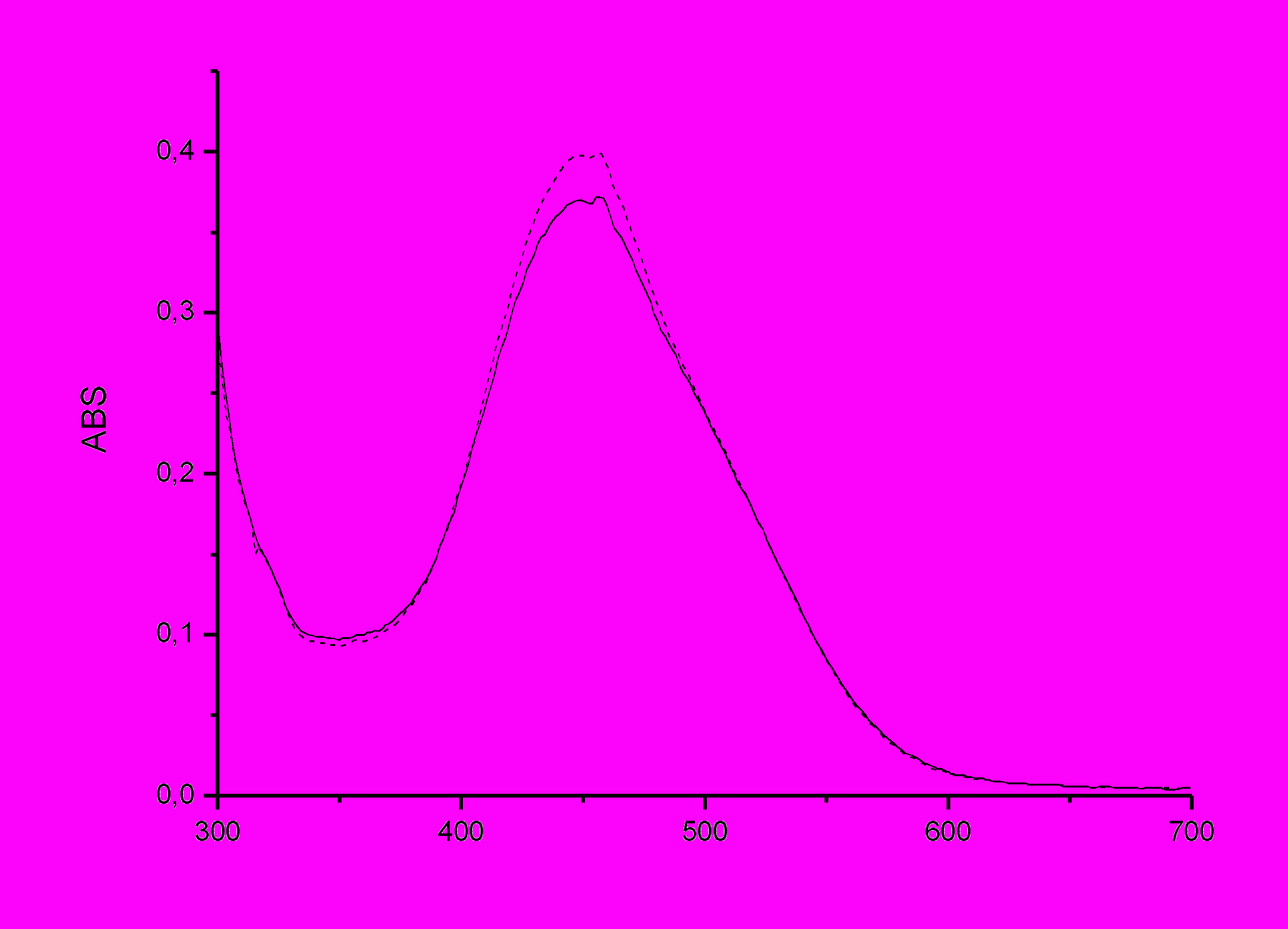
| Рисунок 25 - Спектр поглощения ОМС №1 в пленке ПВБ до (пунктирная линия) и после (сплошная линия) пропитки в растворе перхлората серебра с концентрацией 10-3 моль/л. |
Таблица 58 - Поглощение в полимерных пленках на основе ПВБ с иммобилизованным соединением № 1, до и после пропитки раствором перхлората серебра.
| полимер + ОМС | 0, нм | I0, ед (до пропитки) | Аg+ моль/л | , нм | I, ед (после пропитки) | сдвиг , нм | ΔΙ/I0 % |
| ПВБ +1 | 462±3 | 0,270±0,043 | 10-3 | 462±3 | 0,253±0,043 | 0 | -6 |
| ПВБ + 1 | 463±3 | 0,259±0,043 | 10-5 | 463±3 | 0,232±0,043 | 0 | -10 |
| ПВБ + 1 | 463±3 | 0,273±0,043 | 10-7 | 463±3 | 0,262±0,043 | 0 | -4 |
Максимум флуоресценции фиксируется при длине волны 595 нм при интенсивности 600 ед. После воздействия растворов перхлоратов ртути и серебра с концентрациями 10-3 и 10-5 моль/л сдвигов максимумов флуоресценции не наблюдалось. При этом интенсивность флуоресценции не изменяется.
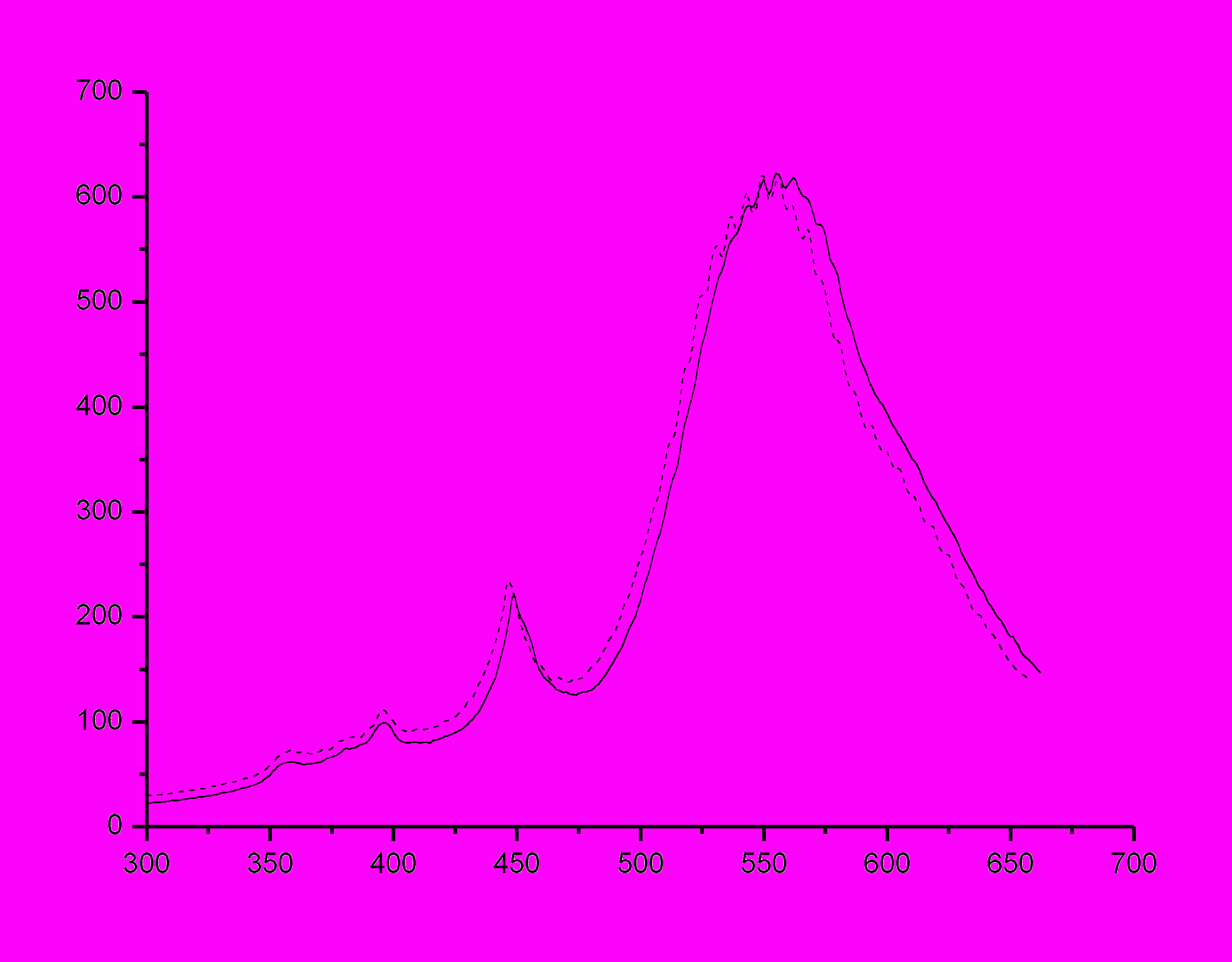 , нм  |
| Рисунок 26 - Спектр флуоресценции ОМС №1 в пленке ПВБ до (пунктирная линия) и после (сплошная линия) пропитки в растворе перхлората ртути с концентрацией 10-3 моль/л. Extinction wavelength 463 nm. |
Таблица 59 - Флуоресцентные характеристики полимерных пленок на основе ПВБ, содержащих соединение № 1, до и после пропитки растворами перхлората ртути.
| полимер + ОМС | 0, нм | I0 ед (до пропитки) | Hg2+ моль/л | , нм | I, ед (после пропитки) | сдвиг , нм | ΔΙ/I0 % |
| ПВБ + 1 | 595±1 | 609±1 | 10-3 | 595±1 | 603±1 | 0 | -1 |
| ПВБ + 1 | 595±1 | 603±1 | 10-5 | 595±1 | 604±1 | 0 | 0 |
| ПВБ + 1 | 595±1 | 575±1 | 10-7 | 595±1 | 602±1 | 0 | -5 |
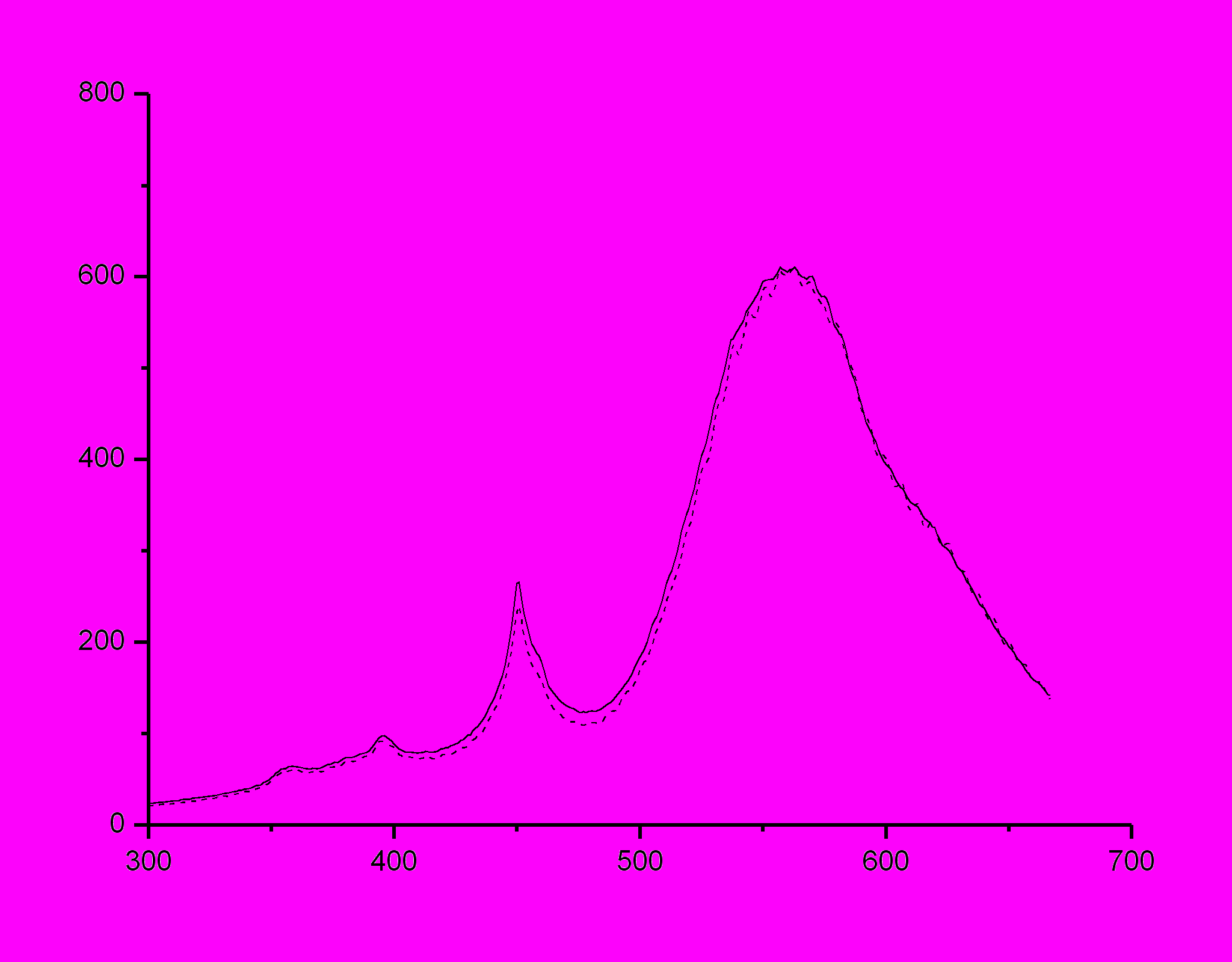 , нм  , нм |
| Рисунок 27 - Спектр флуоресценции ОМС №1 в пленке ПВБ до (пунктирная линия) и после (сплошная линия) пропитки в растворе перхлората серебра с концентрацией 10-3 моль/л. Extinction wavelength 463 nm. |
Таблица 60 - Флуоресцентные характеристики полимерных пленок на основе ПВБ, содержащих соединение № 1 до и после пропитки растворами перхлората серебра.
| полимер + ОМС | 0, нм | I0, ед. (до пропитки) | Аg+ моль/л | , нм | I, ед (после пропитки) | сдвиг , нм | ΔΙ/I0 % |
| ПВБ + 1 | 595±1 | 609±1 | 10-3 | 595±1 | 603±1 | 0 | -1 |
| ПВБ + 1 | 595±1 | 575±1 | 10-5 | 595±1 | 602±1 | 0 | -5 |
| ПВБ + 1 | 595±1 | 603±1 | 10-7 | 595±1 | 604±1 | 0 | 0 |
Величина сдвига максимума поглощения в растворе ОМС № 1 заметна в случае растворов соли серебра и незначительна в случае растворов соли ртути (в пределах ошибки измерения), тогда как в полимерной пленке на основе ПВБ сдвиг полностью отсутствует. Поэтому можно предположить, что соединение № 1 в пленках ПВБ не образует комплексов с катионами ртути и серебра. В связи с этим это соединение неперспективно для дальнейших исследований при его иммобилизации в другие полимерные матрицы. С другой стороны, важно понять условия, при которых возможно образование комплексов с катионами ртути, что следует из теоретических предпосылок.
С этой целью были проведены работы по получению и исследованию модельных мембран в виде мономолекулярных слоев ОМС № 1 на границе раздела фаз и их взаимодействия с катионами ртути.
