Отчет о научно-исследовательской работе
| Вид материала | Отчет |
- Реферат отчет о научно-исследовательской работе состоит, 61.67kb.
- Отчёт о научно-исследовательской работе за 2011 год, 1208.93kb.
- Отчёт о научно-исследовательской работе за 2009 год, 851.3kb.
- Отчёт онаучно-исследовательской работе гу нии но ур за 2010 год, 997.69kb.
- Отчет о научно-исследовательской работе профессорско-преподавательского состава, 617.56kb.
- Отчет о научно-исследовательской работе; пояснительная записка к опытно-конструкторской, 14.47kb.
- Отчет о научно-исследовательской работе (итоговый), 2484.06kb.
- Отчет о научно-исследовательской работе, 2473.27kb.
- Отчет о научно-исследовательской работе, 392.92kb.
- Задачи секции: широкое привлечение учеников к участию в научно исследовательской работе;, 67.94kb.
Таблица 27 - Биохимические показатели сыворотки крови ряда животных [21].
Показатели | собаки | кошки | лошади | коровы | овцы | свиньи | козы |
| АЛТ, МЕ | 8,2-57,3 | 8,3-52,5 | 2,7-20,5 | 6,9-35,3 | 14,8-43,8 | 21,7-46,5 | 15,3-52,3 |
| Амилаза, МЕ | 269,5-1462,4 | 371,3-1192,6 | 46,7-188,1 | 41,3-98,3 | 140,0-270,0 | 43,5-88,0 | - |
| Щелочная Фосфотаза, МЕ | 10,6-100,7 | 12,0-65,1 | 70,1-226,8 | 17,5-152,7 | 26,9-156,1 | 41,0-176,1 | 61,3-283,3 |
| АСТ, МЕ | 8,9-48,5 | 9,2-39,5 | 115,7-287,0 | 45,3-110,2 | 49,0-123,3 | 15,3-55,3 | 66,0-230,0 |
| CPK(CK) МЕ | 13,7-119,7 | 17,0-150,2 | 34,0-165,6 | 14,4-107,0 | 7,7-101,0 | 65,7-489,4 | 16,3-47,7 |
| ГГТ, МЕ | 1,0-9,7 | 1,8-12,0 | 2,7-22,4 | 4,9-25,7 | 19,6-44,1 | 31,0-52,0 | 20,0-50,0 |
| ЛДГ, МЕ | 24,1-219,2 | 35,1-224,9 | 102,3-340,6 | 308,6-938,1 | 83,1-475,6 | 159,6-424,7 | 78,5-265,3 |
| SDH, МЕ | 3,1-7,6 | 2,4-6,1 | 1,2-8,5 | 6,1-18,4 | 3,5-20,6 | 0,5-4,9 | 9,3-20,7 |
| Бикарбонат, ммоль/л | 18,1-24,5 | 16,4-22,0 | 21,7-29,4 | 20,7-28,9 | 20,3-26,7 | 18,0-27,0 | - |
| Кальций, ммоль/л | 2,2-3,0 | 2,0-2,7 | 2,6-3,3 | 2,1-3,8 | 2,3-2,9 | 2,3-2,9 | 2,3-2,9 |
| Хлор, ммоль/л | 102,1-117,4 | 107,5-129,6 | 97,2-110,1 | 95,7-108,6 | 100,8-113,0 | 97,1-106,4 | 100,3-111,5 |
| Фосфор, ммоль/л | 1,0-2,0 | 1,3-2,4 | 0,7-1,7 | 1,4-2,5 | 1,3-2,4 | 1,8-3,0 | 1,2-3,1 |
| Магний, ммоль/л | 0,7-1,1 | 0,8-1,2 | 0,7-1,1 | 0,7-1,2 | 0,8-1,1 | 0,9-1,4 | 0,9-1,2 |
| Калий, ммоль/л | 3,8-5,6 | 3,8-5,3 | 2,8-4,7 | 4,0-5,8 | 4,3-6,3 | 4,4-6,5 | 3,8-5,7 |
| Натрий, ммоль/л | 140,3-153,9 | 145,8-158,7 | 133,3-147,3 | 134,5-148,1 | 141,6-159,6 | 139,2-152,5 | 136,5-151,5 |
| Билирубин, ммоль/л | 0,9-10,6 | 1,2-7,9 | 5,4-51,4 | 0,7-14,0 | 0,7-8,6 | 0,3-8,2 | 1,7-4,3 |
| Холестерол, ммоль/л | 3,0-6,6 | 1,8-4,2 | 1,8-3,7 | 1,6-5,0 | 1,1-2,3 | 2,1-3,5 | 1,7-3,5 |
| Креатинин, мкмоль/л | 44,3-138,4 | 48,6-165,0 | 76,8-174,5 | 55,8-162,4 | 75,8-174,3 | 69,6-207,7 | 59,7-134,8 |
| Глюкоза, ммоль/л | 3,4-6,0 | 3,4-6,9 | 3,5-6,3 | 2,3-4,1 | 2,4-4,5 | 3,7-6,4 | 2,7-4,2 |
| Азот мочевины ммоль/л | 3,1-9,2 | 5,5-11,1 | 3,7-8,8 | 2,8-8,8 | 3,7-9,3 | 2,9-8,8 | 4,5-9,2 |
| Альбумин г/л | 25,8-39,7 | 24,5-37,5 | 25,3-37,6 | 27,5-39,4 | 26,7-36,8 | 22,6-40,4 | 23,5-35-7 |
| Альбумин/ Глобулин | 0,7-1,9 | 0,6-1,2 | 0,5-1,5 | 0,6-1,3 | 0,4-0,8 | 0,4-0,7 | 0,6-1,1 |
| Глобулин г/л | 20,6-37,0 | 24,4-47,0 | 23,5-45,8 | 28,9-48,6 | 32,3-50,0 | 39,5-60,0 | 27,0-44,3 |
| Общий белок г/л | 55,1-75,2 | 57,5-79,6 | 57,1-79,1 | 61,6-82,2 | 58,9-78,1 | 58,3-83,2 | 61,0-74,5 |
Таблица 28 – Биохимический состав сыворотки крови животных [26].
| Показатели | КРС | Овцы | Свиньи | Лошади |
| Кальций, ммоль/л | 1,62-3,37 | 2,1-3,38 | 1,25-3,5 | 2,5-3,5 |
| Фосфор неорг., ммоль/л | 0,81-2,72 | 0,55-3,0 | 1,29-3,42 | 0,5-2,26 |
| Калий ммоль/л | 3,84-6,53 | 3,3-7,3 | 4,1-7,16 | 2,8-9,04 |
| Натрий ммоль/л | 126,3-161,9 | 112,6-157,1 | 140,8-162,8 | 126,3-154,0 |
| Магний ммоль/л | 0,53-1,64 | 0,74-1,44 | 0,82-1,48 | 0,7-2,05 |
| Железо, мкмоль/л | 15,2-37,6 | 11,6-26,8 | 28,64-42,96 | 17,0-35,8 |
| Медь мкмоль/л | 6,28-24,3 | 7,85-39,2 | 11,5-47,1 | 5,49-47,1 |
| Цинк мкмоль/л | 15,3-33,7 | 12,1-35,2 | 8,26-35,2 | 9,18-24,5 |
| Хлор, ммоль/л | 86,0-113,1 | 90,2-124,9 | 88,5-107,2 | 95,0-105,7 |
| Липиды общие.г/л | 2,5-8,59 | 1,5-5,13 | 4,0-12,0 | 1,6-2,61 |
| Триглицериды, ммоль/л | 0,03-0,55 | 0,0-0,56 | 0,22-1,28 | 0,11-1,4 |
| Фосфолипиды, ммоль/л | 0,91-4,18 | 1,17-4,0 | 1,17-3,28 | - |
| ЭЖК, г/л | 1,4-3,2 | 1,6-4,5 | - | - |
| НЭЖК, г/л | 0,03-0,6 | 0,2-0,4 | - | 0,18-0,32 |
| Общий холестерин, г/л | 0,67-2,88 | - | 0,9-1,64 | 0,77-1,5 |
| Свободный холестерин, ммоль/л | 0,18-2,09 | 0,94-1,95 | - | 0,78-1,56 |
| Эстерифицированный холестерин, г/л | 0,47-1,64 | 0,6-1,4 | 0,6-1,1 | 0,3-1,1 |
| Глюкоза, ммоль/л | 2,36-5,48 | 1,75-9,5 | 2,75-5,5 (кр.) | 1,92-5,5(кр.) |
| Молочная к-та, ммоль/л | 0,55-2,22 | 0,99-1,22 (кр.) | 0,31-1,66 (кр.) | 0,99-1,22(кр.) |
| Билир. общ., мкмоль/л | 0,34-8,21 | 0,17-8,55 | 0,17-5,13 | 8,55-47,9 |
| Билир. прям., мкмоль/л | 0,17-3,42 | 0,00-5,13 | 0,17-1,7 | 0,68-9,92 |
Таблица 29 – Биохимические показатели сыворотки крови животных [16]
| Показатели | Собаки | Кошки | Лошади |
| Аспартатаминотрансфераза, Ед | 11-42 | 9-29 | 130-300 |
| Аланинаминотрансфераза, Ед | 9-52 | 19-79 | 2,7-20,0 |
| -Амилаза, Ед | 685-2155 | 580-1720 | 4,9-16,5 |
| γ-Глутамилтрансфераза, Ед | 1-10 | 1-10 | 1-20 |
| Креатинфосфокиназа, Ед | 32-157 | 150-798 | 85-300 |
| Лактатдегидрогеназа, Ед | 23-164 | 55-155 | 100-400 |
| Фосфатаза щелочная, Ед | 18-70 | 39-55 | 70-250 |
| Билирубин общий, моль/л | 3,0-13,5 | 3,0-12,0 | 5,4-51,4 |
| Билирубин прямой, моль/л | 0,0-5,5 | 0,0-5,5 | 3,0-10,0 |
| Мочевина, моль/л | 3,5-9,2 | 5,4-12,1 | 3,5-8,8 |
| Креатинин, мкмоль/л | 26,0-120,0 | 7,-0,0-165,0 | 80,0-180,0 |
| Общий белок, г/л | 40,0-73,0 | 54,0-77,0 | 47,0-75,0 |
| Альбумин, г/л | 22,0-39,0 | 25,0-37,0 | 27,0-37,0 |
| Глюкоза, моль/л | 4,3-7,3 | 3,3-6,3 | 3,0-7,0 |
| Холестерин, моль/л | 2,9-6,5 | 1,6-3,7 | 2,3-3,6 |
| Триглицериды, моль/л | 0,24-0,98 | 0,38-1,10 | 0,1-0,4 |
| Калий, моль/л | 4,3-6,2 | 4,1-5,4 | 2,2-4,5 |
| Кальций, моль/л | 2,3-3,3 | 2,0-2,7 | 2,6-3,3 |
| Натрий, моль/л | 138-164 | 143-165 | 130-143 |
| Железо, моль/л | 20,0-30,0 | 20,0-30,0 | 13,0-23,0 |
| Магний, моль/л | 0,8-1,4 | 0,9-1,6 | 0,6-1,1 |
| Хлор, моль/л | 96,0-118,0 | 107,0-122,0 | 94,0-160,0 |
Сравнивая биохимические показатели, полученные разными авторами можно отметить существенные различия в содержании органических и неорганических веществ. Так по содержанию общего белка в сыворотке крови лошадей значения отличаются на 10-15%, фосфора в сыворотке крови КРС в 3 раза, лошадей - в 1,5 раза, свиней - в 8 раз, овец - в 3 раза. Данные о содержании холестерина в сыворотке крови для всех видов животных отличаются на 10-25%, кальция у кур в 2,5 раза, общего белка в сыворотке крови собак на 20%. У КРС содержание натрия отличается по данным разных авторов на 20%, холестерина в 2 раза, общего билирубина на 40%. У овец калий и натрий изменяются на 20%. По сравнению с иностранными источниками отмечаются ещё большие различия по всем показателям и для всех видов животных: у лошадей различия в содержании альбуминов 22%, мочевины - 24%, глюкозы - 15%, холестерина - 5%, билирубина в 2,3 раза, натрия на 10%, калия на 20%, хлора на 7%. У крс, овец, свиней отличия по всем показателям от 5 до 25 %. Таким образом, средние показатели биохимического состава сыворотки крови животных разных видов по данным разных авторов представлены в таблице 30.
Таблица 30 – Средние значения некоторых биохимических показателей сыворотки крови животных (по данным разных авторов)
| Показатель | Единицы измерения | КРС | Овцы | Свиньи | Лошади | Куры |
| Белок общий | г/л | 53-90 | 37-75 | 51-85 | 47-78 | 43-59 |
| В том числе: Альбумины | г/л | 30-50 | 35-50 | 40-55 | 27-45 | 31-35,1 |
| -глобулины | г/л | 12-20 | 13-20 | 14-20 | 14-18 | 17-19,2 |
| -глобулины | г/л | 10-16 | 7-11 | 16-21 | 20-26 | 10,9-13 |
| -глобулины | г/л | 20-40 | 20-46 | 17-26 | 18-24 | 35-37,1 |
| Билирубин общ. | мкмоль/л | 0,17-5,13 | 0,17-8,55 | 0,17-5,13 | 5,4-5,1 | 0,17-8,6 |
| Кальций общий | ммоль/л | 0,78-3,4 | 2,1-3,65 | 1,25-3,87 | 2,5-3,93 | 2,0-6,8 |
| Липиды общие | г/л | 2,5-8,59 | 1,5-5,13 | 4-35 | 1,6-2,61 | 3,6-21,0 |
| Фосфолипиды общие | ммоль/л | 0,7-4,18 | 1,17-4,0 | 0,9-3,28 | - | - |
| Триглицериды | ммоль/л | 0,03-0,55 | 0,0-0,56 | 0,22-1,28 | 0,11-1,4 | - |
| Молочная кислота | ммоль/л | 0,55-2,22 | 0,99-1,44 | 0,31-1,66 | 0,56-1,44 | 0,89-1,10 |
| Магний | ммоль/л | 0,53-1,64 | 0,74-1,83 | 0,82-1,48 | 0,60-2,05 | 0,82-1,23 |
| Мочевина | ммоль/л | 3,3-7,7 | 3,3-6,0 | 3,3-6,0 | 3,3-8,8 | 2,3-3,7 |
| НЭЖК | г/л | 0,03-1,5 | 0,2-0,4 | 0,08-0,2 | 0,18-0,32 | - |
| Фосфор неорг. | ммоль/л | 0,81-7,07 | 0,55-7,56 | 1,2-8,02 | 0,5-5,81 | 1,10-2,42 |
| Холестерин | ммоль/л | 0,67-5,1 | 0,94-3,64 | 1,56-3,3 | 1,43-3,6 | 2,8-5,2 |
3.1.3. Метод сканирующей электронной микроскопии клеток крови.
Метод сканирующей электронной микроскопии является современным важным методом для исследования различных твердых и жидких биологических объектов, в том числе клеток крови животных. С помощью растрового или сканирующего электронного микроскопа FEI Quanta 600 FEG (РЭМ) можно получить изображения различных объектов с увеличением, превышающим 100 000 крат, с большим числом элементов разложения («пикселов»). РЭМ состоит из катода с полевой эмиссией и интегрированной комплексной системой микроанализа TRIDENT XM 4, состоящей из энергодисперсионного спектрометра (EDS), спектрометра с волновой дисперсией (WDS) и системы анализа структуры и текстуры кристаллических материалов методом дифракции отраженных электронов (EBSD) РЭМ позволяет проводить исследования клеток крови с разрешением порядка 2 нм и минимальными затратами времени на препарирование объектов, обеспечивая их наблюдение с исключительной глубиной резкости.

Рисунок 2 - Сканирующий электронный микроскоп полевой эмиссии с комплексной системой микроанализа.
Методика подготовки клеток крови изучения в РЭМ.
Клетки крови для исследования в РЭМ необходимо вначале зафиксировать. Фиксация заключается в сшивке мембран за счет реакции некоторых альдегидов с белками мембраны. Для исследования в РЭМ в качестве фиксатора клеток крови применяется глутаровый деальдегид. Все методики приготовления образцов можно объединить в одну систему: 1) помещение клеток крови в 1% раствор глутарового диальдегида на фосфатном буфере рН 7,4 и фиксация в течение 20-30 мин; 2) отделение клеток от фиксатора при центрифугировании (1500 об/мин); 3) промывка полученного осадка клеток дистиллированной водой (3-4 раза) для удаления следов фиксатора; 4) дегидратация клеток крови в серии спиртов (50, 60, 70, 80, 95%) или ацетона (60, 70, 90, 95, 100%) в течение 10-30 мин с повторением этой процедуры несколько раз; 5) приготовление суспензии клеток в 100% растворе ацетона, нанесение их на стекло или металлическую подложку. Высушивание мазка в струе горячего воздуха (45°С).
При фиксации клеток крови их помещают в раствор желатиноля из расчета 1 мл крови на 4 мл раствора и добавляли глутаровый диальдегид так, чтобы его концентрация в растворе была 0,5%. Затем клетки фиксируют в течение 10 мин, после этого их осаждают и сливают раствор фиксатора. К клеткам добавляют 1% раствор глутарового диальдегида в физиологическом растворе. Общее время фиксации составляет 60 мин. Затем клетки троекратно промывают дистиллированной водой. Готовые образцы клеток наносят на стекло или металлическую подложку. Если необходимо зафиксировать ткань с находящимися на ней клетками крови, целесообразно поместить ткань в раствор желатина и первый этап фиксации проводить аналогично описанному для клеток крови.
Перед изучением образцов в РЭМ на их поверхность направляют слой углерода или тяжелого металла (серебро, золото, палладий) толщиной 20-30 нм, чтобы снять электрический заряд с поверхности образца. Образец с металлическим столбиком помещают в прибор и при помощи гониометрического столбика создают необходимый угол обзора (10-45°). Ускоряющее напряжение при наблюдении составляет 4 и 10 кВ.
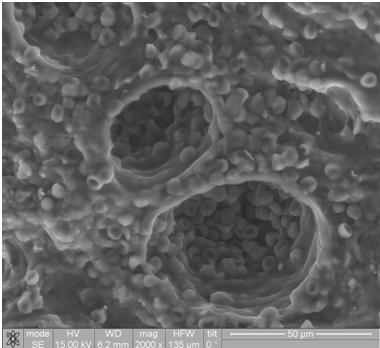
Рисунок 3 - Эритроциты в просвете сосуда (миометрий). Изображение получено с помощью РЭМ.

Рисунок 4 - Гемолиз эритроцитов в сосудистом русле при шоке. Изображение получено с помощью РЭМ.
Для проведения элементарного анализа используется детектор для регистрации спектров характеристического рентгеновского излучения фирмы EPAX, детекторы интегрированы с растровым электронным микроскопом Quanta 600 FEG. Микроэлементный анализ основан на возникновении непрерывного флуоресцентного излучения при бомбардировке исследуемых образцов пучком первичных рентгеновских лучей. Рентгеноспектральный анализ может быть использован для количественного определения элементов в микрообъёмах материалов сложного химического состава. Основу микроанализатора составляет микрофокусная рентгеновская трубка, объединённая с оптическим микроскопом.
Специальная электронно–оптическая система формирует тонкий электронный зонд, который бомбардирует небольшую, примерно 1 –2 мк, область исследуемого шлифа, помещённого на аноде, и возбуждает рентгеновские лучи, спектральный состав которых далее анализируется с помощью спектрографа с изогнутым кристаллом. Такой прибор позволяет проводить рентгеноспектральный анализ шлифа «в точке» на несколько элементов или исследовать распределение одного из них вдоль выбранного направления. Абсолютная чувствительность метода 10-13 –10-15 грамм.
3.1.4. Метод люминесцентной микроскопии крови.
Люминесцентная микроскопия основана на свойстве многих веществ давать свечение - люминесценцию в УФ-лучах или в сине-фиолетовой части спектра света. Ряд биологических веществ, таких как простые белки, коферменты, некоторые витамины, лекарственные средства (ЛС) обладают собственной (первичной) люминесценцией. Другие вещества начинают светиться при добавлении к ним специальных красителей - флюорохромов (вторичная люминесценция). Флюорохромы могут распределяться в клетке диффузно, но могут избирательно окрашивать отдельные клеточные структуры или определённые химические соединения. На этом основано использование люминесцентной микроскопии в цитологических и гистохимических исследованиях.
Иммунофлюоресценция позволяет выявлять различные АГ и их концентрацию в клетках, при этом возможна идентификация вирусов, определение AT и иммунных комплексов, гормонов, различных продуктов метаболизма и др. Люминесцентную микроскопию применяют для диагностики вирусных инфекций, с помощью вторичной люминесценции диагностируют злокачественные опухоли в гистологических и цитологических препаратах, определяют очаги ишемии мышцы сердца при ранних сроках инфаркта миокарда, выявляют амилоид в биоптатах тканей и т. д.
Люминесцентная или флуоресцентная микроскопия состоит в наблюдении под микроскопом зелено-оранжевого свечения микрообъектов, которое возникает при их освещении сине-фиолетовым светом или не видимыми глазом ультрафиолетовыми лучами. В оптическую схему микроскопа вводятся два светофильтра. Один из них помещают перед конденсором. Он пропускает от источника-осветителя излучение только тех длин волн, которые возбуждают люминесценцию либо самого объекта (собственная люминесценция), либо специальных красителей, введённых в препарат и поглощённых его частицами (вторичная люминесценция). Второй светофильтр, который установлен после объектива, пропускает к глазу наблюдателя (или на фоточувствительный слой) только свет люминесценции. В люминесцентной микроскопии используют освещение препаратов как сверху (через объектив, который в этом случае служит и конденсором), так и снизу, через обычный конденсор. Наблюдение при освещении сверху иногда называют «люминесцентной микроскопией в отражённом свете» (этот термин условен — возбуждение свечения препарата не является простым отражением света). Его часто используют совместно с наблюдением по фазово-контрастному методу в проходящем свете. Метод нашел широкое применение в микробиологии, вирусологии, гистологии, цитологии, в пищевой промышленности, при исследовании почв, в микрохимическом анализе, в дефектоскопии. Такое многообразие применений объясняется очень высокой цветовой чувствительностью глаза и высокой контрастностью изображения самосветящегося объекта на тёмном нелюминесцирующем фоне. Кроме того, информация о составе и свойствах исследуемых веществ, которую можно получить, зная интенсивность и спектральный состав их люминесцентного излучения, имеет огромную ценность.
3.1.5 . Исследование реологических свойств сыворотки крови животных
Ещё одним методом исследования крови является реологическое исследование, определение вязкости цельной крови. Вязко-эластичные свойства крови зависят от многих параметров: вязкость плазмы, деформации красных кровяных тел, образования скоплений и гематокрита. Наблюдается зависимость вязкости крови от количества и объема эритроцитов, общего содержания белка и соотношения его фракций в плазме, а также от содержания в крови углекислоты. Углекислый газ повышает вязкость крови, а кислород – понижает, поэтому вязкость венозной крови несколько больше, чем артериальной. Фактически этот показатель связан с количеством белков плазмы, дисперсностью, т.е. величиной коллоидальных частиц белка, и количеством и качеством взвешенных в плазме кровяных шариков. Повышение вязкости отмечается при сгущении крови и некоторых видах лейкозов (эритремии, миелофиброзах), опорожнении депо крови, содержащей большее число эритроцитов, обильном белковом питании, потении, венозных застоях, острых экссудативных процессах, понижение — при первичных и вторичных анемиях.
Вязкость сыворотки по отношению к воде, приравненной к единице, колеблется от 1,5 до 2,0. Вязкость цельной крови – от 3,5 до 5-6. Так как вязкость находится в зависимости от содержания в крови гемоглобина, количества и объёма эритроцитов, поэтому она существенно ниже для сыворотки по сравнению с цельной кровью.
Таблица 31 – Вязкость крови разных видов животных.
| Вид животного | Вязкость крови | ||
| Данные №1, [13] | Данные №2, [5] | ||
| кровь | сыворотка | ||
| КРС | 4,6-5,2 | | 1,87 |
| Лошади | 3,8-4,8 | | 2,04 |
| Верблюды | 4,3-5,2 | | - |
| Козы | 5,0-6,0 | | 1,75 |
| Свиньи | 4,8-6,2 | 5,9 | 1,69 |
| Овцы | 4,2-5,0 | | 1,61 |
| Собаки | 4,7-5,5 | 4,7 | 1,74 |
| Кошки | 4,2-5,0 | 4,2 | - |
| Кролики | 3,5-4,5 | 3,3 | 1,49 |
| Куры | 4,5-5,5 | | - |
Показатели вязкости крови для животных разного вида отличаются незначительно и изменяются в небольших пределах от 4,2 до 5,5, ниже на 15-20% эти показатели только для кроликов (таблица 6). Вязкость сыворотки крови у кроликов тоже самая низкая, ниже на 12-15% по сравнению с другими животными, а самая высокая она у лошадей, выше на 12-17%. Интересно, что для лошадей разных направлений использования показатель вязкости крови отличается: минимальные значения у беспородных лошадей, максимальные – у рысаков, выше на 10-40%, у тяжеловозов значения вязкости крови имеют минимальный разброс и занимают среднее положение, а вязкость сыворотки одинакова (таблица 7). У здорового организма наблюдается выраженный «параллелизм» между количеством гемоглобина и вязкостью крови.
Таблица 32 – Вязкость крови лошадей [4].
| Направление использования | Вязкость крови | Вязкость сыворотки |
| Рысаки | 3,7-7,2 | 1,72-2,04 |
| Тяжеловозы | 4,4-4,7 | 1,72-2,04 |
| Беспородные лошади | 3,4-5,0 | 1,72-2,04 |
Таким образом, для оценки состояния обмена веществ, функций отдельных органов, систем и физиолого-биохимического статуса организма в целом очень важно разносторонне исследовать кровь и её составные части. Для этого уже используются гематологические, биохимические и другие методы, но новая глубина познания физиолого-биохимических процессов, происходящих в организме, позволяет создавать новые методы комплексной оценки изменений, происходящих в системе крови. Одним из них является метод межфазной тензиометрии, основанный на измерении динамического поверхностного натяжения сыворотки крови и объединяющий реологические и биохимические исследования.
3.1.6. Методы измерения поверхностного натяжения сыворотки крови.
Организм является гетерогенной системой с большим количеством поверхностей раздела фаз. Поверхностное натяжение (ПН) цитоплазмы клеток на границе с окружающей их жидкой средой имеет низкие значения, равные в среднем от 0,2 до 2,0×10-4 мН/м [4]. Чем меньше поверхностное натяжения на границе соприкосновения клеток, тем легче они изолируются друг от друга. Поверхностное натяжение определяет форму некоторых клеток. Например, яйцеклетки и лейкоциты при освобождении от действия поверхностного натяжения принимают форму шара, теряя активность. Изменение поверхностного натяжения на поверхностях клеток и органелл играет важную роль в таких процессах, как клеточное деление, фагоцитоз, пиноцитоз, амебоидное движение, изменение проницаемости клеточных мембран и др.
В состав сыворотки крови входят вещества, обладающие поверхностно активными свойствами (белки, липиды и др.). Они способны адсорбироваться на жидких границах раздела фаз и изменять ПН. При изменении физиолого-биохимического статуса организма происходит изменение концентраций этих веществ в сыворотке крови и изменяется её ПН.
Одним из первых способов исследования ПН биологических жидкостей был метод максимального давления в пузырьке. Значения ПН полученные этим методом с помощью прибора Ребиндера для сыворотки крови животных представлены в таблице 33.
Известны десятки методов изучения поверхностного натяжения, которые основаны на прямом измерении капиллярных сил, действующих на искривлённые или плоские поверхности (метод Дю-Нуи, Вильгельми, Легмюра, капиллярного поднятия, статической и динамической капли и др.), анализе формы жидкой поверхности (методы осцилирующей и суживающейся струи, формы капли или пузырька и др.) или разности давлений над искривлённой поверхностью (метод максимального давления в пузырьке, растущей капли и т.д.) [23]. Все перечисленные методы измерения ПН отличаются между собой диапазоном измеряемых времён «существования» межфазной поверхности, точностью и воспроизводимостью результатов.
При исследовании сыворотки крови важное значение приобретает измерение динамического поверхностного натяжения (ДПН) при коротких временах «существования» поверхности. Так как, если для чистых жидкостей (бензол, глицерин, вода) динамическое и статическое натяжение совпадают, то для растворов, к которым относятся все биологические жидкости, существует огромное различие в значениях статического и динамического ПН, например для раствора сывороточного альбумина при малых временах существования поверхности ПН почти не отличается от ПН воды (72 мН/м), а через 2-3 минуты ПН снижается до 15-20 мН/м. Равновесное поверхностное натяжение, т.е. ПН, которое достигается в течение длительного времени и остается постоянным для биологических жидкостей не может быть измерено напрямую, а получается как результат определённой экстраполяции значений, полученных при коротких временах «существования» поверхности.
Таблица 33 – Поверхностное натяжение сыворотки крови животных [22]
| Вид животного | Поверхностное натяжение, мН/м |
| Лошадь | 73,5 |
| КРС | 70,2 |
| Овца | 71,7 |
| Собака | 55,5-69,0 |
| Кролик | 71,5 |
В настоящее время выпускается несколько типов приборов, работающих по этому методу, которые позволяют получать кривую ДПН в диапазоне времени от 0,01 до 100 секунд с воспроизводимостью не менее 0,2%: PBS (Electronetics Comp., США), Sensadyn (Chem Dyne Research Corp., США), BPA-1P (Sinterface Technologies, ФРГ), MPT2 (Lauda, ФРГ).
Для исследования биологических жидкостей важны небольшие объёмы исследуемых проб, доступность анализа получаемых динамических величин. Этим требованиям в большей степени отвечает адаптированный для измерения биологических жидкостей прибор BPA-1P (Sinterface Technologies, ФРГ). Он проводит измерение ДПН при коротких временах «существования» поверхности от 0,01 до 100, минимальный объём пробы 3 мл, анализ тензиограмм проводится с помощью специальной компьютерная программа ADSA, позволяющей определять цифровые значения ПН для разных времён «существования» поверхности.
Принцип работы тензиометра ВРА-1Р. Воздух от компрессора поступает в капилляр, который опущен в исследуемую жидкость. С помощью электрического преобразователя определяется избыточное давление в системе, которое используется для расчёта поверхностного натяжения. Давление, необходимое для отрыва пузырька воздуха от капиллярного кончика, опущенного на границу жидкость-воздух, прямо пропорционально поверхностному натяжению () на этой границе. Электрические сигналы от всех измерительных систем поступают в электронный блок, который посредством аналого-цифрового преобразователя соединён с персональным компьютером.
Чтобы преодолеть капиллярное поднятие смачивающейся жидкости в опущенный в неё капилляр, следует приложить избыточное давление газа, зависящее от поверхностного натяжения жидкости и радиуса кривизны её мениска. Максимальное давление, возникающее при образовании пузырька газа, в процессе выдувания зависит от радиуса капиллярной трубки. По мере роста объёма пузырька газа радиус кривизны уменьшается и приближается к радиусу капилляра. В момент, когда пузырёк примет форму полусферы радиус капилляра будет равен радиусу кривизны и давление достигнет максимальной величины. При дальнейшем росте пузырька радиус кривизны вновь увеличивается, что уменьшает давление внутри пузырька, в результате воздух из капилляра устремляется в пузырёк и пузырёк отрывается [23]. Разделение интервала между пузырьками на так называемый мертвый период и «время жизни» поверхности основано на существовании критической точки зависимости давления от расхода воздуха. В этой точке происходит переход от пузырькового режима истечения газа из капилляра - к струйному.
ПН исследуемой жидкости () рассчитывается по величине измеренного избыточного давления Р по формуле Лапласа:
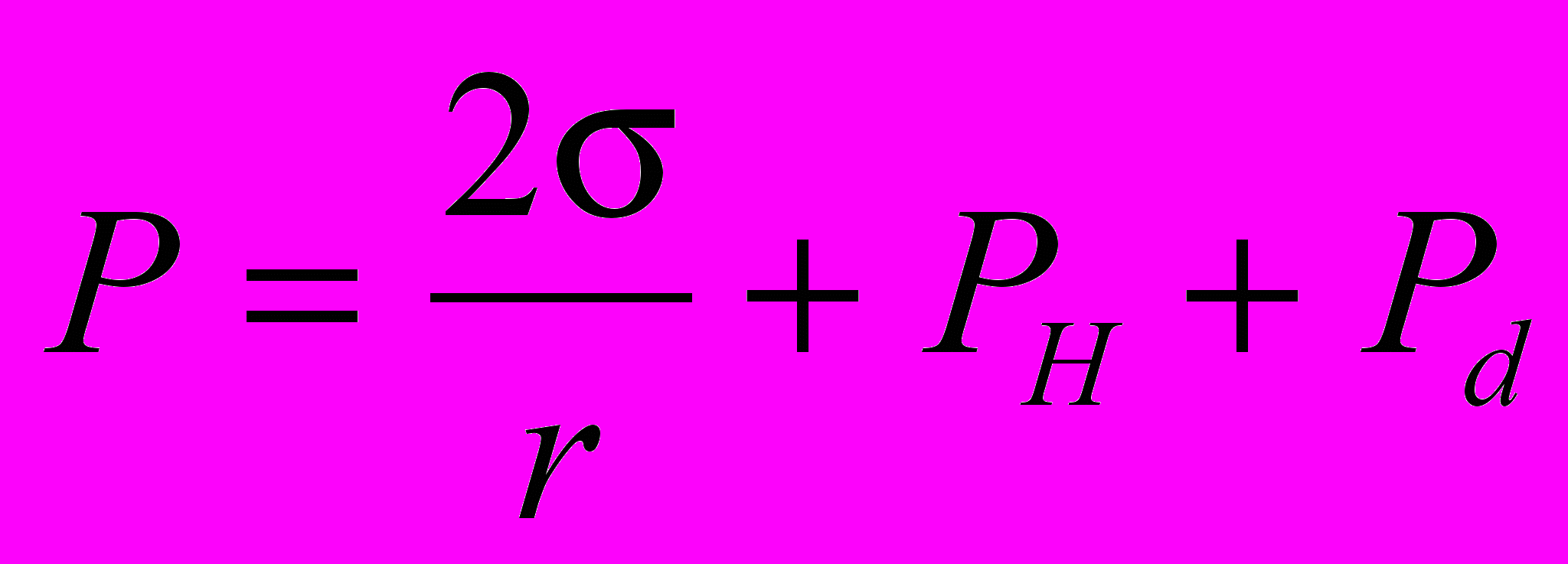 (1)
(1)где r - радиус капилляра, PН - гидростатическое давление в измерительной ячейке, Pd - динамическое давление, обусловленное вязко-инерционными эффектами. Для капилляров, используемых при исследовании биологических жидкостей, Pd0. «Время жизни» поверхности рассчитывается по формуле:
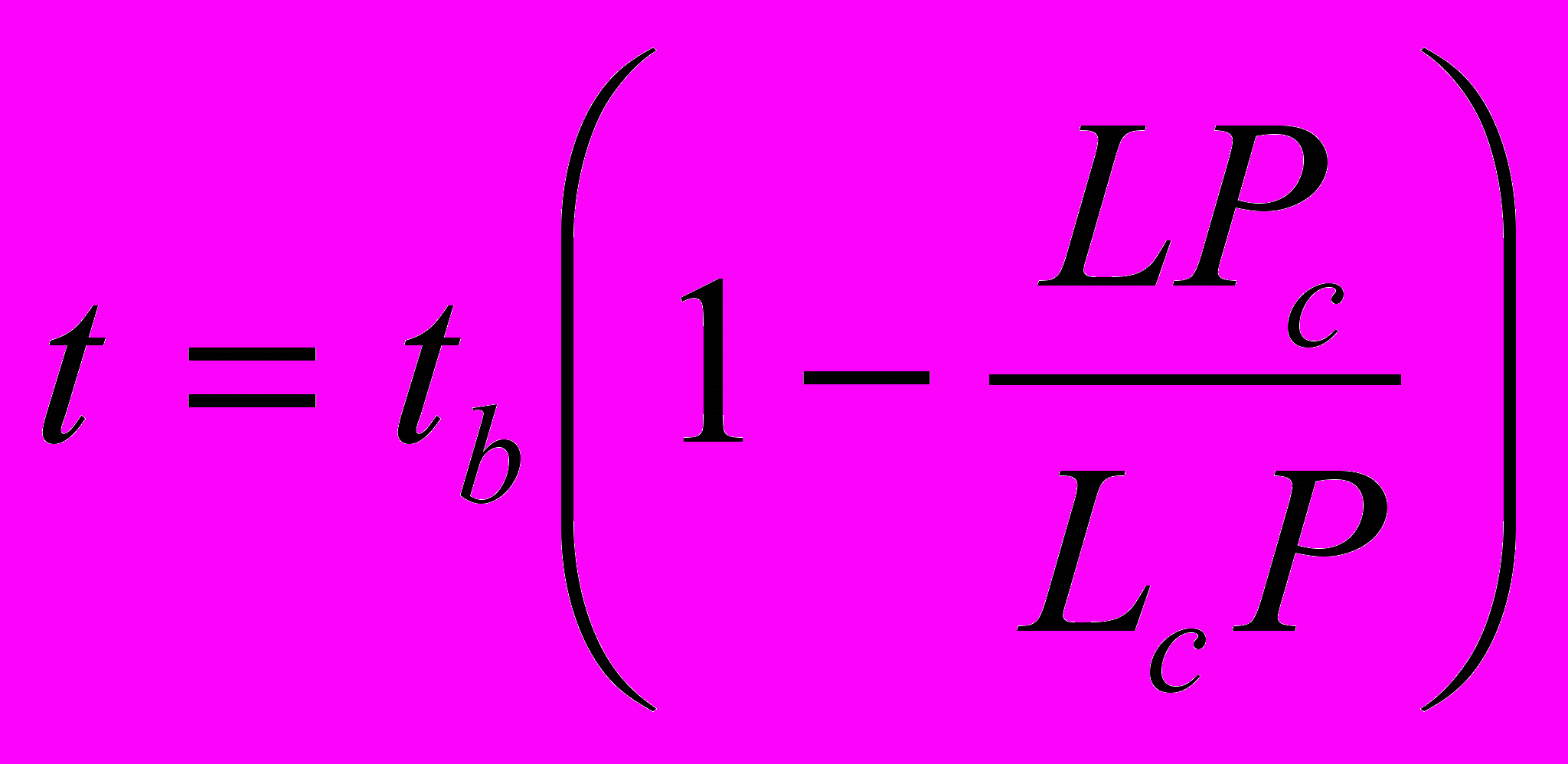 (2)
(2)где tb- измеренный интервал между пузырьками, L- объемный расход воздуха. Значения L и P с индексом “c” относятся к критической точке на зависимости P от L.
При значениях LLc имеет место так называемый струйный режим течения газа в капилляре, тогда как при L Lc на кончике капилляра формируются отдельные пузырьки со временем жизни tf0. Следует отметить, что строгая гидродинамическая теория метода максимального давления в пузырьке (учет инерции, вязкости, нестационарности и т. д.) начала развиваться лишь сравнительно недавно, однако уже было продемонстрировано, что простые соотношения (1) и (2) хорошо выполняются в случае капилляров, используемых при исследовании биологических жидкостей. Сравнение данных ВРА-1Р с другими известными методами (осциллирующей струи, объема капли, динамического капиллярного и пр.) показало хорошее совпадение результатов.
В методе максимального давления поверхность пузырька A в процессе его роста расширяется. Для учета этого явления используют вместо измеряемого (физического) времени tf так называемое эффективное «время жизни» teff, которое соответствует недеформируемой поверхности жидкости. Такой прием позволяет сравнивать различные методы, поскольку результаты измерений в данном случае не зависят от способов измерений.
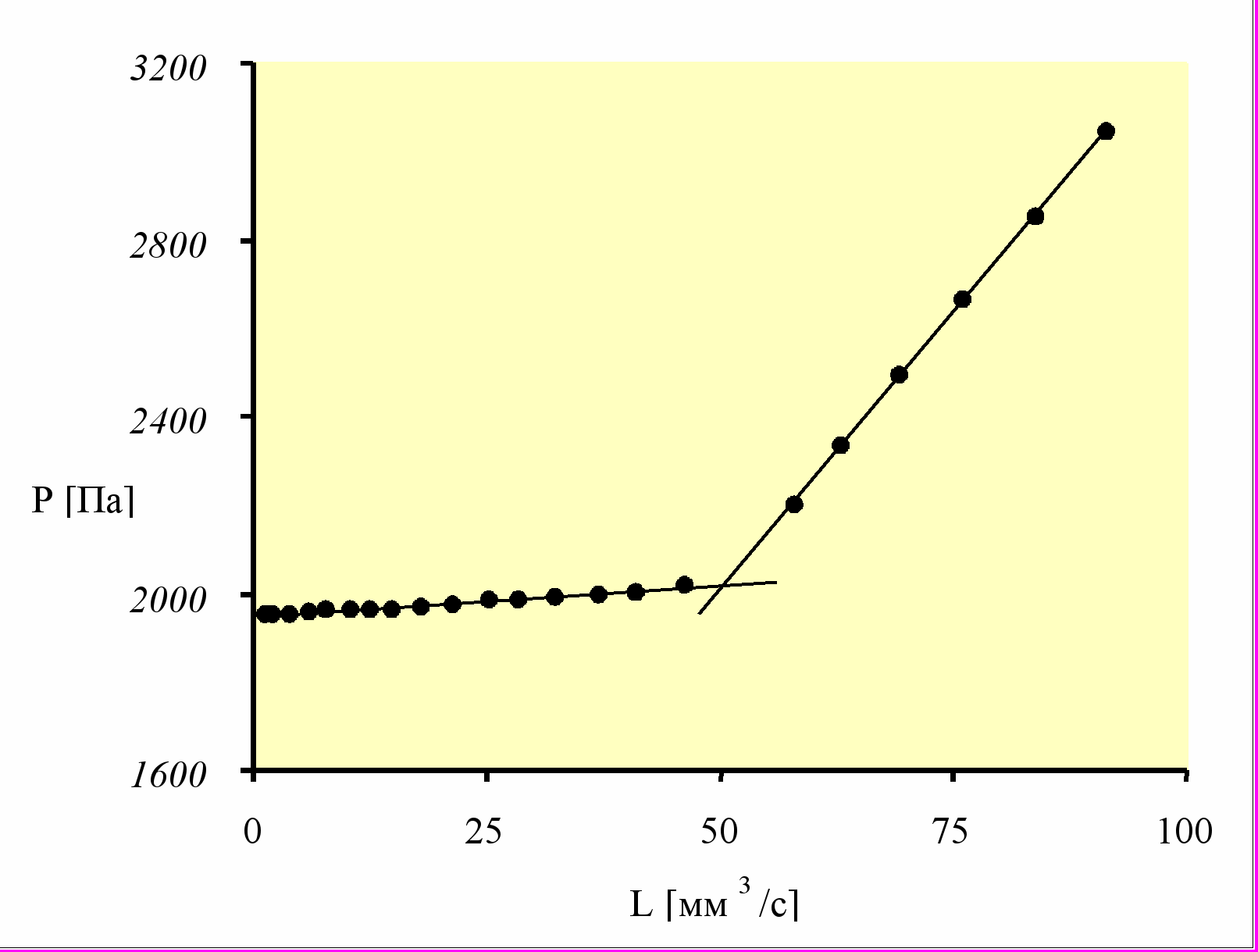
Рисунок 5 - Зависимость давления (Р) от объемного расхода (L) для образца сыворотки крови человека. Точка пересечения прямых - критическая точка (Рс, Lс) [23]
Пересчет физического времени в эффективное осуществляется по формуле:
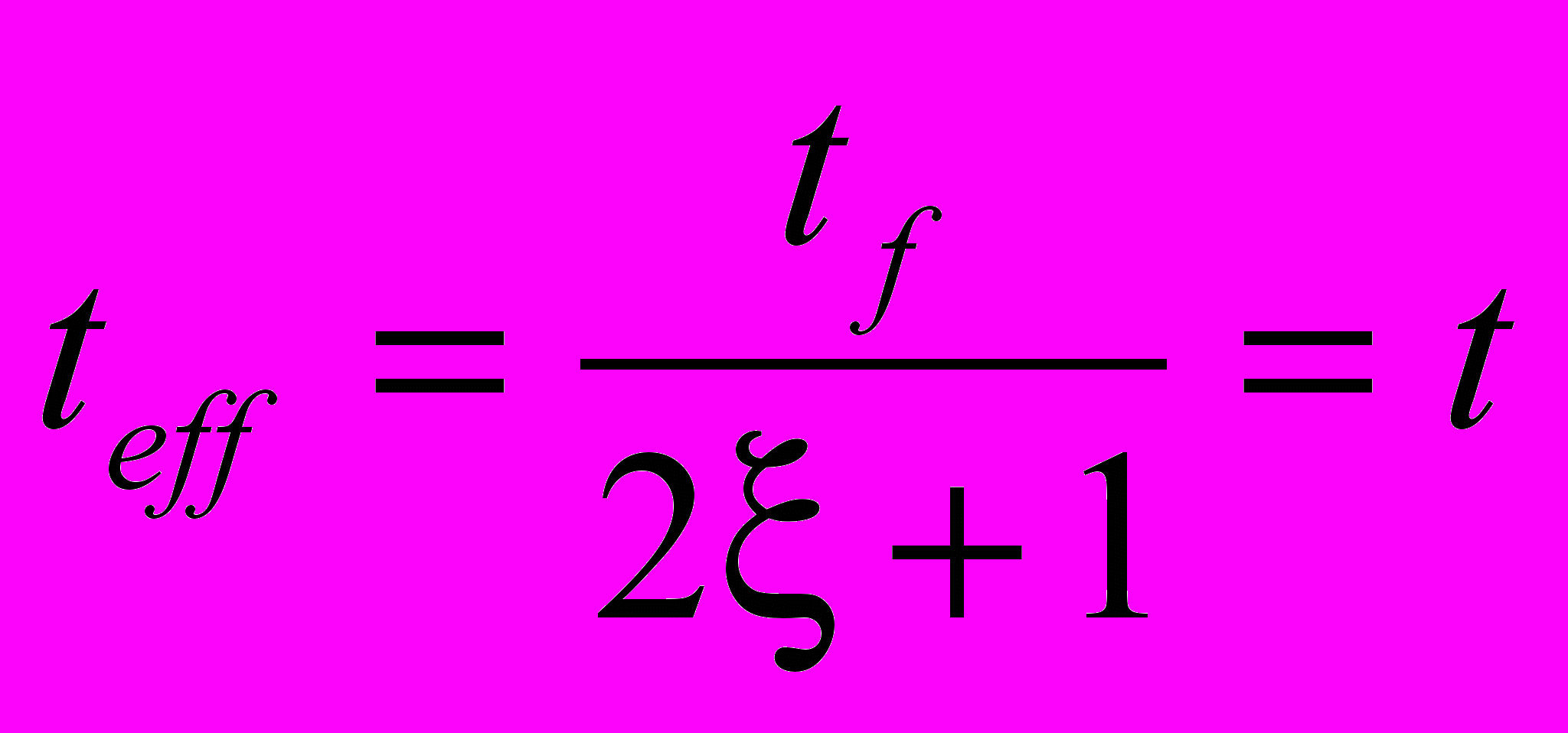 (3)
(3)где коэффициент
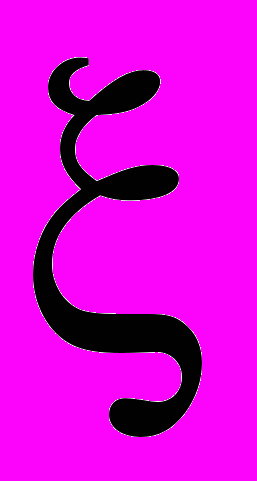 зависит от скорости относительной деформации поверхности (
зависит от скорости относительной деформации поверхности ( ):
): (4)
(4)Значение коэффициента
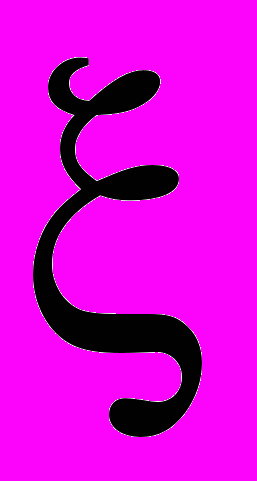 находится в пределах от 0 до 2/3 и зависит от величины динамического ПН. В процессе измерений тензиометром ВРА-1Р величина коэффициента
находится в пределах от 0 до 2/3 и зависит от величины динамического ПН. В процессе измерений тензиометром ВРА-1Р величина коэффициента 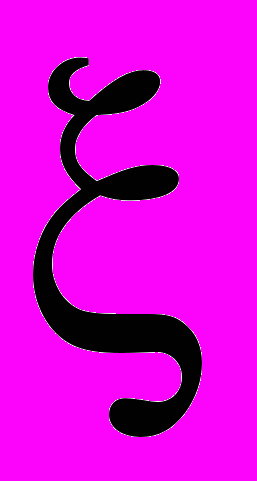 рассчитывается автоматически.
рассчитывается автоматически.Этот метод можно использовать так же для измерения динамических натяжений высоко вязких жидкостей (>150 мН/м). Значительным преимуществом ВРА-1Р является высокая скорость выполнения анализа, полная автоматизация процесса измерений, компьютерная обработка полученной информации.
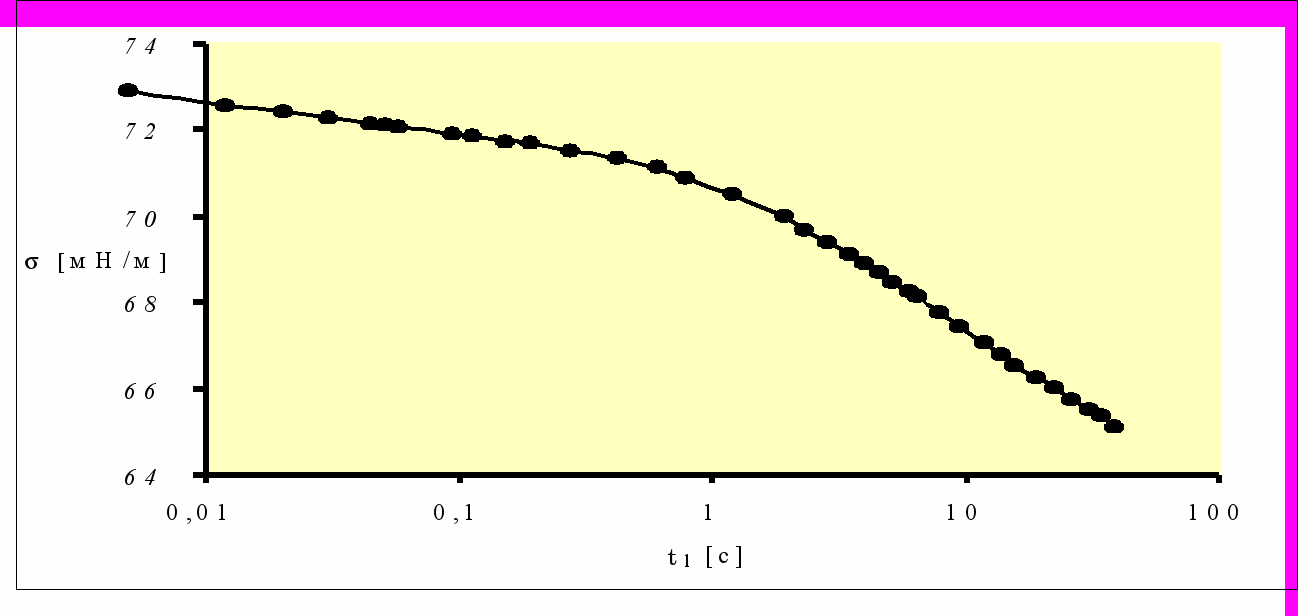
Рисунок 6 - Динамическая тензиограмма сыворотки крови человека в координатах физического времени [23]
