Отчет о научно-исследовательской работе
| Вид материала | Отчет |
- Реферат отчет о научно-исследовательской работе состоит, 61.67kb.
- Отчёт о научно-исследовательской работе за 2011 год, 1208.93kb.
- Отчёт о научно-исследовательской работе за 2009 год, 851.3kb.
- Отчёт онаучно-исследовательской работе гу нии но ур за 2010 год, 997.69kb.
- Отчет о научно-исследовательской работе профессорско-преподавательского состава, 617.56kb.
- Отчет о научно-исследовательской работе; пояснительная записка к опытно-конструкторской, 14.47kb.
- Отчет о научно-исследовательской работе (итоговый), 2484.06kb.
- Отчет о научно-исследовательской работе, 2473.27kb.
- Отчет о научно-исследовательской работе, 392.92kb.
- Задачи секции: широкое привлечение учеников к участию в научно исследовательской работе;, 67.94kb.
3.4. Изучение каталитических свойств липаз в комплексах с синтетическими полимерами
Белковые молекулы (в том числе и ферменты) являются полиамфолитами, поскольку в их состав входят как положительно (лизин, аргинин, гистидин), так и отрицательно заряженные аминокислоты (аспарагиновая и глутаминовая кислота). В этой связи в нейтральных средах на поверхности белковой глобулы присутствуют как положительные, так и отрицательные заряды. Такое строение белковых молекул обуславливает возможность их взаимодействия с ионогенными веществами, в том числе полиэлектролитами различной природы. Результатом подобных взаимодействий является образование нековалентных белок-полиэлектролитных комплексов [34].
Установлено, что белок-полиэлектролитные комплексы спонтанно образуются при смешении растворов отдельных компонентов, главным образом, за счет электростатических взаимодействий между противоположно заряженными группами белка и полииона. Комплексообразование, однако, может быть обусловлено и другими причинами – образованием водородных связей или гидрофобными взаимодействиями, возникающими вследствие неионных взаимодействий между молекулой белка и неполярными участками полиэлектролита. Благодаря этим взаимодействиям образование белок-полиэлектролитных комплексов может происходить даже при таких значениях pH, при которых знаки заряда белковых глобул и цепей полиэлектролитов совпадают [34].
Образование фермент-полиэлектролитных комплексов должно сказываться как на активности фермента, так и на его устойчивости по отношению к различным инактивирующим факторам химической и физической природы. Большую роль здесь будет играть соотношение компонентов комплекса, определяющее число образующихся контактов между молекулой белка и полиэлектролитом.
Для изучения влияния полимеров на активность липаз из различных источников (животного – липаза из поджелудочной железы свиньи - и грибного – липаза из Mucor javanicus - происхождения) были выбраны разнозаряженные полиэлектролиты - Na-полистиролсульфонат (ПСС, полианион) и полидиаллилдиметиламмоний хлорид (ПАМА, поликатион), а также полиэтиленгликоль (ПЭ-240), который является смесью двух олигомеров с разной молекулярной массой. Эти полиэлектролиты находят широкое применение в химических технологиях (как флокулянты для очистки воды), в медицине (лечение гиперкалиемии) и бионанотехнологиях (формирование полиэлектролитных оболочек на коллоидных частицах различной природы для получения микрокапсул, получение нанотрубок, и т.д.).
3.4.1. Влияние полиэлектролитного окружения на активность липаз из поджелудочной железы свиньи и гриба Mucor javanicus
Активность липазы из поджелудочной железы свиньи и липазы из гриба Mucor javanicus была измерена в присутствии ПАМА и ПСС в соотношениях липаза : полимер 1:1, 1:10, 1:100 при рН 7,0 и t 25 ºС (табл. 48). Активность липаз без полиэлектролитов была принята за 100 %.
Таблица 48 - Относительная активность (А) липаз из поджелудочной железы свиньи (Л-1), Mucor javanicus (Л-2) в присутствии ПАМА и ПСС при разных соотношениях липаза : полиэлектролит.
| Параметры | А при соотношении 1:1, % | А при соотношении 1:10, % | А при соотношении 1:100, % | |
| ПАМА | Л-1 | 73±6 | 94±5 | 44±6 |
| Л-2 | 96±4 | 108±5 | 116±3 | |
| ПСС | Л-1 | 23±5 | 117±4 | 115±8 |
| Л-2 | 152±3 | 63±6 | 108±5 | |
Активность липазы из поджелудочной железы свиньи в присутствии ПСС (рис. 11) при соотношениях 1:10 и 1:100 различалась незначительно (117 и 115 %, соответственно) и была максимальной, что может быть связано с увеличением микрогетерогенности системы в результате взаимодействия липазы с полиэлектролитом. В то же время использование эквимолярной смеси липаза:ПСС (1:1) приводит к значительному уменьшению активности липазы (до 23%), поскольку недостаточно ПСС для образования микрогетерогенной границы раздела фаз.
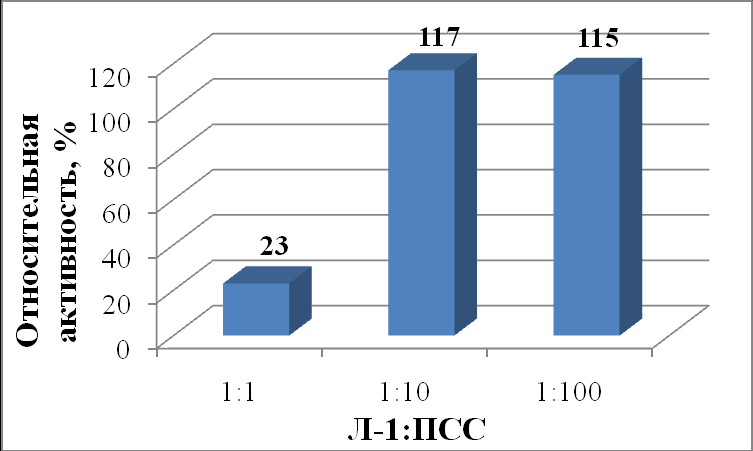 |
| Рисунок 11 - Относительная активность (%) липазы из поджелудочной железы свиньи (Л-1) в зависимости от соотношения липаза : ПСС. |
В присутствии ПАМА наивысшая активность панкреатической липазы наблюдалась при соотношении липаза : полимер равное 1:10 (94%) (рисунок 12). Присутствие ПАМА в соотношении 1:10 незначительно уменьшает активность липазы по сравнению с контролем (на 6%). Это может быть связано с тем, что отрицательно заряженная при нейтральных значениях рН липаза в процессе комплексообразования оказывается расположенной внутри глобулы положительно заряженного полимера и становится менее доступной для субстрата.
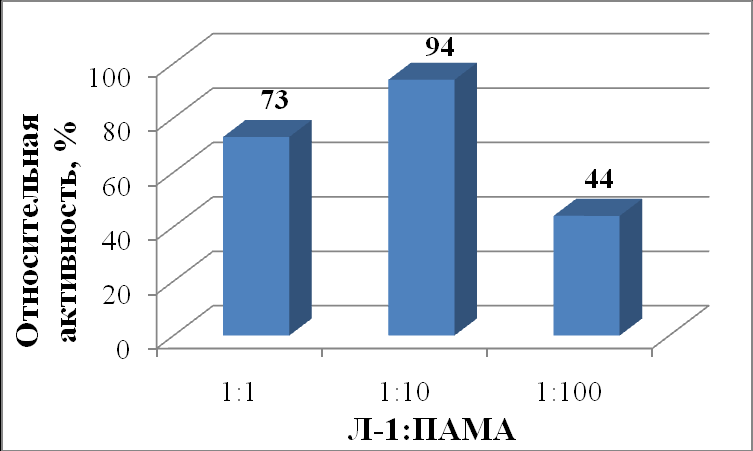 |
| Рисунок 12 - Относительная активность (%) липазы из поджелудочной железы свиньи (Л-1) в зависимости от соотношения липаза : ПАМА |
Это подтверждается тем, что при увеличении концентрации ПАМА в смеси с липазой до 1:100 происходит значительное уменьшение активности до 44% по сравнению с эквимолярной системой (при 1:1 активность составила 73%). Это свидетельствует о значительном экранировании активных центров липазы при связывании с избытком положительно заряженного ПАМА.
Максимальная активность липазы из гриба Mucor javanicus (рисунок 13 и 14) наблюдалась в присутствии ПАМА при соотношении 1:100 (116%), а в присутствии ПСС при соотношении 1:1 (152%). Увеличение активности липазы из Mucor javanicus с увеличением концентрации положительно заряженного ПАМА относительно фермента (от 96 % при соотношении 1:1 до 116 % при соотношении 1:100) связано прежде всего с удалением отрицательно заряженных жирных кислот из реакционной смеси путем электростатического взаимодействия с полиэлектролитом и сдвигом равновесия в сторону образования продуктов реакции. Увеличение активности липазы на 52 % в случае эквимолярного соотношения фермента с ПСС (табл. 48) можно объяснить закреплением каталитически выгодной конформации фермента в комплексе с ПСС.
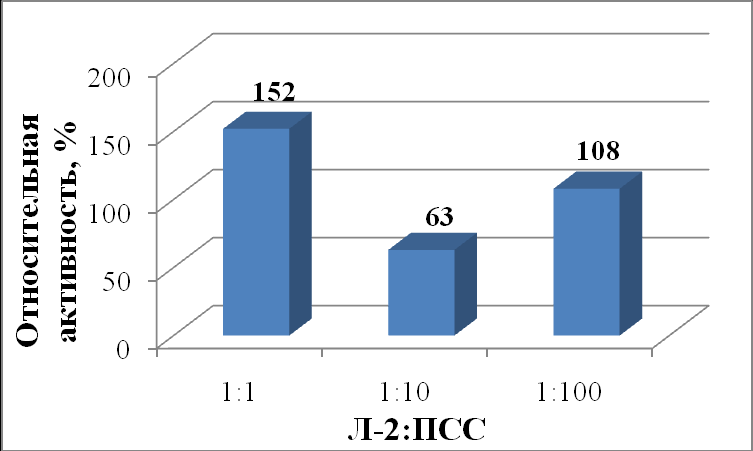 |
| Рисунок 13 - Относительная активность (%) липазы из Mucor javanicus (Л-2) в зависимости от соотношения липаза : ПСС. |
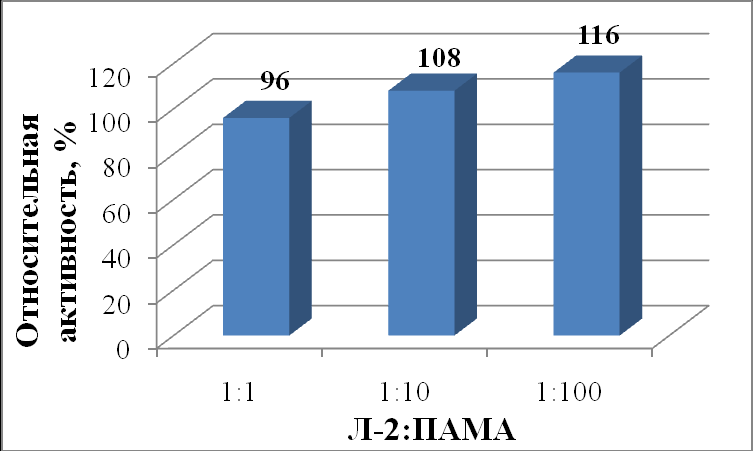 |
| Рисунок 14 - Относительная активность (%) липазы из Mucor javanicus (Л-2) в зависимости от соотношения липаза : ПАМА. |
Таким образом, активность липазы существенно зависит от заряда полиэлектролита и от концентрации его относительно фермента. Наилучшими для липазы из поджелудочной железы свиньи являются системы с ПСС 1:10 и 1:100, для липазы из Mucor javanicus – системы с ПАМА 1:100 или ПСС 1:1.
В комплексах липазы из поджелудочной железы свиньи с полимером ПЭ-240 в соотношениях 1:1 и 1:10 наблюдается повышение каталитической активности липазы при соотношении липаза : полимер 1:1 на 8%, а при соотношении 1:10 изменения активности не происходит (таблица 49).
Таблица 49 - Активность липазы из поджелудочной железы свиньи, в присутствии ПЭ-240 при разных соотношениях липаза : полиэлектролит.
| № | Контроль, ммоль/мл*мин | Активность при соотношении 1:1, ммоль/мл*мин | Контроль, ммоль/мл*мин | Активность при соотношении 1:10, ммоль/мл*мин |
| 1 | 0,0039* | 0,0027 | 0,0011* | 0,0032 |
| 2 | 0,0022 | 0,0029 | 0,0026 | 0,0033 |
| 3 | 0,0029 | 0,0024 | 0,0030 | 0,0023 |
| 4 | 0,0022 | 0,0023 | 0,0031 | 0,0029 |
| 5 | 0,0028 | 0,0031 | 0,0034 | 0,0033 |
| Аср | 0,0025+1,89*10-4 | 0,0027+1,5*10-4 | 0,003+1,66*10-4 | 0,003+1,89*10-4 |
| % | | 8% | | 0% |
3.4.2. Влияние температуры на активность липаз в комплексе с синтетическими полиэлектролитами.
Резкое повышение температуры является одним из важнейших факторов, которые вызывают инактивацию любых ферментов, в том числе липаз. В основе такого действия высокой температуры лежат следующие молекулярные механизмы:
- агрегация за счет водородных связей и гидрофобных взаимодействий;
- изменение первичной структуры в результате разрывов в полипептидной цепи и модификации функциональных групп фермента в результате их окисления, расщепления дисульфидных связей, фосфорилирования, дезаминирования и т.д.
- диссоциация олигомерных белков-ферментов на нефункциональные субъединицы или даже “разворачивание” полипептидной цепи субъединиц.
Высокая стабильность иммобилизованных ферментов, вероятно, является следствием “защиты” ферментов от вредных воздействий за счет специфического микроокружения, уменьшения их подвижности, и подавления, вследствие этого, процессов агрегации фермента и диссоциации молекул фермент-субстратного комплекса [34].
Учитывая обнаруженные эффекты регуляции ферментативной активности липаз и перспективы практического использования были исследованы температурные зависимости активности липаз из поджелудочной железы свиньи и гриба Mucor javanicus в комплексах с полиэлектролитами. Результаты измерений представлены в таблицах 50 (для липазы из поджелудочной железы свиньи) и 51 (для липазы из гриба Mucor javanicus) в виде относительных значений активности липаз (в сравнении с контрольными значениями активности липаз в комплексе с полиэлектролитами при 25 0С, принятыми за 1).
3.4.2.1. Изменение активности липазы из поджелудочной железы свиньи в комплексе с полиэлектролитами при увеличении температуры
При соотношении липаза : ПАМА = 1:1 (табл. 50, рис. 15) активность липазы оказалась ниже, чем в отсутствие полимера при температурах 40 °С (2,7 кр. ед.) и 60 ºС (3,2 кр. ед.) в 1,6 и 1,2 раза, соответственно. Однако, при 80 ºС активность липазы при этом соотношении с ПАМА выше в 2,1 раз, чем активность чистой липазы.
Таблица 50 - Относительная активность (А) панкреатической липазы (Л-1) в присутствии полиэлектролитов при изменении температуры от 20 до 80 °С
| Параметры | А при 20 °С, кр. ед. | А при 25 °С, кр. ед. | А при 40 °С, кр. ед. | А при 60 °С, кр. ед. | А при 80 °С, кр. ед. |
| Л-1 без полимеров | 0,83±0,07 | 1,00±0,05 | 4,47±0,06 | 3,83±0,04 | 2,16±0,05 |
| Л-1:ПАМА 1:1 | 1,72±0,07 | 1,00±0,09 | 2,72±0,03 | 3,20±0,07 | 4,46±0,08 |
| Л-1:ПАМА 1:10 | 1,04±0,06 | 1,00±0,05 | 8,24±0,02 | 8,93±0,05 | 3,60±0,07 |
| Л-1:ПСС 1:1 | 1,00±0,02 | 1,00±0,05 | 2,56±0,06 | 7,55±0,04 | 26,77±0,08 |
| Л-1:ПСС 1:10 | 1,00±0,04 | 1,00±0,07 | 3,05±0,05 | 10,83±0,09 | 7,22±0,05 |
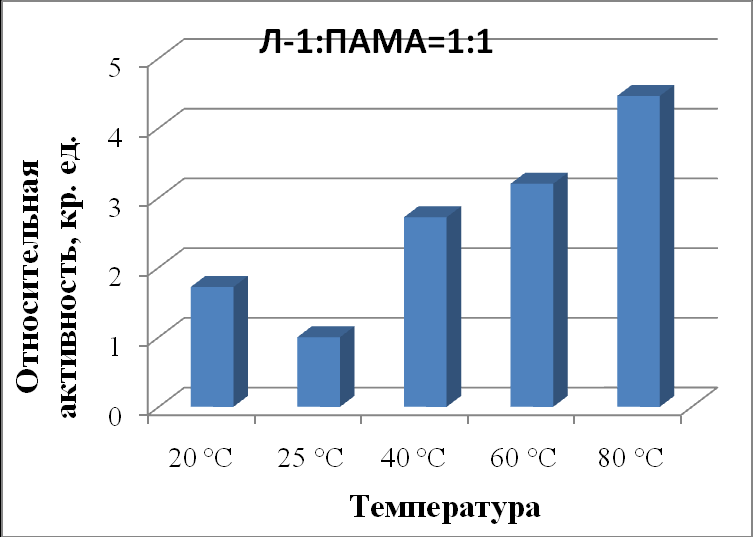 |
| Рисунок 15 - Зависимость активности липазы из поджелудочной железы свиньи в комплексе с ПАМА в соотношении 1:1 от температуры. |
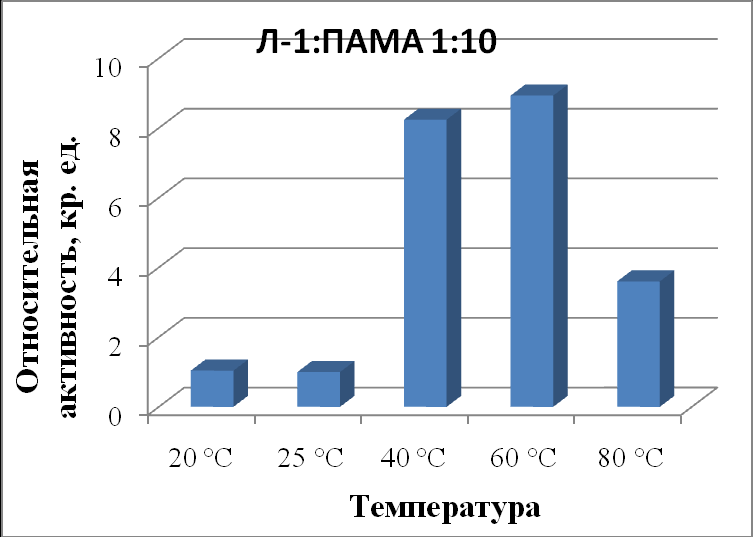 |
| Рисунок 16 - Зависимость активности липазы из поджелудочной железы свиньи в комплексе с ПАМА в соотношении 1:10 от температуры. |
При соотношении липаза : ПАМА 1:10 (табл. 50, рис. 16) активность липазы значительно выше, чем в отсутствие полимера (в 1,8 раз при 40 ºС, в 2,3 раза при 60 ºС, в 1,7 раз при 80 ºС). Кроме того, наблюдается сдвиг температурного оптимума в сторону более высоких температур, по сравнению с исходным ферментом. Все данные свидетельствуют о происходящих конформационных изменениях в системе липаза-полимер, которые делают фермент более устойчивым к температурным воздействиям.
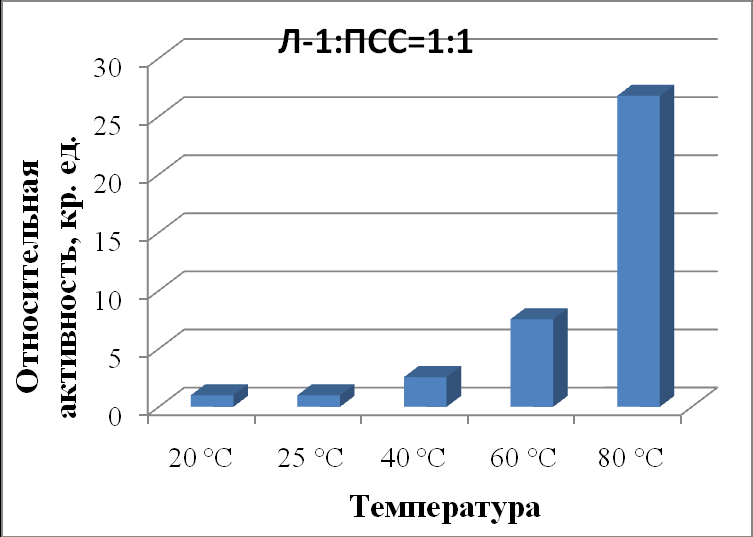 |
| Рисунок 17 - Зависимость активности липазы из поджелудочной железы свиньи в комплексе с ПСС в соотношении 1:1 от температуры. |
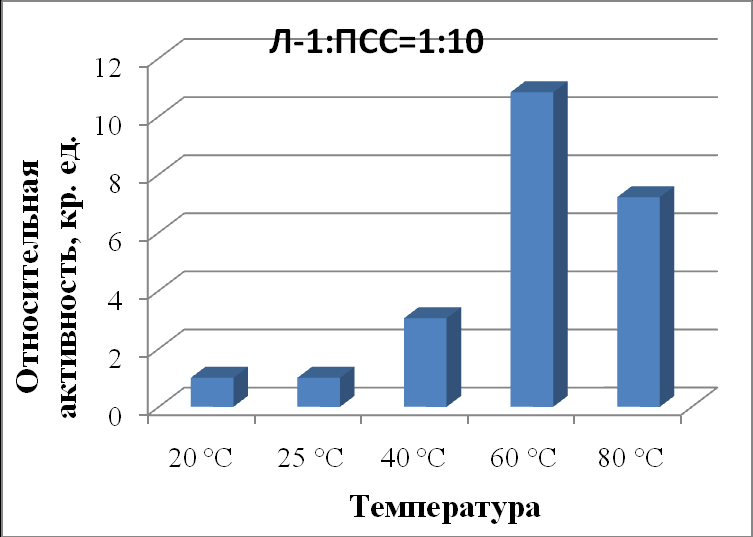 |
| Рисунок 18 - Зависимость активности липазы из поджелудочной железы свиньи в комплексе с ПСС в соотношении 1:10 от температуры. |
Показано, что в присутствии ПСС липаза из поджелудочной железы свиньи при 20 ºС имеет активность около 100% по отношению к контролю при 25 ºС при обеих концентрациях полимера (табл. 50, рис. 17, 18). При повышении температуры до 40 и 60 ºС активность панкреатической липазы во всех случаях была выше контроля: при соотношении 1:1 активность увеличилась в 2,6 и 7,6 раза, а при соотношении 1:10 увеличилась в 3,1 и 10,8 раз, соответственно.
3.4.2.2. Изменение активности липазы из гриба Mucor javanicus в комплексе с полиэлектролитами при увеличении температуры
Активность липазы в присутствии ПАМА в соотношении 1:1 (табл. 51, рис. 19) возросла в 12,8 раз (при 60 ºС) относительно контрольной пробы (при 25 ºС и рН 7,0). При 80 ºС активность липазы значительно снизилась в 2,8 раза, что объясняется началом частичной денатурации фермента при высокой температуре.
Таблица 51 - Относительная активность (А) липазы из Mucor javanicus (Л-2) в присутствии полиэлектролитов при изменении температуры от 20 до 80 °С.
| Параметры | А при 20 °С, кр. ед. | А при 25 °С, кр. ед. | А при 40 °С, кр. ед. | А при 60 °С, кр. ед. | А при 80 °С, кр. ед. |
| Л-2 без полимеров | 1,00±0,05 | 1,00±0,03 | 2,50±0,05 | 4,71±0,06 | 5,63±0,03 |
| Л-2:ПАМА 1:1 | 0,45±0,03 | 1,00±0,05 | 6,50±0,05 | 12,76±0,06 | 4,60±0,07 |
| Л-2:ПАМА 1:10 | 0,46±0,03 | 1,00±0,04 | 1,17±0,06 | 18,60±0,09 | 13,57±0,03 |
| Л-2:ПСС 1:1 | 1,05±0,04 | 1,00±0,06 | 1,32±0,03 | 2,02±0,06 | 2,05±0,03 |
| Л-2:ПСС 1:10 | 1,00±0,06 | 1,00±0,07 | 8,92±0,02 | 12,98±0,09 | 15,00±0,03 |
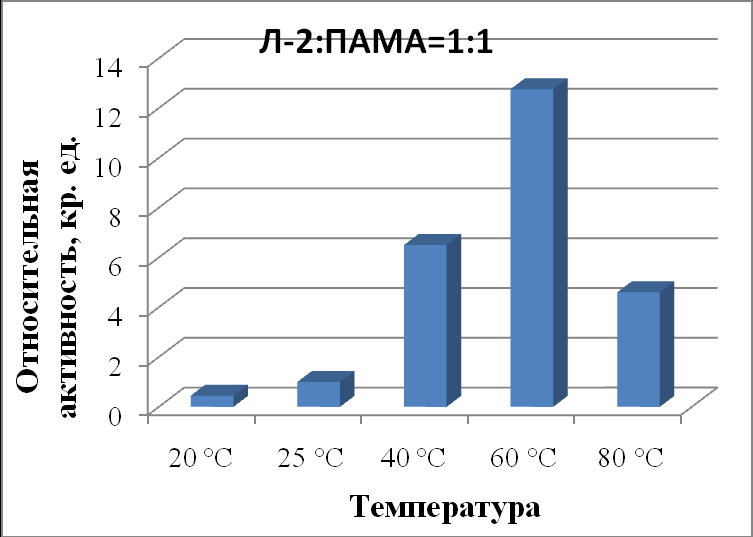 |
| Рисунок 19 - Зависимость активности липазы из Mucor javanicus (Л-2) в комплексе с ПАМА в соотношении 1:1от температуры. |
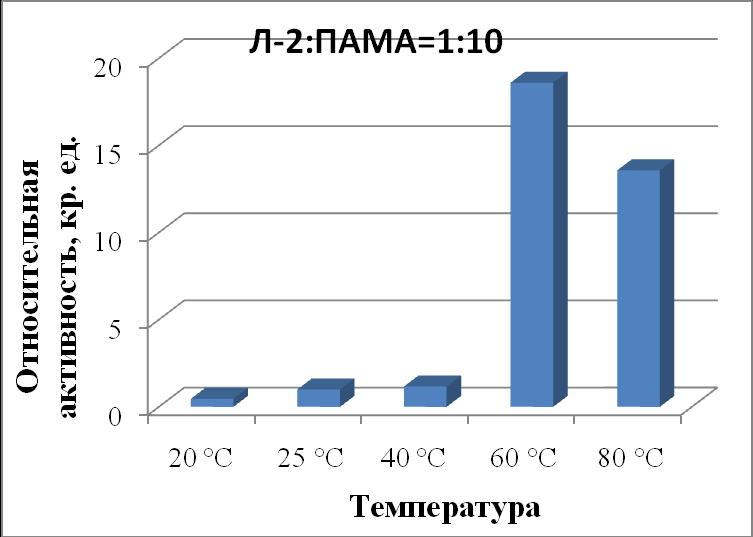 |
| Рисунок 20 - Зависимость активности липазы из Mucor javanicus (Л-2) в комплексе с ПАМА в соотношении 1:10 от температуры. |
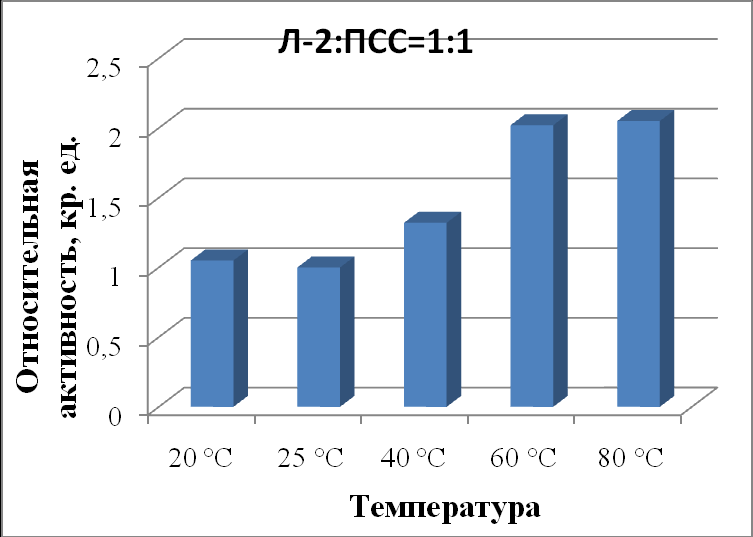 |
| Рисунок 21 - Зависимость активности липазы из Mucor javanicus (Л-2) в комплексе с ПСС в соотношении 1:1 от температуры. |
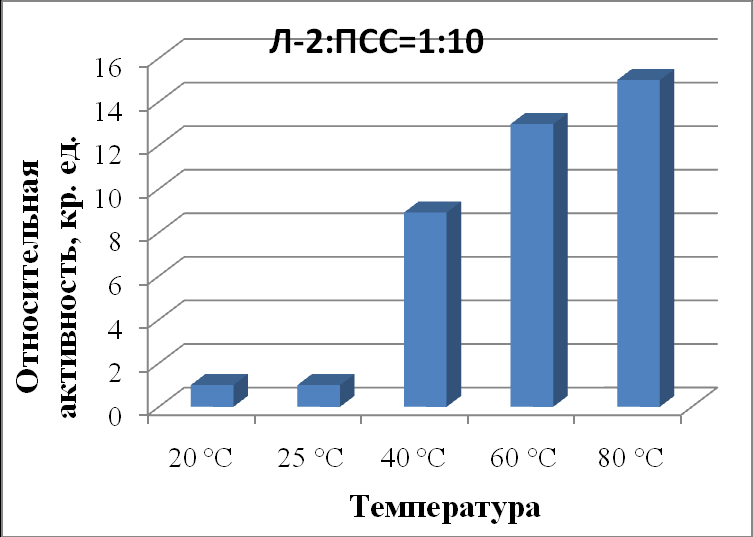 |
| Рисунок 22 - Зависимость активности липазы из Mucor javanicus (Л-2) в комплексе с ПСС в соотношении 1:10 от температуры. |
