Отчет о научно-исследовательской работе
| Вид материала | Отчет |
| Методика измерения ДПН сыворотки крови животных. R - газовая постоянная, T |
- Реферат отчет о научно-исследовательской работе состоит, 61.67kb.
- Отчёт о научно-исследовательской работе за 2011 год, 1208.93kb.
- Отчёт о научно-исследовательской работе за 2009 год, 851.3kb.
- Отчёт онаучно-исследовательской работе гу нии но ур за 2010 год, 997.69kb.
- Отчет о научно-исследовательской работе профессорско-преподавательского состава, 617.56kb.
- Отчет о научно-исследовательской работе; пояснительная записка к опытно-конструкторской, 14.47kb.
- Отчет о научно-исследовательской работе (итоговый), 2484.06kb.
- Отчет о научно-исследовательской работе, 2473.27kb.
- Отчет о научно-исследовательской работе, 392.92kb.
- Задачи секции: широкое привлечение учеников к участию в научно исследовательской работе;, 67.94kb.
3.2. Разработка методики измерения динамического поверхностного натяжения (ДПН) биологических жидкостей животных и освоение специального программного обеспечения для определения параметров ДПН.
3.2.1. Методика измерения ДПН сыворотки крови животных.
При работе с биологическими жидкостями большое значение приобретают такие параметры, как объем анализируемой жидкости, её хранение, толщина капилляра и его очистка.
Существует несколько методов очистки капилляра до и после измерения. Это очистка с помощью ультразвука (УЗ), продувания воздухом в воде, продувания спирта, воды, воздуха через капилляр, промывание с помощью ПАВ, концентрированной серной кислоты, механическая очистка с помощью мандрена (металлической проволоки), обжигание рабочего участка капилляра на открытом огне.
На начальном этапе исследований в период постановки методики экспериментов были опробованы различные методы очистки капилляра. В процессе многочисленных экспериментов было определено, что наиболее эффективный из них при работе с сывороткой крови животных – это сочетание продувания воздуха через капилляр и УЗ очистка.
Установлено, что после проведения экспериментов капилляр необходимо очищать, погружением в этиловый спирт; затем при помощи специального режима работы прибора через него продувается воздух с большей силой, чем необходимо для образования пузырьков (в течение 10-15 минут). После этого, капилляр погружают в дистиллированную воду и процедуру продува воздуха повторяют. При сильном загрязнении капилляр помещают в стакан с дистиллированной водой и ставят в УЗ ванночку на 25 мин, затем промывают в дистиллированной воде, продувая через него воздух.
Если все перечисленные методы очистки капилляра оказались неэффективными, то прибегают к механической очистке с помощью мандрена. Затем всю процедуру очистки с помощью УЗ ванны и продувания воздухом повторяют.
Перед каждым экспериментом необходимо провести измерение ДПН дистиллированной воды для контроля чистоты капилляра. Если капилляр чистый, то тензиограмма для дистиллированной воды представляет собой линию, расположенную параллельно оси абсцисс, то есть значения ДПН при изменении времени существования поверхности изменяются в пределах ошибки и находятся в области 71,8-72,3 мН/м.
Перед началом измерения на приборе автоматически проводится тестирование капилляра сначала в воздушной среде, а затем погрузив его в измеряемую жидкость.
Проведены эксперименты по измерению ДПН сыворотки и плазмы крови, полученные от одного животного при одном взятии крови. В качестве антикоагулянта был использован гепарин 0,1 мл на 5 мл крови. При измерении были получены данные, представленные в таблице 34.
Таблица 34 - Значения динамического поверхностного натяжения сыворотки и плазмы крови коров 3 лет.
| Показатели, n=3 | σ0 мН/м | σ 1 мН/м | σ 2 мН/м | σ 3 мН/м | λ0 мНм-1 с1/2 | λ1 мНм-1 с1/2 |
| Плазма | 74,4±0,4 | 76,5±0,4 | 75,3±0,4 | 59,7±0,5 | 2,01±0,16 | 19,17±0,11 |
| Сыворотка | 77,1±0,4 | 74,5±0,5 | 71,2±0,4 | 62,4±0,5 | 6,26±0,12 | 8,95±0,14 |
Значения ДПН для плазмы были более высокими для коротких и средних времён существования поверхности (σ1=76,5±0,4 мН/м, σ2=75,3±0,4 мН/м) и достоверно ниже при больших временах σ3=59,7±0,5 мН/м, при этом значения для σ0 на 4% ниже. Угол наклона начального участка кривой был ниже, а конечного – выше для плазмы, чем для сыворотки. По-видимому, это связано с более высоким содержанием в плазме белков (за счёт присутствия фибриногена и антикоагулянта гепарина), которые вызывают снижение ДПН при больших временах. Учитывая полученные данные, в дальнейших исследованиях проводилось измерение ДПН сыворотки крови, а не плазмы или цельной крови.
Таблица 35 - Данные межфазной тензиометрии сыворотки крови лошадей при хранении в холодильнике при температуре 4оС
| Время хранения, n=3 | Показатели, мН/м | Жеребцы, 5 лет | Жеребцы, 3 года | Кобылы, 4 года |
| Свежая | σ0 | 74,8±0,4 | 72,9±0,7 | 74,5±0,6 |
| σ3 | 73,2±0,7 | 72,5±0,8 | 73,1±0,8 | |
| 1 сутки | σ0 | 74,8±0,5 | 72,3±0,6 | 74,1±0,6 |
| σ3 | 73,4±0,3 | 72,6±0,6 | 73,1±0,6 | |
| 2 суток | σ0 | 76,1±0,4 | 74,8±0,6 | 76,1±0,6 |
| σ3 | 73,7±0,4 | 74,1±0,7 | 74,2±0,7 | |
| 3 суток | σ0 | 76,2±0,5 | 73,6±0,6 | 73,9±0,6 |
| σ3 | 70,8±0,7 | 72,3±0,9 | 76,8±0,3 |
Для определения возможностей работы с сывороткой при хранении её в холодильнике были проведены измерения ДПН сыворотки крови лошадей в течение трех суток при хранении при температуре +4оС в холодильнике. В результате было определено, что в течение первых двух суток существенных изменений ДПН не происходило и работать с такой сывороткой можно, при дальнейшем хранении в этих условиях ДПН изменялось, что, видимо, связано с процессами разрушения белков, липопротеинов и других поверхностно активных веществ.
Были проведены измерения ДПН сыворотки крови лошадей после размораживания (свежую сыворотку замораживали и хранили в течение 5 дней при температуре -3оС). Было проведено размораживание образцов до трех раз. В результате установлено, что ДПН однократно размороженной сыворотки практически не изменяется (соответствует свежей сыворотке), при втором и третьем размораживании ДПН выше, чем у свежей в среднем на 1-1,5 мН/м, что необходимо учитывать при работе с повторно размороженными пробами, при многократном размораживании происходит ещё более сильное отклонение ДПН от значений, полученных для свежей сыворотки. В связи с этим эксперименты проводились со свежими пробами, не применяя замораживание.
При исследовании содержания общего белка и альбуминов в свежей сыворотке крови и после размораживания наблюдается снижение концентрации обоих компонентов после первого размораживания и значительное повышение после второго, что соответствует динамике изменения ДПН до и после размораживания.
Таблица 36 - Данные межфазной тензиометрии сыворотки крови до и после размораживания
| Вид, пол, возраст n=3 | Условия | Показатели межфазной тензиометрии | ||
| σ0, мН/м | σ3, мН/м | |||
| Жеребцы, 2 года | свежая | 71,320,18 | 72,210,15 | |
| размораживание | 1-е | 71,50,5 | 71,240,16 | |
| 2-е | 71,560,16 | 68,90,2 | ||
| 3-е | 72,00,3 | 69,10,2 | ||
| Жеребцы, 3 года | свежая | 73,60,3 | 72,20,2 | |
| размораживание | 1-е | 71,90,3 | 71,20,3 | |
| 2-е | 73,880,08 | 68,70,3 | ||
| 3-е | 70,40,2 | 68,20,2 | ||
| Жеребцы, 4 года | свежая | 75,70,2 | 68,40,3 | |
| размораживание | 1-е | 71,60,4 | 69,80,5 | |
| 2-е | 71,90,7 | 69,50,6 | ||
| 3-е | 72,30,7 | 72,80,6 | ||
| Жеребцы, 5 лет | свежая | 73,60,5 | 75,70,6 | |
| размораживание | 1-е | 72,70,3 | 72,70,6 | |
| 2-е | 71,470,18 | 72,50,4 | ||
| 3-е | 72,00,2 | 73,10,4 | ||
| Жеребцы, 6 лет | свежая | 75,50,3 | 66,00,2 | |
| размораживание | 1-е | 68,70,4 | 64,40,2 | |
| 2-е | 74,80,3 | 64,90,4 | ||
| 3-е | 70,80,3 | 64,30,4 | ||
Снижение ДПН при замораживании, по-видимому, связано с частичным разрушением белка, тем более - при повторном размораживании, когда, происходят процессы более глубокого распада веществ, содержащихся в сыворотке крови.
В связи с техническими требованиями для получения достоверных значений ДПН капилляр должен находиться на расстоянии не менее 4 мм от стенок и 3 мм от дна стеклянного стакана, в котором находится измеряемая жидкость, погружение капилляра в жидкость происходит на глубину не менее 3 мм. Таким образом, чтобы сократить объём измеряемой жидкости до минимума, были использованы стаканчики диаметром 2 см, высотой 4 см, изготовленные из пенициллиновых пузырьков, что позволяет измерять сыворотку в объёме 3 мл.
Для измерения сыворотки крови лошадей использовался специальный капилляр с радиусом 0,225 см с пластмассовой насадкой, которая обеспечивает образование пузырьков одинакового размера и уменьшает пенообразование при измерении.
Сыворотка крови животных в отличие от химических веществ, ДПН которых в большинстве случаев исследуется в низких концентрациях, содержит компоненты в очень высоких концентрациях, что вызывает засорение капилляра. Поэтому важным техническим моментом исследований является правильная его очистка (см. выше).
Таблица 37 - Данные биохимического анализа общего белка и альбуминов сыворотки крови до и после размораживания.
| Вид, пол, возраст, n=3 | Свежая | 1-е размораживание | 2-е размораживание | |||
| Общий белок, г/л | Альбу-мины, г/л | Общий белок, г/л | Альбу-мины, г/л | Общий белок, г/л | Альбу-мины, г/л | |
| Тёлочки, 6 мес. | 75,2 0,9 | 12,8 0,4 | 75,1 1,3 | 16,9 0,9 | 95,1 1,3 | 15,5 0,6 |
| Коровы, 3 года | 80,2 0,6 | 7,8 0,7 | 75,3 1,3 | 8,96 1,08 | 87,4 1,5 | 7,1 0,6 |
| Тёлки, 1 год | 77,02 1,12 | 7,1 0,8 | 69,4 1,6 | 10,00 1,15 | 78,53 1,14 | 6,4 1,7 |
Эксперимент начинается только после успешного прохождения тестов в воздухе и жидкости.
Во время измерения происходит вспенивание сыворотки, связанное с большим содержанием в ней белка. При повторном измерении ДПН одного образца сыворотки необходимо дождаться полного осаждения пены. Если пена не до конца осела, то можно получить «искажённые» результаты, так как липиды и белки включаются в состав пены и их содержание в образце уменьшается, кроме того, поверхность жидкости при опускании в нее капилляра должна быть ровной, так как прибор автоматически регулирует глубину погружения капилляра.
В программе прибора есть несколько методов измерения ДПН: стандартный - с увеличением времени существования поверхности; сканирующий - экспресс метод; обратный - измерение происходит сначала при больших временах существования поверхности, а потом при малых; статический - измерение статического поверхностного натяжения при одинаковом времени существования поверхности.
Измерение проб сыворотки крови проводилось стандартным методом, при котором происходит постепенное увеличение времени существования поверхности. Этот метод является наиболее информативным, так как позволяет получить значения ДПН при наибольшем количестве времён существования поверхности от 0,01 до 100с.
3.2.2. Анализ тензиограмм с помощью программы ADSA.
Зависимость ПН от «времени жизни» поверхности обусловлена неравновесным характером процессов адсорбции-десорбции поверхностно-активных веществ (липидов, белков и т.п.) на жидкой границе раздела фаз. В начальный момент времени (t0) поверхностный слой не содержит избытка поверхностно-активных компонентов, т.е. адсорбция равна нулю, а ПН раствора и растворителя 0 одинаковы. Для большинства биологических жидкостей величина 0 близка к ПН воды и солевых растворов - 70-74 мН/м. Скорости адсорбции и понижения ПН определяются в общем случае диффузией сурфактантов к поверхности, скоростью преодоления так называемого адсорбционного барьера (электростатической, энтропийной или иной природы) и процессами перестройки адсорбированных молекул в поверхностном слое [24].
Многочисленные теоретические работы дополнены в последнее время теорией кинетики адсорбции без учета перестройки в поверхности, которая была разработана Уордом и Тордеем [24]. Применение данной теории в полном виде встречает значительные затруднения вследствие интегрально-дифференциальной формы итогового уравнения (так называемое уравнение Вольтера) и необходимостью привлечения дополнительных термодинамических и кинетических соотношений. В частности, должны быть использованы уравнения изотермы адсорбции, кинетическое адсорбционное (типа уравнения Ленгмюра) и состояния поверхностного слоя. Эти уравнения были получены для случаев, когда в растворе присутствуют одно или два вещества известной природы. В случае же многокомпонентных биологических жидкостей строгий подход к решению диффузионно-кинетических проблем вряд ли возможен в настоящее время. Использование асимптотических уравнений теории кинетики адсорбции является более простым, но в то же время достаточно информативным методом анализа динамических тензиограмм [24].
При предельно малых временах (t0) из общего уравнения Уорда и Тордея вытекает относительно простое соотношение, которое для многокомпонентного раствора имеет вид:
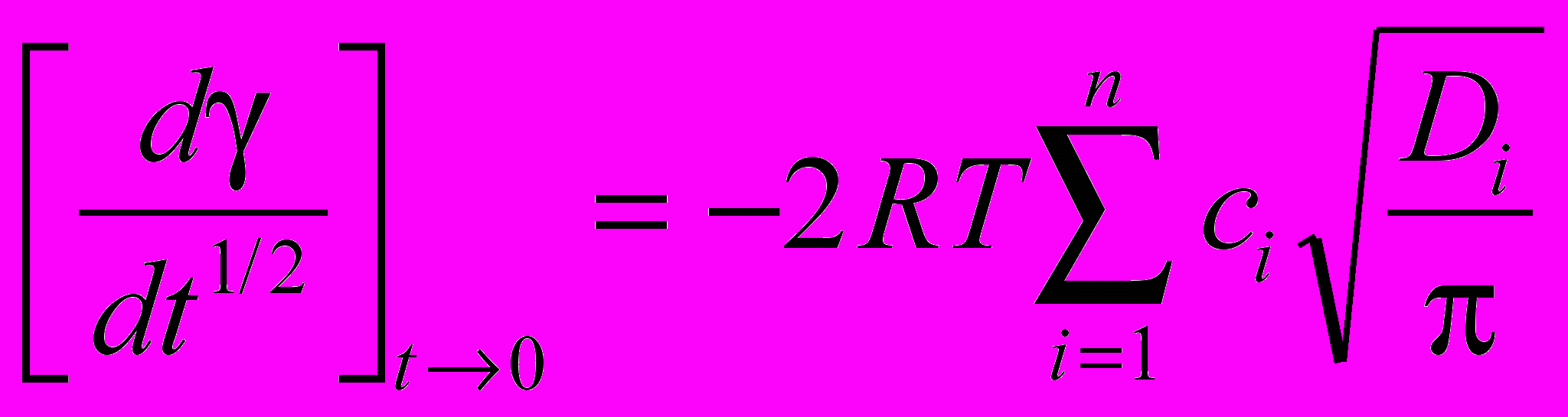 (7)
(7)где R - газовая постоянная, T - температура, сi - концентрация поверхностно-активного компонента, Di - коэффициент диффузии, i - номер компонента, n - общее число ПАВ. Производная в левой части уравнения (7) представляет собой тангенс угла наклона прямой в координатах - t1/2. Поскольку значения коэффициентов диффузии различных ПАВ имеют одинаковый порядок величины, то соотношение (7) показывает, что тангенс угла наклона прямой от t1/2 примерно пропорционален суммарной концентрации ПАВ смеси. Начальный участок кривой хорошо аппроксимируется линейной зависимостью. Точка пересечения линейного участка с осью ординат близка к поверхностному натяжению воды (в наших опытах равна 72,70,3 мН/м). Как следует из теории, величина 0 определяется солевым составом биологической жидкости. Таким образом, сравнивая углы наклона динамических тензиограмм в координатах - t1/2 можно получить информацию о суммарной концентрации поверхностно-активных компонентов в исследуемом образце биологической жидкости.
Второе важное соотношение, вытекающее из теории Уорда - Тордея (так называемое уравнение Йооса - Хансена), относится к случаям предельно больших времен жизни поверхности. Расширенное для многокомпонентной системы, оно может быть записано в виде:
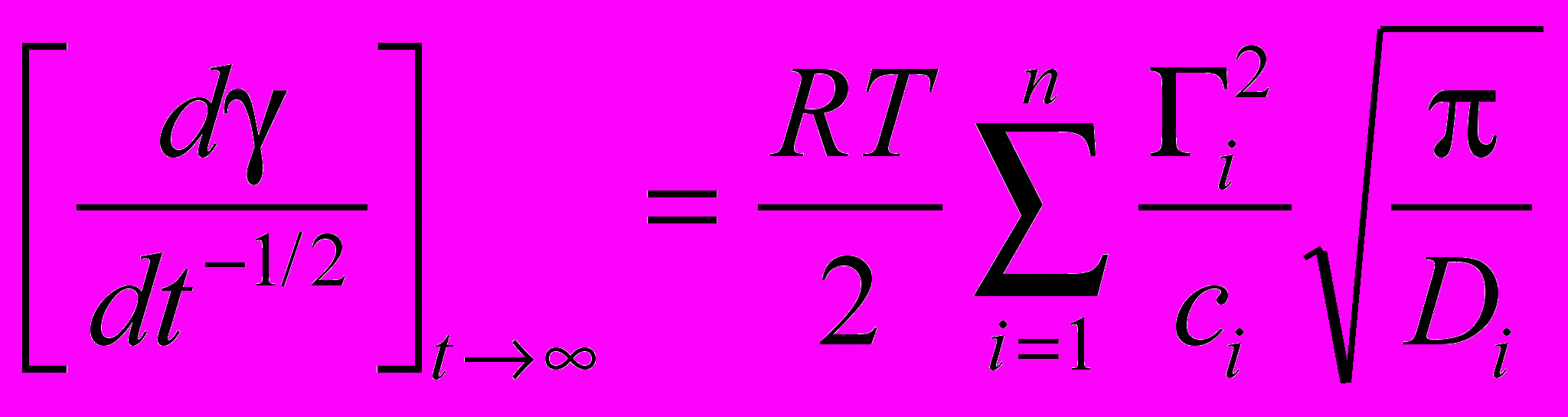 (8)
(8)где Гi- величина гиббсовской (избыточной) адсорбции данного поверхностно-активного соединения.
Производная в левой части этого уравнения берется в координатах - t1/2 и рассчитывается в пределе t ( т.е. t1/20). Поскольку отношение Гi/ci для многих сурфактантов является константой (так называемая константа Генри Кi = Гi/ci), то сумма в правой части уравнения (8) приближенно выражает адсорбцию всех компонентов смеси с учетом их адсорбционной активности (Ki). Таким образом, сравнивая значения производных (d/dt1/2)t для различных образцов биологических жидкостей, мы получаем информацию об изменении их состава по изменению величины адсорбции.
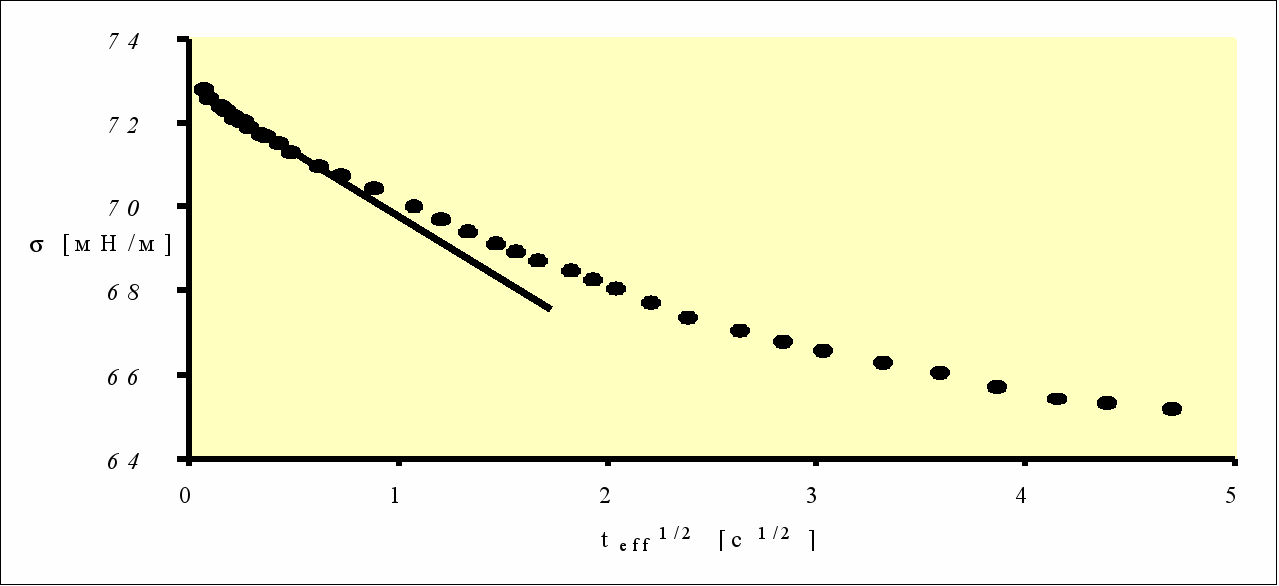
Рисунок 7 - Динамическая тензиограмма сыворотки крови человека в зависимости от teff1/2. Характеристика линейного участка: =72,8 мН/м, =2,8 мН.м-1.с1/2 [24]
Экспериментальная зависимость имеет «квазилинейный» участок при t1/20. Точка пересечения прямой с осью ординат дает величину равновесного (т.е. приведенного к t) ДПН () [24]. Последняя характеристика является чрезвычайно важной и может быть получена только путем экстраполяций динамической тензиограммы в координатах - t1/2.
Анализ общего решения и асимптотических уравнений для «не диффузионной» кинетики адсорбции свидетельствует, что существование адсорбционного барьера оказывает слабое влияние на выражаемую уравнением (6) зависимость от t1/2 при t, поскольку в этих условиях диффузионный поток из раствора к поверхности является наиболее медленной стадией, определяющей скорость адсорбции. В области очень коротких времен, для которых используется уравнение (7), адсорбционный барьер существует только в концентрированных растворах [24] и поэтому им можно пренебречь в случае для биологических жидкостей человека и животных. В то же время процессы перестройки в поверхности, например, адсорбция-десорбция сегментов белковых молекул, могут замедлять кинетику адсорбции в области средних и больших времен по сравнению с диффузионным механизмом.
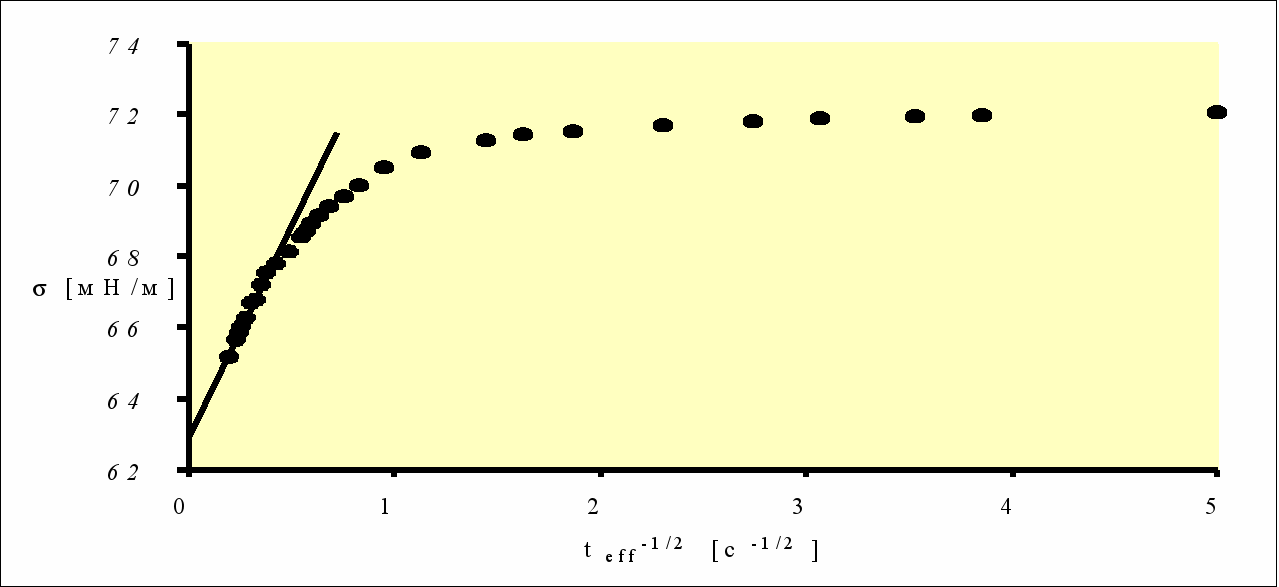
Рисунок 8 - Динамическая тензиограмма сыворотки крови человека в зависимости от teff-1/2. Характеристика линейного участка: =62,9 мН/м, =11,2 мН.м-1.с1/2 [24].
Однако в области небольших (до 3 мН/м) понижений ДПН (малых t) процесс адсорбции макромолекул контролируется диффузией [24]. Таким образом, уравнения (7) и (8) для биологических жидкостей могут использоваться почти без ограничений.
Результаты исследований представляются в виде тензиограмм (кривых зависимости от t), на которых определяются точки, соответствующие t0,01 с (1) и t1 с (2), а также равновесному ДПН (3). Кроме того, подсчитывается угол наклона кривой (λ) в координатах (t-1/2). Значения 1, (как и 0), характеризуют как свойства растворителя, так и адсорбцию в области коротких времен, а 2 - в области средних времен жизни поверхности. Эти процессы обусловлены в основном наличием в биологических жидкостях низко и средне молекулярных поверхностно-активных веществ, тогда как для высокомолекулярных фракций (белков и других соединений) определяющими являются значения 3. При этом угол наклона прямой λ характеризует величину адсорбции и концентрацию основного компонента сыворотки.
