Учебное пособие для модульно-рейтинговой технологии обучения Бийск
| Вид материала | Учебное пособие |
- Методические рекомендации по организации учебного процесса с использованием модульно-рейтинговой, 554.48kb.
- Я. В. Вакула Нефтегазовые технологии Учебное пособие, 2652.31kb.
- Учебное пособие «управление персоналом» для студентов заочного обучения специальности, 1516.37kb.
- М. Н. Машкин Информационные технологии Учебное пособие, 2701.91kb.
- Учебное пособие Уфа 2005 удк 338 (075. 8) Ббк, 1087.66kb.
- Учебный план как средство реализации принципов модульно-рейтинговой технологии обучения, 68.67kb.
- О. Д. Картавцева интенсивный курс обучения изобразительной грамоте учебное пособие, 780.71kb.
- Менеджмента качества положение о модульно-рейтинговой системе квалиметрии учебной деятельности, 1381.23kb.
- Учебное пособие 28365942 Москва 2008 ббк 66., 2986.28kb.
- Формирование профессиональной компетентности будущих специалистов в области вычислительной, 372.85kb.
Ответ: СН3СОО- + Н+ = СН3СООН ; СН3СОО- + Н+ = СН3 СООН; HCN + OH- = CN- + H2O ; Pb2+ + CrO2-4 = PbCrO4 .
2.13.4 Вопросы для самоконтроля
1. Какие реакции называются ионными реакциями?
2. Какими уравнениями выражаются ионные реакции?
3. В каких случаях реакции обмена в растворах электролитов являются необратимыми?
4. В каких случаях реакции обмена в растворах электролитов являются обратимыми?
5. В каких случаях реакции обмена в растворах электролитов не протекают?
6. Запишите возможное уравнение реакции между сульфидом натрия и хлоридом магния, протекающей в водном растворе.
3 ДИСПЕРСНЫЕ СИСТЕМЫ
3.1 Цели изучения раздела
Успешное изучение учебного материала позволит:
− освоить основные представления о классификации и свойствах дисперсных систем; о строении мицелл; об агрегативной и кинетической устойчивости, о применении в технике коллоидных растворов;
− овладеть ключевыми понятиями: дисперсные системы, взвеси, пасты, суспензии, эмульсии, аэрозоли, гели, золи, твердый коллоид, ядро, поверхностная энергия, поверхностное натяжение, адсорбционный и диффузионный слой мицеллы, дисперсность, удельная поверхность, пептизация, коагуляция, седиментация, элекрофорез, электроосмос, броуновское движение, эффект Тиндаля.
3.2 Методические рекомендации по изучению материала
Структурно-логическая схема изучения раздела «Дисперсные системы» представлена на рисунке 3.1.
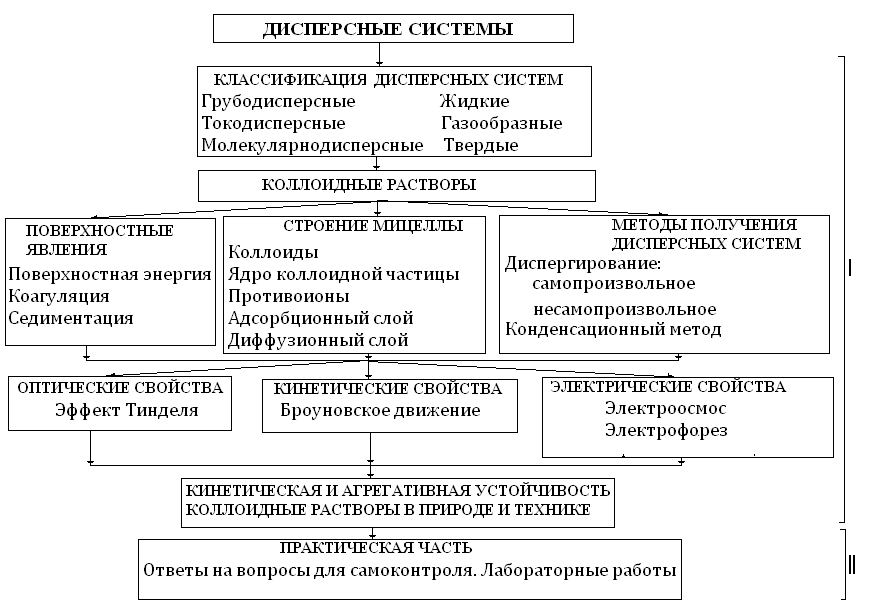
Рисунок 3.1 − Структурная схема раздела «Дисперсные системы»
При изучении раздела обратите внимание на классификацию дисперсных систем в зависимости от размера частиц и от агрегатного состояния дисперсионной среды. Важное значение имеют поверхностные явления в коллоидных системах, от которых зависит строение коллоидных частиц. В свою очередь, со строением мицелл связаны оптические, кинетические и электрические свойства коллоидных растворов. Постарайтесь запомнить основные термины и определения, а также значение и применение коллоидных растворов в технике и быту.
3.3 Общие понятия о дисперсных системах
3.3.1 Классификация дисперсных систем
Истинные растворы содержат молекулы или атомы, размеры которых обычно не превышают 10-9м (1 нм). При увеличении размеров частиц система становится гетерогенной, состоящей из двух или более фаз с сильно развитой поверхностью раздела. Такие системы получили название дисперсных систем.
Слово дисперсия означает раздробление, измельчение.
Дисперсные системы – гетерогенные системы из двух или большего числа фаз с сильно развитой поверхностью раздела между ними.
Дисперсные системы состоят как минимум из двух компонентов:
- дисперсионной среды, которая играет роль растворителя и, следовательно, является непрерывной фазой;
- дисперсной фазы, играющей роль растворённого вещества.
Существуют два типа классификаций дисперсных систем.
Первый тип классификации основан на агрегатном состоянии дисперсионной среды и дисперсной фазы (таблица 3.1).
Взвеси − неоднородные смеси веществ с относительно большими размерами частичек.
Аэрозолями называют взвеси жидких или твердых частиц в газовой среде, обычно в воздухе.
Паста – грубодисперсная система с большой концентрацией дисперсной фазы.
Латексы – млечный сок каучуконосных растений. Представляет собой водную дисперсию глобул натурального каучука, содержащую также белки, соли и др. Наибольшее промышленное значение имеет латекс бразильской гевеи, из которого выделяют каучук натуральный.
Таблица 3.1 − Типы дисперсных систем
| Дисперсионная среда | Дисперсная фаза | Тип системы | Примеры |
| жидкая | твердая | золи, суспензии | известковые, цементные растворы |
| жидкая | эмульсия | молоко, масло, сметана, керосин в воде | |
| газообразная | пены | мыльная пена, морской прибой | |
| твердая | твердая | твердые коллоиды | металлические сплавы |
| жидкая | пористые тела, насыщенные влагой | влажный грунт, опал, жемчуг | |
| газообразная | твердые пены | газобетон, полистирол, пемза | |
| газообразная | твердая | пыль, дым | угольная пыль |
| жидкая | туман | облака и тучи | |
| газообразная | смесь газов | атмосфера земли |
Второй тип классификации основан на размерах частиц дисперсной фазы (таблица 3.2).
Таблица 3.2 − Классификация дисперсных систем по размерам частиц
| Размер частиц дисперсной фазы | 10-5 − 10-7 м | 10-7 − 10-9м | <10-9м |
| Название системы | грубо-дисперсная | тонко-дисперсная (коллоидно – дисперсная) | молекулярно- дисперсная (истинные растворы) |
| Характеристика системы | микрогетерогенная (по той причине, что границу раздела фаз можно увидеть только с помощью микроскопа) | гомогенная | |
Для характеристики меры раздробленности дисперсных систем принято использовать величины:
- поперечный размер частиц а (для сферических частиц – диаметр – d, а частиц, имеющих форму куба, – ребро куба – l);
- дисперсность – величину, обратную поперечному размеру частиц:
 ; (3.1)
; (3.1)- удельная поверхность – отношение площади межфазной поверхности (S) к объему (V) или массе дисперсной фазы Sуд:
 . (3.2)
. (3.2)Дисперсные системы повсеместно распространены в природе. К ним относятся горные породы, грунты, почвы, атмосферные осадки, растительные и животные ткани. Они используются во многих технологических процессах. Именно в виде дисперсных систем выпускается большинство промышленных продуктов и предметов бытового потребления.
3.3.2 Вопросы для самоконтроля
1. Что такое дисперсные системы? Из каких компонентов они состоят?
2. Как классифицируют дисперсные системы по размерам частиц дисперсной фазы и в зависимости от агрегатного состояния?
3. Приведите определения следующих терминов: взвеси, аэрозоли, латексы, пасты.
4. Какие существуют характеристики дисперсных систем?
3.4 Коллоидные растворы
3.4.1 Основные понятия
Коллоидные системы − тонкодисперсные системы, в которых частицы имеют размеры от 1 мкм до 1 нм при условии сохранения гетерогенности и имеют сильно развитую удельную поверхность.
В отличие от истинных растворов, в таких системах имеются границы раздела между частицами вещества и окружающей их средой. Для объектов коллоидной химии характерны два общих признака: гетерогенность и дисперсность. Дисперсность является чисто количественным параметром, указывающим на степень раздробленности, размер межфазной поверхности; гетерогенность же указывает на качественную характеристику объектов.
Для краткости и по исторической традиции до сих пор используется термин «коллоиды», введенный в 1861 г. Т. Грэмом.
Коллоидами Грэм назвал вещества, которые образуют водные растворы с клееподобными свойствами и не проходят через полупроницаемые перегородки – мембраны. По гречески колла означает клей.
Термин «коллоид» относится к любому веществу независимо от его химического состава, структуры, геометрической формы, агрегатного состояния, если, по крайней мере, один из его размеров менее 1 мкм, но более 1 нм.
Это определение дано в традиционном понимании «коллоидно-дисперсных» систем, для которых характерно активное участие частиц в броуновском движении, с вытекающими отсюда молекулярно-кинетическими явлениями (диффузия, осмос).
Т. Грем также применил термины «золь» для коллоидных растворов и «гель» – для студнеобразных коллоидных систем.
Золь – высокодисперсная коллоидная система с жидкой дисперсионной средой и изолированными друг от друга коллоидными частицами.
Гель – коллоидно-дисперсная система с соприкасающимися (агрессивными) коллоидными частицами.
Мицелла − частицы дисперсной фазы золя вместе с окружающей их сольватной оболочкой из молекул дисперсионной фазы.
Студни (гель) − системы «полимер – растворитель», характеризующиеся большими обратимыми деформациями при практическом отсутствии вязкого течения.
Наиболее важны студни на основе сетчатых полимеров с разной степенью поперечной сшитости. При изменении температуры и давления возможен синерезис – отделение части жидкости.
Студни на основе сополимеров акриловой кислоты и акриламида используют для создания мембран с регулируемой проницаемостью, депо для лекарств в организме, в качестве сорбентов и как модели в биологических исследованиях.
3.4.2 Вопросы для самоконтроля
1. Каким образом можно отличить коллоидный раствор от истинного?
2. Дайте понятия следующих терминов: золь, гель, мицелла, студень.
3. Кто впервые ввел понятие коллоид?
4. Что собой представляет синерезис?
3.5 Поверхностные явления
3.5.1 Основные положения
Главные признаки коллоидных систем − гетерогенность и дисперсность. Гетерогенность определяется наличием поверхности раздела фаз.
В коллоидных системах поверхность раздела фаз – это не просто граница, не имеющая толщины. На границе раздела фаз формируется поверхностный слой толщиной в один или несколько молекулярных размеров.
Состояние вещества в поверхностных слоях – это коллоидное состояние вещества.
В чем причина поверхностных явлений? Рассмотрим молекулу, расположенную на границе раздела фаз. У такой молекулы насыщены только те связи, которые направлены в глубь ее фазы, остальные связи ненасыщены. Следовательно, такая молекула обладает избыточной потенциальной энергией. Свободная поверхность жидкости или твердого тела обладает избытком поверхностной энергии (рисунок 3.2).
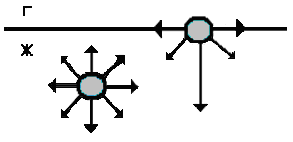
Рисунок 3.2 – Поверхностные явления
Следовательно, для выведения молекул из объема на поверхность надо преодолеть эту силу, т. е. совершить работу и сообщить молекулам определенную энергию. Увеличение площади поверхности приводит к увеличению числа поверхностных молекул, и поверхностная энергия возрастает. Поверхностная энергия Gs равна произведению удельной поверхностной энергии
 на площадь поверхности раздела фаз S:
на площадь поверхности раздела фаз S: , (3.3)
, (3.3)где ΔS – площадь поверхности раздела фаз, м2;
σ − удельная поверхностная энергия, равная работе, необходимой для образования единицы площади свободной поверхности, Дж/м2.
Поверхностное натяжение
 − это работа образования единицы площади свободной поверхности. В случае жидкой поверхности раздела поверхностное натяжение правомерно также рассматривать как работу, необходимую для увеличения единицы длины контура свободной поверхности:
− это работа образования единицы площади свободной поверхности. В случае жидкой поверхности раздела поверхностное натяжение правомерно также рассматривать как работу, необходимую для увеличения единицы длины контура свободной поверхности: , (3.4)
, (3.4)где
 – увеличение длины контура свободной поверхности, м;
– увеличение длины контура свободной поверхности, м; – поверхностное натяжение, н/м.
– поверхностное натяжение, н/м.Благодаря поверхностному натяжению жидкость при отсутствии внешних силовых воздействий принимает форму шара, отвечающую минимальной величине поверхности и, следовательно, наименьшему значению свободной поверхностной энергии.
3.5.2 Явления, связанные с превращениями поверхностной
энергии
Возможны следующие превращения поверхностной энергии:
а) в теплоту;
б) механическую энергию;
в) химическую энергию;
д) электрическую энергию.
Эти превращения сопровождают такие явления, как изменение реакционной способности с изменением дисперсности, адгезия и смачивание, капиллярность, адсорбция, электрические явления.
Адгезия − сцепление поверхностей разнородных тел.
Смачивание − способность впитывать, удерживать влагу.
Капиллярность − явление проникновения жидкости во взаимосвязанные мелкие поры и каналы в твердом материале за счет поверхностного натяжения.
Адсорбция − поглощение газов, паров или жидкостей поверхностным слоем твердого тела (адсорбента) или жидкости.
Коллоидные системы имеют ряд характерных свойств: механических, выражающихся в возникновении пространственных структур и в явлении тиксотропии; электрических, связанных с возникновением заряда на поверхности раздела; оптических − рассеяние света.
Для исследования структуры и описания вязкотекучих свойств дисперсных систем в коллоидной химии используют методы реологии − науки о деформациях и течении материальных систем.
Для нестационарных систем, отличающихся зависимостью реологических свойств от времени, характерны явления тиксотропии и реопексии. Тиксотропия – характерное свойство коагуляционных структур обратимо разжижаться при достаточно интенсивных механических воздействиях (перемешивании, встряхивании) и отвердевать (терять текучесть) при пребывании в покое. Ярко выраженной тиксотропией обладает суспензия бентонитовой глины с концентрацией более 10 % дисперсной фазы. Явление тиксотропии проявляется в природе при образовании плывунов, оползней. Тиксотропия позволяет проводить вибрационную обработку материалов, при которой происходит разрушение структуры, что облегчает процессы перемешивания, плотную укладку, снятие внутренних напряжений и т. д.
К явлению, противоположному тиксотропии, относится реопексия. Например, после тиксотропного разжижения гидрозоля восстановление структуры происходит значительно быстрее, если медленно перемешивать систему.
Как любая система, дисперсные системы стремятся понизить избыточную энергию. Понизить поверхностную энергию дисперсная система может, уменьшив площадь поверхности раздела. Для этого частицы должны укрупниться.
Слияние частиц дисперсной фазы и их укрупнение называется коагуляцией.
Укрупненные частицы под действием собственной тяжести начинают выпадать в осадок. Этот процесс медленный и носит название седиментации.
В результате коагуляции и седиментации частицы дисперсной фазы выпадают в осадок. В результате образуется истинный раствор, содержащий осадок. Дисперсная система перестаёт существовать.
Поверхностные явления присущи всем системам, имеющим поверхность раздела фаз, но сильнее всего они проявляются в дисперсных системах, которые являются гетерогенными и имеют высокоразвитую поверхность.
3.5.3 Вопросы для самопроверки
1. Что собой представляют поверхностные явления?
2. Приведите определение понятий «поверхностная энергия» и «поверхностное натяжение». В чем их сходство и различие?
3. Раскройте сущность явлений коагуляции и седиментации? Что в них общего и чем отличаются друг от друга?
3.6 Строение мицеллы
3.6.1 Общие положения
Частицы дисперсных фаз в коллоидных системах называют мицеллами. Мицеллы являются сложными комплексами из многих тысяч атомов, молекул, ионов. Средний размер мицеллы – от 10-5 до 10-7 см. Мицеллы образуются как в процессе диспергирования фазы в данной среде, так и в процессах образования новой фазы – при конденсации из отдельных молекул и ионов.
Существуют лиофильные (гидрофильные) коллоиды, в которых растворитель взаимодействует с ядрами частиц, и лиофобные (гидрофобные) коллоиды, в которых растворитель не взаимодействует с ядром частиц. Растворитель входит в состав гидрофобных частиц лишь как сольватная оболочка адсорбированных ионов или при наличии стабилизаторов (ПАВ), имеющих лиофобную и лиофильные части.
Мицеллы типичных лиофильных золей состоят из нерастворимого в данной среде ядра (представляющего собой ультрамикрокристаллическое образование), окруженного двойным электрическим слоем ионов. Один слой ионов (т. н. адсорбционный) находится на поверхности ядра, сообщая ему электрический заряд. Этот слой образуется в результате адсорбции какого-либо одного вида ионов из раствора. Эти ионы, сообщающие ядру заряд, называются потенциалопределяющими. В состав адсорбционного слоя входит также часть ионов противоположного знака – компенсирующих ионов. Основная масса этих ионов образует второй слой (слой противоионов), который вследствие теплового движения размыт (диффузный слой). Мицелла обычно окружена ориентированными молекулами растворителя – сольватной оболочкой.
Мицеллы лиофильных коллоидов представляют собой ассоциированный комплекс молекул (или ионов) ряда веществ (например, мыл), имеющих ярко выраженную полярную асимметрию. Такие молекулы обычно состоят из двух частей – длинного углеродного радикала и полярной группы. В водных растворах молекулы мыла вследствие межмолекулярных взаимодействий ориентированы так, что углеводородные цепи образуют внутреннее жидкообразное гидрофобное ядро мицеллы, а наружная поверхность ее состоит из гидратированных полярных групп (рисунок 3.3).
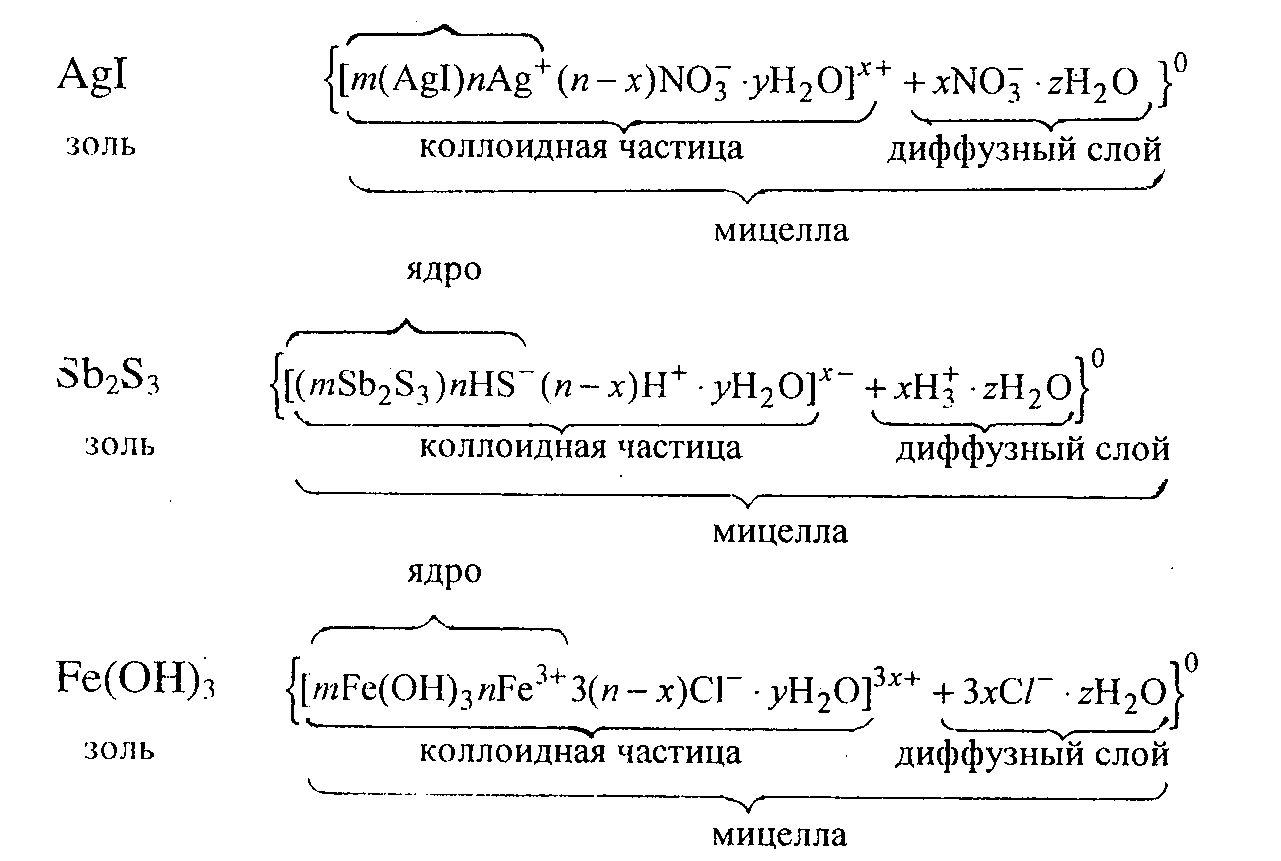
Рисунок 3.3 – Строение мицелл
Ионы Fe3+ (потенциалопределяющие ионы) адсорбируются на поверхности частиц осадка Fe(OH)3, заряжая их положительно; к положительно заряженной поверхности образовавшегося ядра мицеллы притягиваются ионы противоположного знака – противоионы (ионы Cl-). Часть этих ионов, составляющая адсорбционный слой, прочно удерживается у поверхности ядра за счет электростатических и адсорбционных сил. Ядро вместе с адсорбционным слоем составляет коллоидную частицу. Остальные противоионы связаны с ядром только электростатическими силами. Эти противоионы образуют диффузный слой. Наличие заряда у коллоидных частиц приводит к их отталкиванию и обеспечивает устойчивость золя. Коллоидная частица и диффузный слой образуют электронейтральную мицеллу.
3.6.2 Вопросы для самоконтроля
1. Чем отличаются лиофильные коллоиды от лиофобных?
2. Каково строение мицеллы?
3. Чему равен заряд коллоидной частицы и мицеллы?
4. Какие силы удерживают противоионы в абсорбционном и диффузионных слоях? В чем их отличие?
