Учебное пособие для модульно-рейтинговой технологии обучения Бийск
| Вид материала | Учебное пособие |
| Приложени б |
- Методические рекомендации по организации учебного процесса с использованием модульно-рейтинговой, 554.48kb.
- Я. В. Вакула Нефтегазовые технологии Учебное пособие, 2652.31kb.
- Учебное пособие «управление персоналом» для студентов заочного обучения специальности, 1516.37kb.
- М. Н. Машкин Информационные технологии Учебное пособие, 2701.91kb.
- Учебное пособие Уфа 2005 удк 338 (075. 8) Ббк, 1087.66kb.
- Учебный план как средство реализации принципов модульно-рейтинговой технологии обучения, 68.67kb.
- О. Д. Картавцева интенсивный курс обучения изобразительной грамоте учебное пособие, 780.71kb.
- Менеджмента качества положение о модульно-рейтинговой системе квалиметрии учебной деятельности, 1381.23kb.
- Учебное пособие 28365942 Москва 2008 ббк 66., 2986.28kb.
- Формирование профессиональной компетентности будущих специалистов в области вычислительной, 372.85kb.
ПРИЛОЖЕНИ Б
ТЕСТОВЫЕ ЗАДАНИЯ
Тест1
1. Электролиты − это любые вещества, которые:
а) проводят электрический ток;
б) растворимы в воде;
в) не растворимы в органических растворителях;
г) диссоциируют в растворе или расплаве на ионы;
д) образуют сольваты в растворах.
2. Растворы − это:
а) гомогенные многокомпонентные системы, состоящие из продуктов их химического взаимодействия;
б) гомогенные многокомпонентные системы, состоящие из физической смеси различных компонентов;
в) гомогенные многокомпонентные системы, состоящие из двух или нескольких компонентов и продуктов их взаимодействия;
г) гомогенные многокомпонентные системы, образующиеся в результате диссоциации и ионизации различных веществ;
д) гомогенные многокомпонентные системы, образующиеся в результате процесса сольватации.
3. Молярная концентрация:
а) характеризует количество вещества эквивалентов, содержащееся в одном литре раствора;
б) характеризует количество растворенного вещества, содержащееся в одном килограмме растворителя;
в) характеризует долю, которую составляет масса растворенного вещества от массы раствора;
г) характеризует массу вещества, содержащуюся в одном миллилитре раствора;
д) характеризует долю, которую составляет количество растворенного вещества от суммы количества веществ всех компонентов раствора;
е) характеризует отношение объема компонента, содержащегося в системе, к общему объему системы;
ж) характеризует количество растворенного вещества в одном литре раствора.
4. К экстенсивным свойствам систем относят:
а) давление;
б) объем;
в) температуру;
г) концентрацию;
д) энтропию.
5. Единицами измерения молярной концентрации являются:
а) %;
б) г/см3;
в) М;
г) н;
д) моль/1000 г растворителя.
6. Математическая запись закона разбавления Оствальда имеет вид:
а)
 ;
; б)
 ;
;в)
 ;
; г)
 ;
;д)
 ;
;е)
 .
.7. Коэффициент растворимости:
а) показывает, сколько граммов вещества растворено в 100 г растворителя;
б) показывает количество вещества, растворенного в 1000 г растворителя;
в) показывает массу растворенного вещества в 100 г раствора;
г) показывает количество вещества, содержащегося в 1 литре раствора;
д) показывает массу вещества, растворенного в 1 мл раствора.
8. Какое из следующих утверждений справедливо для насыщенных растворов?
а) насыщенный раствор может быть и разбавленным, и концентрированным;
б) насыщенный раствор может быть только концентрированным;
в) насыщенный раствор может быть только разбавленным;
г) насыщенный раствор не может быть разбавленным;
д) насыщенный раствор не может быть концентрированным.
9. Какое вещество, из числа приведенных ниже, хорошо растворяется в воде?
а) метан;
б) оксид железа (III);
в) аммиак;
г) хлорид натрия;
д) сульфид меди (II).
10. Укажите массу хлорида калия, которая выкристаллизуется при охлаждении до 20 оC 626,8 г насыщенного при 100 оC раствора, если растворимость хлорида калия составляет 56,7 г при 100 оC и 34 г при 20 оC.
а) 65,57 г;
б) 67,8 г;
в) 124,1 г;
г) 176,7 г.
Тест 2
1. Какое из веществ, формулы которых приведены ниже, является сильным электролитом?
а)
 ;
;б)
 ;
; в)
 ;
; г)
 ;
; д)
 .
. 2. Какие факторы способствуют усилению процесса диссоциации слабой кислоты?
а) добавление сильной кислоты;
б) добавление щелочи;
в) повышение температуры;
г) разбавление раствора;
д) охлаждение раствора.
3. Реакции между какими веществами, названия которых приведены ниже, протекают практически необратимо?
а) гидроксид железа (II) и серная кислота;
б) хлорид алюминия и гидроксид калия;
в) карбонат калия и соляная кислота;
г) карбонат кальция и гидроксид натрия;
д) сульфат меди (II) и нитрат калия.
4. Реакциями ионного обмена между какими из веществ, названия которых приведены ниже, можно получить карбонат кальция?
а) кальций и оксид углерода (IV);
б) оксид кальция и оксид углерода (IV);
в) нитрат кальция и карбонат натрия;
г) хлорид кальция и углекислый газ;
д) карбонат калия и гидроксид кальция.
5. Математическая запись закона осмотического давления имеет вид:
а)
 ;
; б)
 ;
; в)
 ;
; г)
 ;
;д)
 ;
;е)
 .
.6. Укажите соль, в водных растворах которой индикатор фенолфталеин приобретает малиновую окраску:
а) бромид калия;
б) хлорид хрома (III);
в) карбонат натрия;
г) сульфат меди (II);
д) нитрат калия.
7. Укажите факторы, способствующие усилению гидролиза хлорида железа (III):
а) разбавление раствора;
б) добавление кислоты;
в) добавление щелочи;
г) охлаждение раствора;
д) нагревание раствора;
е) увеличение концентрации соли.
8. Ионы − это:
а) вид атомов, характеризующийся одним и тем же зарядом ядра;
б) одноатомные или многоатомные частицы, несущие электрический заряд;
в) условные заряды атомов, вычисленные из предположения, что все связи в молекуле ковалентные;
г) вид атомов с одинаковыми массовыми числами;
д) вид атомов с одинаковым числом нейтронов.
9. Молярная концентрация эквивалента вещества:
а) характеризует количество вещества эквивалентов, содержащееся в одном литре раствора;
б) характеризует количество растворенного вещества, содержащееся в одном килограмме растворителя;
в) характеризует долю, которую составляет масса растворенного вещества от массы раствора;
г) характеризует массу вещества, содержащуюся в одном миллилитре раствора;
д) характеризует долю, которую составляет количество растворенного вещества от суммы количества веществ всех компонентов раствора;
е) характеризует отношение объема компонента, содержащегося в системе, к общему объему системы;
ж) характеризует количество растворенного вещества в одном литре раствора.
10. Масса (г) кристаллогидрата Сu(NОз)·3Н2О, требуемая для приготовления 470 г 20 % раствора нитрата меди(II), равна:
а) 73,0;
б) 121,0;
в) 182,5;
г) 605,0;
д) 282,5.
Тест 3
1. Мерой электролитической диссоциации принято считать:
а) молярную концентрацию раствора;
б) pH раствора;
в) константу гидролиза;
г) степень электролитической диссоциации;
д) константу диссоциации.
2. Не вступает в реакции ионного обмена в водном растворе:
а) нитрат аммония;
б) карбонат натрия;
в) нитрат калия;
г) нитрит натрия;
д) хлорид алюминия.
3. Титр раствора:
а) характеризует количество вещества эквивалентов, содержащееся в одном литре раствора;
б) характеризует количество растворенного вещества, содержащееся в одном килограмме растворителя;
в) характеризует долю, которую составляет масса растворенного вещества от массы раствора;
г) характеризует массу вещества, содержащуюся в одном миллилитре раствора;
д) характеризует долю, которую составляет количество растворенного вещества от суммы количества веществ всех компонентов раствора;
е) характеризует отношение объема компонента, содержащегося в системе, к общему объему системы;
ж) характеризует количество растворенного вещества в одном литре раствора.
4. Идеальные растворы:
а) состоят из продуктов взаимодействия растворителя и растворенного вещества;
б) это растворы, которые проводят электрический ток;
в) это водные растворы;
г) это раствор, в котором силы всех межмолекулярных взаимодействий молекул растворителя и растворенных веществ одинаковы;
д) это жидкие растворы.
5. Укажите вещество, подвергающееся гидролизу:
а) фенол;
б) сульфит натрия;
в) хлорид натрия;
г) гидроксид калия;
д) соляная кислота.
6. Математическая запись закона Рауля имеет вид:
а)
 ;
;б)
 ;
;в)
 ;
; г)
 ;
;д)
 ;
;е)
 .
.7. Процесс электролитической диссоциации является:
а) неравновесным;
б) эндотермическим;
в) экзотермическим;
г) обратимым;
д) необратимым.
8. Моляльная концентрация:
а) характеризует количество вещества эквивалентов, содержащееся в одном литре раствора;
б) характеризует количество растворенного вещества, содержащееся в одном килограмме растворителя;
в) характеризует долю, которую составляет масса растворенного вещества от массы раствора;
г) характеризует массу вещества, содержащуюся в одном миллилитре раствора;
д) характеризует долю, которую составляет количество растворенного вещества от суммы количества веществ всех компонентов раствора;
е) характеризует отношение объема компонента, содержащегося в системе, к общему объему системы;
ж) характеризует количество растворенного вещества в одном литре раствора.
9. Чтобы ослабить или прекратить гидролиз в растворе хлорида алюминия, необходимо:
а) добавить гидроксид натрия;
б) добавить серную кислоту;
в) добавить хлорид натрия;
г) добавить воду;
д) охладить раствор;
е) нагреть раствор.
10. Если хлорид бария массой 2,08 г содержится в растворе объемом 250 см, то его молярная концентрация эквивалента равна:
а) 0,08 н;
б) 0,04 н;
в) 0,06 н;
г) 0,10 н.
Тест 4
1. Какое из веществ, формулы которых приведены ниже, является слабым электролитом?
а)
 ;
;б)
 ;
; в)
 ;
; г)
 ;
; д)
 .
. 2. Математическая запись первого следствия из закона Рауля имеет вид:
а)
 ;
;б)
 ;
;в)
 ;
; г)
 ;
;д)
 ;
;е)
 .
.3. Укажите формулу частиц, концентрация которых в насыщенном растворе сероводорода наибольшая:
а) H+;
б)
 ;
; в)
 ;
;г)
 ;
;д)
 .
.4. Мольная доля:
а) характеризует количество вещества эквивалентов, содержащееся в одном литре раствора;
б) характеризует количество растворенного вещества, содержащееся в одном килограмме растворителя;
в) характеризует долю, которую составляет масса растворенного вещества от массы раствора;
г) характеризует массу вещества, содержащуюся в одном миллилитре раствора;
д) характеризует долю, которую составляет количество растворенного вещества от суммы количества веществ всех компонентов раствора;
е) характеризует отношение объема компонента, содержащегося в системе, к общему объему системы;
ж) характеризует количество растворенного вещества в одном литре раствора.
5. Какие факторы понижают степень диссоциации уксусной кислоты ?
а) подщелачивание раствора;
б) разбавление раствора водой;
в) подкисление раствора;
г) повышение температуры;
д) понижение температуры;
е) добавление ацетата натрия.
6. Сокращенное ионное уравнение реакции Ba2+ + SO42- = BaSO4. соответствует взаимодействиям таких веществ:
а) гидроксида бария с серной кислотой;
б) гидроксида бария с оксидом серы (VI);
в) хлорида бария с сульфатом натрия;
г) оксида бария с сульфатом калия;
д) карбоната бария с серной кислотой;
е) нитрата бария с сульфитом калия;
ж) хлорида бария с гидросульфатом аммония.
7. Укажите соль, в водных растворах которой индикатор лакмус приобретает синюю окраску:
а) бромид калия;
б) хлорид хрома (III);
в) карбонат натрия;
г) сульфат меди (II);
д) нитрат калия.
8. Какая соль гидролизуется в большей степени?
а) ацетат железа (II);
б) нитрат железа (II);
в) нитрат железа (III);
г) бромид железа (III);
д) хлорид железа (II);
е) ацетат железа (III).
9. Кислотно-основные буферные растворы – это растворы:
а) с постоянным значением рН раствора вне зависимости от количества разбавленной или добавленной сильной кислоты или сильного основания;
б) с переменным значением рН раствора при разбавлении;
в) с сохраняющимся практически постоянным значением рН раствора при разбавлении или добавлении небольших количеств сильной кислоты или сильного основания;
г) с нейтральной реакцией растворов;
д) с щелочной реакцией растворов.
10. Если раствор получен смешением растворов массами 200 и 250 г с массовыми долями 10 и 40 % соответственно, то его массовая доля раствора:
а) 25,4 %;
б) 26,7 %;
в) 31,3 %;
г) 27,5 %.
Тест 5
1. Численное значение степени диссоциации электролита при постоянной температуре существенно зависит:
а) от атмосферного давления;
б) наличия катализатора;
в) агрегатного состояния электролита;
г) концентрации раствора.
2. При сливании растворов каких веществ происходит реакция, описываемая сокращенным ионным уравнением H+ + OH-= H2O:
а) гидроксида бария и серной кислоты;
б) гидроксида меди и азотной кислоты;
в) гидроксида магния и азотной кислоты;
г) гидроксида натрия и уксусной кислоты;
д) гидроксида калия и бромоводородной кислоты;
е) гидрокарбоната натрия и гидроксида натрия?
3. Коллоидная система, в которой дисперсная среда − жидкость, а дисперсионная фаза – газ, называется:
а) туман;
б) эмульсия;
в) паста;
г) пыль;
д) пена;
е) суспензия.
4. Объемная доля:
а) характеризует количество вещества эквивалентов, содержащееся в одном литре раствора;
б) характеризует количество растворенного вещества, содержащееся в одном килограмме растворителя;
в) характеризует долю, которую составляет масса растворенного вещества от массы раствора;
г) характеризует массу вещества, содержащуюся в одном миллилитре раствора;
д) характеризует долю, которую составляет количество растворенного вещества от суммы количества веществ всех компонентов раствора;
е) характеризует отношение объема компонента, содержащегося в системе, к общему объему системы;
ж) характеризует количество растворенного вещества в одном литре раствора.
5. Укажите соль, в водных растворах которой индикатор метилоранж приобретает желтую окраску:
а) бромид калия;
б) хлорид хрома (III);
в) карбонат натрия;
г) сульфат меди (II);
д) нитрат калия.
6. Математическая запись второго следствия из закона Рауля имеет вид:
а)
 ;
;б)
 ;
; в)

г)
 ;
;д)
 ;
;е)
 .
.7. С каким веществом реагирует нитрат меди согласно сокращен-ному уравнению реакции Cu2+ + S2-= CuS:
а) сероводородом;
б) сульфатом натрия;
в) гидросульфидом натрия;
г) сульфитом натрия;
д) сульфидом натрия;
е) сульфидом свинца;
ж) гидросульфатом натрия?
8. Какие вещества, из числа приведенных ниже, при смешивании в умеренном количестве с водой образуют дисперсную систему, называемую суспензией?
а) негашеная известь;
б) нефть;
в) порошок мела;
г) цемент;
д) ацетон;
е) каустик.
9. Гидролиз какой соли описывается уравнением S2- + H2O = HS- + OH-:
а) сульфида алюминия;
б) сульфида аммония;
в) гидросульфида натрия;
г) сульфида натрия;
д) сульфита натрия;
е) гидросульфита натрия?
10. Укажите объем 2 M раствора соляной кислоты, который надо добавить к 80 мл 7 M раствора, чтобы образовался 4 M раствор.
а) 80 мл;
б) 100 мл;
в) 120 мл;
г) 140 мл;
д) 70 мл.
Тест 6
1. Какое из веществ, формулы которых приведены ниже, является электролитом средней силы?
а)
 ;
;б)
 ;
; в)
 ;
; г)
 ;
; д)
 .
. 2. Укажите формулу частиц, концентрация которых в растворе ортофосфорной кислоты наибольшая:
а)
 ;
;б)
 ;
;в)
 ;
;г)
 ;
;д)
 .
.3. Массовая доля:
а) характеризует количество вещества эквивалентов, содержащееся в одном литре раствора;
б) характеризует количество растворенного вещества, содержащееся в одном килограмме растворителя;
в) характеризует долю, которую составляет масса растворенного вещества от массы раствора;
г) характеризует массу вещества, содержащуюся в одном миллилитре раствора;
д) характеризует долю, которую составляет количество растворенного вещества от суммы количества веществ всех компонентов раствора;
е) характеризует отношение объема компонента, содержащегося в системе, к общему объему системы;
ж) характеризует количество растворенного вещества в одном литре раствора.
4. Коллоидная система, в которой дисперсная среда − газ, а дисперсионная фаза – жидкость, называется:
а) туман;
б) эмульсия;
в) паста;
г) пыль;
д) пена;
е) суспензия.
5. Какое сокращенное ионное уравнение соответствует реакции водных растворов гидрокарбоната натрия и гидроксида натрия:
а)
 ;
;б)
 ;
; в)
 ;
; г)
 .
.6. По теории Брёнстеда − Лаури кислота – это:
а) вещество, способное отдавать протон;
б) акцептор электронов;
в) электролит, диссоциирующий в растворах с образованием ионов водорода;
г) вещество, способное принимать протон;
д) донор электронов.
7. Какие из веществ, название которых приведены ниже, образуют при диссоциации в качестве анионов только гидроксид-ионы?
а) кислоты;
б) оксиды;
в) амфотерные гидроксиды;
г) соли;
д) основания.
8. Математическая запись, определяющая степень гидролиза:
а)
 ;
;б)
 ;
; в)

г)
 ;
;д)
 ;
;е)
 .
.9. Смешали 400 мл 0,8 М раствор серной кислоты и 100 мл 42 % раствор серной кислоты (ρ = 1,324 г/см3). Какая будет молярная концентрация полученного раствора:
а) 1,65 М;
б) 1,77 М;
в) 1,95 М;
г) 2 М;
д) 2,5 М.
Тест 7
1. Давление пара над раствором:
а) ниже, чем над чистым растворителем;
б) выше, чем над чистым растворителем;
в) равно давлению пара над чистым растворителем;
г) не зависит от концентрации раствора;
д) не зависит от природы растворителя.
2. Метод определения молекулярной массы вещества, основанный на разнице температур замерзания растворителя и раствора, называется:
а) эбулиоскопия;
б) криоскопия;
в) микроскопия;
г) термоскопия;
д) гастроскопия.
3. Математическая запись, определяющая степень диссоциации:
а)
 ;
;б)
 ;
; в)
 ;
; г)
 ;
;д)
 ;
;е)
 .
.4. По теории кислот и оснований С. Аррениуса кислота – это:
а) вещество, способное отдавать протон;
б) акцептор электронов;
в) электролит, диссоциирующий в растворах с образованием ионов водорода;
г) вещество, способное принимать протон;
д) донор электронов.
5. Коллоидная система, в которой дисперсная среда − газ, а дисперсионная фаза − твердое вещество, называется:
а) туман;
б) эмульсия;
в) паста;
г) пыль;
д) пена;
е) суспензия.
6. Только сильные электролиты перечислены в ряду:
а)
 ,
, ,
, ;
;б)
 ,
, ,
, ;
;в)
 ,
,  ,
, ;
;г)
 ,
,  ,
,  ;
;д)
 ,
, ,
,  .
.7. Единицами измерения молярной концентрации эквивалента раствора являются:
а) %;
б) г/см3;
в) М;
г) н;
д) моль/1000 г растворителя.
8. Гидролиз какой соли описывается уравнением S2- + H2O = HS- + OH-:
а) сульфида алюминия;
б) сульфида аммония;
в) гидросульфида натрия;
г) сульфида натрия;
д) сульфита натрия;
е) гидросульфита натрия?
9. Укажите соль, в водных растворах которой индикатор лакмус приобретает красную окраску:
а) бромид калия;
б) хлорид алюминия;
в) карбонат натрия;
г) сульфат лития;
д) нитрат калия.
10. Пересчитайте массовую долю раствора, выраженную в процентах 10 % Na2CO3, в молярную и молярную концентрацию эквивалента раствора:
а) 1,20 М и 0,65 н;
б) 1,21 М и 0,605 н;
в) 1,25 М и 0,605 н;
г) 1,35 М и 0,502 н;
д) 1,12 М и 2,24 н.
Тест 8
1. Какие вещества, из числа приведенных ниже, хорошо растворяются в воде?
а) метан;
б) оксид железа (III);
в) бензол;
г) хлорид калия;
д) гидроксид бария.
2. По теории кислот и оснований Льюиса кислота – это:
а) вещество, способное отдавать протон;
б) акцептор электронов;
в) электролит, диссоциирующий в растворах с образованием ионов водорода;
г) вещество, способное принимать протон;
д) донор электронов.
3. Какие из веществ, название которых приведены ниже, являются электролитами?
а) глицерин;
б) азотная кислота;
в) уксусная кислота;
г) хлорид калия,
д) крахмал.
4. Коллоидная система, в которой дисперсная среда − жидкость, а дисперсионная фаза – жидкость, называется:
а) туман;
б) эмульсия;
в) паста;
г) пыль;
д) пена;
е) суспензия.
5. Метод определения молекулярной массы вещества, основанный на разнице температур кипения растворителя и раствора, называется:
а) эбулиоскопия;
б) криоскопия;
в) микроскопия;
г) термоскопия;
д) гастроскопия.
6. Укажите соль, в водных растворах которой индикатор метилоранж приобретает розовую окраску:
а) бромид калия;
б) хлорид бария;
в) карбонат натрия;
г) сульфат алюминия;
д) нитрат калия.
7. Какая соль подвергаются гидролизу необратимо:
а)
 ;
;б)
 ;
;в)
 ;
;г)
 ;
;д)
 .
.8. Гидролиз водных растворов каких солей ослабляется при добавлении минеральной кислоты:
а)
 ;
;б)
 ;
;в)
 ;
;г)
 ;
; д)
 .
.9. Самопроизвольное перемещение растворителя через мембрану в системе «растворитель – мембрана – раствор» называется:
а) конвективным перемешиванием;
б) циркуляцией вихревого потока;
в) ламинарным током;
г) диализом;
д) осмосом.
10. Определите концентрацию ионов [ОН-] в 0,01 м NH4OH. Рассчитайте значения рН этого раствора при температуре 295 К, если степень диссоциации α = 4,24 · 10-2.
а)
 = 4,24· 10-1 моль/л,
= 4,24· 10-1 моль/л,  = 4;
= 4;б)
 = 8,28 · 10-5 моль/л,
= 8,28 · 10-5 моль/л,  = 2;
= 2;в)
 = 4,24 · 10-4 моль/л,
= 4,24 · 10-4 моль/л,  = 10,63;
= 10,63;г)
 = 4,28 · 10-5 моль/л ,
= 4,28 · 10-5 моль/л ,  = 4,24;
= 4,24;д)
 = 4,5 · 10-5 моль/л ,
= 4,5 · 10-5 моль/л ,  = 4.
= 4.Тест 9
1. В 0,1 М растворе какой соли самая высокая концентрация ионов Н+?
а)
 ;
;б)
 ;
;в)
 ;
;г)
 ;
;д)
 .
.2. Что происходит с величиной рН раствора при растворении соли в воде, образованной сильной кислотой и сильным основанием ?
а) величина
 раствора увеличивается;
раствора увеличивается;б) величина
 раствора уменьшается;
раствора уменьшается; в) величина
 раствора не изменяется;
раствора не изменяется;г) сначала увеличивается, затем уменьшается.
3. Единицами измерения моляльной концентрации раствора являются:
а) %;
б) г/см3;
в) М;
г) н;
д) моль/1000 г растворителя.
4. Коллоидные растворы представляют собой смесь компонентов, размеры частиц которых:
а) меньше 10-9 (меньше 1 нм);
б) больше 10-6 м (больше 1000 нм);
в) от 10-9 до 10-7 м (от 1 до 100 нм);
г) от 10-6 до 5∙ 10-6 м (от 1000 до 5000 нм).
5. Золи – это:
а) коллоидные системы с изолированными друг от друга коллоидными частицами;
б) высокодисперсные коллоидные системы с жидкой дисперсионной средой;
в) коллоидные системы с соприкасающимися коллоидными частицами;
г) грубодисперсные системы с относительно малой концентрацией дисперсной фазы.
6. Вычислите температуру кристаллизации 2%-ногo раствора этилового спирта С 2Н5ОН. Криоскопическая константа воды 1,86.
а) минус 0,92;
б) минус 0,72;
в) минус 0,82;
г) минус 0,62;
д) минус 0,52.
7. Какие факторы понижают степень диссоциации уксусной кислоты:
а) подщелачивание раствора;
б) разбавление раствора водой;
в) подкисление раствора;
г) изменение температуры;
д) добавление ацетата натрия.
8. С каким веществом реагирует нитрат меди согласно сокращенному уравнению реакции Cu2+ + S2- = CuS:
а) сероводородом;
б) сульфатом натрия;
в) гидросульфидом натрия;
г) сульфитом натрия;
д) сульфидом натрия;
е) сульфидом свинца;
ж) гидросульфатом натрия.
9. Проводит электрический ток:
а) сжиженный хлороводород;
б) дистиллированная вода;
в) раствор хлороводорода;
г) раствор сахара.
10. Рассчитайте, сколько нужно взять граммов кристаллогидрата CuSO4 ·5H2O и воды для приготовления 100 мл 10%-ного раствора сульфата меди CuSO4 плотностью 10% CuSO4 = 1, 107 г/см3:
а) 10,2 г
 ·
· и 80 г
и 80 г  ;
;б) 17,3 г
 ·
· и 93,4 г
и 93,4 г  ;
; в) 12,2 г
 ·
· и 94,8 г
и 94,8 г  ;
;г) 15,2 г
 ·
· и 84,8 г
и 84,8 г  .
.Тест 10
1. Щелочная среда образуется при растворении соли:
а)
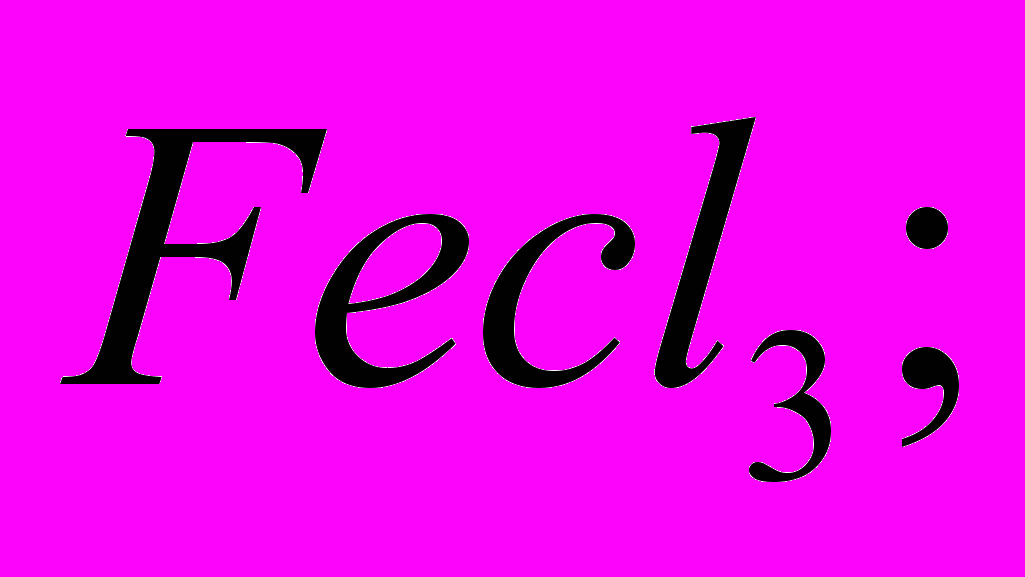
б)
 ;
; в)
 ;
; г)
 .
.2. Только слабые электролиты перечислены в ряду:
а)
 ,
, ,
, ;
;б)
 ,
, ,
, ;
;в)
 ,
, ,
, ;
;г)
 ,
,  ,
,  .
.3. Коллоидные растворы относятся:
а) к грубодисперсным системам;
б) тонкодисперсным системам;
в) молекулярно-дисперсным системам;
г) истинным растворам;
д) среднедисперсным системам.
4. Ионное произведение воды равно:
а)
 ;
;б)
 ;
; в)
 ;
; г)
 ;
;д)
 ;
;е)
 ;
;ж)
 .
.5. Активность иона − это:
а) мера интенсивности электрического поля, создаваемого ионами в растворе;
б) коэффициент, учитывающий все виды взаимодействий в растворах, приводящих к отклонению от свойств идеального раствора;
в) условная концентрация его, соответственно которой он действует в химических реакциях;
г) отрицательный десятичный логарифм концентрации ионов водорода;
д) отрицательный десятичный логарифм концентрации гидроксид ионов.
6. Электролитическая диссоциация − это:
а) распад молекул на ионы под действием электрического поля;
б) это процесс распада молекул веществ на ионы под действием полярных молекул растворителя, а также при их расплавлении;
в) это окислительно-восстановительный процесс, который про-текает на электродах при прохождении постоянного электрического тока через растворы или расплавы электролитов;
г) процесс, при котором составные части вещества взаимодействуют с составными частями воды, образуя слабодиссоциирующие ионы или молекулы;
д) обратимая химическая реакция, при которой происходит обмен ионами между твердым веществом и раствором электролита, либо между различными электролитами, находящимися в растворе.
7. Выберите правильные утверждения: произведение растворимости зависит:
а) от природы растворенного вещества и растворителя;
б) от температуры;
в) от концентрации;
г) от давления;
д) от вязкости.
8. Какие силы удерживают противоионы в адсорбционном слое:
а) электростатические;
б) адсорбционные;
в) ядерные;
г) электростатические и адсорбционные;
д) гравитационные.
9. Рассчитать, сколько миллилитров 3%-ного раствора K2CrO4 и воды нужно взять, чтобы приготовить 100 мл 2 % раствора K2CrO4; (3 %
 ) = 1,082 г/см3.
) = 1,082 г/см3.а) 66 мл 3 % раствора
 и 34 мл
и 34 мл  ;
;в) 56,2 мл 3 % раствора
 и 43,8 мл
и 43,8 мл  ;
; б) 64,9 мл 3 % раствора
 и 35,1 мл
и 35,1 мл  ;
;г) 68,9 мл 3 % раствора
 и 34,1 мл
и 34,1 мл  ;
;д) 65 мл 3 % раствора
 и 35 мл
и 35 мл  .
.