Учебное пособие для модульно-рейтинговой технологии обучения Бийск
| Вид материала | Учебное пособие |
- Методические рекомендации по организации учебного процесса с использованием модульно-рейтинговой, 554.48kb.
- Я. В. Вакула Нефтегазовые технологии Учебное пособие, 2652.31kb.
- Учебное пособие «управление персоналом» для студентов заочного обучения специальности, 1516.37kb.
- М. Н. Машкин Информационные технологии Учебное пособие, 2701.91kb.
- Учебное пособие Уфа 2005 удк 338 (075. 8) Ббк, 1087.66kb.
- Учебный план как средство реализации принципов модульно-рейтинговой технологии обучения, 68.67kb.
- О. Д. Картавцева интенсивный курс обучения изобразительной грамоте учебное пособие, 780.71kb.
- Менеджмента качества положение о модульно-рейтинговой системе квалиметрии учебной деятельности, 1381.23kb.
- Учебное пособие 28365942 Москва 2008 ббк 66., 2986.28kb.
- Формирование профессиональной компетентности будущих специалистов в области вычислительной, 372.85kb.
3.7 Методы получения коллоидных растворов
3.7.1 Основные положения
Для того чтобы получить коллоидный раствор или золь, необходимо выполнить два условия:
1) создать в жидкости твердые или жидкие нерастворимые частицы коллоидной степени дисперсности;
2) обеспечить устойчивость этих частиц, предохранив их от слипания друг с другом (от коагуляции), т. е. стабилизировать систему.
Стабилизация коллоидных систем может производиться путем введения в систему нового компонента − стабилизатора, который адсорбируется на поверхности коллоидных частиц и придает частицам заряд или образует защитную оболочку. Часто стабилизатором служит избыток электролита, применяемый при получении коллоидной системы.
Коллоидные системы можно получить двумя способами: диспергированием и конденсационным методом.
Диспергирование основано на получении из сплошного и крупного по размерам тела более мелких частиц дисперсной фазы. Диспергирование может быть самопроизвольным и несамопроизвольным.
Самопроизвольное диспергирование характерно для лиофильных систем.
Несамопроизвольное диспергирование бывает:
- механическое (коллоидные мельницы);
- физическое (диспергирование ультразвуком);
- физико-химическое (пептизация).
Виды механического диспергирования в зависимости от агрегатного состояния дисперсной фазы:
- измельчение, истирание, раздавливание и т. д.;
- распыливание;
- барботаж.
К физико-химическим методам получения коллоидных растворов относят пептизацию. Пептизацией называют переход свежеприготовленного осадка в раствор под действием пептизаторов (FeCl3), образовавшихся при коагуляции осадков, частицы которых имеют коллоидный размер. Пептизация бывает двух видов:
- непосредственная;
- посредственная.
Непосредственной называется такая пептизация, при которой осадок и пептизатор имеют общий ион.
Например, осадок CuS можно пептизировать с помощью ионов меди или серы (Cu2+; S2-).
Посредственной называется такая пептизация, при которой осадок и пептизатор не имеют общих ионов, но взаимодействуют между собой химически, например, гидроксид алюминия – осадок, соляная кислота – пептизатор.
К конденсационным методам относятся реакции обмена, окисления-восстановления, гидролиза. Конденсация связана с укрупнением частиц, в том числе и частиц молекулярных размеров, до частиц определенного класса дисперсных систем.
Конденсация − начальная стадия образования новой фазы из пересыщенного раствора, пара или переохлажденной жидкости. Пересыщение в растворе может быть достигнуто в результате химической реакции с образованием малорастворимого вещества, например, при образовании нерастворимых в воде солей (BaSO4, галогениды серебра). Коллоидные системы образуются при этом, если рост возникающих зародышей новой фазы тормозится уже на начальной стадии, например, при возникновении большого числа зародышей в единице объема с последующим резким падением пересыщения или при введении добавок адсорбирующихся веществ, замедляющих рост зародышей.
Метод ионного обмена:
 ,
,

 ,
,.

Если соли взять в эквивалентных количествах, то образуется истинный раствор, содержащий осадок иодида серебра.
Если эту же реакцию провести при избытке KJ, то после протекания реакции в растворе остаются ионы калия и йода.
 .
.В данном случае протекают одновременно два процесса. Образуются молекулы трудно растворимого вещества, которые собираются вместе, готовые выпасть в осадок.
Одновременно молекулы AgJ адсорбируют на своей поверхности ионы йода. Ионы йода притягивают к себе ионы противоположного знака, т.е. ионы калия. Образуются так называемые мицеллы − частицы дисперсной фазы гидрофобного золя:
 .
.Рассмотрим образование гидрофобного золя на основе окислительно-восстановительной реакции методом окисления − восстановления:

 ,
,
 2
2  ,
,1
 .
.В данном случае ядром будет сера. Она имеет достаточно близкое химическое строение с анионом HS-, чтобы адсорбировать его на своей поверхности:
 .
. При использовании метода гидролиза для приготовления коллоидных растворов следует получить частицы размером от 1 до 500 нм, подобрать дисперсионную среду, в которой не растворяется вещество частиц, и обеспечить устойчивость частиц. В качестве вещества коллоидных частиц в водных средах служат металлы, оксиды, гидроксиды, сульфиды и другие малорастворимые соединения металлов и неметаллов. Например, в результате гидролиза солей железа (III) получают его гидроксид:
 .
.Для повышения устойчивости коллоидов в раствор вводят стабилизаторы, например ПАВ, или ионы вещества, из которого состоит частица. В природе идут естественные процессы образования коллоидных растворов при взаимодействии воды с глиной, органическими, например гумусовыми, кислотами и другими веществами. Природные воды, особенно в периоды половодья, содержат заметное количество веществ в коллоидном состоянии.
3.7.2 Вопросы для самоконтроля
1. Какие условия необходимы для получения золей?
2. Какими способами можно получить коллоидные системы?
3. Какие существуют разновидности метода диспергирования?
4. Раскройте понятие явления пептизации.
5. В чем заключается конденсационный метод получения коллоидных систем?
3.8 Оптические свойства коллоидных растворов
3.8.1 Основные положения
Если рассматривать путь светового луча, проходящего через совершенно прозрачный коллоидный раствор, сбоку на темном фоне, то он становится видимым. Этот оптический эффект называется конусом Тиндаля (рисунок 3.4). Он вызывается рассеянием света частицами дисперсной фазы коллоидного раствора и является следствием коллоидной степени дисперсности этих частиц. При сильном увеличении каждая частица в конусе Тиндаля кажется светящейся точкой. Размеры и форму частиц нельзя установить, можно лишь подсчитать их число.
Частицы дисперсной фазы золей по своим размерам меньше длин волн лучей видимого света. Поэтому они рассеивают свет, причем довольно интенсивно, но не отражают его. Частицы в грубодисперсных системах отражают свет, их величину и форму часто можно установить без оптического увеличения. Эффект Тиндаля можно наблюдать в темноте при прохождении луча света через запыленное и накуренное помещение.
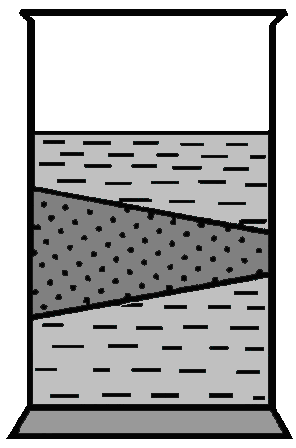
Рисунок 3.4 – Эффект Тиндаля
Специфика оптических свойств объектов коллоидной химии определяется их основными признаками: гетерогенностью и дисперсностью. Гетерогенность обусловливает изменение направления (отражение, преломление) световых, электронных и других лучей на границе раздела фаз и неодинаковое поглощение (пропускание) этих лучей сопряженными фазами. Дисперсные системы обладают фазовой и соответственно оптической неоднородностью.
Оптические методы принадлежат к самым распространенным методам исследования состава и структуры веществ и материалов.
Ультрамикроскопия отличается от обычной микроскопии тем, что дисперсная система (объект) освещается сбоку мощным пучком света. Наблюдают свет, рассеянный частицами, взвешенными в среде с иным показателем преломления. Применение ультрамикроскопа позволяет подсчитать число частиц, наблюдать их движение и определять размер частиц с диаметром до 2–3 нм.
На измерении интенсивности света, отраженного твердыми частицами, взвешенными в растворе, основан нефелометрический метод исследования концентрации, размера и формы частиц, межчастичных взаимодействий и других свойств дисперсных систем (например, молекулярных масс макромолекул).
Турбидиметрический метод исследования основан на измерении
интенсивности света, прошедшего через дисперсную систему. Интенсивность падающего светового потока ослабляется в результате его рассеяния дисперсной системой. Применение метода ограничивается золями, отличающимися сравнительно высокой мутностью.
3.8.2 Вопросы для самоконтроля
1. В чем заключается эффект Тиндаля?
2. Почему частицы золя становятся видимыми в световом пучке на темном фоне?
3. Можно ли установить размеры и форму частиц в эффекте Тиндаля?
4. Охарактеризуйте оптические методы изучения коллоидных систем.
3.9 Кинетические свойства коллоидных растворов
3.9.1 Основные положения
Для коллоидных растворов характерно движение частиц дисперсной фазы, вызываемое беспорядочными ударами со стороны молекул среды, находящихся в тепловом движении. Его впервые наблюдал шотландский ботаник Броун в 1828 году: в микроскопе взвешенные в воде частицы цветочной пыльцы и спор находились в непрерывном беспорядочном движении, не затухающем во времени.
Именно поэтому движение частиц дисперсной фазы в дисперсионной среде золя называется броуновским.
Диффузией (от лат. diffusio – распространение) называют самопроизвольно протекающий в системе процесс выравнивания концентрации молекул, ионов или коллоидных частиц под влиянием их теплового хаотического движения.
Если частица велика, то она испытывает одновременно множество ударов со всех сторон, в результате чего эти удары взаимно уравновешиваются. Частица коллоидной степени дисперсности, как очень малая, никогда не испытывает одинаково сильных и частых ударов со всех сторон, и в одно мгновение более сильным оказывается удар с одной стороны, а в следующее мгновение − с другой. В результате направление движения каждой частицы подвергается непрерывному и притом беспорядочному изменению.
Изучение броуновского движения показало, что кинетические свойства коллоидных растворов близки кинетическим свойствам истинных растворов. Однако скорости перемещения частиц в коллоидных растворах меньше, чем в истинных (это связано с размерами частиц).
Кроме того, движение частиц молекулярной степени дисперсности нельзя наблюдать в микроскоп.
3.9.2 Вопросы для самоконтроля
1. Когда, кем и в каком опыте впервые наблюдалось броуновское движение?
2. Приведите определение диффузии.
3. Раскройте сущность броуновского движения.
3.10 Электрические свойства коллоидных растворов
3.10.1 Основные положения
Электрокинетические явления – это эффекты, связанные с относительным движением двух фаз под действием электрического поля, с возникновением разности потенциалов при относительном смещении двух фаз, на границе между которыми существует двойной электрический слой. Они наблюдаются чаще всего в диспергированных системах. Электрокинетические явления делят на две группы. К первой группе относят электроосмос и электрофорез, ко второй – электродинамический и электрокинетические потенциалы.
В 1909 г. профессор Московского университета Ф. Рейсе наблюдал воздействие постоянного электрического тока на диспергированную в воде глину и на этом основании описал электрические свойства коллоидных растворов. Частицы дисперсной фазы (глины) перемещались к аноду, где вследствие их большого скопления наблюдалось помутнение раствора. Частицы же дисперсионной среды (воды) перемещались к катоду, где наблюдалось повышение уровня прозрачной жидкости. Направленное движение частиц к электродам говорило об их заряде, причем стало ясным, что дисперсная фаза несет на себе заряд, противоположный по знаку заряду среды. Движение частиц дисперсной фазы к одному из электродов при пропускании через золь постоянного электрического тока получило название электрофореза, а движение частиц дисперсионной среды − электроосмос.
Итак, электрофорез и электроосмос обусловлены наличием разноименного заряда у частиц дисперсной фазы и дисперсионной среды. На границе раздела фаз возникает двойной электрический слой, состоящий из тонкой (адсорбционной) части и протяженной диффузной части. Между фазами (на границе между определяющими ионами и противоионами) возникает разность потенциалов, называемая электротермодинамическим потенциалом φ, равная приблизительно одному вольту. Часть скачка потенциала, обусловленная диффузным слоем, называется электрокинетическим, или (дзета)-потенциалом ς, равным приблизительно 0,1 в (рисунок 3.5). Электрокинетический потенциал определяется толщиной и зарядом диффузного слоя, которые зависят от концентрации и заряда противоионов и температуры. Его значение можно регулировать, например, введением противоионов с высоким значением зарядов.
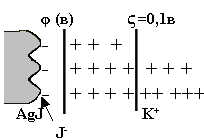

Рисунок 3.5 – Электрокинетический и электродинамический
потенциалы
Наибольшее практическое применение получили электрофорез и электроосмос, особенно электрофоретический метод нанесения покрытий на деталях сложной конфигурации. В практике успешно эксплуатируются автоматические линии грунтовки кузовов автомобилей, покрытия катодов радиоламп, полупроводниковых деталей, нагревателей и т. д. Электрофорез используется в медицине, в биологии при выявлении биохимической и физиологической роли различных высокомолекулярных соединений. Практическое применение электроосмоса ограничено из-за большого расхода электроэнергии. Тем не менее это явление используется для удаления влаги при осушке различных объектов (стен зданий, сыпучих материалов, при строительстве плотин, дамб и т. д.), для пропитки материалов различными веществами. При электроосмотической осушке в объект вводят электроды, представляющие собой полые металлические трубы с отверстиями. В замкнутой электрической цепи происходит электроосмотический перенос жидкости к определенному электроду, на котором она собирается, и затем ее откачивают насосом.
3.10.2 Вопросы для самоконтроля
1. Кто и в каком году проводил исследования электрических свойств коллоидных растворов?
2. Раскройте сущность явлений электрофореза и электроосмоса.
3. Приведите понятия электродинамического и электрокинетического потенциалов.
4. Какие практические примеры использования электрических свойств коллоидных систем существуют?
3.11 Агрегативная устойчивость коллоидных растворов
3.11.1 Основные положения
Различают термодинамический и кинетический факторы агрегативной устойчивости дисперсных систем. Основными факторами, обеспечивающими устойчивость дисперсных систем, будут те, которые снижают поверхностное натяжение. Эти факторы относят к термодинамическим. Они уменьшают вероятность эффективных соударений между частицами, создают потенциальные барьеры, замедляющие или даже исключающие процесс коагуляции. Коагуляция − процесс укрупнения частиц, потеря агрегативной устойчивости золя. Чем меньше поверхностное натяжение, тем ближе система к термодинамически устойчивой.
Кинетические свойства коллоидных растворов определяют их кинетическую устойчивость, которая состоит в том, что концентрация коллоидных растворов одинакова по всему объему системы и при правильном хранении не изменяется во времени. Кинетические факторы, снижающие скорость коагуляции, связаны в основном с гидродинамическими свойствами среды: с замедлением сближения частиц, вытекания и разрушения прослоек среды между ними.
Различают следующие термодинамические и кинетические факторы устойчивости дисперсных систем:
а) электростатический фактор, который заключается в уменьшении межфазного натяжения вследствие возникновения двойного электрического слоя на поверхности частиц;
б) адсорбционно-сольватный фактор, состоящий в уменьшении межфазного натяжения при взаимодействии частиц дисперсной фазы со средой (благодаря адсорбции и сольватации);
в) энтропийный фактор, заключающийся в стремление дисперсной фазы к равномерному распределению по объему системы (как и распределение растворенного вещества в истинных растворах);
г) структурно-механический фактор, который является кинетическим; его действие обусловлено тем, что на поверхности частиц имеются пленки, обладающие упругостью и механической прочностью, разрушение которых требует затраты энергии и времени;
д) гидродинамический фактор, снижающий скорость коагуляции благодаря изменению вязкости среды и плотности дисперсной фазы и дисперсионной среды;
е) смешанные факторы, наиболее характерные для реальных систем.
Обычно агрегативная устойчивость обеспечивается несколькими факторами одновременно.
При длительном хранении гидрофильные золи переходят в особое «студнеобразное» коллоидное состояние. В таком виде их называют гелями. Структура геля такова, что мицеллы не разрушаются, а просто связываются друг с другом, образуя своеобразные ячейки, внутри которых сохраняется среда Н20. Гель можно высушить, превратив его в твердый коллоид (рисунок 3.6).
Примером гидрофильного золя может служить золь желатина. В продаже имеется твердый коллоид желатина. При набухании в воде образуется гель. При нагревании геля («студня») образуется золь. Все процессы обратимы:
Золь ↔ Гель ↔ Твердый коллоид
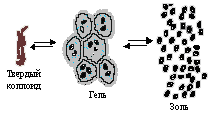
Рисунок 3.6 – Коагуляция коллоидных растворов
Сохранение во всех состояниях мицеллярной структуры связано с высокой устойчивостью гидрофильной коллоидной системы.
Устойчивость золя можно нарушить, устранив одноименный заряд коллоидных частиц и защитную гидратную оболочку. На границе раздела коллоидная частица − среда устанавливаются два равновесия:
(а) Противоионы в коллоидной частице ↔ Противоионы в среде ;
(б) Вода в коллоидной частице ↔ Вода в среде.
Если сместить равновесие (а) влево, то возрастет число противоионов в коллоидной частице и уменьшится ее заряд. Уменьшение заряда частицы приведет, в свою очередь, к уменьшению числа молекул воды в гидратной оболочке коллоидной частицы, т.е. к смещению равновесия (б) в правую сторону. Устойчивость коллоидной системы нарушится. При некоторых условиях число противоионов в коллоидной частице может стать таким, что их заряд полностью нейтрализует заряд зарядообразующих ионов, т. е. коллоидная частица станет незаря-женной. При этом потенциал становится равным нулю. Такое состояние коллоидной частицы называется изоэлектрическим. Гидратная оболочка частицы в изоэлектрическом состоянии в значительной мере разрушена. Коллоидные частицы не защищены и при столкновениях слипаются, укрупняются. Коагуляция золя приводит к потере его кинетической устойчивости, которая выражается в образовании осадка.
Одним из основных методов коагуляции служит введение в коллоидную систему электролита, имеющего противоионы по отношению к заряженным коллоидным частицам. Например, в раствор с отрицательно заряженными коллоидными частицами вводят сульфаты алюминия или железа. В результате заряд коллоидных частиц нейтрализуется. Кроме того, при этом происходит гидратация ионов электролита за счет молекул Н2О из дисперсионной среды. Эффективность коагуляции возрастает при введении флокулянтов, например полиакриламидов, способствующих укрупнению частиц. Коагуляцию также проводят путем анодного растворения алюминия и железа с переходом в раствор ионов А13+ и Fe2+.
3.11.2 Вопросы для самоконтроля
1. В чем заключается кинетический фактор устойчивости коллоидных систем?
2. В чем заключается термодинамический фактор устойчивости коллоидных систем?
3. Какие существуют факторы агрегативной устойчивости коллоидных систем?
4. Что собой представляет изоэлектрическое состояние коллоидной частицы?
5. Какие существуют методы коагуляции?
