–£—á–Ķ–Ī–Ĺ–ĺ–Ķ –Ņ–ĺ—Ā–ĺ–Ī–ł–Ķ –ī–Ľ—Ź –ľ–ĺ–ī—É–Ľ—Ć–Ĺ–ĺ-—Ä–Ķ–Ļ—ā–ł–Ĺ–≥–ĺ–≤–ĺ–Ļ —ā–Ķ—Ö–Ĺ–ĺ–Ľ–ĺ–≥–ł–ł –ĺ–Ī—É—á–Ķ–Ĺ–ł—Ź –Ď–ł–Ļ—Ā–ļ
| –í–ł–ī –ľ–į—ā–Ķ—Ä–ł–į–Ľ–į | –£—á–Ķ–Ī–Ĺ–ĺ–Ķ –Ņ–ĺ—Ā–ĺ–Ī–ł–Ķ |
| –ü—Ä–ł–ľ–Ķ—Ä–Ĺ—č–Ļ –Ņ–Ķ—Ä–Ķ—á–Ķ–Ĺ—Ć –≤–ĺ–Ņ—Ä–ĺ—Ā–ĺ–≤ –ļ —ć–ļ–∑–į–ľ–Ķ–Ĺ—É –•–ė–ú–ė–Į –ú–ĺ–ī—É–Ľ—Ć 2. –†–ź–°–Ę–í–ě–†–ę. –Ē–ė–°–ü–ē–†–°–Ě–ę–ē –°–ė–°–Ę–ē–ú–ę |
- –ú–Ķ—ā–ĺ–ī–ł—á–Ķ—Ā–ļ–ł–Ķ —Ä–Ķ–ļ–ĺ–ľ–Ķ–Ĺ–ī–į—Ü–ł–ł –Ņ–ĺ –ĺ—Ä–≥–į–Ĺ–ł–∑–į—Ü–ł–ł —É—á–Ķ–Ī–Ĺ–ĺ–≥–ĺ –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā–į —Ā –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ĺ–ł–Ķ–ľ –ľ–ĺ–ī—É–Ľ—Ć–Ĺ–ĺ-—Ä–Ķ–Ļ—ā–ł–Ĺ–≥–ĺ–≤–ĺ–Ļ, 554.48kb.
- –Į. –í. –í–į–ļ—É–Ľ–į –Ě–Ķ—Ą—ā–Ķ–≥–į–∑–ĺ–≤—č–Ķ —ā–Ķ—Ö–Ĺ–ĺ–Ľ–ĺ–≥–ł–ł –£—á–Ķ–Ī–Ĺ–ĺ–Ķ –Ņ–ĺ—Ā–ĺ–Ī–ł–Ķ, 2652.31kb.
- –£—á–Ķ–Ī–Ĺ–ĺ–Ķ –Ņ–ĺ—Ā–ĺ–Ī–ł–Ķ ¬ę—É–Ņ—Ä–į–≤–Ľ–Ķ–Ĺ–ł–Ķ –Ņ–Ķ—Ä—Ā–ĺ–Ĺ–į–Ľ–ĺ–ľ¬Ľ –ī–Ľ—Ź —Ā—ā—É–ī–Ķ–Ĺ—ā–ĺ–≤ –∑–į–ĺ—á–Ĺ–ĺ–≥–ĺ –ĺ–Ī—É—á–Ķ–Ĺ–ł—Ź —Ā–Ņ–Ķ—Ü–ł–į–Ľ—Ć–Ĺ–ĺ—Ā—ā–ł, 1516.37kb.
- –ú. –Ě. –ú–į—ą–ļ–ł–Ĺ –ė–Ĺ—Ą–ĺ—Ä–ľ–į—Ü–ł–ĺ–Ĺ–Ĺ—č–Ķ —ā–Ķ—Ö–Ĺ–ĺ–Ľ–ĺ–≥–ł–ł –£—á–Ķ–Ī–Ĺ–ĺ–Ķ –Ņ–ĺ—Ā–ĺ–Ī–ł–Ķ, 2701.91kb.
- –£—á–Ķ–Ī–Ĺ–ĺ–Ķ –Ņ–ĺ—Ā–ĺ–Ī–ł–Ķ –£—Ą–į 2005 —É–ī–ļ 338 (075. 8) –Ď–Ī–ļ, 1087.66kb.
- –£—á–Ķ–Ī–Ĺ—č–Ļ –Ņ–Ľ–į–Ĺ –ļ–į–ļ —Ā—Ä–Ķ–ī—Ā—ā–≤–ĺ —Ä–Ķ–į–Ľ–ł–∑–į—Ü–ł–ł –Ņ—Ä–ł–Ĺ—Ü–ł–Ņ–ĺ–≤ –ľ–ĺ–ī—É–Ľ—Ć–Ĺ–ĺ-—Ä–Ķ–Ļ—ā–ł–Ĺ–≥–ĺ–≤–ĺ–Ļ —ā–Ķ—Ö–Ĺ–ĺ–Ľ–ĺ–≥–ł–ł –ĺ–Ī—É—á–Ķ–Ĺ–ł—Ź, 68.67kb.
- –ě. –Ē. –ö–į—Ä—ā–į–≤—Ü–Ķ–≤–į –ł–Ĺ—ā–Ķ–Ĺ—Ā–ł–≤–Ĺ—č–Ļ –ļ—É—Ä—Ā –ĺ–Ī—É—á–Ķ–Ĺ–ł—Ź –ł–∑–ĺ–Ī—Ä–į–∑–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ļ –≥—Ä–į–ľ–ĺ—ā–Ķ —É—á–Ķ–Ī–Ĺ–ĺ–Ķ –Ņ–ĺ—Ā–ĺ–Ī–ł–Ķ, 780.71kb.
- –ú–Ķ–Ĺ–Ķ–ī–∂–ľ–Ķ–Ĺ—ā–į –ļ–į—á–Ķ—Ā—ā–≤–į –Ņ–ĺ–Ľ–ĺ–∂–Ķ–Ĺ–ł–Ķ –ĺ –ľ–ĺ–ī—É–Ľ—Ć–Ĺ–ĺ-—Ä–Ķ–Ļ—ā–ł–Ĺ–≥–ĺ–≤–ĺ–Ļ —Ā–ł—Ā—ā–Ķ–ľ–Ķ –ļ–≤–į–Ľ–ł–ľ–Ķ—ā—Ä–ł–ł —É—á–Ķ–Ī–Ĺ–ĺ–Ļ –ī–Ķ—Ź—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā–ł, 1381.23kb.
- –£—á–Ķ–Ī–Ĺ–ĺ–Ķ –Ņ–ĺ—Ā–ĺ–Ī–ł–Ķ 28365942 –ú–ĺ—Ā–ļ–≤–į 2008 –Ī–Ī–ļ 66., 2986.28kb.
- –§–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ –Ņ—Ä–ĺ—Ą–Ķ—Ā—Ā–ł–ĺ–Ĺ–į–Ľ—Ć–Ĺ–ĺ–Ļ –ļ–ĺ–ľ–Ņ–Ķ—ā–Ķ–Ĺ—ā–Ĺ–ĺ—Ā—ā–ł –Ī—É–ī—É—Č–ł—Ö —Ā–Ņ–Ķ—Ü–ł–į–Ľ–ł—Ā—ā–ĺ–≤ –≤ –ĺ–Ī–Ľ–į—Ā—ā–ł –≤—č—á–ł—Ā–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ļ, 372.85kb.
–ü–†–ė–õ–ě–Ė–ē–Ě–ė–ē –í
–ü–†–ė–ú–ē–†–Ě–ę–ô –ü–ē–†–ē–ß–ē–Ě–¨ –í–ě–ü–†–ě–°–ě–í –ö –≠–ö–ó–ź–ú–ē–Ě–£
1. –•–ł–ľ–ł—á–Ķ—Ā–ļ–ł–Ķ —Ā–ł—Ā—ā–Ķ–ľ—č.
2. –§–į–∑–į, –ļ–ĺ–ľ–Ņ–ĺ–Ĺ–Ķ–Ĺ—ā—č, –≥–Ķ—ā–Ķ—Ä–ĺ–≥–Ķ–Ĺ–Ĺ—č–Ķ –ł –≥–ĺ–ľ–ĺ–≥–Ķ–Ĺ–Ĺ—č–Ķ —Ā–ł—Ā—ā–Ķ–ľ—č.
3. –ü–į—Ä–į–ľ–Ķ—ā—Ä—č —Ā–ł—Ā—ā–Ķ–ľ—č.
4. –°–Ņ–ĺ—Ā–ĺ–Ī—č –≤—č—Ä–į–∂–Ķ–Ĺ–ł—Ź —Ā–ĺ—Ā—ā–į–≤–į —Ä–į—Ā—ā–≤–ĺ—Ä–ĺ–≤.
5. –ö–Ľ–į—Ā—Ā–ł—Ą–ł–ļ–į—Ü–ł—Ź —Ä–į—Ā—ā–≤–ĺ—Ä–ĺ–≤.
6. –†–į—Ā—ā–≤–ĺ—Ä–ł–ľ–ĺ—Ā—ā—Ć. –ö–ĺ—ć—Ą—Ą–ł—Ü–ł–Ķ–Ĺ—ā —Ä–į—Ā—ā–≤–ĺ—Ä–ł–ľ–ĺ—Ā—ā–ł.
7. –Ě–Ķ–Ĺ–į—Ā—č—Č–Ķ–Ĺ–Ĺ—č–Ķ, –Ĺ–į—Ā—č—Č–Ķ–Ĺ–Ĺ—č–Ķ, –Ņ–Ķ—Ä–Ķ—Ā—č—Č–Ķ–Ĺ–Ĺ—č–Ķ —Ä–į—Ā—ā–≤–ĺ—Ä—č.
8. –ö–ĺ–Ĺ—Ü–Ķ–Ĺ—ā—Ä–ł—Ä–ĺ–≤–į–Ĺ–Ĺ—č–Ķ –ł —Ä–į–∑–Ī–į–≤–Ľ–Ķ–Ĺ–Ĺ—č–Ķ —Ä–į—Ā—ā–≤–ĺ—Ä—č.
9. –ě–Ī—Č–ł–Ķ –∑–į–ļ–ĺ–Ĺ–ĺ–ľ–Ķ—Ä–Ĺ–ĺ—Ā—ā–ł —Ä–į—Ā—ā–≤–ĺ—Ä–Ķ–Ĺ–ł—Ź.
10. –†–į—Ā—ā–≤–ĺ—Ä–ł–ľ–ĺ—Ā—ā—Ć –≥–į–∑–ĺ–≤ –≤ –∂–ł–ī–ļ–ĺ—Ā—ā—Ź—Ö.
11. –†–į—Ā—ā–≤–ĺ—Ä–ł–ľ–ĺ—Ā—ā—Ć –∂–ł–ī–ļ–ĺ—Ā—ā–Ķ–Ļ –≤ –∂–ł–ī–ļ–ĺ—Ā—ā—Ź—Ö.
12. –†–į—Ā—ā–≤–ĺ—Ä–ł–ľ–ĺ—Ā—ā—Ć —ā–≤–Ķ—Ä–ī—č—Ö –≤–Ķ—Č–Ķ—Ā—ā–≤ –≤ –∂–ł–ī–ļ–ĺ—Ā—ā—Ź—Ö.
13. –ó–į–ļ–ĺ–Ĺ –°.–ź. –©—É–ļ–į—Ä–Ķ–≤–į.
14. –ó–į–ļ–ĺ–Ĺ —Ä–į—Ā–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–ł—Ź –Ě–Ķ—Ä–Ĺ—Ā—ā–į ‚Äď –®–ł–Ľ–ĺ–≤–į.
15. –ó–į–ļ–ĺ–Ĺ—č –†–į—É–Ľ—Ź –ł —Ā–Ľ–Ķ–ī—Ā—ā–≤–ł—Ź –ł–∑ –Ĺ–Ķ–≥–ĺ.
16. –ě—Ā–ľ–ĺ—Ā –ł –ĺ—Ā–ľ–ĺ—ā–ł—á–Ķ—Ā–ļ–ĺ–Ķ –ī–į–≤–Ľ–Ķ–Ĺ–ł–Ķ. –ü—Ä–ł–Ĺ—Ü–ł–Ņ –í–į–Ĺ—ā-–ď–ĺ—Ą—Ą–į. –ė–∑–ĺ—ā–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ł–Ļ –ļ–ĺ—ć—Ą—Ą–ł—Ü–ł–Ķ–Ĺ—ā.
17. –≠–Ľ–Ķ–ļ—ā—Ä–ĺ–Ľ–ł—ā–ł—á–Ķ—Ā–ļ–į—Ź –ī–ł—Ā—Ā–ĺ—Ü–ł–į—Ü–ł—Ź.
18. –Ę–Ķ–ĺ—Ä–ł—Ź —ć–Ľ–Ķ–ļ—ā—Ä–ĺ–Ľ–ł—ā–ł—á–Ķ—Ā–ļ–ĺ–Ļ –ī–ł—Ā—Ā–ĺ—Ü–ł–į—Ü–ł–ł –°. –ź—Ä—Ä–Ķ–Ĺ–ł—É—Ā–į.
19. –Ę–Ķ–ĺ—Ä–ł—Ź –ļ–ł—Ā–Ľ–ĺ—ā –ł –ĺ—Ā–Ĺ–ĺ–≤–į–Ĺ–ł–Ļ –°. –ź—Ä—Ä–Ķ–Ĺ–ł—É—Ā–į.
20. –Ę–Ķ–ĺ—Ä–ł—Ź –ļ–ł—Ā–Ľ–ĺ—ā –ł –ĺ—Ā–Ĺ–ĺ–≤–į–Ĺ–ł–Ļ –Ď—Ä—Ď–Ĺ—Ā—ā–Ķ–ī–į ‚ąí –õ–į—É—Ä–ł.
21. –≠–Ľ–Ķ–ļ—ā—Ä–ĺ–Ĺ–Ĺ–į—Ź —ā–Ķ–ĺ—Ä–ł—Ź –õ—Ć—é–ł—Ā–į.
22. –°–Ľ–į–Ī—č–Ķ —ć–Ľ–Ķ–ļ—ā—Ä–ĺ–Ľ–ł—ā—č.
23. –°—ā–Ķ–Ņ–Ķ–Ĺ–ł –ł –ļ–ĺ–Ĺ—Ā—ā–į–Ĺ—ā—č –ī–ł—Ā—Ā–ĺ—Ü–ł–į—Ü–ł–ł —Ā–Ľ–į–Ī—č—Ö —ć–Ľ–Ķ–ļ—ā—Ä–ĺ–Ľ–ł—ā–ĺ–≤.
24. –ó–į–ļ–ĺ–Ĺ —Ä–į–∑–Ī–į–≤–Ľ–Ķ–Ĺ–ł—Ź –ě—Ā—ā–≤–į–Ľ—Ć–ī–į.
25. –ė–ĺ–Ĺ–Ĺ–ĺ–Ķ –Ņ—Ä–ĺ–ł–∑–≤–Ķ–ī–Ķ–Ĺ–ł–Ķ –≤–ĺ–ī—č.
26. –í–ĺ–ī–ĺ—Ä–ĺ–ī–Ĺ—č–Ļ –ł –≥–ł–ī—Ä–ĺ–ļ—Ā–ł–Ľ—Ć–Ĺ—č–Ļ –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–ł.
27. –ö–ł—Ā–Ľ–ĺ—ā–Ĺ–ĺ-–ĺ—Ā–Ĺ–ĺ–≤–Ĺ—č–Ķ –ł–Ĺ–ī–ł–ļ–į—ā–ĺ—Ä—č.
28. –Ď—É—Ą–Ķ—Ä–Ĺ—č–Ķ —Ä–į—Ā—ā–≤–ĺ—Ä—č.
29. –Ę–Ķ–ĺ—Ä–ł—Ź —Ā–ł–Ľ—Ć–Ĺ—č—Ö —ć–Ľ–Ķ–ļ—ā—Ä–ĺ–Ľ–ł—ā–ĺ–≤ –•—é–ļ–ļ–Ķ–Ľ—Ź ‚ąí –Ē–Ķ–Ī–į—Ź.
30. –ź–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć, –ļ–ĺ—ć—Ą—Ą–ł—Ü–ł¬≠–Ķ–Ĺ—ā –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł –ł –ł–ĺ–Ĺ–Ĺ–į—Ź —Ā–ł–Ľ–į —Ä–į—Ā—ā–≤–ĺ—Ä–ĺ–≤.
31. –ü—Ä–ĺ–ł–∑–≤–Ķ–ī–Ķ–Ĺ–ł–Ķ —Ä–į—Ā—ā–≤–ĺ—Ä–ł–ľ–ĺ—Ā—ā–ł.
32. –Ę—Ä–ł —Ā–Ľ—É—á–į—Ź –≥–ł–ī—Ä–ĺ–Ľ–ł–∑–į —Ā–ĺ–Ľ–Ķ–Ļ.
33. –£—Ā–Ľ–ĺ–≤–ł—Ź –Ĺ–Ķ–ĺ–Ī—Ä–į—ā–ł–ľ–ĺ–≥–ĺ –≥–ł–ī—Ä–ĺ–Ľ–ł–∑–į —Ā–ĺ–Ľ–Ķ–Ļ.
34. –ü–ĺ–ī–į–≤–Ľ–Ķ–Ĺ–ł–Ķ –≥–ł–ī—Ä–ĺ–Ľ–ł–∑–į —Ā–ĺ–Ľ–Ķ–Ļ.
35. –ė–ĺ–Ĺ–Ĺ—č–Ļ –ĺ–Ī–ľ–Ķ–Ĺ.
36. –ö–Ľ–į—Ā—Ā–ł—Ą–ł–ļ–į—Ü–ł—Ź –ī–ł—Ā–Ņ–Ķ—Ä—Ā–Ĺ—č—Ö —Ā–ł—Ā—ā–Ķ–ľ.
37. –ö–ĺ–Ľ–Ľ–ĺ–ł–ī–Ĺ—č–Ķ —Ä–į—Ā—ā–≤–ĺ—Ä—č.
38. –ü–ĺ–≤–Ķ—Ä—Ö–Ĺ–ĺ—Ā—ā–Ĺ—č–Ķ —Ź–≤–Ľ–Ķ–Ĺ–ł—Ź.
39. –ü–ĺ–Ľ—É—á–Ķ–Ĺ–ł–Ķ –ļ–ĺ–Ľ–Ľ–ĺ–ł–ī–Ĺ—č—Ö —Ä–į—Ā—ā–≤–ĺ—Ä–ĺ–≤.
40. –°—ā—Ä–ĺ–Ķ–Ĺ–ł–Ķ –ľ–ł—Ü–Ķ–Ľ–Ľ—č.
41. –ě–Ņ—ā–ł—á–Ķ—Ā–ļ–ł–Ķ —Ā–≤–ĺ–Ļ—Ā—ā–≤–į –ļ–ĺ–Ľ–Ľ–ĺ–ł–ī–Ĺ—č—Ö —Ä–į—Ā—ā–≤–ĺ—Ä–ĺ–≤.
42. –≠–Ľ–Ķ–ļ—ā—Ä–ł—á–Ķ—Ā–ļ–ł–Ķ —Ā–≤–ĺ–Ļ—Ā—ā–≤–į –ļ–ĺ–Ľ–Ľ–ĺ–ł–ī–Ĺ—č—Ö —Ä–į—Ā—ā–≤–ĺ—Ä–ĺ–≤.
43. –ź–≥—Ä–Ķ–≥–į—ā–ł–≤–Ĺ–į—Ź —É—Ā—ā–ĺ–Ļ—á–ł–≤–ĺ—Ā—ā—Ć –ļ–ĺ–Ľ–Ľ–ĺ–ł–ī–Ĺ—č—Ö —Ā–ł—Ā—ā–Ķ–ľ.
44. –°–Ķ–ī–ł–ľ–Ķ–Ĺ—ā–į—Ü–ł—Ź –ł –ļ–ĺ–į–≥—É–Ľ—Ź—Ü–ł—Ź.
45. –†–Ķ–ĺ–Ľ–ĺ–≥–ł—Ź. –Ę–ł–ļ—Ā–ĺ—ā—Ä–ĺ–Ņ–Ĺ—č–Ķ —Ā–≤–ĺ–Ļ—Ā—ā–≤–į –ļ–ĺ–Ľ–Ľ–ĺ–ł–ī–Ĺ—č—Ö —Ä–į—Ā—ā–≤–ĺ—Ä–ĺ–≤.
46. –ü—Ä–ł–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ķ –ļ–ĺ–Ľ–Ľ–ĺ–ł–ī–Ĺ—č—Ö —Ä–į—Ā—ā–≤–ĺ—Ä–ĺ–≤.
47. –°—É—Ā–Ņ–Ķ–Ĺ–∑–ł–ł.
48. –≠–ľ—É–Ľ—Ć—Ā–ł–ł.
49. –ü–Ķ–Ĺ—č.
–ü–†–ė–õ–ě–Ė–ē–Ě–ė–ē –ď
–†–ź–°–Ę–í–ě–†–ė–ú–ě–°–Ę–¨ –°–ě–õ–ē–ô, –ö–ė–°–õ–ě–Ę, –ě–°–Ě–ě–í–ź–Ě–ė–ô –í –í–ě–Ē–ē
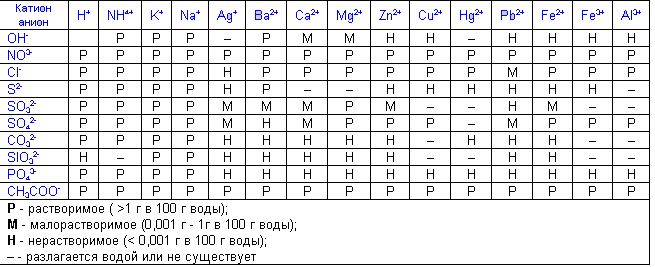
–ü–†–ė–õ–ě–Ė–ē–Ě–ė–ē –Ē
–°–Ę–ē–ü–ē–Ě–ė –Ē–ė–°–°–ě–¶–ė–ź–¶–ė–ė –≠–õ–ē–ö–Ę–†–ě–õ–ė–Ę–ě–í
| –≠–Ľ–Ķ–ļ—ā—Ä–ĺ–Ľ–ł—ā | –§–ĺ—Ä–ľ—É–Ľ–į | –°—ā–Ķ–Ņ–Ķ–Ĺ—Ć –ī–ł—Ā—Ā–ĺ—Ü–ł–į—Ü–ł–ł, % |
| –ö–ł—Ā–Ľ–ĺ—ā—č: | ||
| —Ā–ĺ–Ľ—Ź–Ĺ–į—Ź | HCl | 92 |
| –Ī—Ä–ĺ–ľ–ĺ–≤–ĺ–ī–ĺ—Ä–ĺ–ī–Ĺ–į—Ź | HBr | 92 |
| –Ļ–ĺ–ī–ĺ–≤–ĺ–ī–ĺ—Ä–ĺ–ī–Ĺ–į—Ź | HI | 92 |
| –į–∑–ĺ—ā–Ĺ–į—Ź | HNO3 | 92 |
| —Ā–Ķ—Ä–Ĺ–į—Ź | H2SO4 | 58 |
| —Ā–Ķ—Ä–Ĺ–ł—Ā—ā–į—Ź | H2SO3 | 34 |
| —Ą–ĺ—Ā—Ą–ĺ—Ä–Ĺ–į—Ź | H3PO4 | 27 |
| —Ą—ā–ĺ—Ä–ĺ–≤–ĺ–ī–ĺ—Ä–ĺ–ī–Ĺ–į—Ź | HF | 8,5 |
| —É–ļ—Ā—É—Ā–Ĺ–į—Ź | CH3COOH | 1,3 |
| —É–≥–ĺ–Ľ—Ć–Ĺ–į—Ź | H2CO3 | 0,17 |
| —Ā–Ķ—Ä–ĺ–≤–ĺ–ī–ĺ—Ä–ĺ–ī–Ĺ–į—Ź | H2S | 0,07 |
| —Ā–ł–Ĺ–ł–Ľ—Ć–Ĺ–į—Ź | HCN | 0,01 |
| –Ī–ĺ—Ä–Ĺ–į—Ź | H3BO3 | 0,01 |
| –ě—Ā–Ĺ–ĺ–≤–į–Ĺ–ł—Ź: | ||
| –≥–ł–ī—Ä–ĺ–ļ—Ā–ł–ī –Ī–į—Ä–ł—Ź | Ba(OH)2 | 92 |
| –≥–ł–ī—Ä–ĺ–ļ—Ā–ł–ī –ļ–į–Ľ–ł—Ź | KOH | 89 |
| –≥–ł–ī—Ä–ĺ–ļ—Ā–ł–ī –Ĺ–į—ā—Ä–ł—Ź | NaOH | 84 |
| –≥–ł–ī—Ä–ĺ–ļ—Ā–ł–ī –į–ľ–ľ–ĺ–Ĺ–ł—Ź | NH2OH | 1,3 |
| –°–ĺ–Ľ–ł: | ||
| —Ö–Ľ–ĺ—Ä–ł–ī –ļ–į–Ľ—Ć—Ü–ł—Ź | KCl | 86 |
| —Ö–Ľ–ĺ—Ä–ł–ī –į–ľ–ľ–ĺ–Ĺ–ł—Ź | NH4Cl | 85 |
| —Ö–Ľ–ĺ—Ä–ł–ī –Ĺ–į—ā—Ä–ł—Ź | NaCl | 84 |
| –Ĺ–ł—ā—Ä–į—ā –ļ–į–Ľ–ł—Ź | KNO3 | 83 |
| –Ĺ–ł—ā—Ä–į—ā —Ā–Ķ—Ä–Ķ–Ī—Ä–į | AgNO3 | 81 |
| —Ö–Ľ–ĺ—Ä–ł–ī —Ü–ł–Ĺ–ļ–į | ZnCl2 | 73 |
| —Ā—É–Ľ—Ć—Ą–į—ā –Ĺ–į—ā—Ä–ł—Ź | Na2SO4 | 69 |
| —Ā—É–Ľ—Ć—Ą–į—ā —Ü–ł–Ĺ–ļ–į | ZnSO4 | 40 |
| —Ā—É–Ľ—Ć—Ą–į—ā –ľ–Ķ–ī–ł | CuSO4 | 40 |
–ü–†–ė–õ–ě–Ė–ē–Ě–ė–ē –ē
–°–†–ē–Ē–Ě–ė–ē –ö–ě–≠–§–§–ė–¶–ė–ē–Ě–Ę–ę –ź–ö–Ę–ė–í–Ě–ě–°–Ę–ė –ė–ě–Ě–ě–í –ü–†–ė –†–ź–ó–õ–ė–ß–Ě–ě–ô –ė–ě–Ě–Ě–ě–ô –°–ė–õ–ē –†–ź–°–Ę–í–ě–†–ź
| –ė–ĺ–Ĺ–Ĺ–į—Ź —Ā–ł–Ľ–į (I) | z = 1 | z = 2 | z = 3 | z = 4 |
| 0,0001 0,0002 0,0005 0,001 0,002 0,005 0,01 0,02 0,05 0,1 | 0,99 0,98 0,97 0,96 0,95 0,92 0,89 0,87 0,84 0,81 | 0,95 0,94 0,90 0,86 0,81 0,72 0,63 0,57 0,50 0,44 | 0,90 0,87 0,80 0,73 0,64 0,51 0,39 0,28 0,21 0,16 | 0,83 0,77 0,67 0,26 0,45 0,30 0,18 0,12 0,06 0,04 |
| 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0 | 0,80 0,81 0,82 0,84 0,87 0,89 0,92 0,96 0,99 | 0,41 0,42 0,45 0,50 0,56 0,63 0,72 0,83 0,96 | 0,14 0,14 0,17 0,21 0,27 0,36 0,48 0,66 0,91 | 0,03 0,03 0,04 0,06 0,10 0,16 0,27 0,48 0,85 |
–ü–†–ė–õ–ě–Ė–ē–Ě–ė–ē –Ė
–ö–ě–Ě–°–Ę–ź–Ě–Ę–ę –Ē–ė–°–°–ě–¶–ė–ź–¶–ė–ė –Ě–ē–ö–ě–Ę–ě–†–ę–• –°–õ–ź–Ď–ę–• –≠–õ–ē–ö–Ę–†–ě–õ–ė–Ę–ě–í
| –í–Ķ—Č–Ķ—Ā—ā–≤–ĺ | –ö–ī | –í–Ķ—Č–Ķ—Ā—ā–≤–ĺ | –ö–ī |
| HCOOH | К=1,77 · 10-4 | H2O | К=1,8 · 10-16 |
| CH3COOH | К=1,75 · 10-5 | NH4OH | К=1,79 · 10-5 |
| HCN | К=7,9 · 10-10 | Al(OH)3 | К3=1,38 · 10-9 |
| HAlO2 | К=6 · 10-13 | Cu(OH)2 | К2=3,4 · 10-7 |
| HF | К=6,61 · 10-4 | Cd(OH)2 | К2=5 · 10-3 |
| HNO2 | К=4,6 · 10-4 | Fe(OH)2 | К2=1,3 · 10-4 |
| Cr(OH)3 | К3=1, · 10-10 | Ni(OH)2 | К2=2,5 · 10-5 |
| H2SO3 | К1=1,7 · 10-2 К2=6,3 · 10-8 | Fe(OH)3 | К2=1,82 · 10-11 К3=1,35 · 10-12 |
| H2SiO3 | К1=1,3 · 10-10 К2=1,6 · 10-12 | Pb(OH)2 | К1=9,6 · 10-4 К2=3 · 10-8 |
| H3PO4 | К1=7,5 · 10-3 К2=6,31 · 10-8 К3=1,3 · 10-12 | H3BO3 | К1=5,8 · 10-10 К2=1,8 · 10-13 К3=1,6 · 10-14 |
| H2CO3 | К1=4,45 · 10-7 К2=4,8 · 10-11 | H2S | К1=1,1 · 10-7 К2=1 · 10-14 |
| Zn(OH)2 | К1=4,4 · 10-5 К2=1,5 · 10-9 | AgOH | К=1,1 · 10-4 |
–ü–†–ė–õ–ě–Ė–ē–Ě–ė–ē –ė
–ü–†–ě–ė–ó–í–ē–Ē–ē–Ě–ė–Į –†–ź–°–Ę–í–ě–†–ė–ú–ě–°–Ę–ė
| –í–Ķ—Č–Ķ—Ā—ā–≤–ĺ | –ü–† –ľ–ĺ–Ľ—Ć/–Ľ | –í–Ķ—Č–Ķ—Ā—ā–≤–ĺ | –ü–† –ľ–ĺ–Ľ—Ć/–Ľ |
| AgBr | 4,4 ‚ąô 10-13 | PbF2 | 2,7 . 10‚ÄĒ8 |
| AgCl | 1,56 ‚ąô 10-10 | PbCl2 | 2,12 ‚ąô 10 ‚Äď5 |
| AgI | 9,7 ‚ąô 10-17 | PbI2 | 9,8 ‚ąô 10-9 |
| Ag2CrO4 | 4,05 ‚ąô 10-12 | PbSO4 | 1,6 ‚ąô 10 ‚Äď8 |
| Ag2SO4 | 7,7 ‚ąô 10-5 | PbS | 3,6 ‚ąô 10-29 |
| Ag2S | 1,6 ‚ąô 10-49 | ZnS | 7,4 ‚ąô 10-27 |
| BaCO3 | 8,1 ‚ąô 10-9 | AgOH | 1,93 ‚ąô 10-8 |
| BaSO4 | 1,08 ‚ąô 10-10 | Al(OH)3 | 5,1 ‚ąô 10-33 |
| CaCO3 | 4,8 ‚ąô 10 ‚Äď9 | Cr(OH)3 | 6,7 ‚ąô 10-31 |
| CaSO4 | 6,1 ‚ąô 10-5 | Cu(OH)2 | 5,0 ‚ąô 10-19 |
| Ca3(PO4)2 | 1,0 ‚ąô 10-25 | Fe(OH)2 | 1,65 ‚ąô 10-15 |
| CdS | 1,2 ‚ąô 10-28 | Fe(OH)3 | 3,8 ‚ąô 10-38 |
| CuS | 4,0 ‚ąô 10-38 | Mg(OH)2 | 5,5 ‚ąô 10-12 |
| FeS | 3,7 ‚ąô 10-19 | Ni(OH)2 | 1,6 ‚ąô 10-14 |
| Fe2S3 | 1,0 ‚ąô 10-88 | Pb(OH)2 | 1,0 ‚ąô 10-15 |
| MgCO3 | 1,0 ‚ąô 10-5 | Zn(OH)2 | 1,3 ‚ąô 10-17 |
| MnS | 2,0 ‚ąô 10-15 | Tl2SO4 | 1,5 . 10‚ÄĒ4 |
| Ni(OH)2 | 1,6 . 10‚ÄĒ14 | Tl2S | 3,0 . 10‚ÄĒ9 |
| NiS | 1,1 ‚ąô 10-27 | Tl2CrO4 | 1,0 . 10‚ÄĒ12 |
| PbBr2 | 5,0 . 10‚ÄĒ5 | TlCl | 1,9 . 10‚ÄĒ4 |
| Pb(BrO3)2 | 1,6 . 10‚ÄĒ4 | Tl2CO3 | 4,0 . 10‚ÄĒ3 |
| PbC2O4 | 7,3 . 10‚ÄĒ11 | SrSO4 | 2,1 ‚ąô 10‚ÄĒ7 |
| PbCrO4 | 2,8 . 10--13 | SrCrO4 | 2,7 . 10‚ÄĒ5 |
–ú–į–ļ—Ä—É—ą–ł–Ĺ–į –Ę–į—ā—Ć—Ź–Ĺ–į –ė–≤–į–Ĺ–ĺ–≤–Ĺ–į
–•–ė–ú–ė–Į
–ú–ĺ–ī—É–Ľ—Ć 2. –†–ź–°–Ę–í–ě–†–ę. –Ē–ė–°–ü–ē–†–°–Ě–ę–ē –°–ė–°–Ę–ē–ú–ę
–£—á–Ķ–Ī–Ĺ–ĺ–Ķ –Ņ–ĺ—Ā–ĺ–Ī–ł–Ķ –ī–Ľ—Ź –ľ–ĺ–ī—É–Ľ—Ć–Ĺ–ĺ-—Ä–Ķ–Ļ—ā–ł–Ĺ–≥–ĺ–≤–ĺ–Ļ —ā–Ķ—Ö–Ĺ–ĺ–Ľ–ĺ–≥–ł–ł –ĺ–Ī—É—á–Ķ–Ĺ–ł—Ź
–†–Ķ–ī–į–ļ—ā–ĺ—Ä –°–ĺ–Ľ–ĺ–≤—Ć–Ķ–≤–į –°.–í.
–Ę–Ķ—Ö–Ĺ–ł—á–Ķ—Ā–ļ–ł–Ļ —Ä–Ķ–ī–į–ļ—ā–ĺ—Ä –°–į–∑–ĺ–Ĺ–ĺ–≤–į –í.–ü.
–ü–ĺ–ī–Ņ–ł—Ā–į–Ĺ–ĺ –≤ –Ņ–Ķ—á–į—ā—Ć 25.05.07. –§–ĺ—Ä–ľ–į—ā 60—Ö84 1/16.
–£—Ā–Ľ. –Ņ. –Ľ. 9,25. –£—á.-–ł–∑–ī. –Ľ. 8,60.
–ü–Ķ—á–į—ā—Ć ‚Äď —Ä–ł–∑–ĺ–≥—Ä–į—Ą–ł—Ź, –ľ–Ĺ–ĺ–∂–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ-–ļ–ĺ–Ņ–ł—Ä–ĺ–≤–į–Ľ—Ć–Ĺ—č–Ļ
–į–Ņ–Ņ–į—Ä–į—ā ¬ęRISO TR-1510¬Ľ.
–Ę–ł—Ä–į–∂ 100 —ć–ļ–∑. –ó–į–ļ–į–∑ 2007-37.
–ė–∑–ī–į—ā–Ķ–Ľ—Ć—Ā—ā–≤–ĺ –ź–Ľ—ā–į–Ļ—Ā–ļ–ĺ–≥–ĺ –≥–ĺ—Ā—É–ī–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ
—ā–Ķ—Ö–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ —É–Ĺ–ł–≤–Ķ—Ä—Ā–ł—ā–Ķ—ā–į.
656038, –≥. –Ď–į—Ä–Ĺ–į—É–Ľ, –Ņ—Ä. –õ–Ķ–Ĺ–ł–Ĺ–į, 46.
–ě—Ä–ł–≥–ł–Ĺ–į–Ľ-–ľ–į–ļ–Ķ—ā –Ņ–ĺ–ī–≥–ĺ—ā–ĺ–≤–Ľ–Ķ–Ĺ –ė–ė–ě –Ď–Ę–ė –ź–Ľ—ā–ď–Ę–£.
–ě—ā–Ņ–Ķ—á–į—ā–į–Ĺ–ĺ –Ĺ–į –ė–ė–ě –Ď–Ę–ė –ź–Ľ—ā–ď–Ę–£.
659305, –≥. –Ď–ł–Ļ—Ā–ļ, —É–Ľ. –Ę—Ä–ĺ—Ą–ł–ľ–ĺ–≤–į, 29.
