Під загальною редакцією проф. Малого В. П. проф. Кратенко I. С. Харків 2006
| Вид материала | Диплом |
- Матер І а л и науково-практичної конференції з міжнародною участю 1-2 березня 2007, 7242.75kb.
- Под общей редакцией проф. Малого В. П., проф. Кратенко И. С. Харьков 2008, 8344.22kb.
- Р. А. Хальфин 08. 12. 2006 г. N 6530-рх методические рекомендации, 1062.91kb.
- За загальною редакцією, 1428.32kb.
- Программа студенческой олимпиады мгмсу по стоматологии 30. 10., 33.94kb.
- М. А. Рыбалко (отв редактор), проф, 973.68kb.
- Реферат циклу підручників «Україна в світовій політиці», 148.74kb.
- Колективу авторів у складі: проф. Гаращенко Ф. Г., проф. Закусило О. К., проф. Зайченко, 259.94kb.
- Программа по курсу "Уголовное право" / Сост проф. Б. С. Волков, проф. И. Д. Козочкин,, 638.15kb.
- Квалификационные тесты по дерматовенерологии Москва, 2267.11kb.
СОВРЕМЕННАЯ ТРАКТОВКА ГЕНЕРАЛИЗОВАННЫХ ФОРМ ГЕМАТОГЕННОГО ОСТЕОМИЕЛИТА У ДЕТЕЙ
Снисарь В.И., Носарь Е.А.
Днепропетровская государственная медицинская академия
Генерализованные формы гематогенного остеомиелита (по классификации Т.П. Краснобаева) должны рассматриваться, как сепсис/тяжелый сепсис, так как имеются все критерии его проявления: МБС – микробиологическое событие, МВР – местная воспалительная реакция, СВР – системная воспалительная реакция, а также СПОН – синдром полиорганной недостаточности, который всегда наблюдается при токсической форме остеомиелита. Наш вывод основывается на приведенном анализе 21 случая генерализованных форм остеомиелита за период 2000-2005 гг.. (таблица 1), который показал, что у всех детей при поступлении в стационар наблюдалась одышка (70%), тахикардия (86%), выраженная температурная реакция (100%), лейкоцитоз > 15 тыс. (100%). Гипотензию, как проявление тяжелого сепсиса и септического шока мы регистрировали только при токсической форме остеомиелита и преимущественно у детей старше 10 лет.
Таблица 1. Распределение больных детей по возрасту и срокам поступления.
| Форма остеомиелита | Возраст (в годах) | Сроки поступления (сутки) | ||||||||
| До 1 | 1-3 | 3-5 | 5-7 | 7-10 | 10-14 | <1 | До 3 | До 5 | >5 | |
| Токсическая | - | - | - | 1 | 1 | 6 | - | 3 | 3 | 2 |
| Септико-пиемическая | 8 | - | - | - | 2 | 3 | - | 2 | 1 | 10 |
Если при септико-пиемической форме сочетания вышеприведенных критериев системного воспалительного ответа в 35% случаев равнялось 2, а 65% – 3, то при токсическом течении остеомиелита мы всегда наблюдали все компоненты ССВО в сочетании со снижением артериального давления. Последний клинический симптом подтверждает тяжесть генерализованного процесса (сепсиса) у всех больных с токсической формой остеомиелита.
Тяжесть развившегося СПОН и количество вовлекаемых органов и систем высоко коррелировали со сроками поступления в стационар. Двое больных с токсической формой остеомиелита, которым патогенетическое лечение было начато позже 5 суток, имели выраженные проявления полиорганной недостаточности, закончившихся летальным исходом.
80% детей с септико-пиемической формой госпитализировались в клинику спустя 5 и более суток от начала заболевания. При этом ни в одном случае мы не наблюдали проявления септического шока и СПОН.
Таким образом, классификация Краснобаева Т.П. гематогенного остеомиелита не противоречит современным рекомендациям по проблеме сепсиса, а дополняется современными его критериями с учетом выраженности генерализации процесса.
КОМПЛЕКСЫ ЦЕРУЛОПЛАЗМИНА С БЕЛКАМИ НЕЙТРОФИЛОВ КАК ПОКАЗАТЕЛЬ ГНОЙНОЙ ПАТОЛОГИИ
Соколов А.В., Пулина М.О., Кристиян А.В., Захарова Е.Т., Васильев В.Б.
ГУ НИИ Экспериментальной Медицины РАМН, Санкт-Петербург
Церулоплазмин (ЦП, ферро-О2-оксидоредуктаза) – медьсодержащая оксидаза плазмы крови, белок острой фазы воспаления. Благодаря наличию нескольких ферментативных активностей (ферроксидаза, купроксидаза, супероксиддисмутаза, глутатион-зависимая пероксидаза) ЦП препятствует образованию активных форм кислорода. ЦП используется в терапии как антиоксидант, стимулятор гемопоэза при иммунодепрессии и интоксикации. Взаимодействуя с другими белками, ЦП приобретает новые функции. Так, взаимодействие ЦП с миелопероксидазой (МПО), приводящее к ингибированию ее прооксидантной активности, было открыто в 1997 году группой Segelmark et al. Нашей группой было открыто взаимодействие ЦП с лактоферрином (ЛФ), трансферрином молока, экзокринных секретов и гранул нейтрофилов. Данный комплекс был обнаружен in vivo при инъекции ЛФ человека в кровяное русло крыс, а также в грудном молоке и слезной жидкости. Поскольку ЛФ и МПО являются белками нейтрофилов, нашей целью было изучение комплексообразования ЦП с белками нейтрофилов и скрининг наличия таких комплексов в крови больных с гнойной патологией.
Вначале мы определили белки-мишени для взаимодействия с ЦП среди нейтрофильных белков. Для этого мы использовали аффинную хроматографию нейтрофильного экстракта на иммобилизованном ЦП (ЦП-Сефароза). Оказалось, что кроме ЛФ и МПО, с ЦП взаимодействуют нейтрофильная эластаза и азуроцидин (САР 37, гомолог эластазы без активности протеиназы). Данные белки были определены с помощью анализа N-концевой аминокислотной последовательности и масс-спектрометрии фрагментов трипсинолиза. Этим же методом мы обнаружили, что частично очищенный из крови ЦП содержит примесь комплекса ЦП-МПО, сорбирующуюся на Гепарин-Сефарозе. В экспериментах по аффинной хроматографии ЛФ и МПО на ЦП-Сефарозе мы не наблюдали конкуренции данных белков за связывание с иммобилизованным ЦП. Это позволило предположить существование тройного комплекса ЦП-ЛФ-МПО.
Методом диск-электрофореза, мы изучали изменение подвижности ЦП, обусловленное массой и зарядом белка при комплексообразовании. Добавление к ЦП очищенных ЛФ, МПО и смеси ЛФ и МПО вызывало ретардацию зоны ЦП, выявляемой после электрофореза в полиакриламидном геле при окраске хромогенным субстратом – о-дианизидином (Рис. 1). Используя этот метод, мы впервые обнаружили комплексы ЦП-ЛФ (подвижность В), ЦП-МПО (подвижность А) и ЦП-ЛФ-МПО (зона на старте) при патологии in vivo, анализируя биологические жидкости: в сыворотке крови 40 больных с гнойными поражениями конечностей, в лаваже 2-х больных с абсцессами в легких, в плевральной жидкости 2-х больных туберкулезом, и в 2-х из 30 вагинальных секретов с подозрением на микробные инфекции. Электрофорез этих образцов показал наличие, наряду с основной зоной ЦП сыворотки (подвижность С), дополнительных зон с меньшей подвижностью. Данные зоны исчезали при добавлении к образцам антител к ЛФ и МПО (Рис. 1, 6 и 7).
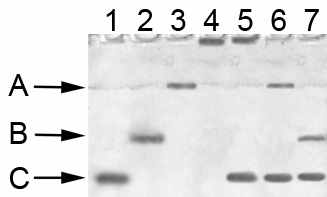
Рис. 1. Выявление ЦП при диск-электрофорезе в полиакриламидном геле (окраска о-дианизидином) образцов: 1 – сыворотки крови здорового донора (5 мкл), 2 – 1+ ЛФ (0,5 мкг), 3 – 1+ МПО (1 мкг), 4 – 1+ ЛФ (0,5 мкг) и МПО (1 мкг), 5 – сыворотка больной А. с абсцессом плеча (5 мкл), 6 – 5 + антитела к ЛФ, 7 – 5 + антитела к МПО.
При диск-электрофорезе образцов сыворотки млекопитающих 7 видов, к которым добавили МПО человека, наблюдалась ретардация ЦП. Что говорит об отсутствии видоспецифичности при образовании комплекса ЦП-МПО. Такие же результаты были получены нами ранее при изучении комплексообразования между ЦП и ЛФ разных видов млекопитающих. При введении 2 мг МПО человека в кровяное русло крыс весом 150 г, мы наблюдали, что по мере уменьшения концентрации МПО, гетерогенный комплекс ЦП крысы - МПО человека исчезал из циркуляции в течение 30 минут. При инъекции кроликам внутрикожно в параспинальную область полного адъюванта Фрейнда и суспензии полиакриламидного геля (моделирование гнойного воспаления), мы наблюдали в сыворотке крови ЦП с ретардацией, подобной комплексам ЦП-МПО человека и ЦП-ЛФ человека при диск-электрофорезе. При отборе проб сыворотки у кроликов, данные комплексы выявлялись на следующий день после инъекции, что сопровождалось повышением содержания ЦП в сыворотке в 2 раза.
Таким образом, появление комплексов ЦП с белками нейтрофилов (ЦП-ЛФ, ЦП-МПО и ЦП-ЛФ-МПО) в крови и других биологических жидкостях, может служить одним из показателей функциональной активности нейтрофилов и использоваться для диагностики гнойных воспалений. Исследование выполнено при поддерже грантов РФФИ № 05-04-48765 и Н.Ш. 1730.2003.4.
