Під загальною редакцією проф. Малого В. П. проф. Кратенко I. С. Харків 2006
| Вид материала | Диплом |
- Матер І а л и науково-практичної конференції з міжнародною участю 1-2 березня 2007, 7242.75kb.
- Под общей редакцией проф. Малого В. П., проф. Кратенко И. С. Харьков 2008, 8344.22kb.
- Р. А. Хальфин 08. 12. 2006 г. N 6530-рх методические рекомендации, 1062.91kb.
- За загальною редакцією, 1428.32kb.
- Программа студенческой олимпиады мгмсу по стоматологии 30. 10., 33.94kb.
- М. А. Рыбалко (отв редактор), проф, 973.68kb.
- Реферат циклу підручників «Україна в світовій політиці», 148.74kb.
- Колективу авторів у складі: проф. Гаращенко Ф. Г., проф. Закусило О. К., проф. Зайченко, 259.94kb.
- Программа по курсу "Уголовное право" / Сост проф. Б. С. Волков, проф. И. Д. Козочкин,, 638.15kb.
- Квалификационные тесты по дерматовенерологии Москва, 2267.11kb.
Госпитальная инфекция в отделении реанимации многопрофильного стационара
Хабиров Т.Ш., Закирова И.А., Хабибуллина И.А., Харисов Р.Р., Никифоров Д.А., Хусаинов И.Р., Детистова З.З.
МСЧ ОАО «Татнефть», г. Альметевск
Цель исследования. Целесообразность проведения бактериологического контроля в отделении реанимации многопрофильного стационара; методы профилактики внутрибольничной инфекции.
Материал и методы. Нами проанализировано 324 случая бактериологического исследования больных за период 2003-2005 гг. Все больные находились в отделении реанимации. Из них: политравма - 67 (20,7%); пневмония - 35 (10,8%); инсульты-75 (23,1%); черепно - мозговая травма - 78 (24%); ожоги - 14 (4,3%); хирургические перитониты - 26 (8%); менингит - 9 (2,8%); заболевание почек с ОПН - 13 (4%); сепсис - 7 (2,3%). На респираторной поддержке находилось 99 (30,6%) больных. На исследование забирался следующий материал: посев мокроты - 79; посев секрета трахеобронхиального дерева (ТБД) - 144; посев ликвора - 9; посев мочи - 21; отделяемое раневой поверхности - 26; кровь - 28; содержимое плевральной полости - 8; мазок из зева и носоглотки - 7; посев с подключичного катетера - 2. Во всех случаях – с постановкой проб на чувствительность к антибиотикам. Посевы забирались на 7, 10 сутки нахождения в отделении. До получения результатов проводилась эмпирическая стартовая антибактериальная терапия. У больных, находящихся на респираторной поддержке замена контура аппарата производилась каждые 48 часов, устанавливался бактериологический фильтр между эндотрахеальной трубкой и контуром. Больным, получающим энтеральное питание, в зонд назначались эубиотики, бактериофаги. Многоразовый расходный материал проходил тщательную обработку в условиях центральной стерилизационной и систематический бактериологический контроль перед применением. В отделении проводилась регулярная обработка палат и оборудования с последующим эпидемиологическим контролем.
Обсуждение результатов. Микроорганизмы выделены в 122 случаях: посев мокроты - 49; посев секрета из ТБД - 44; посев ликвора -1; посев мочи - 9; отделяемое раневой поверхности - 13; кровь - 2; содержимое плевральной полости -1; мазок из зева и носоглотки - 2; посев с подключичного катетера - 1. Высеваемость - 37,7 %. Наиболее частыми возбудителями являлись: Ech.coli - 24,4 % (чувствительность к амикацину, цефатаксиму, канамицину); Pr.vulgaris - 3,1 % (ципрофлоксацин, гентомицин, амикацин); Ps.aeruginosae - 26,7 % (ципрофлоксацин, амикацин); Kl.pneumoniae - 3,3 % (амикацин, цефатаксим, цефамандол); Candida - 14,3 %; St.aureus - 21 % (ципрофлоксацин, ванкоцин, клиндомицин); St.epiderm. - 7,2 % (эритромицин).
После получения результатов на чувствительность к антибиотикам проводилась этиотропная терапия. Комбинация двух препаратов применялась у 36,2 % пациентов. Наиболее часто использовались: амикацин - 23,6 %, ципрофлоксацин - 9,8 %, цефалоспорины 3 поколения - 15,4 %, ванкоцин - 4,9 %. Первоначальная оценка эффективности антибактериальной терапии осуществлялась в течение 48 часов от начала лечения. Второй этап антибактериальной терапии был проведен в 14 случаях, после контрольного бактериологического исследования. Исследовано 84 посева: секрет из ТБД - 39; мокрота - 35; с раневой поверхности - 10; с подключичного катетера - 1) Высеваемость - 16,7 %. Выделенная микрофлора представлена следующим образом: St.aureus - 28,6 %; Ech.coli - 21,4 %; Ps.aeruginosae - 21,4 %; Candida - 14,3 %; St.epiderm. - 14,3 %. При повторном контрольном исследовании роста микроорганизмов не отмечалось.
Таким образом, систематический бактериологический контроль позволяет определить наиболее частых возбудителей нозокомиальных инфекций в ОАРИТ, проводить рациональную антибактериальную терапию и профилактику внутрибольничной инфекции.
Применение лапаростомического аппарата в комплексном лечении абдоминального сепсиса
Хаджиев О.Ч., Татарчук П.А., Шестопалов Д.В., Слуцкая О.С.
Крымский государственный медицинский университет им. С.И.Георгиевского
При лечении абдоминального сепсиса достаточно трудным является вопрос выбора оптимальной лечебной, и в первую очередь хирургической тактики. Принцип радикального оперативного лечения основан на полной, адекватной и ранней ликвидации или отграничении всех основных, дополнительных и потенциальных источников (очагов) эндогенной интоксикации как микробного, так и дисметаболического характера. Лечение резидуального и профилактика рекуррентного внутрибрюшного инфицирования достигается обоснованным выбором одного или нескольких методов: перитонеального лаважа антисептиками в проточном или фракционном режиме; программируемой (этапной) ревизии и санации брюшной полости; лапаростомии.
Среди путей улучшения результатов программируемых санационных релапаротомий при абдоминальном сепсисе у больных с перитонитом многие авторы указывают на необходимость оптимального выбора лапаростомического устройства. В нашей клинике разработан и используется для закрытия брюшной полости лапаростомический аппарат (рис.1), состоящий из прокалывающих элементов (1), пластин для фиксации прокалывающих элементов (2) с фиксаторами прокалывающих элементов (3) и фиксаторами зубчатой пластины (4), и зубчатой пластины (5). Прокалывающие элементы изготовлены из медицинской стали, дугообразно изогнуты, заострены с двух концов. Пластины для фиксации прокалывающих элементов изготовлены из органической пластмассы.
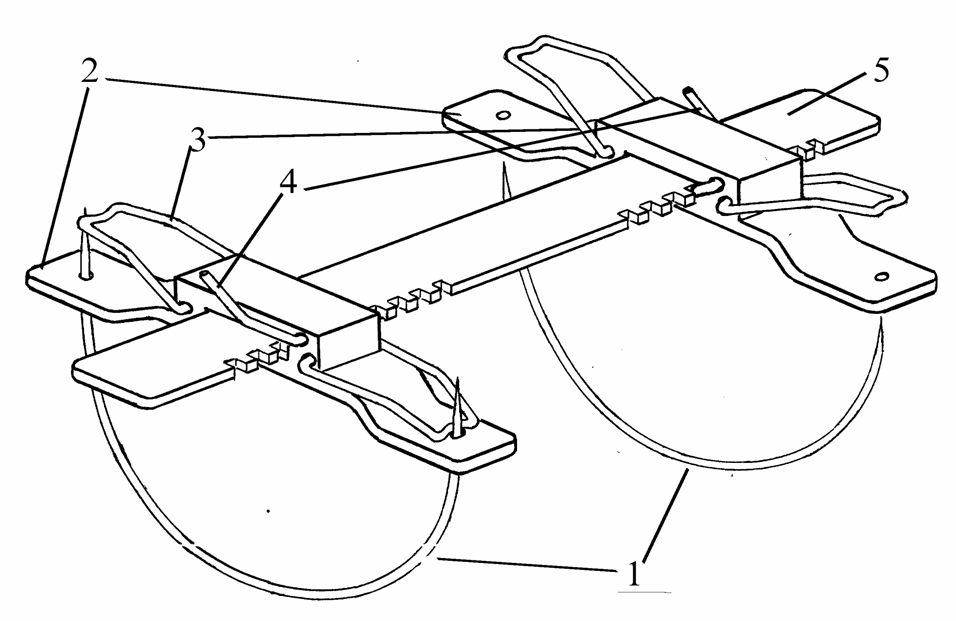
Рис.1. Лапаростомический аппарат (Патент Украины № 36777 А, А 61 В 17/08) 1) – прокалывающие элементы; 2) – пластины для фиксации прокалывающих элементов; 3) – фиксаторы прокалывающих элементов; 4) фиксаторы зубчатой пластины; 5) зубчатая пластина
На концах пластин для фиксации прокалывающих элементов есть отверстия, соответствующие диаметру прокалывающих элементов. В отверстия вводятся концы прокалывающих элементов. В центрах пластин для фиксации прокалывающих элементов есть отверстия прямоугольной формы для проведения зубчатой пластины. В пластины для фиксации прокалывающих элементов вмонтированы П-образные стальные фиксаторы прокалывающих элементов (3), закрепленные в центрах пластин для фиксации прокалывающих элементов с возможностью вращения. Так при опущении фиксатора прокалывающего элемента к поверхности пластины, он плотно прижимает конец прокалывающего элемента в отверстии пластины для фиксации прокалывающих элементов, предотвращая возможность смещения прокалывающего элемента. При поднятии фиксатора прокалывающего элемента он освобождает конец прокалывающего элемента, что делает возможным снятие пластины для фиксации прокалывающих элементов. В центре пластины для фиксации прокалывающих элементов вмонтирован фиксатор зубчатой пластины (4), П-образной формы, имеет 2 рычага – “управляющий” (более длинный) и “фиксирующий” (более короткий) (Рис.1) При вращении фиксатора для зубчатой пластины за “управляющий” рычаг к поверхности зубчатой пластины, “фиксирующий” рычаг входит в паз между зубцами зубчатой пластины и фиксирует узлы устройства в заданном положении. Зубчатая пластина (5) изготовлена из органической пластмассы или из медицинской стали. На ее боковых поверхностях есть зубцы, расстояние и глубина пазов между которыми соответствует размеру “фиксирующего” рычага фиксатора для фиксации зубчатой пластины.
Лапаростомический аппарат используют таким образом. После окончания этапа санации брюшной полости при гнойном перитоните, на расстоянии 3-3,5 см от краев раны намечаются места вкола и выкола прокалывающих элементов. Потом под контролем зрения, параллельно длиннику раны вводятся прокалывающие элементы (1). На концы прокалывающих элементов, которые выступают над кожей, насаживаются пластины для фиксации прокалывающих элементов (2) и фиксируются фиксаторами прокалывающих элементов (3) путем их прижатия к поверхности пластины для фиксации прокалывающих элементов вдоль концов прокалывающих элементов. В соответствующие отверстия пластин для фиксации прокалывающих элементов проводится зубчатая пластина (5). После сближения узлов устройства на расстояние, необходимое для полного или частичного закрытия брюшной полости, осуществляется фиксация частей аппарата путем вращения фиксатора зубчатой пластины за “управляющий” рычаг так, чтобы “фиксирующий” рычаг вошел в паз между зубцами зубчатой пластины, исключая возможность смещения узлов устройства. При повторных санациях брюшной полости путем поднятия “управляющего” рычага фиксатора зубчатой пластины, освобождается и удаляется зубчатая пластина, что делает возможным раскрытие брюшной полости.
Лапаростомический аппарат был успешно использован при лечении 25 больных с разлитым гнойным перитонитом, леченных с использованием метода лапаростомии. Из 25 больных умерло 5. Двое больных в старческом возрасте погибли в первые трое суток от сердечно-сосудистой недостаточности. Трое на фоне продолжающегося перитонита.
Следует отметить, что использование устройств для закрытия ран у этой категории больных, позволяет значительно уменьшить время оперативного вмешательства во время повторных санаций, а также значительно уменьшить воспалительно-некротические изменения в стенке лапаротомной раны. Последнее достигается за счет того, что каналы от проколов прокалывающих элементов устройств не сообщаются с инфицированной брюшной полостью, как это происходит при закрытии ран с помощью лигатур.
Выводы.
Разработанный аппарат по сравнению с предложенными ранее устройствами имеет ряд значительных преимуществ: он выполнен из пластика с легкими металлическими фиксаторами из медицинской стали, прост в применении, значительно сокращает время для туалета брюшной полости и ее закрытия.
Предложенная нами методика лапаростомии с использованием разработанной конструкции может быть применена в комплексном лечении абдоминального сепсиса.
