Координационная химия и реакционная способность смешанных ацидопорфириновых комплексов марганца в растворах 02. 00. 01 неорганическая химия 02. 00. 04 физическая химия
| Вид материала | Автореферат |
СодержаниеDpoep (4) ( |
- Рабочая программа дисциплины (модуля) «математический анализ», 424.74kb.
- Рабочая программа дисциплины (модуля) «Уравнения математической физики», 266.58kb.
- Рабочая программа дисциплины (модуля) «Линейная алгебра и аналитическая геометрия», 275.82kb.
- Координационные свойства комплексов меди и марганца с β-октаалкилпорфиринами и их мезо-фенильными, 305.31kb.
- Алкилиденанилины: структура и реакционная способность в гидрировании 02. 00. 03 органическая, 495.9kb.
- Утверждаю, 65.11kb.
- «Неорганическая химия», 1345.55kb.
- Рабочая программа дисциплина ‹‹Неорганическая химия›› опд. Ф. 02 Специальность 020101, 343.5kb.
- Химия и химическое образование на рубеже веков: смена целей, методов и поколений, 258.11kb.
- Конспект лекций по курсу «Неорганическая и аналитическая химия», 18.21kb.
Таблица 11. Кинетические параметры реакций (Х)MnP с H2O2 в ДМФА
| (X)MnP | 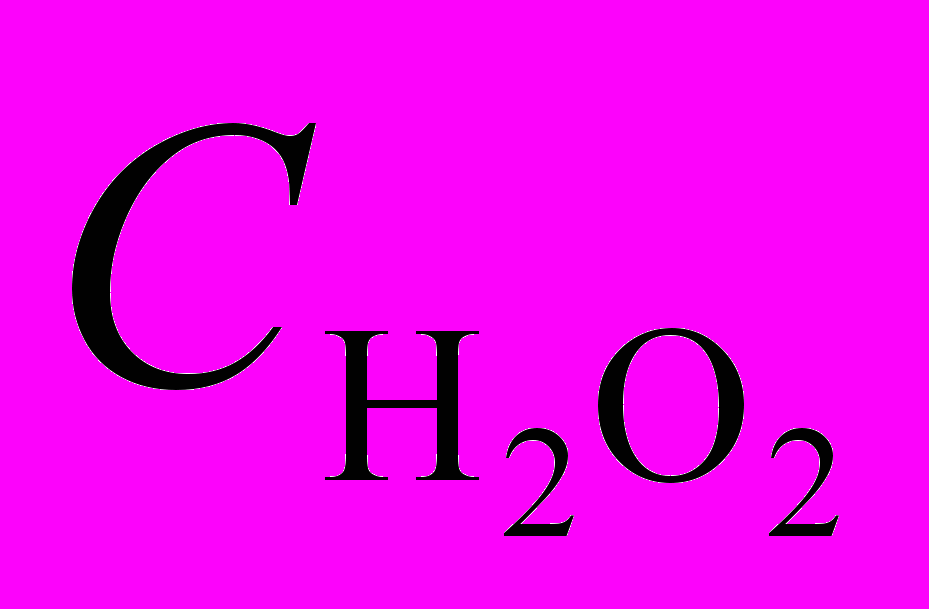 , моль/л , моль/л | Кинетическое уравнение | k .102 | Е, кДж/моль | -S, Дж/моль.K |
| (Cl)MnTPP | 0,017 0,10 | 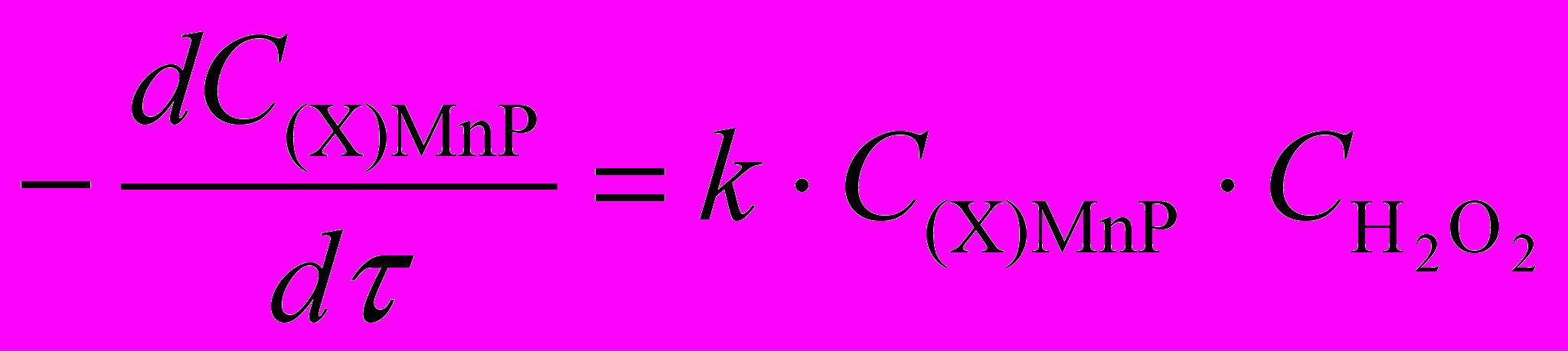 | 5,5 0,4 | 64 2 | 61 6 |
| | 1,26 3,32 | 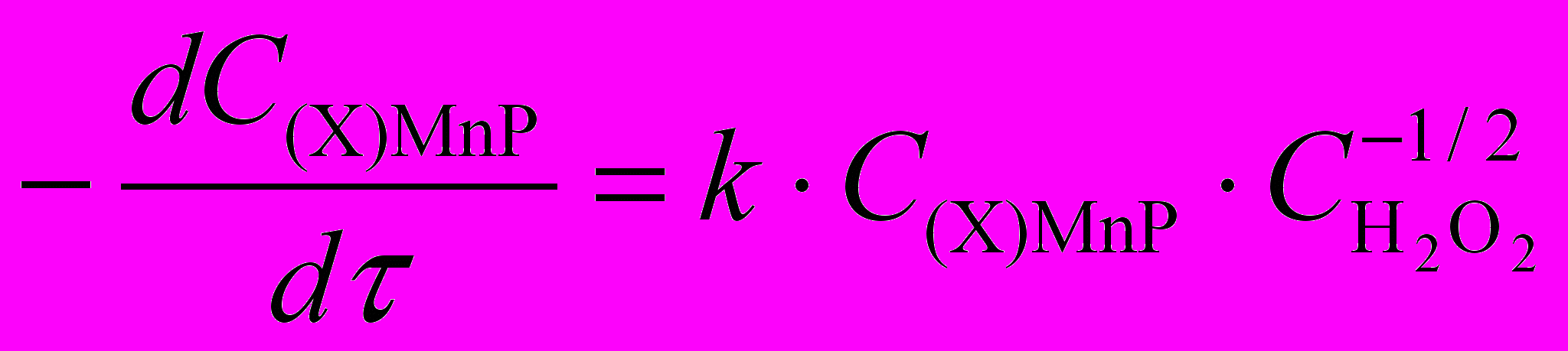 | 1,3 0,1 | 49 1 | 124 3 |
| (АсО)MnTPP | 0,013 0,05 | 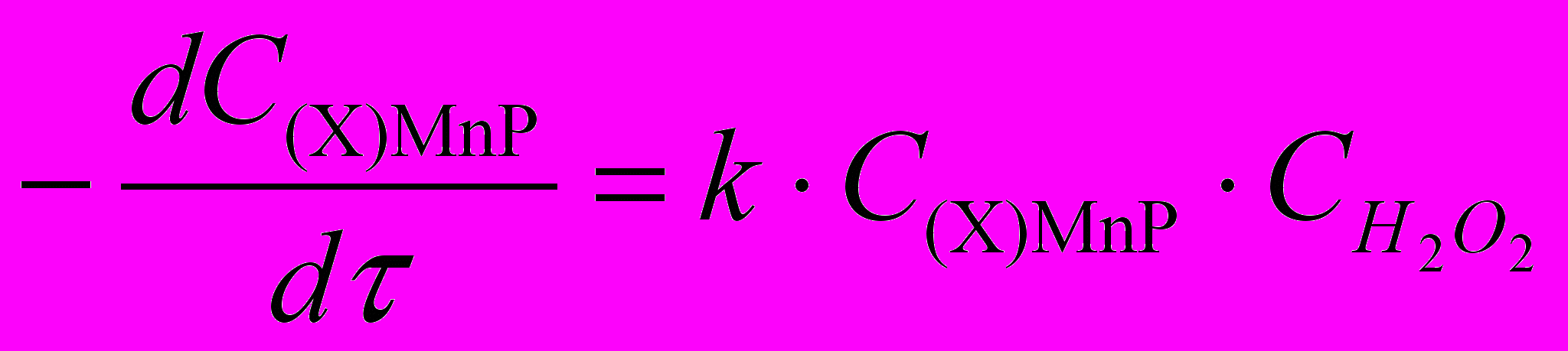 | 15,4 2,0 | 54 1 | 87 3 |
| (Cl)MnОЕP | 0,01 0,07 | 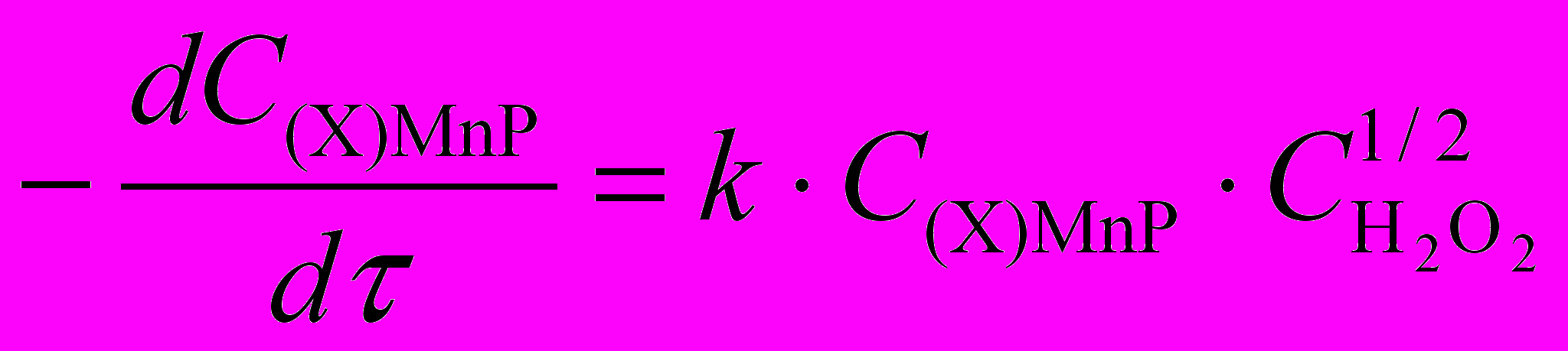 | 0,46 0,01 | 63 1 | 85 3 |
| | 1,00 2,22 | 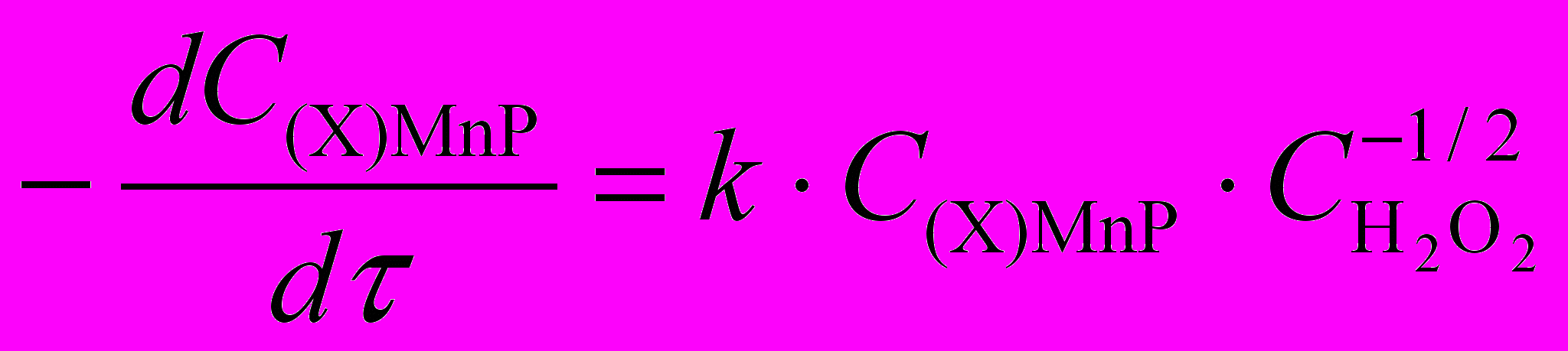 | 0,127 0,002 | 50 2 | 140 6 |
С учетом данных по ЭСП, кинетике и термодинамике реакций взаимодействия марганец(III)порфиринов с H2O2 в среде ДМФА - H2O в зависимости от концентрации пероксида и температуры предложена схема реакций для комплексов тетрафенилпорфина (схема 5). При низких концентрациях H2O2 комплекс (Cl)(H2O2)MnIIITPP с координированной в шестое координационное место молекулой H2O2 не накапливается в реакционной смеси. Его равновесная концентрация невелика из-за низких значений K1 ((20 3) л.моль-1 при 298 K) и концентрации Н2О2. Кроме того, он подвергается окислению по макроциклу. При более высо-
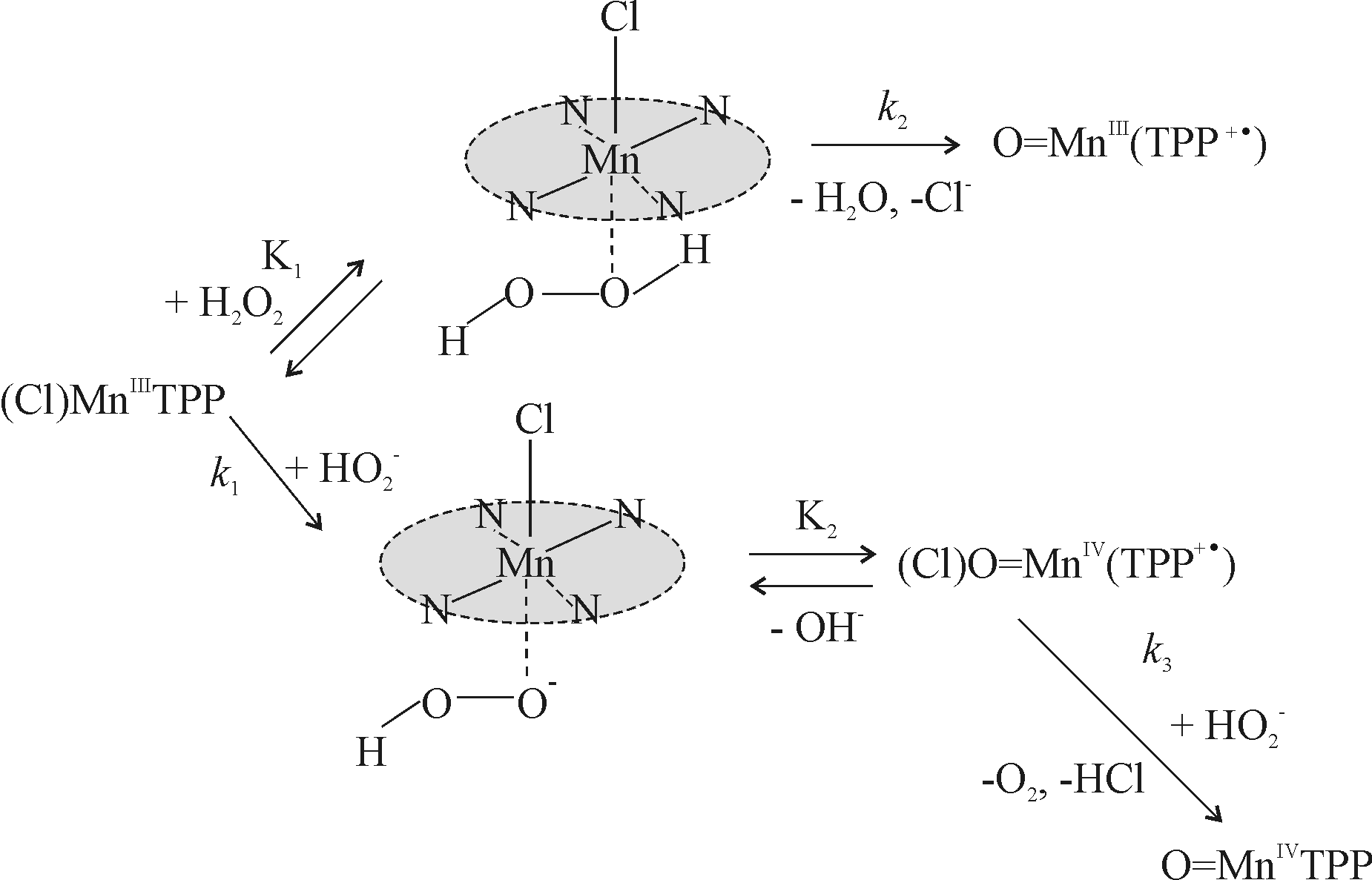 | ких концентрациях пероксида первая стадия проходит быстро и необратимо. Пероксид координируется в виде HO  за счет донорно-акцепторной связи. Затем происходит перенос двух электронов с легко поляризуемого порфиринового макроцикла и катиона марганца на за счет донорно-акцепторной связи. Затем происходит перенос двух электронов с легко поляризуемого порфиринового макроцикла и катиона марганца накоординированный |
| Схема 5. Суммарная схема реакции (Cl)MnTPP с H2O2 |
пероксид с установлением равновесия. Атака HО
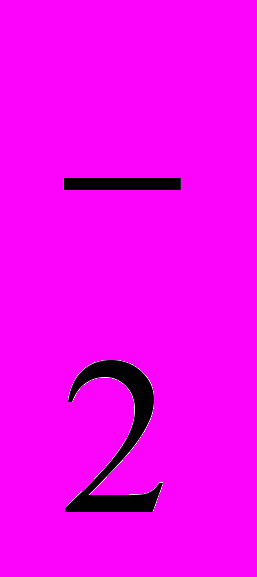 на координационный центр катион-радикального комплекса марганца(IV) способствует медленному превращению до конечного продукта. Закономерности протекания реакций изменяются при возрастании концентрации пероксида водорода по причине появления в кинетически значимых количествах иона пергидроксила HО
на координационный центр катион-радикального комплекса марганца(IV) способствует медленному превращению до конечного продукта. Закономерности протекания реакций изменяются при возрастании концентрации пероксида водорода по причине появления в кинетически значимых количествах иона пергидроксила HО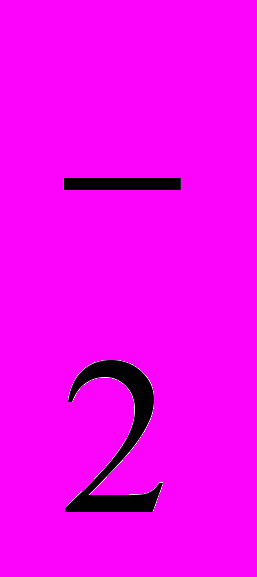 . Последнее приводит к координации HО
. Последнее приводит к координации HО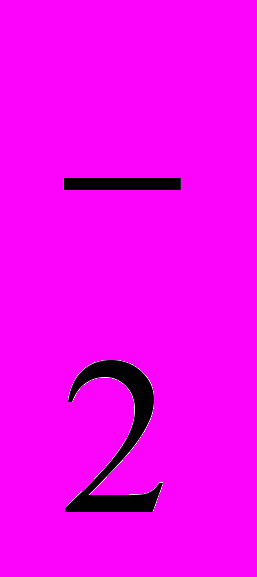 , имеющего большое сродство к катиону металла, вместо молекулы Н2О2 на первой стадии с участием металлопорфирина.
, имеющего большое сродство к катиону металла, вместо молекулы Н2О2 на первой стадии с участием металлопорфирина.Рост реакционной способности в случае (AcO)MnIIITPP объясняется более прочным связыванием ацидолиганда AcO- по сравнению с Cl-. Очевидно, что в среде ДМФА – H2O, где проходит реакция, в исходном комплексе при координации H2O2 происходит замещение координированной в шестое координационное место молекулы ДМФА. Благодаря эффекту транс-влияния Черняева замещение ДМФА проходит легче в комплексе (AcO)MnIIITPP, чем в (Cl)MnIIITPP. Кроме того, благодаря возможности передачи электронных эффектов ацидолиганда через переходный металл с частично заполненной d-оболочкой на макроцикл, последний легче отдает электрон с образованием -катион-радикала в составе (AcO)MnIIITPP по сравнению с (Cl)MnIIITPP.
Механизм окисления комплекса (Cl)MnOEP отличается тем, что реакция останавливается на стадии образования одноэлектронно восстановленной формы O=MnIII(OEP
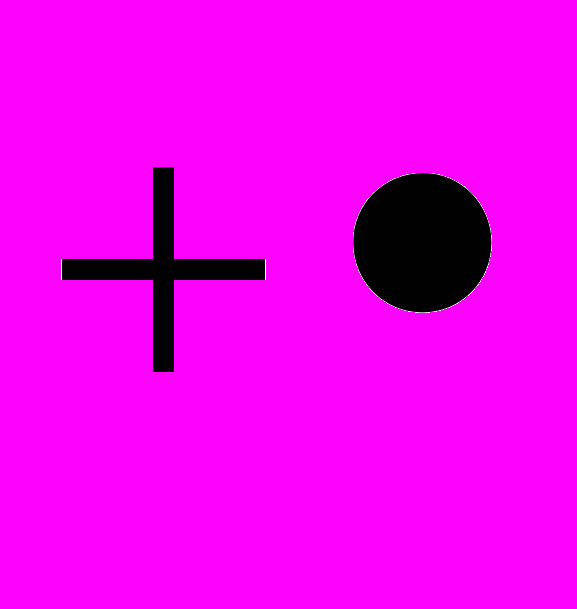 ), которая фиксируется в эксперименте как относительно устойчивый конечный продукт.
), которая фиксируется в эксперименте как относительно устойчивый конечный продукт.Изменение деталей механизма реакции октаэтилпорфинового комплекса с H2O2 в сравнении с комплексами с Н2ТРР связано с различием в электронном состоянии ароматического лиганда. Анализ данных раздела показывает, что, изменяя электронное состояние макроцикла и связей Mn–N, можно добиться оптимальных параметров для реакции координации молекул H2O2 и ионов HO2- на различных стадиях реакции с пероксидом и затем использовать это при разработке синтетических каталаз.
Результаты исследования реакции H2O2 с (X)MnP демонстрирует легкость переходов между комплексами марганца(III) и марганца(IV), а также достаточно высокую устойчивость марганецпорфиринов в отношении H2O2.
Для выяснения роли эффекта экранирования координационного центра анионом X- исследования реакций с H2O2 проведены также для неэкранированных медь(II)порфиринов в нейтральной и щелочной средах 3,7,50 . Эти результаты представлены в диссертации в разделе VIII.2.1.
Каталазная активность марганец(III)порфиринов (X)MnIIIP исследована для реакций, протекающих в гомогенных условиях в щелочной среде 3,7,32,38,49,50 (раздел VIII.2). H2O2, (X)MnIIIP и KOH находятся в водно-органической фазе, органический компонент - ДМФА. В отсутствие КОН в такой системе разложение H2O2 с выделением газообразного О2 не происходит (раздел VIII.1). Константа скорости разложения пероксида водорода нулевого порядка по кислороду увеличивается с ростом концентраций комплекса марганца(III), KOH и H2O2 в системе при условии значительного избытка других реагентов по сравнению с комплексом (рис. 13-16). Свободный порфирин не катализирует рассматриваемую реакцию.
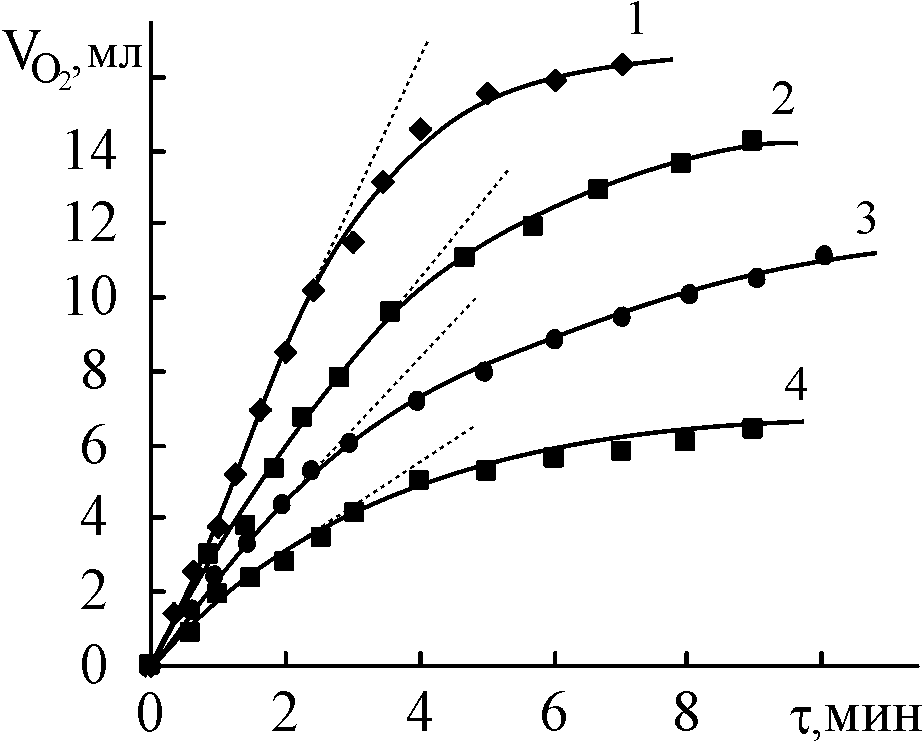 | 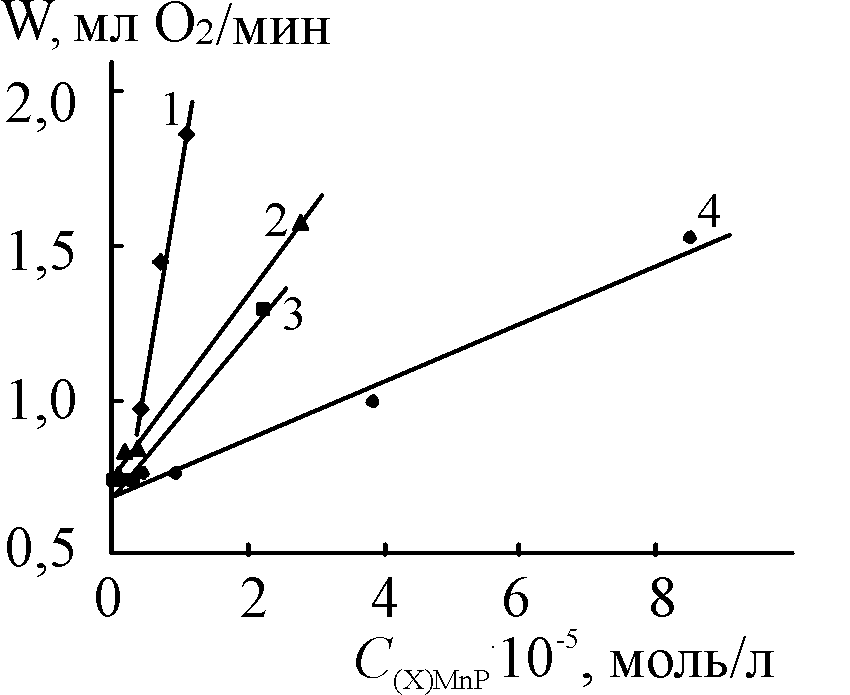 |  |
| Рис. 13. Зависимость 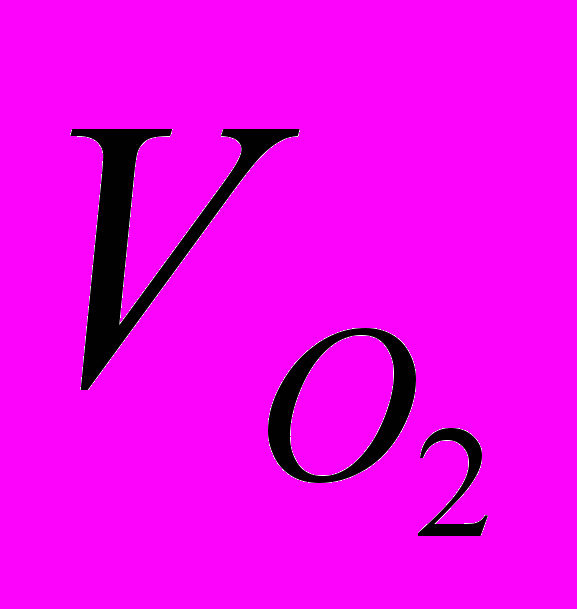 - -в присутствии (Cl)MnMPOMP (1), (Cl)MnOEP (2), (AcO)MnOEP (3) и (Cl)Mn5,15 DPOEP (4) (С = 1,08.10-5; 2,77.10-5; 2,25.10-5 и 3,87.10-5 моль/л соответственно). 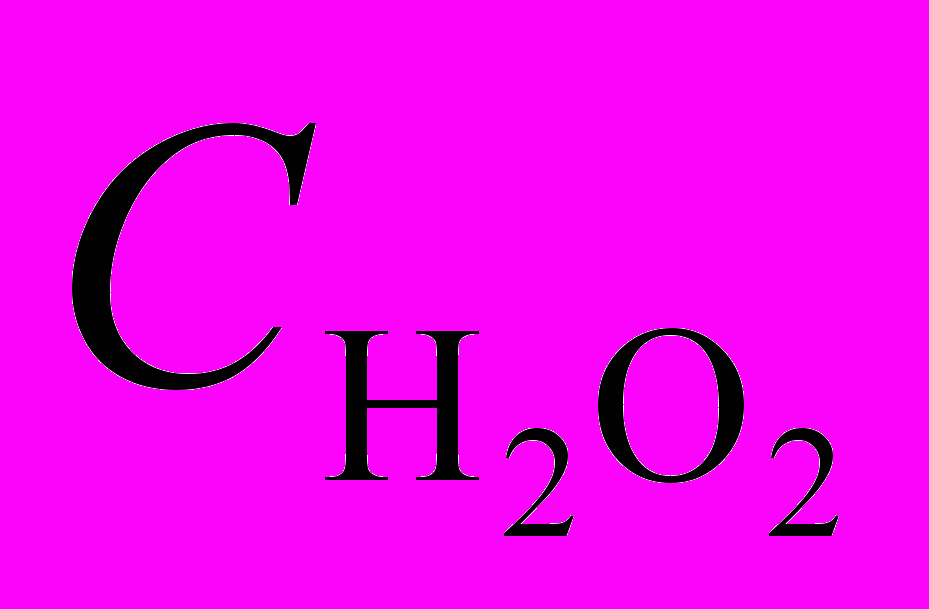 = 3,49; = 3,49; 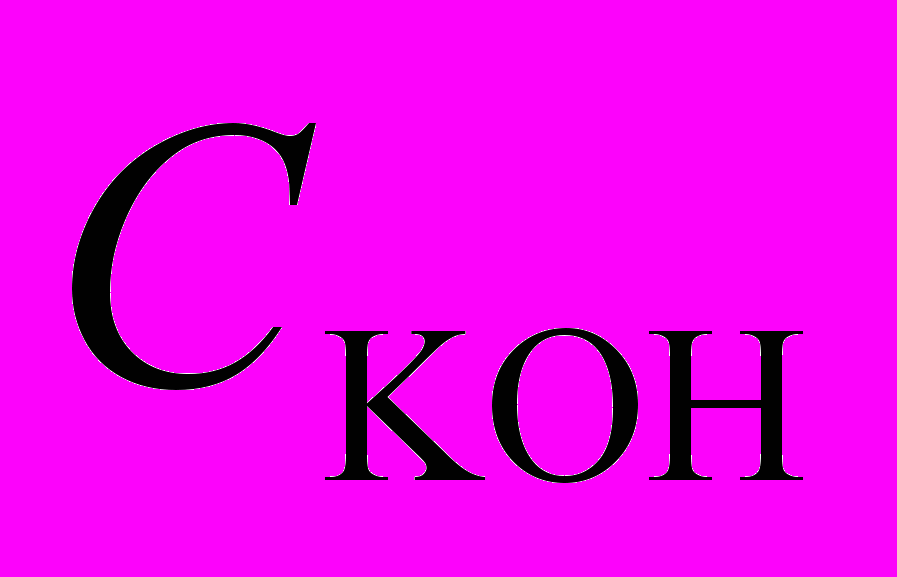 = 1,5.10-2 моль/л. T=343 K = 1,5.10-2 моль/л. T=343 K | Рис. 14. Зависимость константы скорости разложения Н2О2 от концентрации (Cl)MnMPOЕP (1), (Cl)MnOEP (2), (AcO)MnOEP (3), (Cl)Mn5,15DPOEP (4), (Cl)MnMPOMP (5), (Cl)MnTPP (6), (AcO)MnTPP (7). 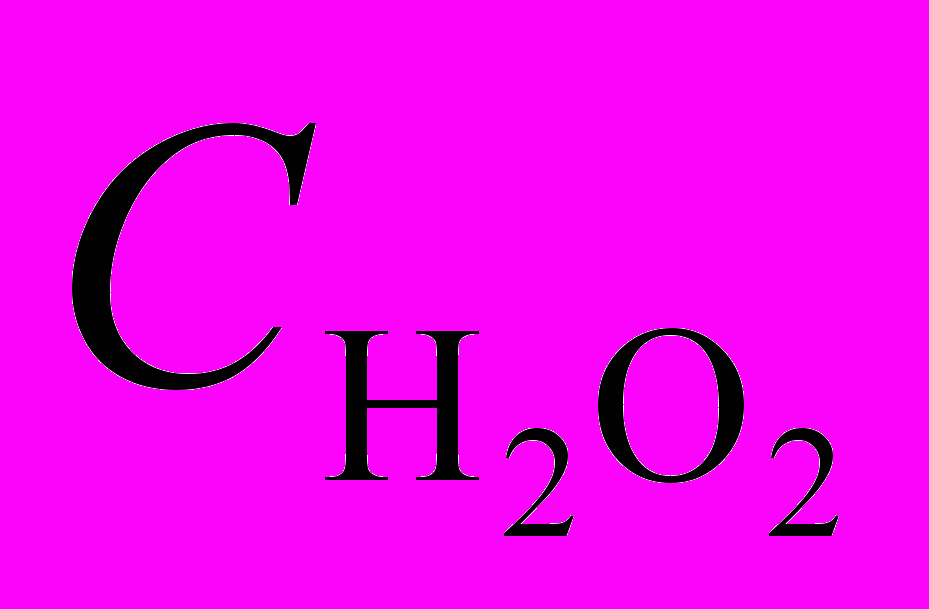 =3,49 (1-4); 3,98 (5-7) моль/л, СКОН=1,5.10-2 (1-4); 1,9.10-2 (5-7) моль/л. T = 343 K =3,49 (1-4); 3,98 (5-7) моль/л, СКОН=1,5.10-2 (1-4); 1,9.10-2 (5-7) моль/л. T = 343 K | |
Комплексы со смешанным лигандным окружением марганца проявляют существенную каталазную активность, повышая скорость процесса разложения Н2О2 и понижая энергию активации. Так, присутствие (AcO)MnTPP в реакционной смеси снижает энергию активации более чем в 5 раз (c 72 до 14 кДж/моль), (Cl)MnTPP – в 2 раза (до 37 кДж/моль). По данным рис. 13-16 определены кинетические уравнения (29) и (30) для реакций с участием комплексов тетрафенилпорфина и октаалкилпорфиринов соответственно.
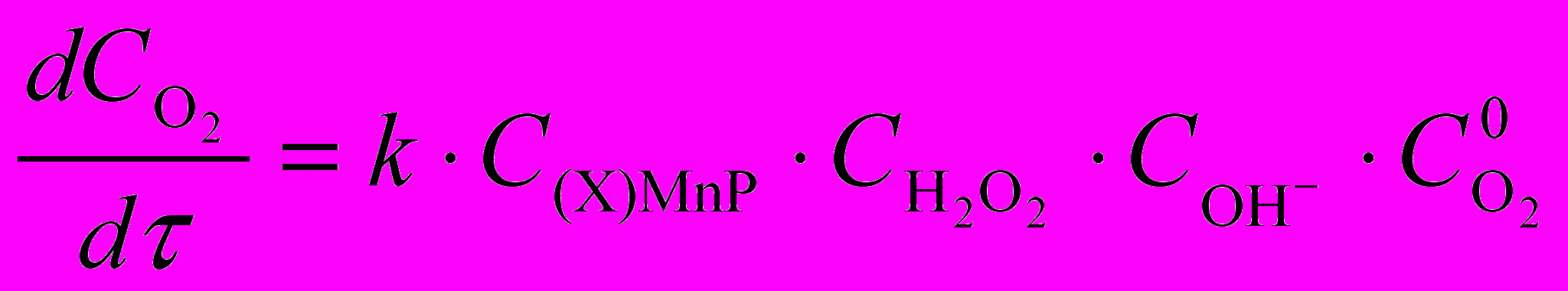 (29)
(29)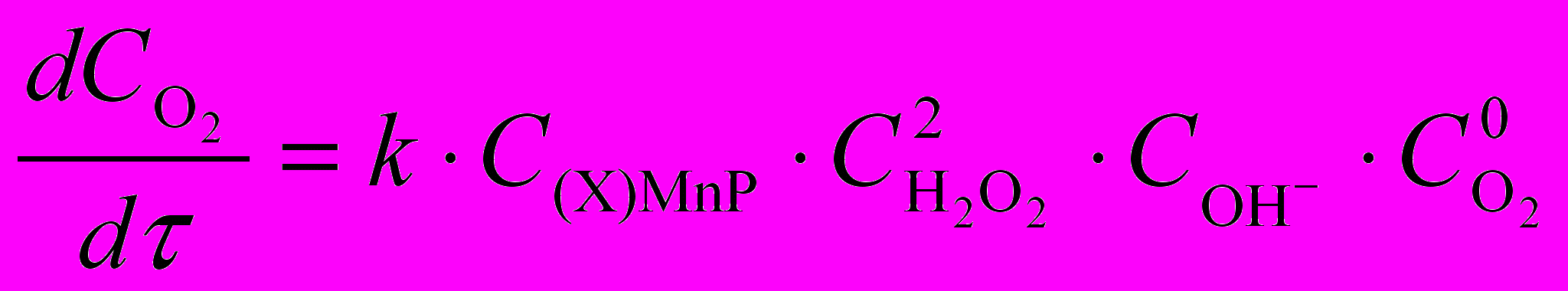 (30)
(30) 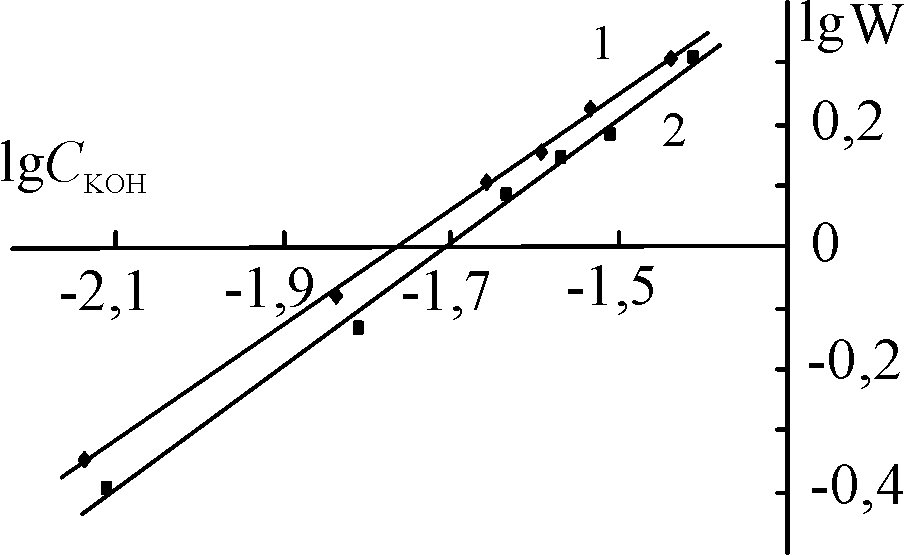 | 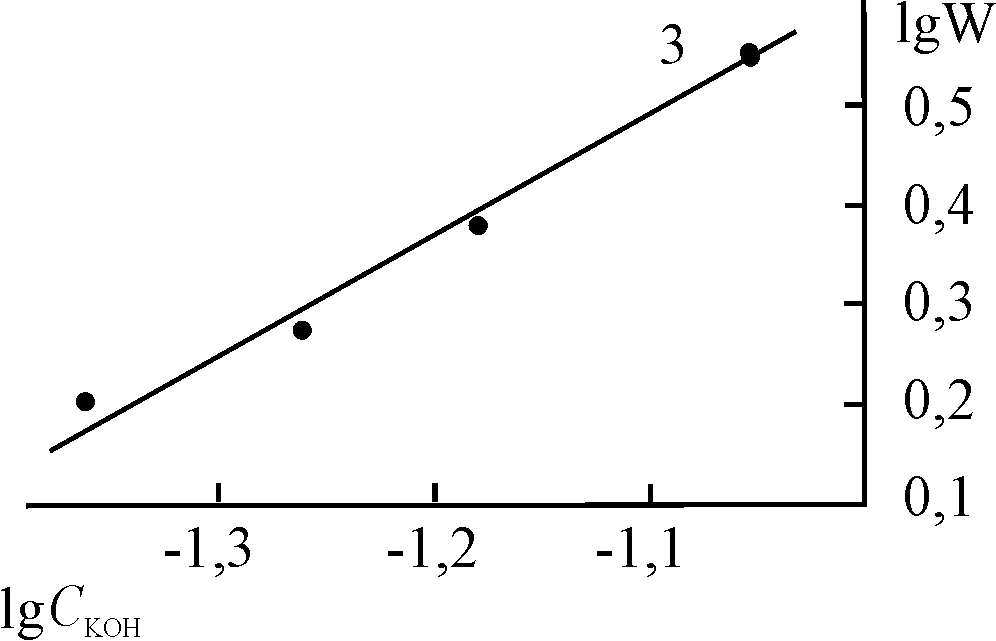 | ||
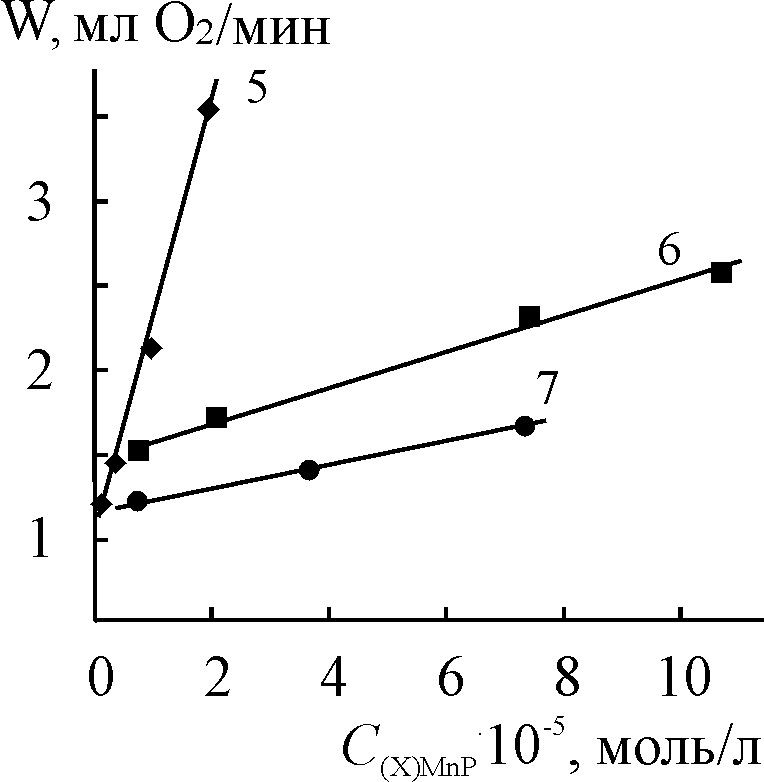
| Рис. 15. Логарифмические зависимости констант скорости разложения Н2О2 в присутствии (Cl)MnOEP (1), (Cl)Mn5,15DPOEP (2) и (Cl)MnTPP (3) от концентрации KOH. С(Х)MnP = 0,2.10-5 (1, 2) и 0,47.10-5 (3) моль/л, 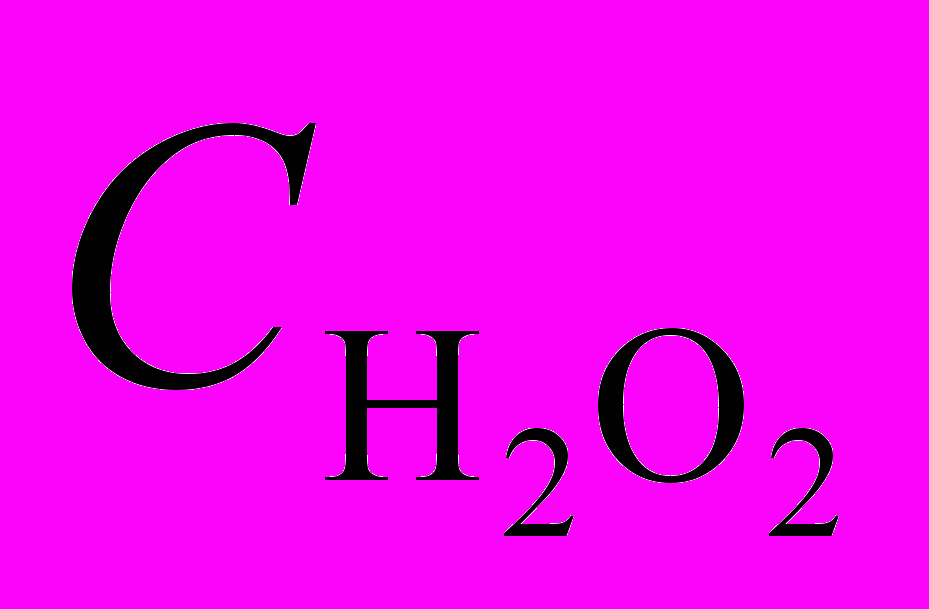 = 3,49 (1 2) и 3,98 (3) моль/л. T = 343 K = 3,49 (1 2) и 3,98 (3) моль/л. T = 343 K | |||
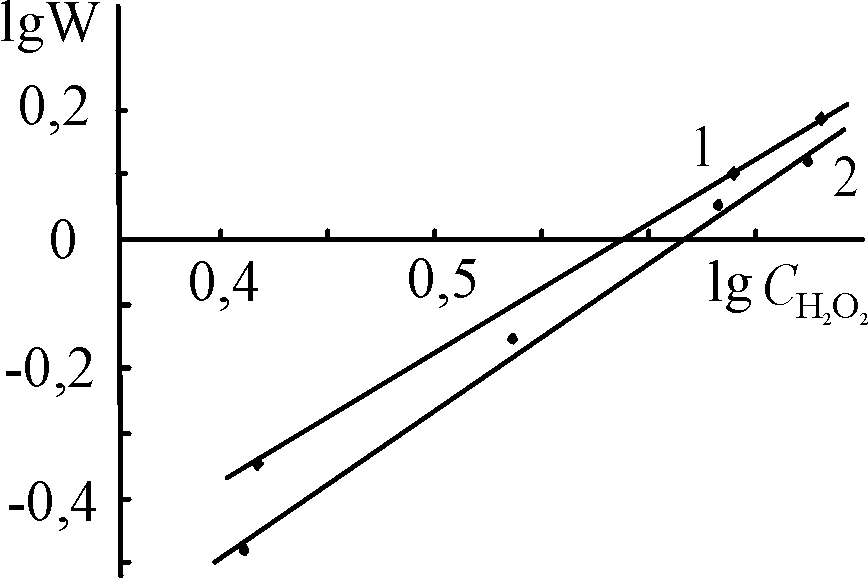 | 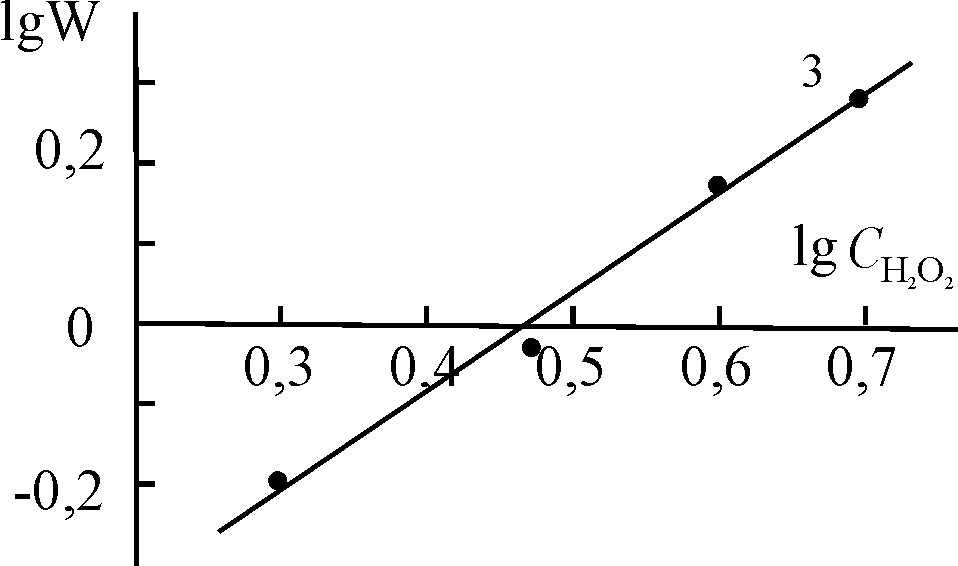 | 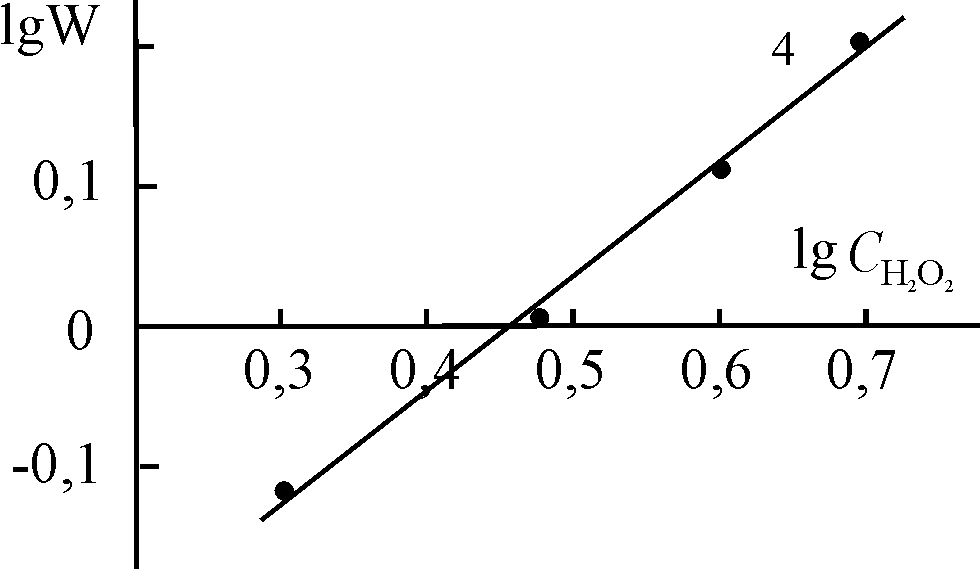 | |
| Рис. 16. Логарифмические зависимости констант скорости разложения Н2О2 в присутствии (Cl)MnOEP (1), (Cl)Mn5,15DPOEP (2), (Cl)MnTPP (3) и (AcO)MnTPP (4) от концентрации H2O2. С(Х)MnP = 0,2.10-5 (1, 2), 0,47.10-5 (3) и 0,8.10-5 (4) моль/л, СКОН = 1,5.10-2 (1, 2) и 1,9.10-2 (3, 4) моль/л. T = 343 K | |||
На основе кинетических данных, с учетом результатов предыдущего раздела предложены схемы реакций, для которых получены теоретические кинетические уравнения, совпадающие с экспериментальными уравнениями (29) и (30). Обоснован ион-молекулярный механизм процесса с кинетически существенными стадиями двухэлектронного окисления металлопорфирина и его последующего частичного восстановления, учитывающий кислотно-основные равновесия пероксида.
Зависимость каталитической активности марганецпорфирина от функционального замещения в макроцикле свидетельствует о том, что порфириновый лиганд оказывает существенное влияние на каталитический процесс, изменяя электронную плотность на центральном атоме металла, что согласуется с предположением о координации H2O2 марганец(III)порфирином в начале процесса. Восстановление катализатора с выделением O2 происходит в результате последующего взаимодействия с HO
 . В своей основе полученные выводы по механизму каталитического действия марганец(III)порфиринов соответствуют данным по механизму функционирования природных каталаз. Поэтому выбор марганецпорфиринов в качестве моделей последних верен. Показано, что эффективный катализ разложения пероксида водорода определяется степенью координационного связывания порфирина, структурой смешанной координационной сферы и взаимным влиянием лигандов в комплексе. Таким образом, появляется возможность регулировать, а, главное, увеличивать каталитическую активность каталаз модификацией ароматической части их молекул.
. В своей основе полученные выводы по механизму каталитического действия марганец(III)порфиринов соответствуют данным по механизму функционирования природных каталаз. Поэтому выбор марганецпорфиринов в качестве моделей последних верен. Показано, что эффективный катализ разложения пероксида водорода определяется степенью координационного связывания порфирина, структурой смешанной координационной сферы и взаимным влиянием лигандов в комплексе. Таким образом, появляется возможность регулировать, а, главное, увеличивать каталитическую активность каталаз модификацией ароматической части их молекул.ВЫВОДЫ
Разработан раздел координационной химии марганца «координационные соединения марганца с порфиринами». Установлены закономерности кинетики и термодинамики реакций образования, диссоциации, замещения и обмена лигандов, окисления – восстановления, каталитических реакций порфириновых комплексов марганца в зависимости от степени окисления центрального атома, состава координационной сферы и строения макроцикла (природы, количества и местонахождения функциональных заместителей). Показано, что функциональное замещение можно рассматривать как инструмент регулирования координационных свойств и реакционной способности ацидопорфириновых комплексов марганца при их практическом использовании.
- Марганец образует с дианионами порфиринов многочисленные комплексы, находясь в степенях окисления +2, +3, +4 или +5, как правило, в высокоспиновом состоянии. Порфириновые лиганды стабилизируют марганец в виде Mn3+ или (NMn)2+. В редких случаях образуются комплексы с молекулярным порфирином или окисленной формой дианиона порфирина. Вывод сделан из анализа известных рентгеноструктурных данных и собственных данных по химии марганецпорфиринов.
- Из анализа ЭСП, ИК, ПМР, ЭПР спектров поглощения, а также атомно-абсорбционных спектров 45-ти изученных комплексов и имеющихся литературных данных следует, что наиболее специфичными для порфириновых комплексов марганца в разных степенях окисления являются электронные спектры поглощения из-за проявления в них дополнительных полос, связанных с определенным электронным состоянием марганца в комплексах, а также с появлением новых форм комплексов в протолитических растворителях.
- Исследованием кинетики и механизма образования марганцевых комплексов с замещенными азапорфиринами и набором ацидолигандов выявлены новые закономерности протекания реакции комплексообразования - основной реакции для синтеза марганецпорфиринов. Получено 45 комплексов марганца, в том числе 20 новых. Впервые обнаружен и исследован твердофазный синтез комплекса SAT структуры из (хлор)марганец(III)монофенилоктаметил-порфина.
- В протолитических растворителях в отсутствие диссоциации марганецпорфирины в зависимости от строения образуют молекулярные растворы или другие растворенные устойчивые формы: ион-молекулярные ассоциаты (H+solv…MnIIIP, H+solv…MnVP), протонированные по мезо-атомам азота молекулы (в случае азапорфиринов), двукратно протонированный по нейтральному порфириновому лиганду комплекс (SAT), а также окисленные по ароматическому макроциклу или атому марганца молекулы. Для перечисленных форм получены спектральные, термодинамические, кинетические характеристики.
- На примере марганец- и медьпорфиринов установлено разнообразие стехиометрических механизмов диссоциации, традиционно считавшихся универсальными для комплексов порфиринов и фталоцианинов (SEN3 механизм). Оно обусловлено широкими вариациями в структуре координационных сфер и координированных макроциклов, а также изменением равновесного состава и форм протона в протолитических растворителях – реагентах и средах для прохождения реакций диссоциации. Кинетическое уравнение диссоциации марганецпорфирина всегда включает концентрацию комплекса в первой степени. Концентрация реагента – сольватированного протона – входит в кинетическое уравнение либо в виде концентрации индивидуальной частицы, либо в виде общей кислотности, порядок по сольватированному протону может изменяться от 0 до 2.
- Основные закономерности реакции диссоциации в смешанных растворителях уксусная – серная кислоты, полученные на примере смешанных порфиринсодержащих комплексов марганца(III) и модельных медь(II)порфиринов, таковы:
- существует несколько интервалов концентраций серной кислоты в составе смешанного растворителя (
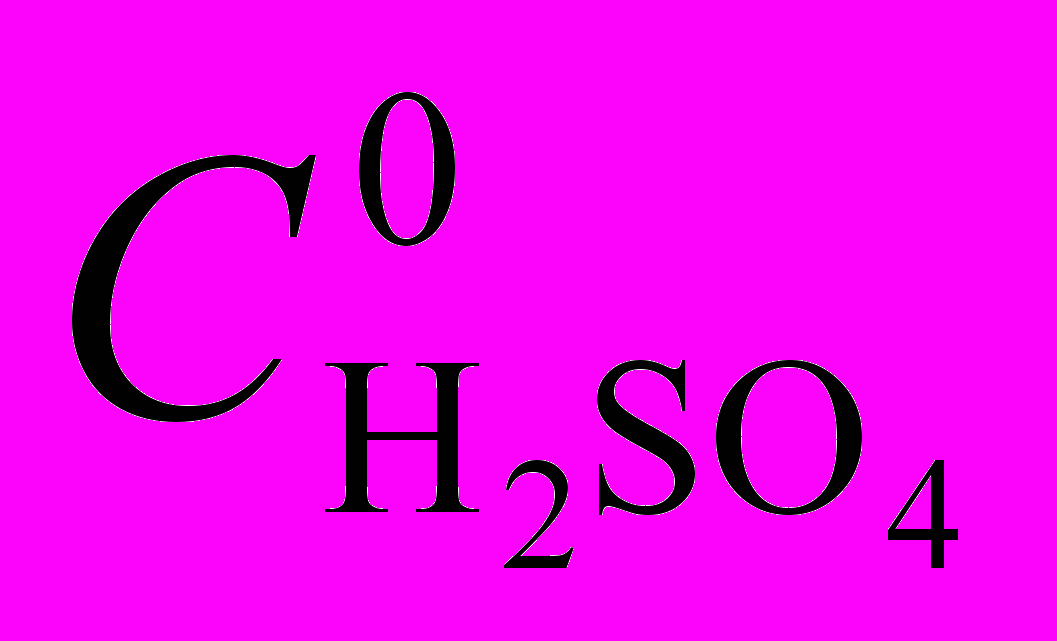 , моль/л: 10-4 0,15; 0,15 0,3; 0,3 3; 3 8) с однотипными уравнениями скорости и механизмами реакции диссоциации;
, моль/л: 10-4 0,15; 0,15 0,3; 0,3 3; 3 8) с однотипными уравнениями скорости и механизмами реакции диссоциации;- кинетические уравнения диссоциациии отличаются друг от друга показателем степени (1, 1½ или 2) протонирующей частицы, приводящей к диссоциации комплекса; протонирующими частицами выступают протонированные молекулы уксусной кислоты, неионизированные молекулы серной кислоты или вся совокупности протонодонорных частиц, находящихся в равновесии.
- при изменении структуры макроциклического лиганда диапазоны составов растворителей с одинаковым кинетическим уравнением могут перекрываться.
7. В смешанных растворителях H2SO4 – H2O (область Бранда) наличие нескольких кинетических уравнений и механизмов диссоциации определяется строением макроциклического лиганда и состоянием равновесия ионизации координационной сферы по ацидолиганду. В реакциях диссоциации комплексов в серной кислоте в качестве активной протонодонорной частицы выступает неионизированная молекула H2SO4, или (редко) катион гидроксония.
8. Впервые определена кинетическая устойчивость марганецпорфиринов и проведена количественная оценка электронного и стерического вкладов при функциональном замещении в макроциклическом лиганде, изменении степени окисления атома марганца в комплексе и варьировании ацидолиганда в смешанной координационной сфере. Функциональное замещение в макроциклическом лиганде оказывает существенно большее влияние на устойчивость смешанных ацидопорфириновых комплексов по сравнению с порфириновыми комплексами двухзарядных катионов. Впервые проведена прямая количественная оценка макроциклического эффекта (МЦЭ) как основного фактора устойчивости марганецпорфиринов. Установлено наличие в нем -составляющей. Соединения марганца(III) и нитридомарганца(V) отнесены к стабильным металлопорфиринам.
9. Систематически исследовано влияние мезо-азазамещения в порфириновом макроцикле на кинетику и механизм реакции обмена ацидолигандами между комплексами марганца(III) и марганца(V). Взаимодействие нитридомарганец(V)тетрафенилпорфина с марганец(III)октафенилтетразапорфирина-ми протекает необратимо из-за сильного -акцепторного действия мезо-атомов азота. Исследованием кинетики процесса в зависимости от природы ацидолиганда в составе комплекса марганца(III), растворителя и функционального замещения в макроцикле, температуры и других факторов установлено, что реакция обмена ацидолигандами протекает по бимолекулярному механизму через стадию образования -нитридомостикового интермедиата.
10. Механизм процесса разложения пероксида водорода в водно-органической среде в присутствии марганец(III)порфиринов имеет ион-молекулярную природу. Кинетически существенными реакциями являются двухэлектронное окисление металлопорфирина, его последующее частичное восстановление и кислотно-основные равновесия пероксида. По результатам исследования реакции прямого окисления марганец(III)порфиринов с изменяющейся структурой макроциклического и ацидолигандов пероксидом водорода установлено образование различных окисленных форм комплексов и возможность их взаимных переходов, а также устойчивость макроцикла в условиях окисления.
11. Эффективный катализ разложения пероксида водорода определяется степенью координационного связывания порфирина, структурой смешанной координационной сферы и взаимным влиянием лигандов в комплексе. Использование марганецпорфиринов в качестве катализаторов разложения пероксида водорода как простых моделей природных каталаз позволило спектрально описать промежуточные комплексы, определить принципы регулирования (а, главное, увеличения) активности катализаторов модификацией ароматической части их молекул и показать, что изученные соединения функционируют подобно природным каталазам в естественных условиях.
12. На примере реакции диспропорционирования пероксида водорода в присутствии марганецпорфиринов, диссоциации координационных центров и окисления комплексов установлено, что кинетика и механизмы реакций с участием ароматических макроциклических комплексов металлов определяются не столько их высокой устойчивостью, а соотношением прочности связывания макроцикла и малых анионных лигандов и формой существования комплексов в протолитических средах.
