Координационная химия и реакционная способность смешанных ацидопорфириновых комплексов марганца в растворах 02. 00. 01 неорганическая химия 02. 00. 04 физическая химия
| Вид материала | Автореферат |
- Рабочая программа дисциплины (модуля) «математический анализ», 424.74kb.
- Рабочая программа дисциплины (модуля) «Уравнения математической физики», 266.58kb.
- Рабочая программа дисциплины (модуля) «Линейная алгебра и аналитическая геометрия», 275.82kb.
- Координационные свойства комплексов меди и марганца с β-октаалкилпорфиринами и их мезо-фенильными, 305.31kb.
- Алкилиденанилины: структура и реакционная способность в гидрировании 02. 00. 03 органическая, 495.9kb.
- Утверждаю, 65.11kb.
- «Неорганическая химия», 1345.55kb.
- Рабочая программа дисциплина ‹‹Неорганическая химия›› опд. Ф. 02 Специальность 020101, 343.5kb.
- Химия и химическое образование на рубеже веков: смена целей, методов и поколений, 258.11kb.
- Конспект лекций по курсу «Неорганическая и аналитическая химия», 18.21kb.
а Величина достоверности аппроксимации прямых в координатах –lg kэф – lg
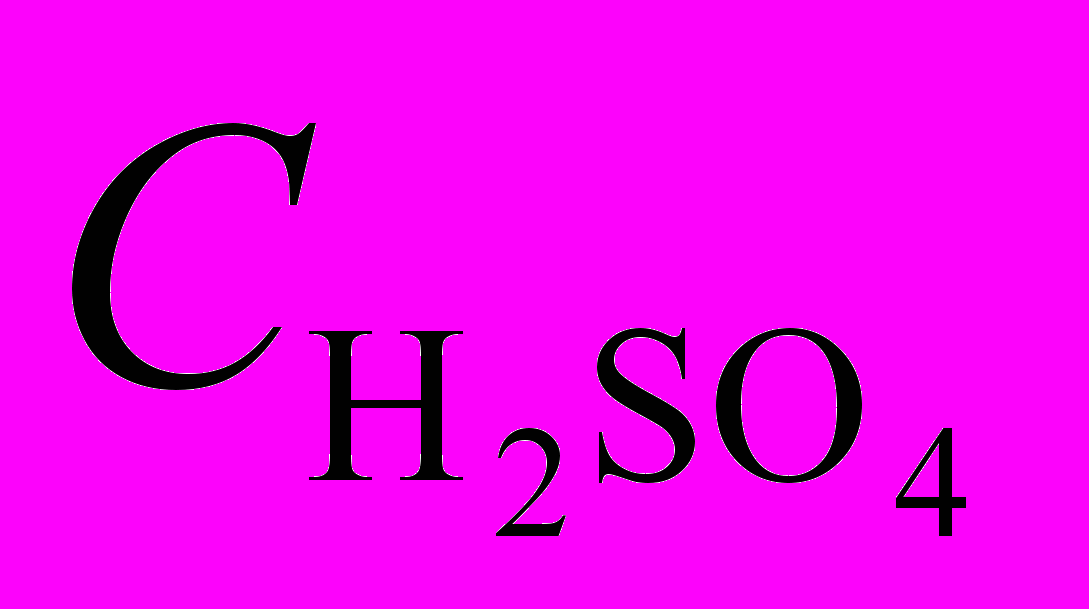 R2 0,98
R2 0,98б Комплекс не образует H-ассоциат в концентрированной серной кислоте
в Порядок реакции диссоциации по равновесной концентрации неионизированной H2SO4
Таблица 8. Константы скорости, энергии и энтропии активации диссоциации марганецоктаэтилпорфиринов в концентрированной H2SO4
| Комплекс | 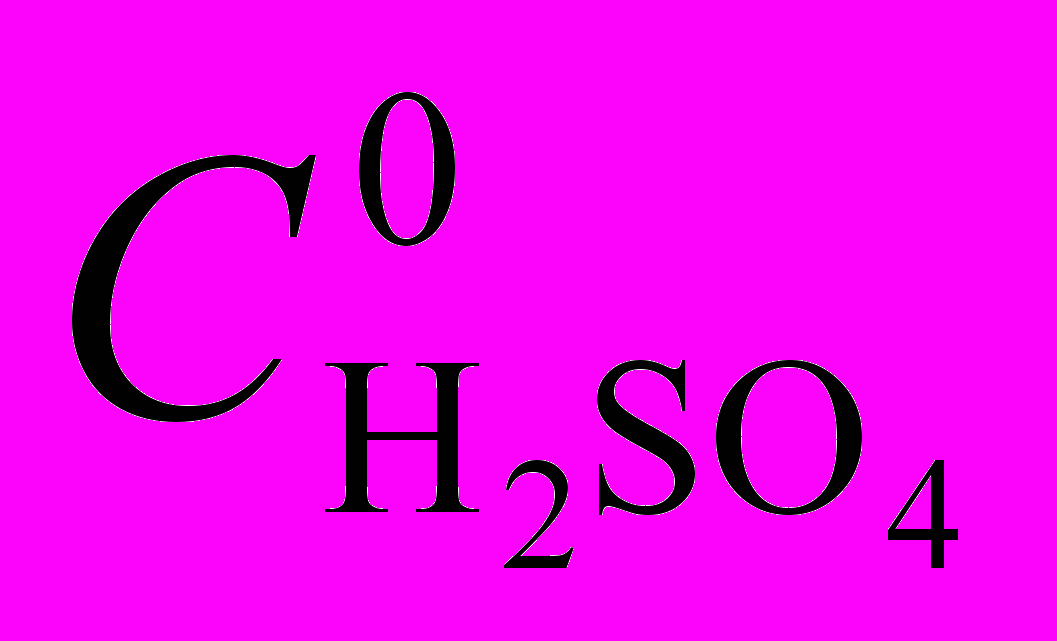 , моль/л , моль/л | k298.105,моль-2.л2.с-1 | Е, кДж/моль | S, Дж/моль.K |
| (Cl)MnOEP | 17,7818,12 | 2,06 0,10 | 68 2 | -114 6 |
| | 18,1218,66 | 0,13 0,06 | 72 3 | -123 10 |
| (AcO)MnOEP | 17,5518,03 | 1,37 0,10 | | |
| | 18,0318,66 | 0,12 0,01 | | |
Таблица 9. Кинетические параметры реакции комплексов марганца с октафенилтетразапорфиринами с 17,4 - 18,6 М H2SO4
| Комплекс | k298·104, с-1 | Е, кДжмоль | -S, ДжмольK |
| (Cl)MnIIIOPTAP | 2,9±0,2 | 70±2 | 83±6 |
| (N)MnVOPTAP | 0,0014±0,0001а | 124±3 | 32±9 |
| (Cl)MnIIIOBPTAP | 1,4±0,1а | 59±7 | 128±22 |
a определено экстраполяцией зависимости lg kэф – 1/T
Глава VI. Устойчивость марганецпорфиринов в растворах. 2,5,12,16,25,37 Полученный массив данных по скоростям и механизмам диссоциации комплексов использован для выявления факторов устойчивости комплексов марганца с порфиринами в растворах. Кроме того, для выяснения закономерностей влияния структурной модификации макроцикла на координационный центр и реакционную способность металлопорфиринов в отсутствие эффектов экранирования атома металла ацидолигандами в разделе VI.I изучены кинетика и механизмы реакций простых (не смешанных) комплексов порфиринов с кислотами в зависимости от функционального замещения в макроцикле. Исследованы
мезо-фенилзамещенные медь(II)- и палладий(II)октаэтилпорфирины и комплекс
CuButP IV 6,18,29,35,43. На количественном уровне показано, что факторы стабилизации комплексов в растворах разделяются на электронные и стерические.
Сравнение устойчивости проведено только для близких по структуре соединений с одинаковыми механизмами диссоциации или для однотипных комплексов при одинаковом составе протоно-донорного растворителя. Электронное влияние заместителей может способствовать кислотно-основным взаимодействиям марганецпорфирина с образованием H-ассоциатов или окислению по макроциклу. Эти процессы подробно рассмотрены ранее в главах II и IV. Такие взаимодействия с кислотами приводят к значительному увеличению устойчивости марганецпорфиринов.
В разделе VI.2 обсуждена взаимосвязь между природой функционального замещения в макроцикле и устойчивостью марганец(III)порфиринов в растворах. Комплексы марганца с октаалкилпорфиринами значительно устойчивее комплексов тетрафенилпорфина благодаря действию +I эффекта алкильных групп на связи Mn–N. При этом комплексы несимметричных порфиринов заметно устойчивее по сравнению с симметричными. В случае замещенных тетрафенилпорфиринов стабилизация достигается, напротив, при введении в фенильные кольца электроноакцепторных групп. Обнаружено, что химическая стабилизация или дестабилизация комплексов тетрафенилпорфина при введении одних и тех же заместителей в пиррольные и бензольные остатки макроцикла не только отличается количественно, но и может быть противоположной по знаку, например, при бром-замещении. В диссертации показано, что механизм влияния на координационный центр функциональных групп, расположенных в макроцикле или в фенильных мезо-заместителях макроцикла принципиально отличается. Заместители в макроцикле марганецтетрафенилпорфина оказывают электронное воздействие на связи Mn N, в то время как эффект от замещения в бензольных остатках затрагивает лишь n-электронные пары атомов N.
В разделе VI.3 дана количественная оценка взаимного влияния ацидолиганда и макроциклического лиганда в марганец(III)порфиринах. Скорость диссоциации комплексов по связям Mn–N увеличивается в ряду
(AcO)MnP < (Cl)MnP < (SCN)MnP в AcOH – H2SO4, при этом значения константы k298 изменяются в пределах одного порядка (см. пример в табл. 4). Прочность связи Mn с донорными атомами AcO наибольшая (бидентатная координация по данным ИК спектров).
Константы скорости диссоциации комплексов тетрафенилпорфина в конц. H2SO4, где они существуют при комнатной температуре в виде H-ассоциатов, в случае разных ацидолигандов очень близки, причем это справедливо и для (N)MnVTPP. Нивелирование различий в скорости диссоциации по связям Mn-N комплексов с различными ацидолигандами происходит благодаря образованию H-ассоциатов марганецтетрафенилпорфинами. Отметим, что (N)MnVTPP удалось переосадить на лед без разрыва связей Mn–N. Такой результат получен впервые. Комплексы марганца(III) разрушаются при переосаждении.
Стерические факторы устойчивости марганец(III)порфиринов, к которым относятся эффекты экранирования координационного центра и деформации ароматического макроцикла, рассмотрены в разделах VI.4 и VI.5.
Впервые проведена прямая количественная оценка макроциклического эффекта (МЦЭ) в процессе диссоциации комплексов протопорфирина 8,23 сравнением кислотности двух растворителей, в среде которых металлопорфирин и его ближайший нециклический аналог – соответствующий комплекс биливердина - диссоциируют с близкими скоростями. В этом случае исследован прямой МЦЭ, чего нельзя достичь, сравнивая устойчивость комплексов металла с порфирином и его аналогами – предельным тетраамином или аммиаком. Скорость диссоциации комплекса биливердина ((Cl)МnB) измерена в смешанном растворителе ДМСО – AcOH. В 100% AcOH этот комплекс диссоциирует при растворении. Сравнение кислотности смешанного растворителя AcOH – 8 M Н2SО4, в котором измерена скорость диссоциации (Cl)MnPP, и 100% AcOH показывает, что кинетическая устойчивость (Cl)MnPP в 17,3.107 раз больше, чем у (Cl)MnB. Это означает, что комплекс (Cl)MnPP стабилизируется за счет МЦЭ более чем в 17,3.107 раз. Реально это может быть еще большая величина, так как скорость диссоциации (Cl)MnPP в рассматриваемой среде меньше, чем скорость диссоциации (Cl)MnB в AcOH. Сравнением комплексов марганца(III) с - комплексами показано, что присутствие -электронной составляющей в устойчивости марганец(III)порфиринов увеличивает МЦЭ в процессе диссоциации в 2.104 раз.
Экранирование координационного центра марганец(III)тетрафенил-порфиринов ацидолигандом, макроциклом и объемистыми заместителями – адамантаноиламино-группами в орто-положениях фенильных колец приводит к изменению кинетических закономерностей реакции их диссоциации в конц. H2SO4 по сравнению с ранее рассмотренными марганецтетрафенилпорфиринами (уравнения 16, 17 и 18) 9,11. Обосновано, что диссоциация связей Mn–N становится возможной только после отщепления ацидо-лиганда X, которое происходит в медленной стадии, определяющей скорость всего процесса, подобно описанной выше реакции деструкции комплексов марганца с октафенилтетразапорфином.
Множественное функциональное замещение приводит к изменению устойчивости и появлению специфических черт суммарного механизма диссоциации металлопорфиринов не только благодаря действию электронных эффектов замещения, но и через деформацию макроцикла. По мере увеличения количества мезо-фенильных заместителей в (X)MnOEP облегчается диссоциация связей
Mn–N, что вызвано электроно-акцепторным действием фенильных групп и нарастающей деформацией макроцикла 48,49 .
Глава VII. Смешаннолигандная природа стабильных марганецпорфиринов. Реакции замещения малых ацидолигандов. Процессы аксиальной координации анионов, малых и больших молекул относятся к важнейшим в химии металлопорфиринов. Способность MP присоединять дополнительные лиганды определяет их роль в ферментативных и каталитических процессах. Явление координации лигандов металлопорфиринами служит также основой для получения новых комплексов и построения супрамолекулярных самосборных молекулярных ансамблей. Процессы аксиальной координации в случае комплексов высокозарядных катионов усложняются по сравнению с MIIP за счет более высоких координационных чисел комплексообразователей и возможных окислительно-восстановительных превращений центральных атомов. В последнее время эти реакции привлекают пристальное внимание.
В разделе VII.1 рассмотрены немногочисленные имеющиеся в литературе данные по изучению процессов аксиальной координации на марганецпорфиринах. Обсуждены собственные результаты исследования взаимодействия (AcO)MnOPTAP с тетрагидрофураном (ТГФ) в толуоле (реакции 22, 23) 44, которые далее использованы при обсуждении механизма реакции обмена ацидолигандами между комплексами марганца с порфиринами и порфиразинами.
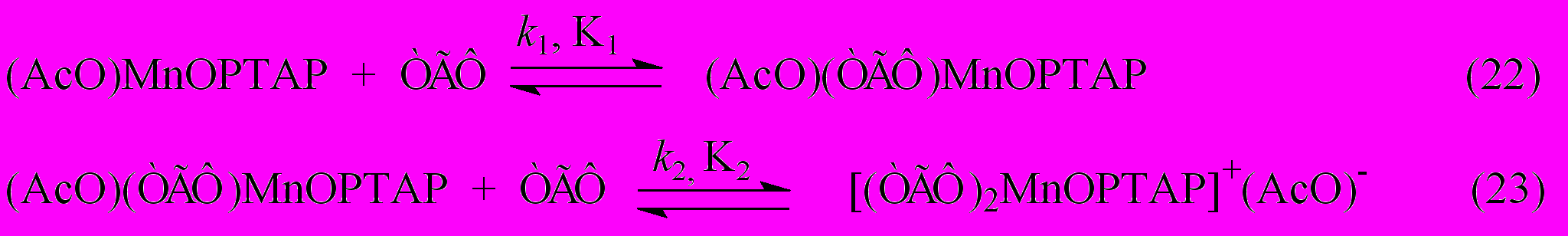
k1 = (3,0 0,3).10-4 с-1.моль-1.л, K1 = (44,4 5,7) л.моль-1, K2 = (2,10,5) л.моль-1.
Одним из особенных свойств марганецпорфиринов является способность к обмену ацидо-лигандами между комплексами марганца в устойчивых степенях окисления +3 и +5. Кроме марганца, подобные реакции обнаружены только для комплексов хрома. В диссертации обсуждены данные литературы по изучению процесса обмена между комплексами марганца и хрома с октаэтил- и тетрафенилпорфиринами. Представлены собственные результаты исследования реакции обмена ацидолигандами между комплексами марганца(V) и марганца(III)
с тетрафенилпорфином и октафенилтетразапорфиринами (уравнение 24, табл. 10) 34,39,40,45. Показаны особенности реакции с участием азапорфиринов, обусловленные -акцепторным влиянием мезо-аза-групп в марганецоктафенилтетразапорфине по сравнению с марганецпорфиринами.
| (N)MnVTPP + (X)MnIIIOPTAP  (N)MnVOPTAP + (X)MnIIITPP (N)MnVOPTAP + (X)MnIIITPP | (24) |
Кинетика реакции переноса атома азота между комплексами порфиринов и азапорфиринов исследована при различных соотношениях исходных концентраций комплексов. В большинстве случаев реагенты были взяты в сравнимых концентрациях или имелся лишь относительно небольшой (до десятикратного) избыток одного из них. В этих условиях реакция (24) имеет первый порядок по каждому из реагентов:
 (25)
(25)Таблица 10. Кинетические параметры реакций (N)MnVTPP с марганец(III)тетраза-порфиринами (СФ-26)
| Растворитель | X | k, моль-1.л.с-1 | E, кДж/моль | -ΔS, ДжмольK | ||
| 288 K | 298 K | 308 K | ||||
| (N)MnVTPP + (X)MnIIIOPTAP | ||||||
| CHCl3 | AcO | 162 | 233 | 376 | 315 | 14218 |
| | Cl | 233 | 445 | 706 | 415 | 8318 |
| | HSO4 | 11610 | 23224 | 50633 | 545 | 2518 |
| | SCN | 26828 | 49952 | 64646 | 3212 | 9341 |
| | N3 | 37638 | 51845 | 75641 | 263 | 11310 |
| ТГФ | AcO | 417318K | 121 | 212 | 43,12,3 | 86,78 |
| C6H6 | AcO | - | 454 | - | - | - |
| C6H5CH3 | AcO | 353 | 455 | 728 | 274 | 13015 |
| CH2Cl2 | AcO | 27129 | 50950 | 85944 | 42,73,8 | 57,212,6 |
| (N)MnVTPP + (Cl)MnIIIOBPTAP | ||||||
| CHCl3 | Cl | 151±14 | 233±24 | 438±37 | 40±9 | 74±30 |
Значения констант скорости реакции для бромзамещённого марганец(III)октафенилтетразапорфирина в 5-6 раз выше по сравнению с незамещённым комплексом при практически одинаковых активационных характеристиках благодаря –I-эффекту восьми атомов брома в фенильных кольцах макроциклического лиганда.
Реакция (2) необратима, т.е. (N)MnVOPTAP не обменивается лигандом N с другими комплексами марганца. Вмести с тем, он способен вступать в реакцию обмена аксиальными лигандами с порфириновым комплексом хрома(III) (реакция 26), k298 = (143 ± 11) моль-1с-1л, E = (52 ± 1) кДжмоль, S = (- 35 ± 2) ДжмольK.
| (N)MnVOPTAP + (AcO)Cr IIITPP (N)CrVTPP + (AcO)MnIIIOPTAP | (26) |
Мезо-азазамещение в порфириновом макроцикле, увеличивая положительный заряд на атоме металла-комплексообразователя, препятствует протеканию реакции (N)MnVOPTAP с (X)MnIIITPP. Положительный заряд на атоме хрома в комплексе (AcO)CrIIITPP больше, чем у марганца в (N)MnVOPTAP, что облегчает нуклеофильную атаку комплекса хрома атомом азота.
Анализ кинетических закономерностей реакции (24) в зависимости от природы ацидолиганда X, растворителя, функционального замещения в порфиразиновом комплексе и других факторов показывает, что наиболее вероятен механизм реакции, включающий стадию образования -нитридо-мостикового интермедиата в результате нуклеофильной атаки нитридным комплексом атома марганца(III) в составе (X)MnIIIOPTAP без предварительного образования катионного комплекса [MnIIIOPTAP]+ (уравнения 27, 28). Константа равновесия K1 входит в значение константы скорости k (уравнение 25), обуславливая зависимость скорости суммарного процесса от природы ацидолиганда X.
(N)MnVTPP + (X)MnIIIOPTAP
 [TPPMn...N...MnOPTAP]+X (27)
[TPPMn...N...MnOPTAP]+X (27)[TPPMn...N...MnOPTAP]+X
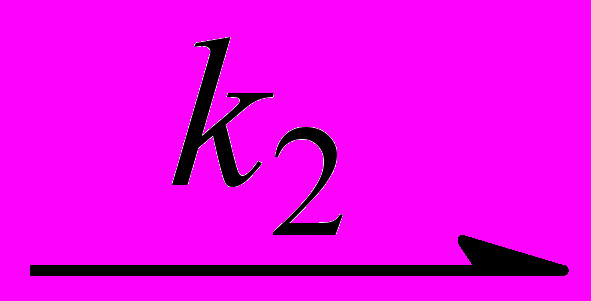 (X)MnIIITPP + (N)Mn VOPTAP (28)
(X)MnIIITPP + (N)Mn VOPTAP (28)Тетразапорфириновые комплексы (X)MnIIIOPTAP оказались гораздо более эффективными акцепторами нитридного атома азота, чем комплексы собственно порфиринов, например, октаэтилпорфина (X)MnIIIOEP, из-за повышения электрофильности металла-комплексообразователя. Более слабые -донорные свойства порфиразинового макроцикла по сравнению с порфириновым приводят к ослаблению нуклеофильных свойств атома азота в образующемся комплексе нитридомарганца(V), поэтому перенос N в системе (N)MnVTPP/(X)MnIIIOPTAP необратим в отличие от случая комплексов собственно порфиринов.
Глава VIII. Значение марганецпорфиринов в биологии и медицине. Модельная реакция марганецпорфиринов с пероксидом водорода. Марганец входит в состав сравнительно небольшого числа ферментов, но играет фундаментальную роль в биосфере, поскольку с его участием в зеленых растениях происходит фотохимическое восстановление воды, обеспечивающее выделение в атмосферу кислорода и поступление электронов в цепь переноса последних при фотосинтезе. Природные ферменты, в частности, каталазы и пероксидазы, не выделены в индивидуальном виде из-за их неустойчивости. Использование более простых моделей, в качестве которых могут выступать порфириновые комплексы марганца, позволяет исследовать механизмы реакций и оценить влияние различных факторов на каталитическую активность комплексных соединений, а также получить эффективные синтетические катализаторы различных процессов.
В этой главе рассмотрено влияние функционального замещения в порфириновом лиганде и природы ацидолиганда на кинетику и механизм реакции разложения пероксида водорода в присутствии марганец(III)порфиринов в водно-органической среде. Несмотря на сложность процессов с участием H2O2, применение этого окислителя перспективно с точки зрения развивающейся быстрыми темпами экологически чистой так называемой «зеленой химии».
До настоящего времени не создано строгой теории, позволяющей предсказать реакционную способность новых координационных соединений, в том числе порфириновых комплексов, и объяснить, с чем связаны различия в их каталитической активности в отношении разложения пероксида водорода. Предпринимались лишь отдельные попытки изучения влияния лигандного окружения центрального иона на его каталитическую активность и механизм разложения Н2О2. В подобной ситуации приобретает особое значение получение новых сведений по механизму каталазного действия (X)n-2MP, как соединений с регулируемой координационной насыщенностью центрального атома металла. В диссертации исследование каталазной активности марганецпорфиринов предварялось изучением их реакционной способности по отношению к самому пероксиду водорода. В большинстве случаев комплексы оказались неиндифферентными к воздействию H2O2.
В разделе VIII.1. приведены результаты исследования кинетики и механизма реакций окисления ацидопорфириновых комплексов марганца(III) пероксидом водорода (табл. 11, схема 5)
