Координационная химия и реакционная способность смешанных ацидопорфириновых комплексов марганца в растворах 02. 00. 01 неорганическая химия 02. 00. 04 физическая химия
| Вид материала | Автореферат |
- Рабочая программа дисциплины (модуля) «математический анализ», 424.74kb.
- Рабочая программа дисциплины (модуля) «Уравнения математической физики», 266.58kb.
- Рабочая программа дисциплины (модуля) «Линейная алгебра и аналитическая геометрия», 275.82kb.
- Координационные свойства комплексов меди и марганца с β-октаалкилпорфиринами и их мезо-фенильными, 305.31kb.
- Алкилиденанилины: структура и реакционная способность в гидрировании 02. 00. 03 органическая, 495.9kb.
- Утверждаю, 65.11kb.
- «Неорганическая химия», 1345.55kb.
- Рабочая программа дисциплина ‹‹Неорганическая химия›› опд. Ф. 02 Специальность 020101, 343.5kb.
- Химия и химическое образование на рубеже веков: смена целей, методов и поколений, 258.11kb.
- Конспект лекций по курсу «Неорганическая и аналитическая химия», 18.21kb.
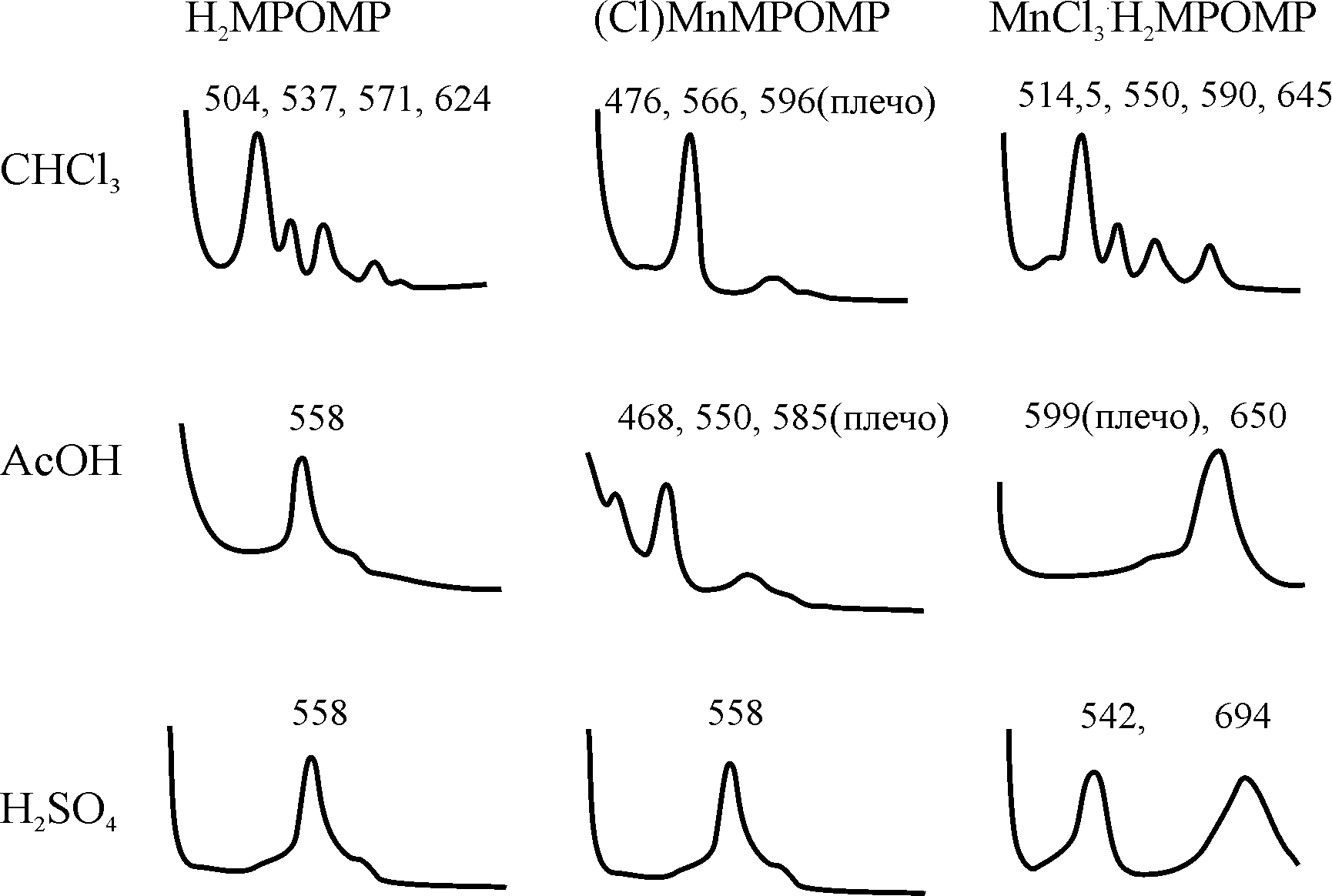
Рис. 2. ЭСП H2MPOMP и его комплексов в различных растворителях
Таблица 2. Химические сдвиги протонов (м. д.) в ПМР спектрах H2MPOMP и его
комплексов (вн. ст. ГМДС)
| Соединение и растворитель | мезо- | -СН3 | о- | м-, п- | NH |
| H2MPOMP CDCl3 | 10,13 с; 9,92 с | 3,58 с; 3,52 с; 2,46 с | 8,02 м | 7,75 м | -3,20 с; -3,30 с |
| H2MPOMP CDCl3+ 0,5%CF3COOH | 10,50 с; 10,37 с | 3,59 с; 3,53 с; 2,44 с | 8,26 м | 8,01 м | -2,99 с; -4,21 с |
| (Cl)MnMPOMP CDCl3 | 33,4; 30,5 | 1,56; 1,26; 0,88 | < - 3 | - | |
| MnCl3.H2MPOMP CDCl3 | 8,84 с | 1,56 с; 1,25 с; 0,86 с | 8,22 м | 7,75 м | -2,79 с |
| MnCl3.H2MPOMP CDCl3+ 0,5%CF3COOH | 8,60 с | 1,59 с; 1,25 с; 0,86 с | 7,99 м | 0,39 с | |
Глава IV. Закономерности образования и количественная характеристика кислотно-основных форм марганецпорфиринов в растворах. Установление природы частиц, образующихся при растворении (X)MnP в кислотных растворителях, имеет первостепенное значение для разработки вопросов реакционной способности комплексов. В главе IV демонстрируется многообразие таких частиц, по составу гораздо более сложных по сравнению с продуктами простых кислотно-основных равновесий. Впервые обнаружена обратимая реакция одноэлектронного окисления макроциклического лиганда в составе комплексов марганца(III) с этиопорфирином I, его аналогами с пропильными и бутильными группами вместо этильных и с 3,7,12,18-тетраметил-2,8,13,17-тетра(н-бутил)-порфином (H2But IV) в смешанном растворителе AcOH – H2SO4 47,50. -Катион-радикальная форма идентифицируется по электронному спектру поглощения (кривая 2 на рис. 3). Константа равновесия редокс-реакции при 298 K равна
(0,25 0,06) л.моль-1 в случае (Cl)MnBut IV.
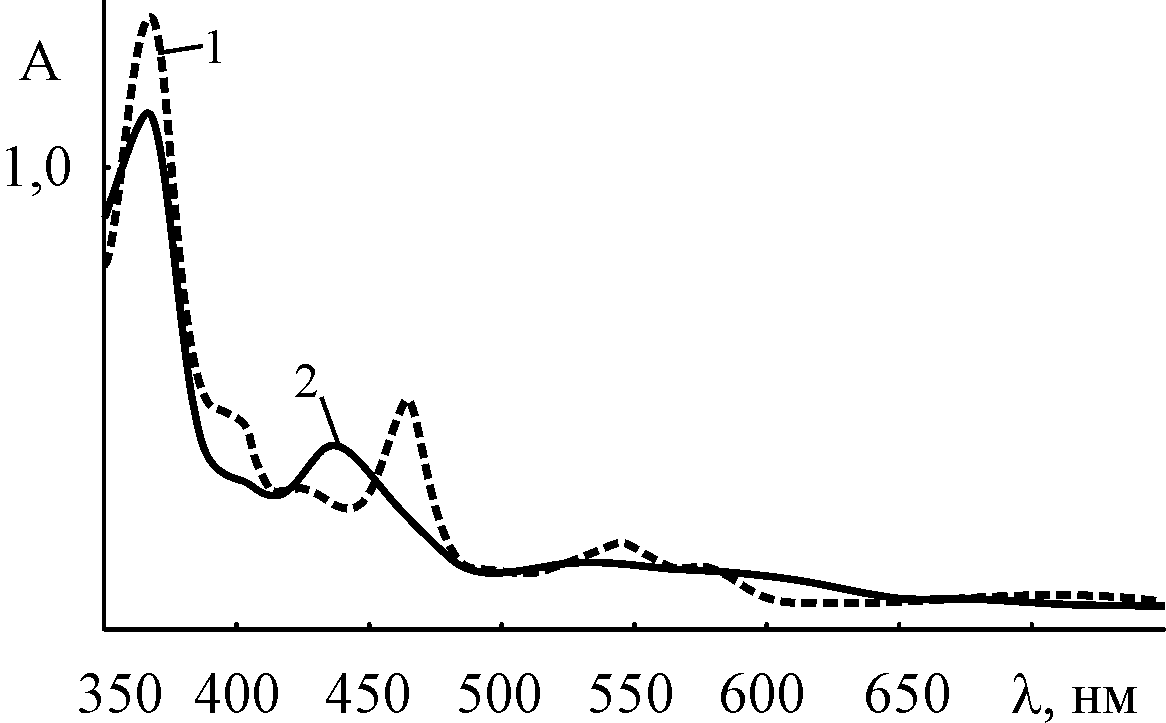 | 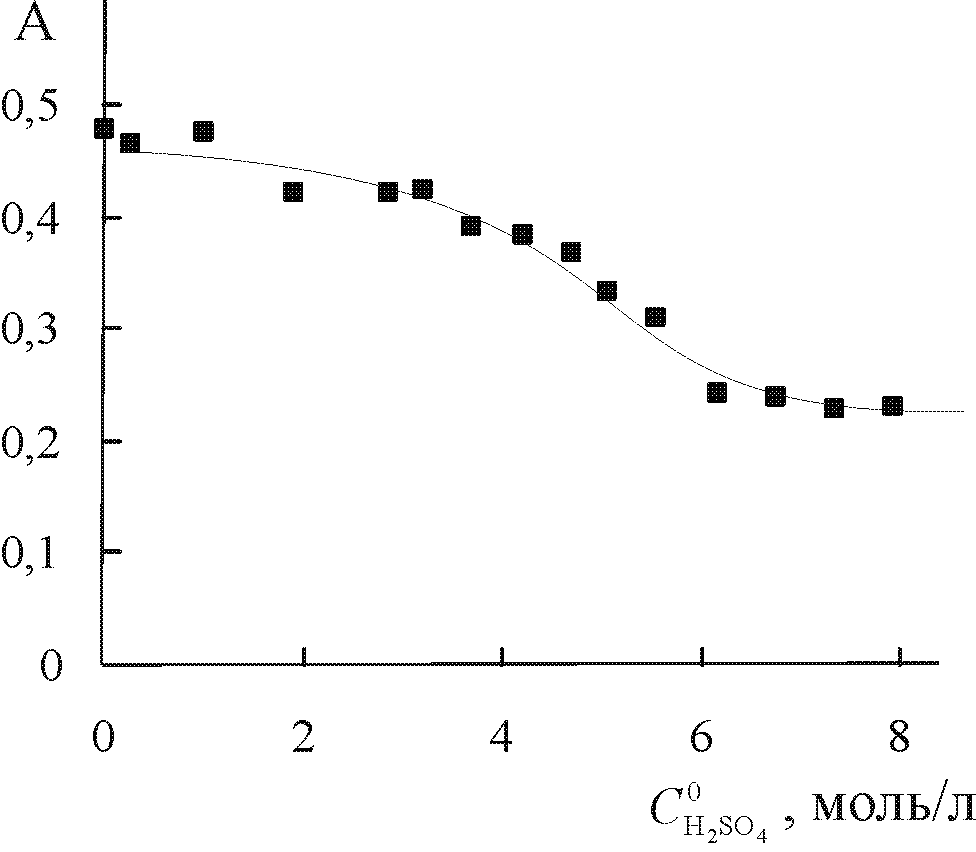 |
| Рис. 3. ЭСП (Cl)MnButP IV в AcOH (1) и AcOH – 6,5M H2SO4 (2) | Рис. 4. Зависимость оптической плотности раствора (Cl)MnButP IV в AcOH – H2SO4 от 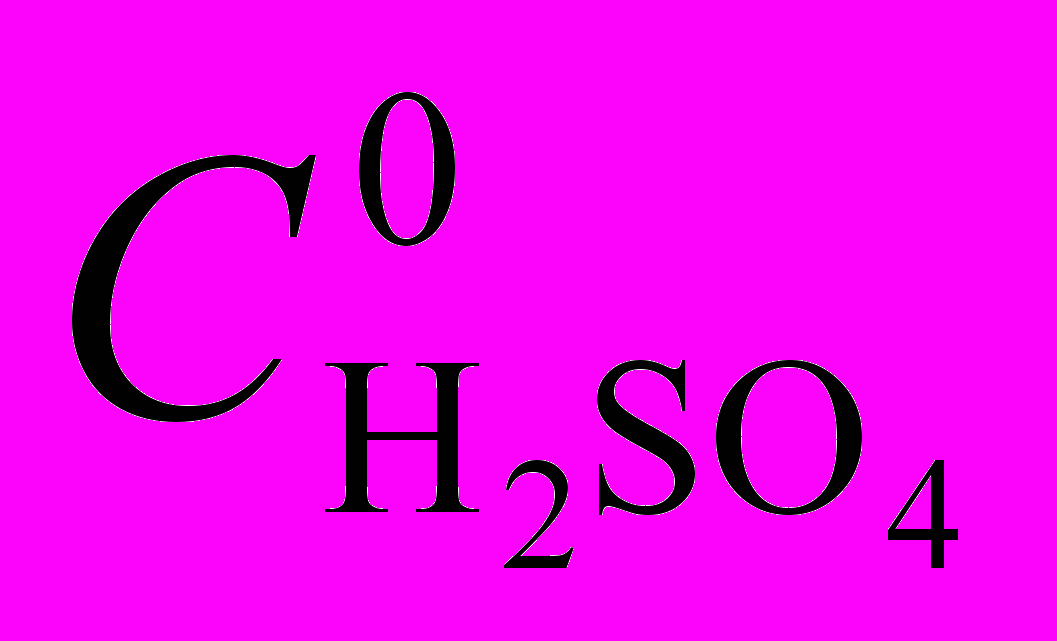 . T = 298 K, = 465 нм. . T = 298 K, = 465 нм. |
Обосновано положение о том, что способность к образованию -катион-радикальных форм марганец(III)порфиринами связана с исчерпывающим β-ал-кильным замещением молекулы и накачкой электронной плотности в макрокольцо, что определяет его электроноизбыточное состояние. В особенности это относится к метильному замещению.
Обнаружен первый пример окисления центрального атома в марганец(III)порфирине в сернокислых растворах 46,47 (раздел IV.2). Комплекс марганца(III) с 2,7,12,17-тетраметил-3,8,13,18-тетра(н-бутил)порфином ((Cl)MnBut I) устойчив в AcOH. Он не разрушается и в конц. H2SO4, как и в смешанном растворителе AcOH–H2SO4 при нагревании, однако его спектр резко отличается от спектров, известных для порфиринов и марганец(III)порфиринов в кислотах [max, нм (lg ) в H2SO4: 427 (5,03), 571 (3,93), 620 (3,82), 768 (3,79)]. При растворении комплекса в деаэрированной серной кислоте спектральная картина иная, образования продукта с упомянутым ЭСП не наблюдается. Для реакции в AcOH–H2SO4 обнаружена линейная зависимость отрицательного логарифма константы скорости при 298 K от функции кислотности смешанного растворителя H0 с тангенсом угла наклона прямой близким к двум:
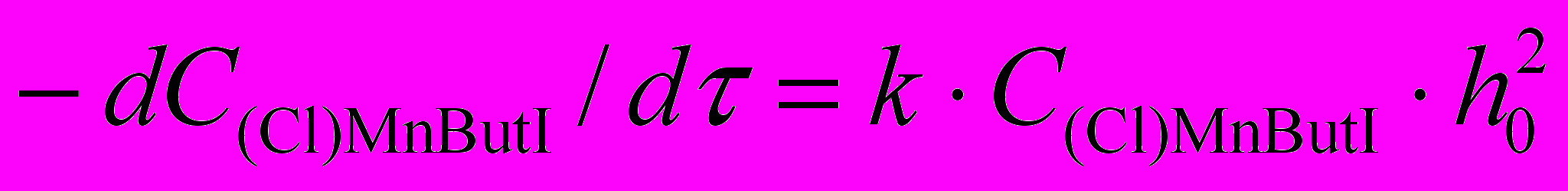 , где h0 – кислотность среды.
, где h0 – кислотность среды.В ЭПР спектре свежеприготовленного раствора (Cl)MnButP I в H2SO4 при 293 K регистрируется узкий сигнал (g = 2,0012). Он свидетельствует об изменении степени окисления центрального атома в комплексе при растворении в кислоте, т. к. для марганец(III)порфиринов, как и других систем с высокоспиновой d 4 электронной конфигурацией, регистрация ЭПР спектров невозможна. Продукт с max 427–429 нм устойчив в смешанном растворителе AcOH–H2SO4 и в конц. H2SO4 на холоду в течение длительного времени (более 3 месяцев) и при нагревании. В результате его переосаждения из H2SO4 на лед выделен марганец(III)порфирин. Приведенные в диссертации результаты спектральных (ЭСП, ЭПР) и кинетических исследований, а также анализ литературных данных по структуре и спектрам марганецпорфиринов (главы I и II) позволяют заключить, что при растворении комплекса (Cl)MnButP I в конц. H2SO4 или ее смесях с AcOH наблюдается одноэлектронное окисление центрального атома Mn кислородом в присутствии сольватированных протонов до оксо-комплекса (O)MnIVButP I.
| В разделе IV.3 обсуждены условия образования протонированных форм марганецтетрафенилпорфиринов. При растворении в конц. H2SO4 (15–18,6 М) тетрафенилпорфин (H2TPP), ряд его функциональных производных и комплексов с металлами, в том числе с Mn, дают ассоциат с протоном кислоты (X)n-2MTPP…H+…A (A – анион или молекула кислоты), отличимый по характерному ЭСП с двумя широкими полосами в видимой области 1,17,21,22 (рис. 5). | 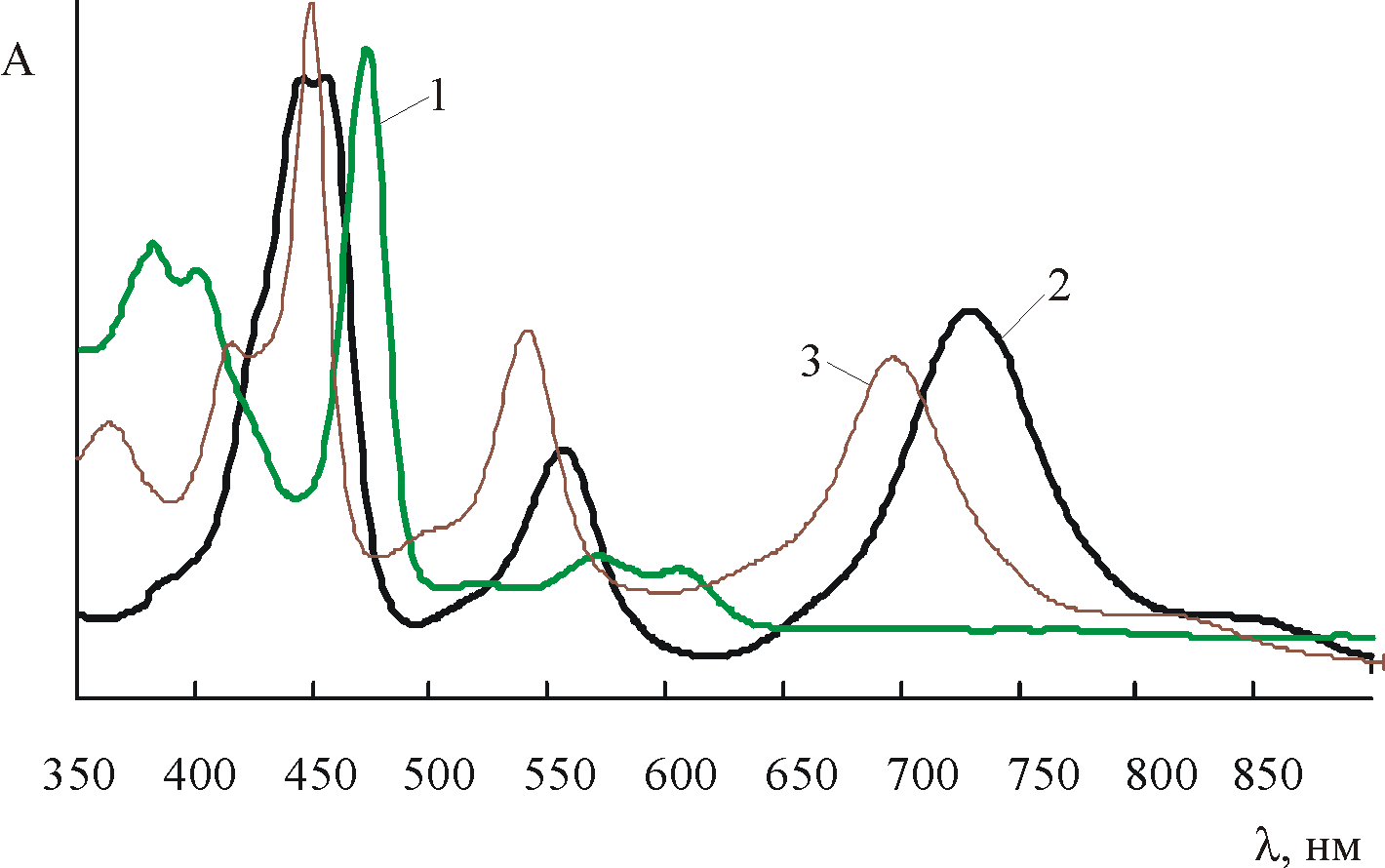 |
| Рис. 5. ЭСП (Cl)MnT(4-Br)PP в AcOH (1) и конц. H2SO4 (2); (N)MnTPP в конц. H2SO4 (3). |
В разделе IV.4 рассмотрены кислотно-основные превращения SAT комплекса марганца с монофенилоктаметилпорфином 24,28,31. SAT комплекс MnCl3.H2MPOMP устойчив на воздухе в твердом виде и в растворах, не содержащих кислоту. При добавлении кислот к раствору ЭСП исходного комплекса в органическом растворителе переходит в спектр новой формы с одной интенсивной полосой при 648658 нм в зависимости от природы и концентрации кислоты (рис.2). Спектрофотометрическим титрованием хлороформного раствора MnCl3.H2MPOMP ледяной AcOH определена стехиометрия процесса протонирования и константа равновесия, равная (0,70,2) л2.моль-2. В концентрированной водной серной кислоте происходит дальнейшее протонирование дикатиона SAT комплекса. В ЭСП этой устойчивой формы присутствуют две широкие интенсивные полосы при 542 и 694 нм (рис. 2). Такой спектр характерен для Н-ас-социатов металлопорфиринов и тетрафенилпорфина, образующихся в растворах с высокой концентрацией протонов. При нагревании растворов ЭСП закономерно переходит в однополосный спектр дважды протонированного SAT комплекса. Показано, что переход от H-ассоциата [MnCl3.H4MPOMP]2+…H+Solv к неассоциированной форме объясняется сульфированием фенильного остатка в комплексе и связанным с этим понижением основности макроцикла (константа скорости реакции k298 = (18,0 0,7).10-9 л2моль-2с-1, E = (88,5 0,5) кДж/моль, S = (- 103 2) Дж/моль.K).
В диссертации обоснована суммарная схема химических превращений комплекса MnCl3.H2MPOMP (схема 3).
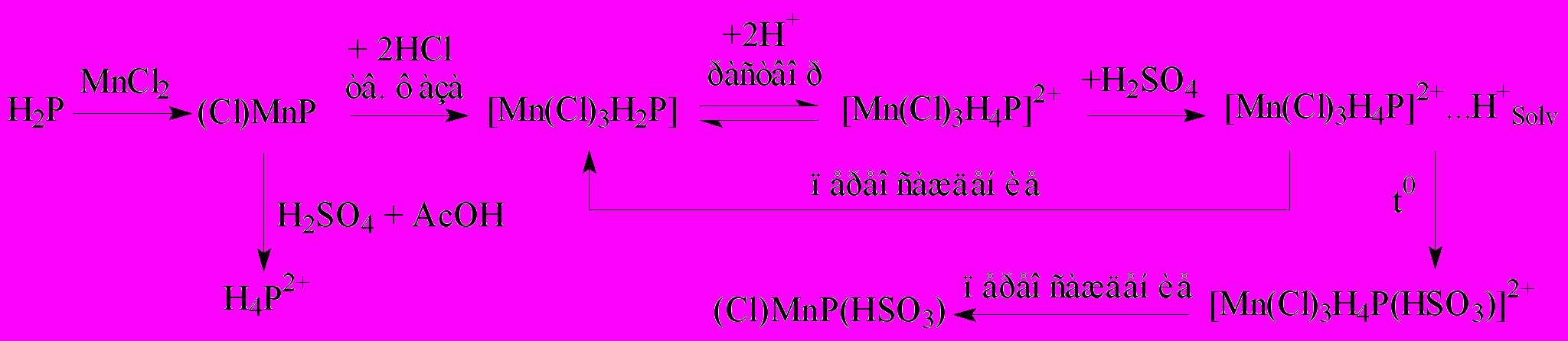
Здесь P – дианион монофенилоктаметилпорфина
Схема 3. Синтез и химические превращения SAT комплекса MnCl3.H2MPOMP
Таким образом, сочетание в структуре порфирина одного электроноакцепторного фенила и восьми электронодонорных метилов в качестве функциональных заместителей приводит к появлению у него уникальной способности – образовывать в молекулярном состоянии устойчивый SAT комплекс, обладающий основными свойствами и образующий за счет протонирования несколько устойчивых форм в протолитических растворителях.
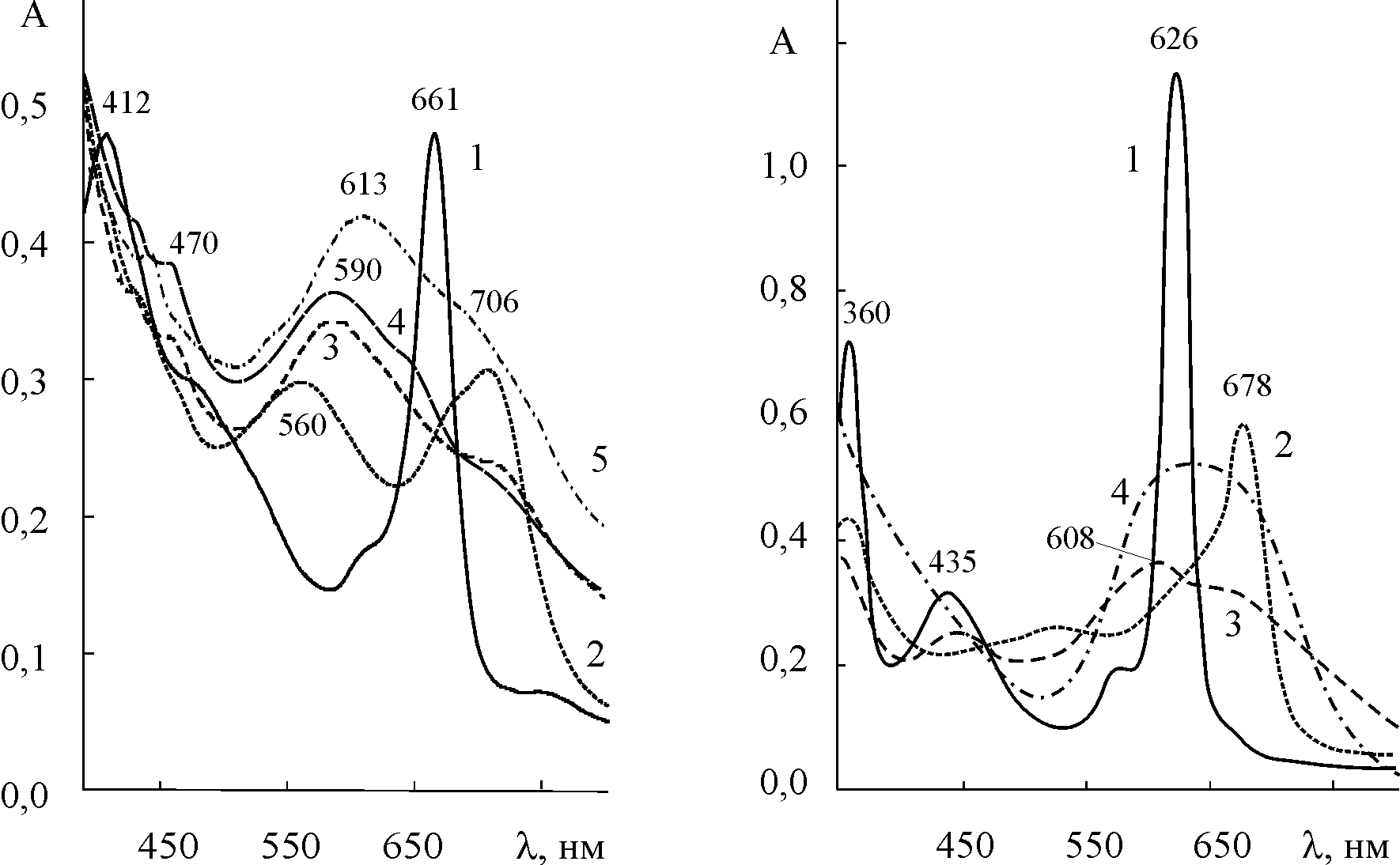
В разделе IV.5 приведены результаты исследования кислотно-основных взаимодействия комплексов октафенилтетразапорфина с марганцем в степенях окисления +3 и +5 в среде кислот 26 (рис. 6).
| а | б |
| Рис. 6. а) ЭСП (Cl)MnIIIOPTAP в CH2Cl2 – CF3COOH, 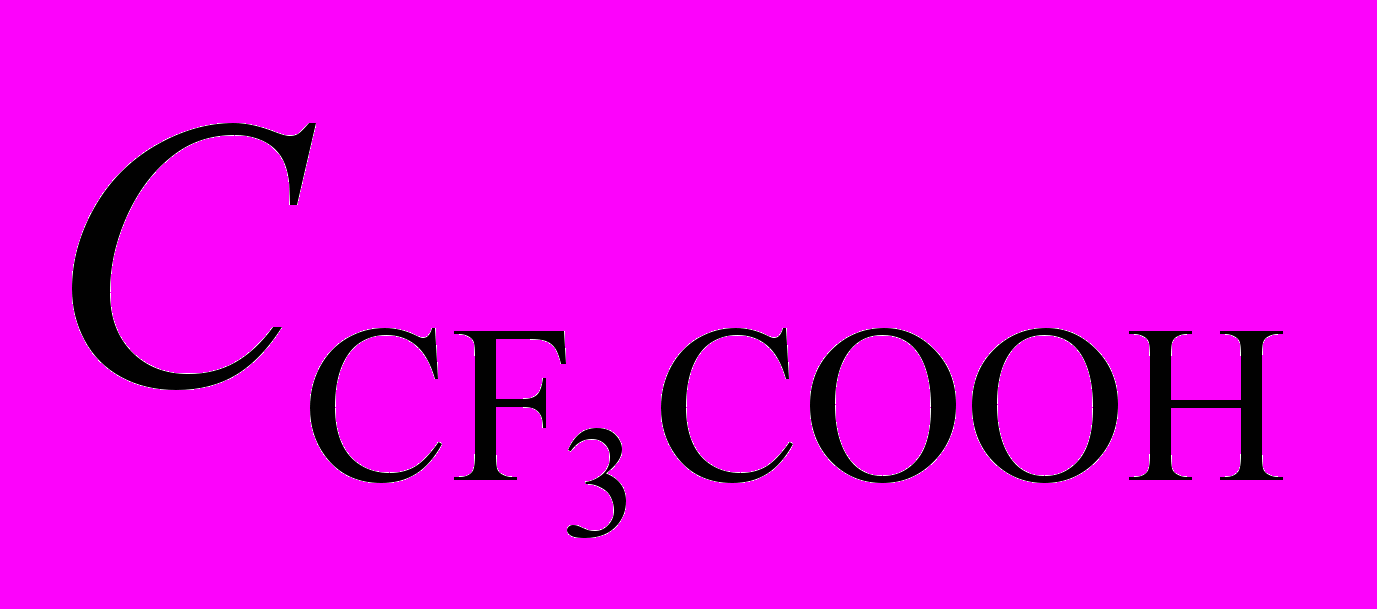 , моль/л: 0 (1), 0,5 (2), 5,8 (3), 13,47 (4) и в H2SO4 (17,70 моль/л) (5); б) ЭСП (N)MnVOPTAP в CH2Cl2 – CF3COOH, , моль/л: 0 (1), 0,5 (2), 5,8 (3), 13,47 (4) и в H2SO4 (17,70 моль/л) (5); б) ЭСП (N)MnVOPTAP в CH2Cl2 – CF3COOH, 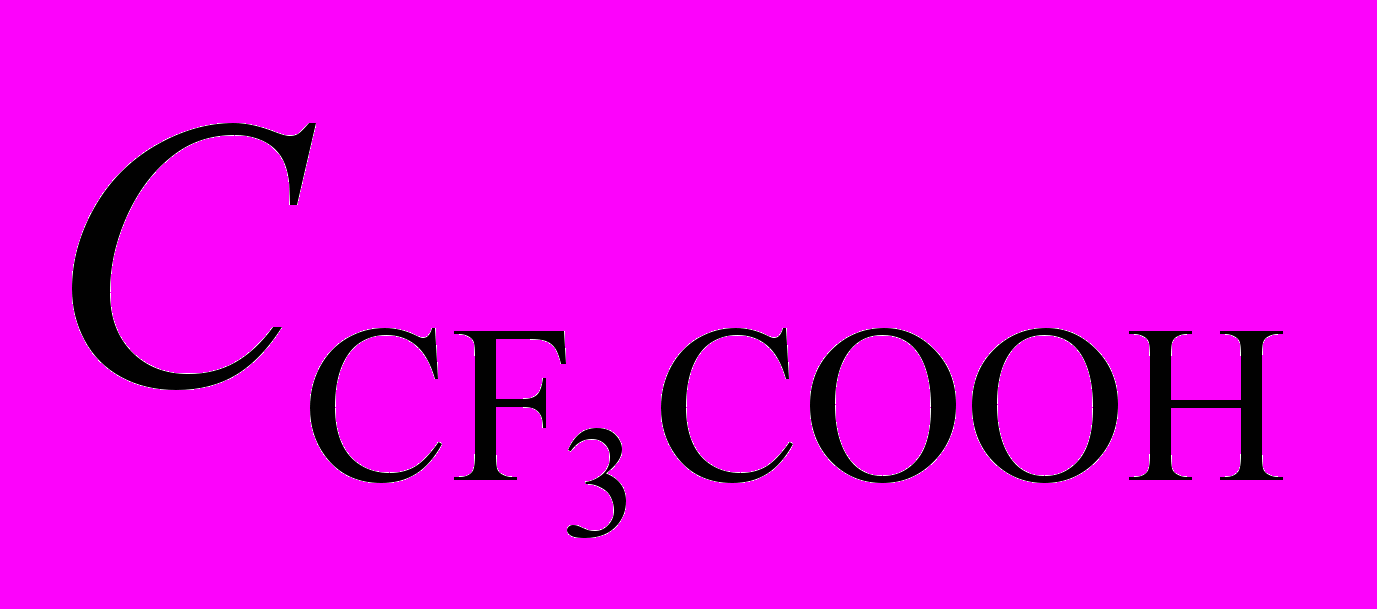 , моль/л: 0 (1), 0,1 (2), 13,47 (3) и в H2SO4 (17,79 моль/л) (4) , моль/л: 0 (1), 0,1 (2), 13,47 (3) и в H2SO4 (17,79 моль/л) (4) | |
Показатели ступенчатых констант, найденных спектрофотометрическим титрованием растворов марганецоктафенилтетразапорфинов трифторуксусной кислотой в дихлорметане, равны: pK1 = 0,29 0,01; pK2 = - 0,62 0,08 для комплекса марганца(III) и pK1 = 0,99 0,02; pK2 = - 0,70 0,03 для комплекса марганца(V). Размерность K - л.моль-1. Меньшая основность мезо-атомов азота в (Cl)MnOPTAP по сравнению с аналогичными комплексами p-металлов [докт. дисс. Стужина П. А., Иваново, 2004 г.] отражает вклад прямой дативной -связи азотметалл (a2ud) и -связи (N
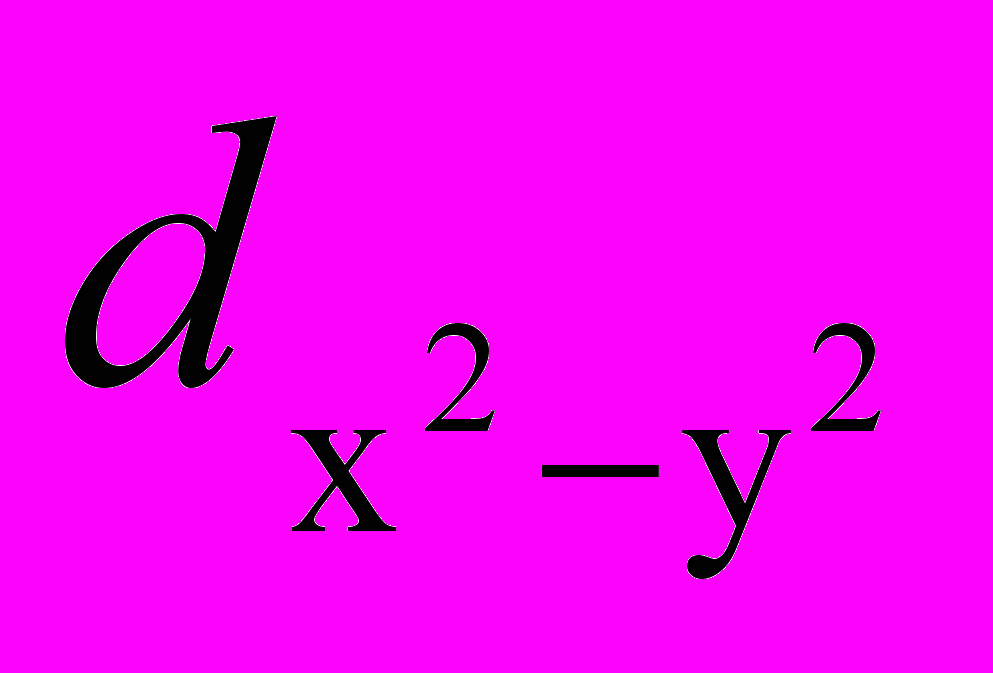 ) в случае комплекса марганца(III). Значение pK1 для (N)MnOPTAP выше, чем для (Cl)MnOPTAP. Т. е. в комплексе марганца(V) основность внешнециклических атомов азота выше, чем в комплексе марганца(III), что объяснено в диссертации различными свойствами катионов с электронной конфигурацией d 2 и d 4, а также сильным влиянием электроно-донорного нитридного лиганда. Координация последнего приводит к заселению d орбиталей марганца(V), что уменьшает эффект дативной -связи, понижающий основность в случае марганца(III). Значения pK2 для комплексов марганца с центральным атомом в различных степенях окисления очень близки, следовательно, взаимодействие одного из мезо-атомов азота макроцикла с протоном нивелирует влияние экстралиганда и степени окисления марганца на основность второго мезо-атома азота.
) в случае комплекса марганца(III). Значение pK1 для (N)MnOPTAP выше, чем для (Cl)MnOPTAP. Т. е. в комплексе марганца(V) основность внешнециклических атомов азота выше, чем в комплексе марганца(III), что объяснено в диссертации различными свойствами катионов с электронной конфигурацией d 2 и d 4, а также сильным влиянием электроно-донорного нитридного лиганда. Координация последнего приводит к заселению d орбиталей марганца(V), что уменьшает эффект дативной -связи, понижающий основность в случае марганца(III). Значения pK2 для комплексов марганца с центральным атомом в различных степенях окисления очень близки, следовательно, взаимодействие одного из мезо-атомов азота макроцикла с протоном нивелирует влияние экстралиганда и степени окисления марганца на основность второго мезо-атома азота.Cодержание IV главы демонстрирует наличие у марганецпорфиринов свойств многоцентровых слабых оснований. Локализация взаимодействия с протоном в среде кислот, как и устойчивость протонированных форм (константа основности) резко зависят от состава и стехиометрии координационных сфер, а также от типа функционального замещения макроциклического лиганда. Данные по кислотно-основным свойствам марганецпорфиринов получены впервые и использованы при исследовании фундаментальных свойств ароматических комплексов Mn – устойчивости координационных сфер и механизмов диссоциации комплексов. Все данные, представленные в последующих главах, где приведены результаты исследования диссоциации марганецпорфиринов, относятся к конкретной нейтральной или протонированной форме комплексов.
Глава V. Кинетика и механизмы диссоциации марганецпорфиринов в протолитических растворителях. Процессы диссоциации металлопорфиринов проходят в среде концентрированных сильных кислот и за редким исключением являются необратимыми (уравнение 4). Необратимость реакции не позволяет исследовать ее термодинамику. Скорость реакции (4) измерена для многих порфириновых комплексов в условиях избыточной концентрации сольватированных протонов (H+solv) по отношению к металлопорфирину.
| (X)m-2MnP + 4H 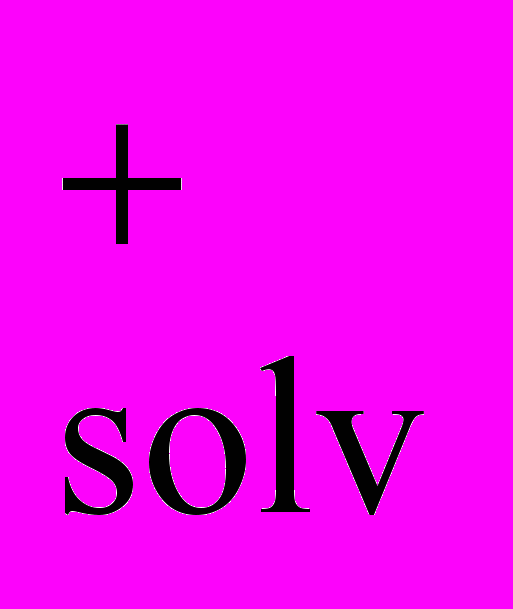 H4P2+ + Mn H4P2+ + Mn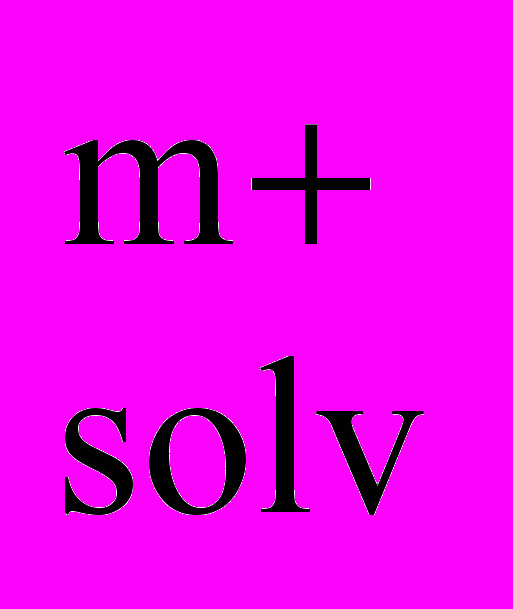 + (m-2)X- + (m-2)X- | (4) |
Использование смешанных растворителей с различной кислотностью дает возможность получить кинетические параметры реакций распада как лабильных, так и стабильных комплексов.
Систематическое изучение кинетики диссоциации комплексов в зависимости от строения, температуры и кислотности среды, проведенное в работе на примере комплексов Mn, позволило подойти к трактовке механизма реакции. Разнообразие структур марганцевых комплексов с порфиринами обуславливает появление новых закономерностей кинетики реакций их диссоциации и широкой вариации количественных параметров последних. Рассмотрению этих вопросов посвящена пятая глава диссертации.
V.1. Лабильные порфириновые комплексы марганца(II) 2,5. Марганец(II)порфирины существуют только в бескислородных условиях. Они устойчивы в нейтральных и щелочных растворах, однако легко распадаются на порфирин и катион Mn2+ в слабокислых средах.
V.2. Стабильные марганецпорфирины. Стабильными являются порфириновые и порфиразиновые комплексы марганца(III) и нитридомарганца(V). Они не разрушаются в апротонных растворителях и лишь в растворах с высоким содержанием протонов диссоциируют по связям Mn–N по уравнению (4). Индивидуальный или смешанный протолитический растворитель одновременно выступает в качестве реагента в реакции диссоциации комплекса.
Марганец(IV)порфирины устойчивы лишь при низких температурах (195 K) в инертных растворителях. Они легко восстанавливаются без разложения до марганец(III)-производных, со скоростью, сильно зависящей от растворителя и температуры. Известная устойчивость электронной конфигурации d 3, а также полученные нами результаты исследования комплекса (Cl)MnBut I в сильных кислотах (глава IV) позволяют предполагать, что связи Mn–N в порфириновых комплексах марганца(IV) очень устойчивы к воздействию H+. Легкость восстановления MnIVP в MnIIIP объясняется, очевидно, предпочтительностью d 4 конфигурации атома Mn из-за возникновения переноса электронной плотности с ароматического макроцикла на атом Mn (прямая дативная -связь) в MnIIIP благодаря наличию высокой -электронной плотности и поляризуемости связей и макроцикла в целом.
Исследование диссоциации металлопорфиринов по связям металл – азот порфирина и металл – донорный атом аксиального лиганда способствует пониманию природы и закономерностей изменения электронного состояния координационных центров соединений в зависимости от их строения. Это именно та реакция и тот реакционный центр, влияние на которые функционального замещения в макроцикле и структуры молекул в целом можно измерить количественно. В настоящей работе на примере ацидопорфириновых комплексов марганца(III) впервые проведено систематическое изучение устойчивости (кинетической инертности) смешаннолигандных ацидопорфириновых комплексов высокозарядного катиона в зависимости от структуры макроцикла.
V.2.1. Cостояние и кинетика диссоциации марганец(III)порфиринов в
смешанных протоно-донорных растворителях.
Комплексы тетрафенилпорфина и его функциональных производных 5,17,20,27,41. Исследование кинетики диссоциации (X)MnIIITPP проводилось ранее лишь в узких диапазонах концентраций протона в протолитической среде. Диссоциация комплекса (Cl)MnIIITPP в нашей работе изучена в максимально возможном широком диапазоне составов смешанного растворителя AcOH - H2SO4 (рис. 7, 8), что позволило определить кинетическое уравнение реакции (5) 27.
 | (5) |
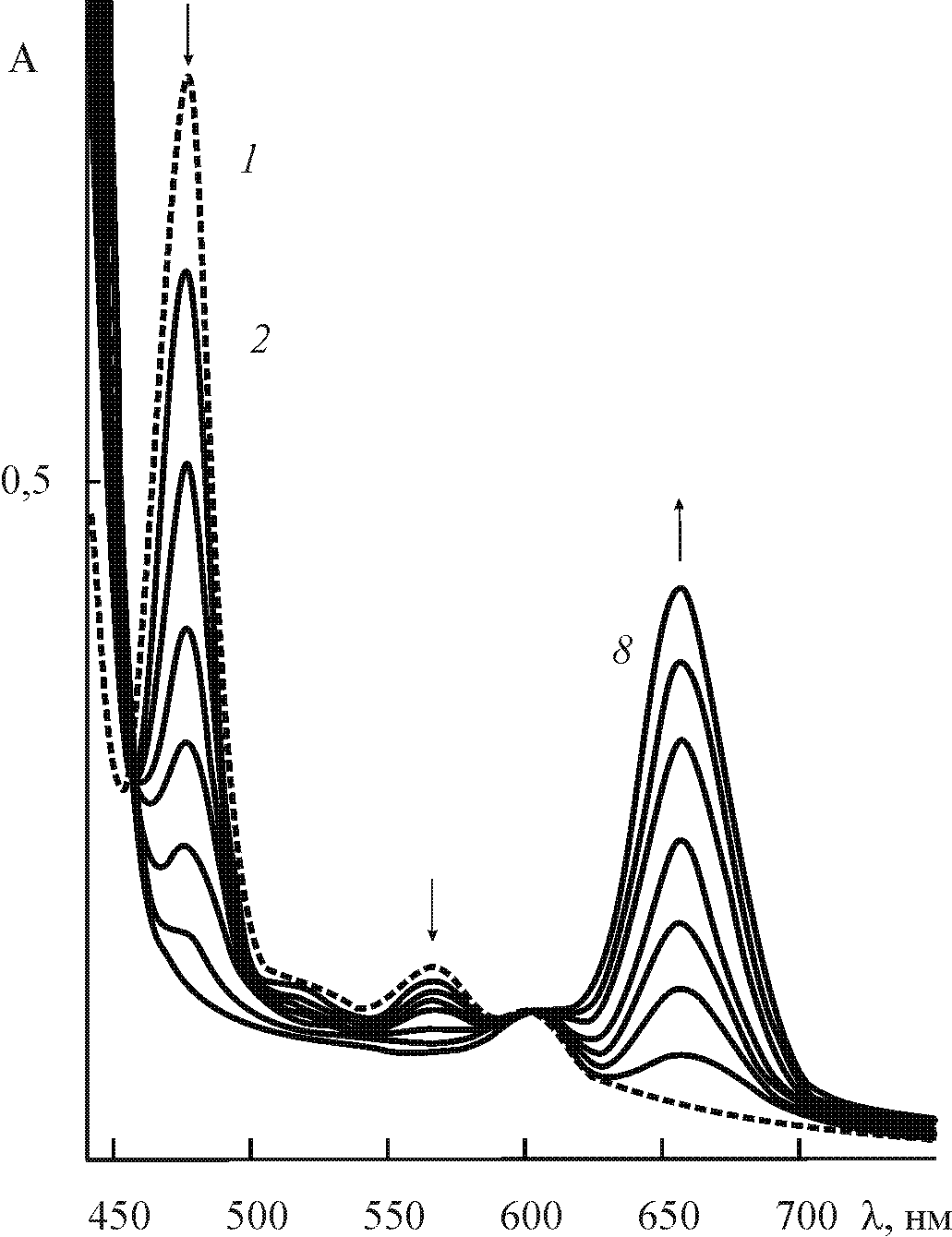 | 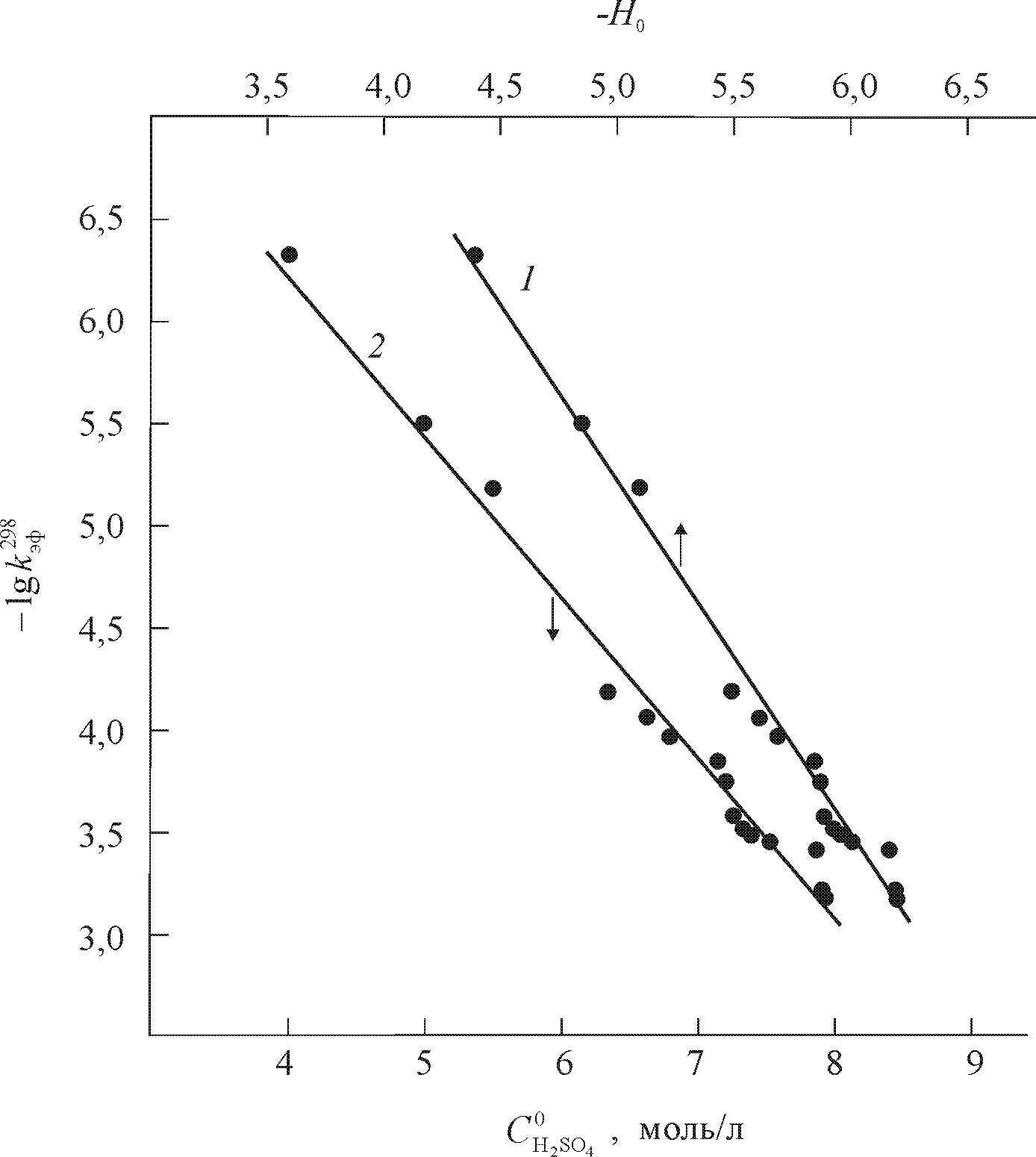 |
| Рис. 7. ЭСП (Cl)MnTPP в процессе термостатирования при 298 K в смешанном растворителе AcOH – 4,0 моль/л H2SO4 ( 1) и AcOH – 7,1 моль/л H2SO4 (2 – 8). | Рис. 8. Зависимость логарифмов эффективных констант скорости диссоциации (Cl)MnTPP при 298 K от функции кислотности растворителя ( 1) и начальной концентрации H2SO4 в AcOH (2). |
| | Кинетические закономерности диссоциации марганец(III)порфиринов в смешанных растворителях AcOH - 48 моль/л H2SO4 - первый порядок реакции по концентрации комплекса, второй – по 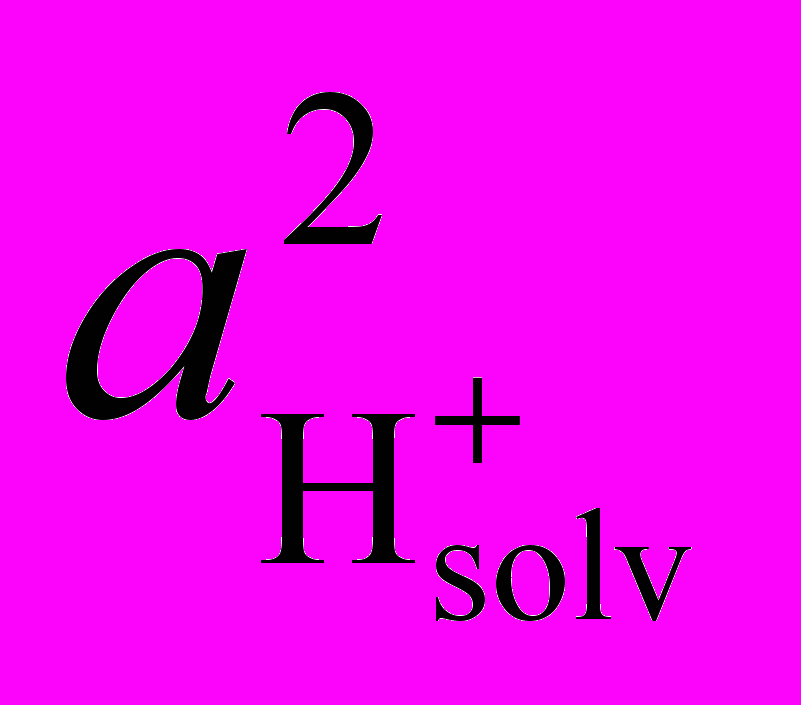 , высокие значения энергии активации, отрицательные величины изменения энтропии активации - хорошо трактуются с учетом элементарных стадий (6 – 9). В равновесии (6) основанием может выступать также молекула H2SO4 (автопротолиз). Уравнение скорости (10) для лимитирующей стадии (7) после учета равновесия (6) совпадает с экспериментальным (уравнения 11 и 5). На скоростьопределяющей стадии (7) молекула H2SO4, выступая как двухосновная кислота, протонирует два противоположных атома N, что приводит к диссоциации двух связей Mn-N за вершиной потенциального барьера. Предполагаемое переходное состояние представлено схемой 4. , высокие значения энергии активации, отрицательные величины изменения энтропии активации - хорошо трактуются с учетом элементарных стадий (6 – 9). В равновесии (6) основанием может выступать также молекула H2SO4 (автопротолиз). Уравнение скорости (10) для лимитирующей стадии (7) после учета равновесия (6) совпадает с экспериментальным (уравнения 11 и 5). На скоростьопределяющей стадии (7) молекула H2SO4, выступая как двухосновная кислота, протонирует два противоположных атома N, что приводит к диссоциации двух связей Mn-N за вершиной потенциального барьера. Предполагаемое переходное состояние представлено схемой 4. | 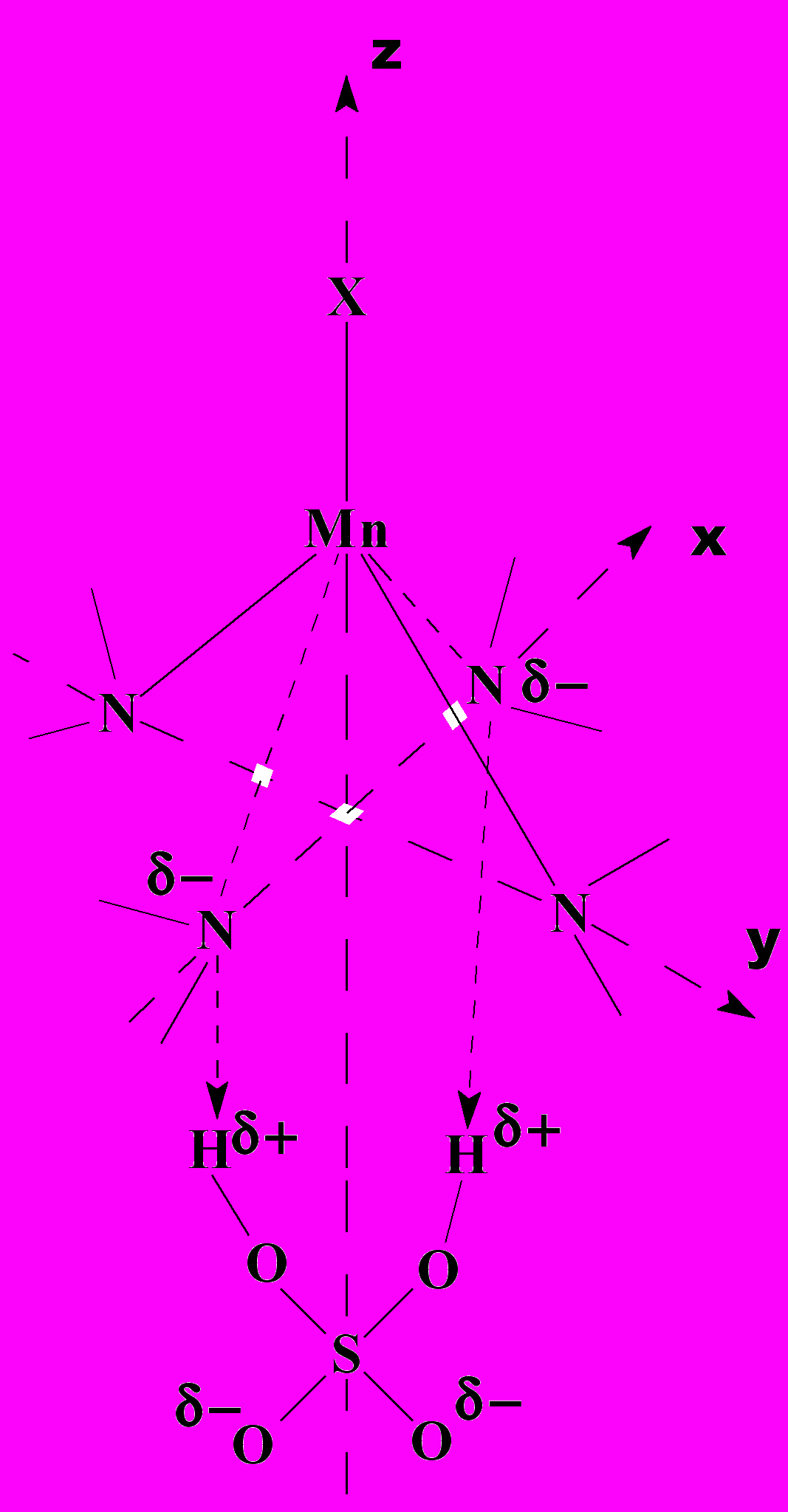 Схема 4. Переходное состояние лимитирующей стадии реакции SE2 диссоциации марганецпорфиринов | ||
|---|---|---|---|---|
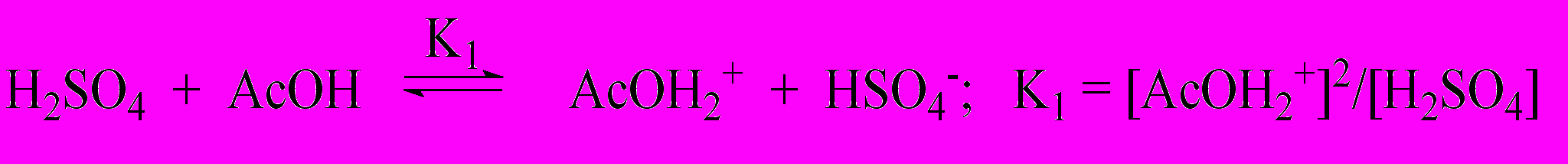 | (6) | | ||
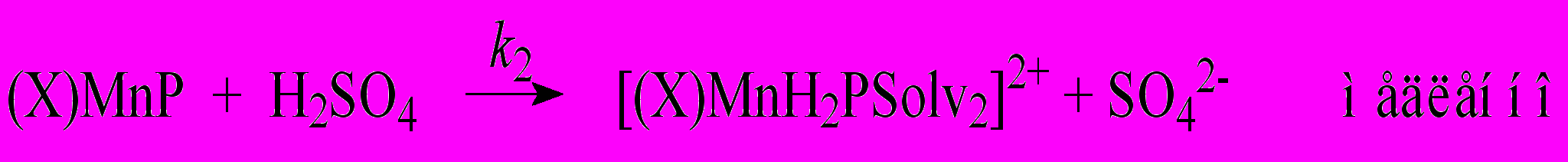 | (7) | | ||
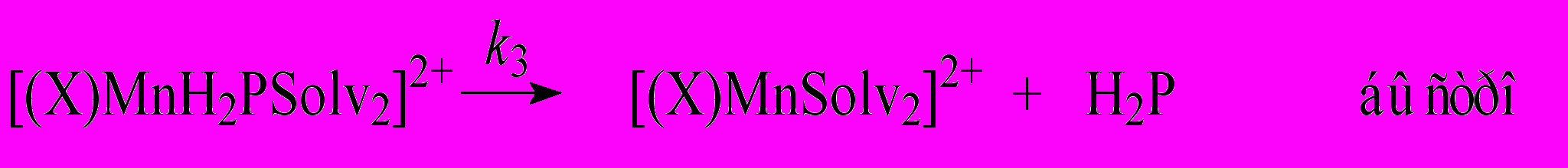 | (8) | | ||
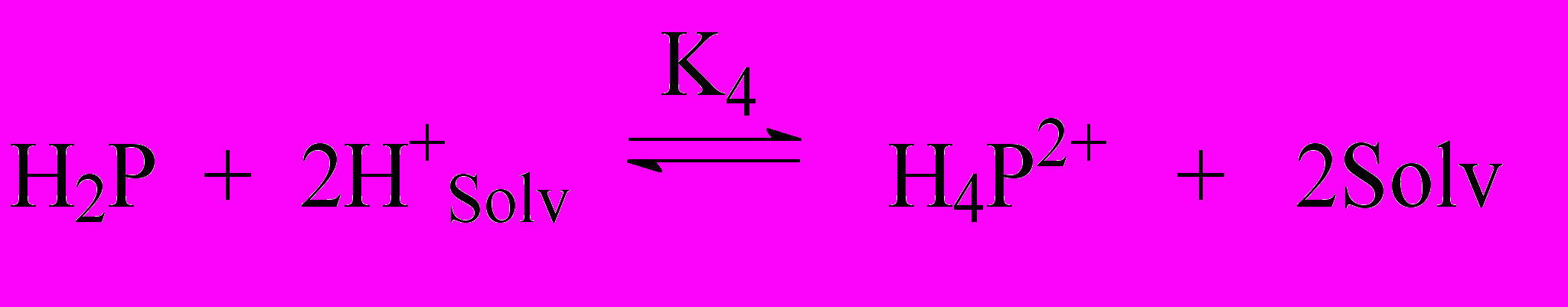 | (9) | | ||
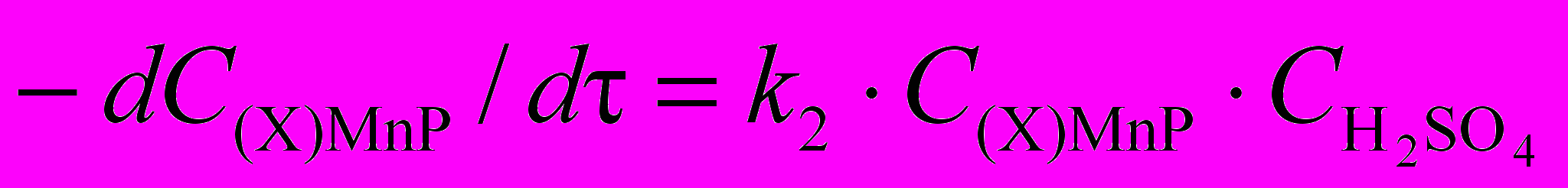 | (10) | | ||
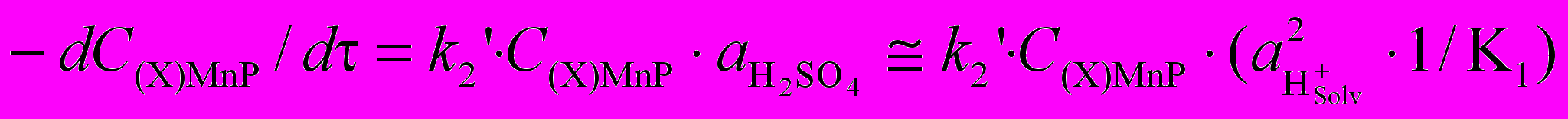 | (11) | | ||
С учетом бимолекулярной лимитирующей стадии (7) и электрофильной природы активации механизм трактуется как SE2.
Комплексы октаалкилпорфиринов с различным количеством мезо-фенильных заместителей 7,38,46,48,49. Изучено влияние последовательного мезо-фенил-замещения, как электронного и геометрического факторов, на кинетику, механизмы диссоциации и устойчивость марганец(III)октаэтилпорфина ((Cl)MnOEP). Комплексы марганца(III), отличающиеся друг от друга числом мезо-фенильных заместителей, диссоциируют в смешанных растворителях AcOH – H2SO4 разного состава (и кислотности) (табл. 4). Зависимость скорости реакции от начальной концентрации серной кислоты
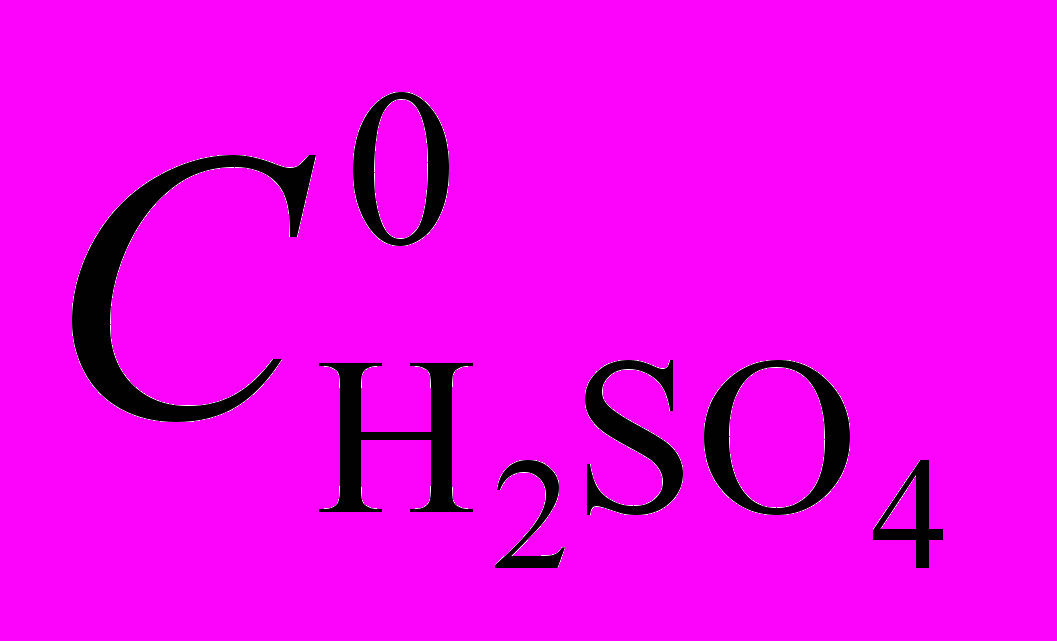 в уксусной для рассматриваемых соединений неодинакова. Для три- и тетрафенилзамещенных комплексов (Cl)MnTriPOEP и (Cl)MnTetPOEP (рис. 9, 10), диссоциирующих при концентрации H2SO4 0,0018 – 0,07 моль/л, наблюдается нелинейная зависимость kэф от
в уксусной для рассматриваемых соединений неодинакова. Для три- и тетрафенилзамещенных комплексов (Cl)MnTriPOEP и (Cl)MnTetPOEP (рис. 9, 10), диссоциирующих при концентрации H2SO4 0,0018 – 0,07 моль/л, наблюдается нелинейная зависимость kэф от 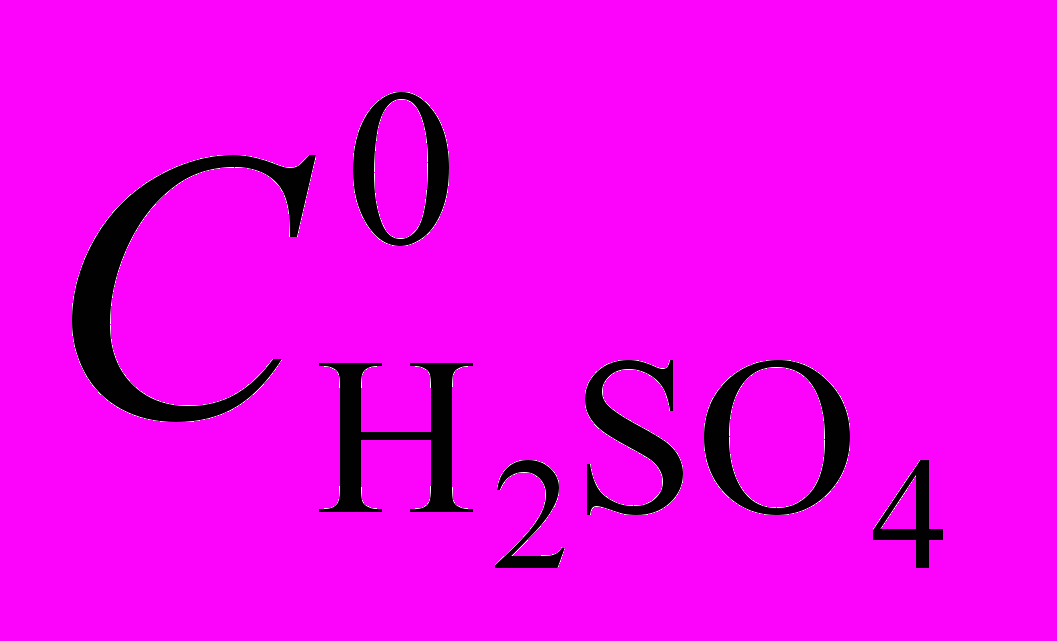 , хорошо описываемая уравнением (12).
, хорошо описываемая уравнением (12). 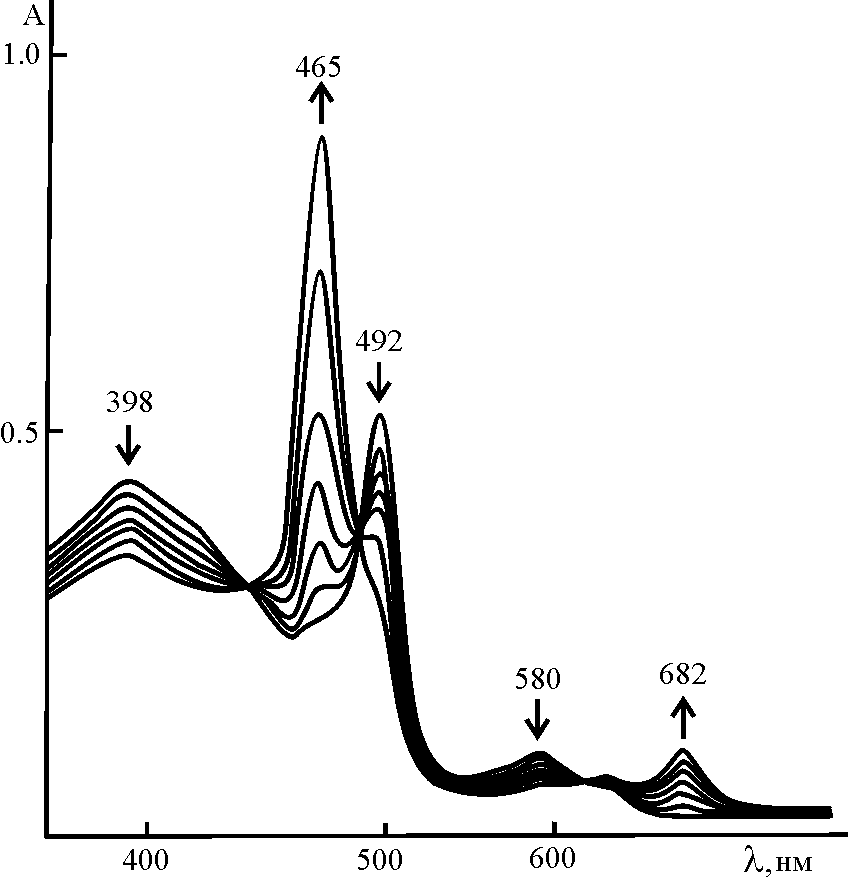 | 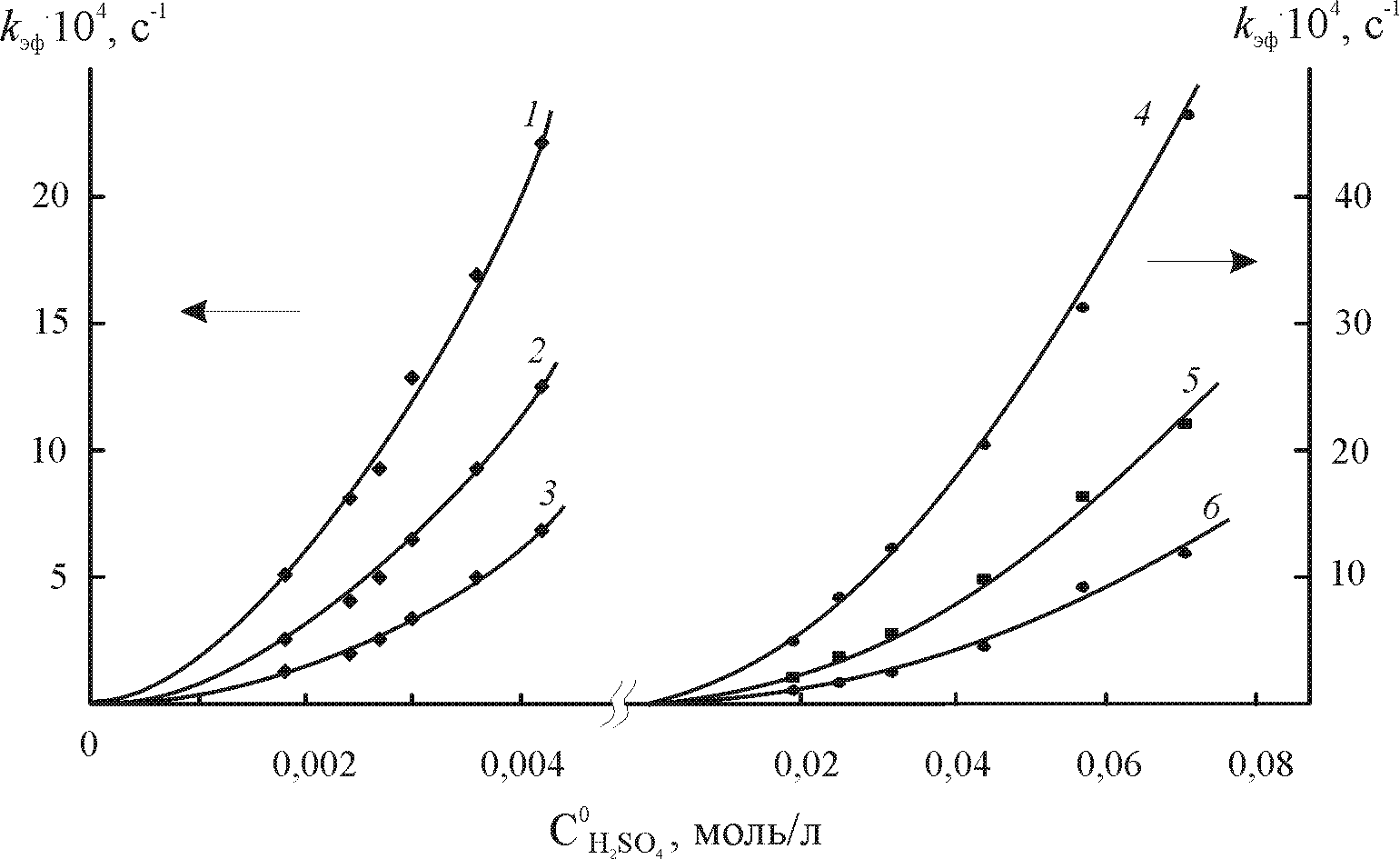 |
| Рис. 11. Изменение ЭСП (Cl)MnTetPOEP в процессе диссоциации в AcOH – 0,002 М H2SO4 при 298 K | Рис. 12. Зависимость эффективных констант скорости диссоциации (Cl)MnTetPOEP ( 1 - 3) и (Cl)MnTriPOEP (4 - 6) от начальной концентрации H2SO4 в AcOH при T, K: 288 (3, 6), 298 (2, 5), 308 (1, 4). R2 > 0,99 |