1. Респираторные инфекции
| Вид материала | Реферат |
- Памятка по профилактике и лечению гриппа для населения Грипп и другие острые респираторные, 19.79kb.
- Центр медицинской профилактики г. Тамбова острые респираторные вирусные инфекции (орви), 43.01kb.
- Грипп и острые респираторные вирусные инфекции и их профилактика, 26.29kb.
- Критерии отнесения детей в группу «Часто болеющие дети» (чбд), 164.85kb.
- Алгоритм оказания помощи пациентам с орви и гриппом. Общие положения. Острые респираторные, 464.61kb.
- Управляемая аэроионотерапия в оздоровлении часто болеющих детей м. А. Хан, Е. Л. Вахова,, 69.43kb.
- Антибактериальная терапия инфекций нижних дыхательных путей в амбулаторных условиях, 123.18kb.
- Я острые респираторные вирусные инфекции (орви) являются самой распространенной патологией,, 93.85kb.
- Гу «Слуцкий зональный центр гигиены и эпидемиологии» Энтеровирусные инфекции, 32.7kb.
- Н. С. Титова Внутриутробные инфекции у новорожденных Учебное пособие, 872.72kb.
Диагностика и лечение токсической дифтерии
С 2005 года в России и Москве впервые через 25 лет снова достигнут и сохраняется спорадический уровень заболеваемости дифтерией (показатель < 0,1 на 100 000 населения) — период, когда внимание к выявлению больных, диагностике и лечению дифтерии снижается. Несмотря на тяжелую эпидемию дифтерии в 90-е годы до сих пор вопросы лечения токсических форм вызывают дискуссии, в практику не внедрены методы их ранней диагностики. В 2007 г. в России умерли от дифтерии 7 из 8 взрослых, заболевания которых относятся к группе риска по летальности. Интенсивный рост заболеваемости и смертности в 90-е годы совпал с началом социальных потрясений в бывших республиках СССР. Резкое усиление миграции, прежде всего в столицу, сопровождалось быстрой сменой возбудителя дифтерии биоварианта mitis на более агрессивный — gravis по высокой степени токсинообразования и колонизационной активности (риботип «С.-Петербург/Россия»), который в Москве стал составлять 96–98% всех штаммов. Пик заболеваемости в Москве отмечен в 1994 г., когда показатель составил 46,9 на 100 000 населения, что в 45 раз выше среднемноголетнего уровня 80-х годов. Смертность увеличилась от 0,03 в 1989 году до 1,67 на 100 000 населения в 1994 году. В начале эпидемического подъема дифтерии в Москве структура ее клинических форм изменилась за счет увеличения доли токсической дифтерии II и III степени тяжести (ТДII и ТДIII), а затем и появления гипертоксической дифтерии (ГД), увеличения комбинированных форм и крупа. Летальность в группе риска у взрослых и непривитых детей увеличилась в 1989–1990 гг. до 42,8% и 31,5%. Это позволило прогнозировать рост заболеваемости и тяжести дифтерии. Были приняты меры к уменьшению его тяжелых последствий: проведение массовой иммунизации населения, организация в ИКБ № 1 Городского учебно-методического центра с целью разработки критериев ранней клинической диагностики и эффективной терапии наиболее тяжелых форм, масштабного обучения врачей диагностике и профилактике дифтерии (обучено более 5 тысяч врачей ЛПУ), внедрения новых методов лечения тяжелых больных. У взрослых, преобладавших среди больных дифтерией (75,3%), группа риска по летальности составила в 1989–2004 гг. в целом по Москве 2030 чел. — 21,1%. Если сравнить удельный вес наиболее тяжелых заболеваний в группе риска у взрослых за 1994 г. (всего 601, ТДIII — 178 (29,6%), ГД — 28 (4,7%), тяжелые комбинированные 173 (28,8%), в сумме 379 (63,1%)) и за весь период эпиднеблагополучия с 1989 по 2004 гг. (всего 2030, ТДIII — 585 (28,8%), ГД — 145 (7,1%) тяжелые комбинированные 528 (26,0%), в сумме 1258 (62,0%)), то эти показатели сохранили постоянную величину — более 60%. Аналогичное сравнение в группе риска по летальности среди непривитых детей выявило соответственно 84,5% и 81,9%. Это свидетельствует о том, что сохранилось влияние факторов тяжести, среди которых в Москве и Центральном регионе следует особо отметить почти 100-процентную циркуляцию возбудителя дифтерии биовара гравис и социально-миграционную отягощенность. В ИКБ №1, куда осуществлялась провизорная госпитализация, группа риска в годы максимальной заболеваемости была более высокой, чем в целом по Москве — 42,3–50,1%. Основная масса больных гипертоксической и токсической дифтерией III степени тяжести (до 80%) госпитализировалась в этот стационар.
Поскольку главной задачей диагностики и лечения дифтерии всегда было предупреждение летальных исходов, первостепенное внимание было уделено тем ее формам, при которых существует реальная угроза для жизни. К ним относятся токсическая дифтерия II, III степени тяжести, гипертоксическая, токсическая с поздним поступлением (в периоде осложнений), дифтерийный круп и тяжелые комбинированные формы.
Клинические наблюдения в условиях тяжелой эпидемии позволили разработать критерии ранней диагностики токсических форм дифтерии, сопряженных с риском летального исхода. От легких и среднетяжелых форм токсическая дифтерия отличается значительной интоксикацией, болевыми симптомами, лимфаденитом, наличием токсического отека слизистых оболочек ротоглотки и подкожной клетчатки, время появления, темпы прогрессирования и выраженность которых являются критериями степени тяжести болезни от субтоксической до гипертоксической. Грубейшую ошибку допускают те клиницисты, которые игнорируют необходимость раннего определения степени тяжести токсической дифтерии. К сожалению, современная МКБ-10 не предусматривает регистрацию степени тяжести токсических форм. Наиболее частой ошибкой является ориентировка на нижнюю границу отека подкожной клетчатки шеи без учета времени его появления. Не принимаются во внимание размеры лимфоузла и распространение отека не только вниз к ключице, но и вверх на лицо и кзади на спину, а также его плотность. Кроме того, не учитывается выраженность болевых симптомов, фарингеальный стеноз, раннее геморрагическое пропитывание слизистых оболочек. Продромальный период, отмечаемый у части больных, и редкие варианты с прогрессированием тяжести при характерном остром или бурном начале тяжелых форм дифтерии могут затруднять оценку тяжести заболевания, так как нарушается характерная для дифтерии корреляция тяжести и темпов развития симптомов. Гипертоксическая дифтерия — 91 больной. Бактериологическое подтверждение — 86,8%, у всех — биовар gravis высокой степени токсигенности. Больные были госпитализированы в инфекционный стационар преимущественно в первые двое суток болезни (91,2%): в первые 12 часов — 2,2%, последующие 12 часов — 34,0%, первую половину вторых суток — 36,3%, вторую половину вторых суток — 18,7%. В начале третьих суток — 8,8% больных. Заболевание начиналось очень остро с фиксацией больными часа появления первых симптомов. Продромальный период от нескольких часов до суток (легкое недомогание и слабая боль в горле), реже — до 2–3 дней (появление отечности верхней части шеи без нарушения самочувствия) — у 13,0% больных. Симптомы интоксикации: быстрое повышение температуры до высоких цифр с ознобом, общая разбитость и ломота, артралгии — у 18% больных, прогрессирующая слабость, анорексия (более чем у половины больных) или снижение аппетита, бледность, головокружение, оглушенность, нарушение сна (при заболевании ночью), тошнота, многократная рвота (у 12% больных), приступообразные боли в животе (у 7% больных), у некоторых больных — страх смерти. У трети больных отмечалась эйфория или делирий, преимущественно при поступлении в начале вторых суток болезни. В это время у них наблюдались гиперемия лица и шеи, блеск глаз, яркость губ, а также тахикардия и повышение АД. У 4 больных, поступивших в начале вторых суток болезни, еще до начала лечения отмечено резкое снижение высокой температуры до 35,3–36,0 °C. Уже с первых часов болезни наблюдался лейкоцитоз, нормо- или гипертромбоцитоз с последующим снижением тромбоцитов на 2–3 сутки. Ранняя гипокоагуляция, в том числе тромбоцитопения, отмечалась при наиболее тяжелых вариантах гипертоксической дифтерии. Болевые симптомы. У всех больных были четко выражены три болевых симптома: боль в горле при глотании и при пальпации тонзиллярного лимфоузла, болезненность и затруднение при открывании рта. Четвертый болевой симптом, боль в области шеи, отмечен у 27% больных, поступивших в первые сутки болезни. Боль в горле при глотании интенсивно нарастала, в связи с чем уже в первые сутки, а иногда и в первые часы прием пищи, а затем и питье становились невозможными. Резкую боль часть больных испытывала при разговоре. Болезненность тонзиллярного лимфоузла отмечалась рано, больные вздрагивали при его пальпации уже в самые ранние сроки госпитализации. Болезненность при открывании рта появлялась и усиливалась, приводя к болевому тризму уже в первые сутки болезни. У больных, поступивших через 12, 13, 16 и 18 часов от начала болезни, болевой тризм был выражен настолько резко, что миндалины были недоступны осмотру. В то же время у некоторых больных при осмотре в конце первых — начале вторых суток, несмотря на болезненность при открывании рта, осмотр миндалин был возможен. Боль в области шеи разной степени интенсивности появлялась рано, уменьшалась и исчезала по мере увеличения отека шеи, тогда как другие болевые симптомы усиливались и были выражены резко. Внезапная полная анестезия болевых ощущений наступила у 3 больных на вторые-третьи сутки болезни. Кроме того, еще более чем у половины больных в эти же сроки отмечено заметное уменьшение болевых ощущений, не адекватное выраженности воспалительного процесса в ротоглотке.
^ Местное воспаление. Наиболее частым вариантом было быстрое развитие токсического отека слизистых оболочек ротоглотки, начиная с миндалин. Увеличение миндалин (или одной миндалины) можно было заметить с первых часов болезни. Они выдвигались в передние отделы ротоглотки и становились хорошо доступными осмотру. Если увеличение происходило преимущественно за счет отека, оно было более быстрым, а поверхность — выпуклой. Если за счет инфильтрации миндалина была плотной с несколько бугристой поверхностью (редкий вариант начальных изменений), усиление отека приводило к соприкосновению миндалин, их смещению кзади или кпереди и погружению в нижние отделы ротоглотки. Уже к середине первых суток у многих больных осмотр миндалин был затруднен, тем более что отмечалось усиление болевого тризма. У больных наиболее тяжелыми формами дифтерии, в первую очередь гипертоксической, нами отмечена своеобразная черта токсического отека слизистых оболочек мягкого и твердого неба — четкая граница отека, которая чаще всего была ступенеобразной — под прямым углом к поверхности, реже — несколько скошенной или с острым козырьком. При увеличении отека или его продвижении на соседние участки эта четкая граница сохранялась. Быстрое и выраженное прогрессирование токсического отека слизистых оболочек ротоглотки приводило к появлению затрудненного дыхания (фарингеальный стеноз) и вынужденному положению больного — сидя или стоя. Усиление стеноза чаще всего являлось причиной обращения больных гипертоксической дифтерией за медицинской помощью в конце первых — начале вторых суток. Среди больных, госпитализированных в первые 36 часов от начала болезни, выраженный фарингеальный стеноз отмечен у 95,5%. Наряду с багрово-цианотичной гиперемией слизистых оболочек более чем у половины больных отмечалась их бледность с синюшным или рыжеватым оттенком и инъекцией сосудов. Геморрагическое пропитывание отдельных участков миндалин, а затем и других отделов ротоглотки можно было наблюдать у больных, поступивших через 12, 14 и более часов от начала болезни (ссылка скрыта). У 3 больных к концу первых суток наблюдалась сплошная, до границы с твердым небом, геморрагическая имбибиция. Уже через несколько часов, а тем более в первые сутки болезни у всех больных можно было обнаружить фибринозные налеты на разных этапах их формирования: более зрелые и грубые на миндалинах и свежеформирующиеся (в виде фибринозных рыхлых переплетений либо желеобразного покрытия) — за их пределами, включая мягкое и даже твердое небо. Характерно очаговое геморрагическое пропитывание налетов через несколько часов от начала болезни с его увеличением в дальнейшем. В течение первых суток тонзиллярные лимфоузлы увеличивались до 2´3,5 и 3,5´5 см, достигая в начале вторых суток размеров 5´7, 6´9 см и более. Они были плотными и резко болезненными. Токсический отек подкожной клетчатки шеи начинал появляться над тонзиллярными лимфоузлами через несколько часов от начала болезни (с 3–5 до 10–12 часа). К концу первых суток он достигал ключицы или спускался ниже, предварительно появившись на лице, в заушной области или на спине, становился плотным. В это же время становились заметными геморрагические элементы над отеком. У трети больных отмечен также подчелюстной лимфаденит с отеком подбородочной области. В конце первых — начале вторых суток у части больных выявлялся плотный лепешкообразный отек подкожной клетчатки на отдельных участках грудной клетки, удаленных от нижней границы отека шеи: в центре грудины, на плече, в подмышечной области, над лопаткой и т. д.
Критерии ранней диагностики гипертоксической дифтерии:
- в первые 12 часов от начала болезни наряду с остро прогрессирующей интоксикацией и болевыми симптомами (боль в области шеи, затруднение глотания и открывания рта, болезненность лимфоузлов) — развитие токсического отека слизистых оболочек ротоглотки, начиная с миндалин, фарингеальный стеноз, фибринозные налеты на разных стадиях формирования, более зрелые на миндалинах, свежие — за их пределами, лимфаденит и появление отека шеи над лимфоузлом, начинающееся геморрагическое пропитывание слизистых оболочек ротоглотки; редкий вариант — буллезные выпячивания на отдельных участках мягкого и твердого неба в связи с неравномерным развитием отека. В случаях, когда поначалу миндалины увеличивались за счет инфильтрации, они — небольшие (до I или I–II степени), плотные с геморрагическим некрозом поверхности (струпом) или геморрагическим фибринозным складчатым налетом;
- к концу первых суток — быстрое прогрессирование всей симптоматики, усиление фарингеального стеноза, выраженный тризм жевательных мышц, оттеснение резко увеличенных миндалин в нижние отделы ротоглотки и выбухающий отек мягкого (и твердого) неба, завершение формирования пленчатых налетов на миндалинах, грубых, с геморрагическим пропитыванием, продолжение формирования свежих налетов на мягком и твердом небе, распространение отека шеи не только вниз до ключицы, но и раннее появление на лице и спине, его плотность и выбухание, появление геморрагий над отеком шеи, у части больных — изолированные участки плотного отека подкожной клетчатки на удаленных от шеи местах грудной клетки.
Следует учитывать редкие варианты местного процесса — неравномерное развитие отека в ротоглотке либо его отсутствие на протяжении первых суток на фоне прогрессирующей интоксикации и болевых симптомов. При отсутствии отека в эти сроки местный процесс характеризовался резкой инфильтрацией миндалин с их увеличением до I–II и более, иногда > III степени, геморрагическим некрозом их поверхности, образованием черных фибринозных пленок, геморрагической имбибицией слизистых оболочек, включая мягкое и даже твердое небо. В связи с отсутствием отека болевой тризм выражен слабо.
Токсическая дифтерия III степени тяжести. Объем наблюдений — 109 больных. Бактериологическое подтверждение — 82,6%, в том числе биовар gravis — 75,2%, mitis — 7,4%. Сроки поступления: в первые сутки (14–15 часов от начала болезни) — 1,8%, на вторые сутки — 41,3%, на третьи — 33,9%, на четвертые — 20,2%, пятые и более — 2,8%. По сравнению с гипертоксической дифтерией время обращения и госпитализации сдвигалось на сутки. При сходстве симптомов гипертоксической и токсической дифтерии III степени тяжести принципиальное отличие между ними заключалось в более медленных темпах их развития и меньшей выраженности у больных ТДIII. Как и при ГД, у части больных (5%) наблюдался продромальный период. Следует отметить, что в условиях циркуляции высокотоксигенного возбудителя у больных ТДIII интоксикация была более выражена, чем в прежние годы, — у части больных наблюдались головокружение и оглушенность, артралгии, частичная анестезия болевых ощущений (на 3–4 день болезни). Также отмечалась большая выраженность болевого синдрома и токсического отека слизистых оболочек ротоглотки. У части больных (19,3%) даже наблюдалось возникновение фарингеального стеноза, но менее выраженного и в более поздние сроки, чем при гипертоксической дифтерии, — у 7% больных с конца вторых суток, у 12% — на 3–4 сутки.
С первых часов болезни появлялись три болевых симптома — боль при глотании и пальпации лимфоузлов (у всех больных), у части из них — боль в области шеи, стихавшая при появлении ее отека. Болевой тризм жевательных мышц на вторые сутки был выражен у 75,5% больных, при поступлении на третьи сутки — у 65%. Тонзиллярные лимфоузлы на вторые сутки достигали 3´4 или 3´5 см (84%), дальнейшее увеличение до 5´6 см отмечено у 18% больных. Отек подкожной клетчатки шеи у большинства больных появлялся над лимфоузлами с конца первых суток, тогда как в 80-е годы — чаще в начале вторых суток. Дальнейшее увеличение отека шеи: начало вторых суток — середина шеи, конец вторых суток — у основания шеи и над ключицей, на третьи сутки — ниже ключицы. У 30,3% больных отмечался плотный выпуклый отек подкожной клетчатки, у 24% его раннее распространение на лицо и спину (ссылка скрыта).
^ Критерии ранней диагностики токсической дифтерии III степени тяжести:
• в первые сутки болезни (до появления отека подкожной клетчатки шеи) — острое начало, интоксикация, нарастающая боль в горле, затрудняющая прием пищи, быстрое увеличение миндалин за счет отека и появление отека небных дужек, язычка, мягкого неба, формирование фибринозных однородных налетов на миндалинах и у части больных — за их пределами, увеличение тонзиллярных лимфоузлов до 2´3 и более см, их болезненность и плотность; к концу первых суток может появиться затруднение при открывании рта, лимфоузлы увеличиваются (нередко до 4´5 см), появляется отек подкожной клетчатки над лимфоузлами;
• на вторые сутки болезни — усиление интоксикации и болевых симптомов, в том числе тризма жевательных мышц, распространение отека на мягкое (и твердое) небо с формированием фибринозных налетов на отечной поверхности, появление участков геморрагической имбибиции слизистых оболочек, начиная с миндалин; отек шеи — над лимфоузлами, достигает середины шеи либо к концу вторых суток находится у ее основания; дополнительные критерии — появление отека на лице, спине, его выпуклый характер и плотность.
В более поздние сроки, когда граница отека шеи спускается ниже ключицы, симптомы достигают максимального развития.
Токсическая дифтерия II степени тяжести. Бактериологическое подтверждение у 41 из 55 больных (74,5%), gravis — 65,5%, mitis — 9,0%. Сроки госпитализации: в первые сутки — 3,6%, вторые — 32,7%, третьи — 40,0%, четвертые — 9,0%, пятые и более — 14,5%.
^ Критерии ранней диагностики токсической дифтерии II степени тяжести:
- острое начало болезни, повышение температуры, нередко с ознобом, слабость, ломота, снижение аппетита (головокружение и тошнота — у единичных больных);
- боль в горле при глотании, усиливающаяся, затрудняющая прием пищи на вторые-третьи сутки, тогда же возможно появление болевого тризма (у трети больных);
- максимальное увеличение тонзиллярных лимфоузлов до 2´3 см (у 89,0%), до 3´5 см (у 11,0 больных), их болезненность и уплотнение;
- появление отека подкожной клетчатки над лимфоузлами на вторые сутки, его распространение до середины шеи или ключицы на следующий день.
При осмотре на вторые-третьи сутки — отек миндалин, которые не всегда смыкаются, язычка, мягкого неба. У единичных больных — переход на твердое небо. Фибринозные налеты — на миндалинах, язычке, мягком небе. Геморрагический компонент местного процесса отмечен у 1/5 больных, умеренно выражен, появляется поздно (3–4 сутки).
Таким образом, на основании клинических симптомов с оценкой времени их появления, темпа прогрессирования и манифестности можно не только рано распознать токсическую дифтерию, но и определить степень ее тяжести, включая гипертоксическую. Диагностике помогает учет патогенетического представления о том, что количеством токсина определяется выраженность местных, регионарных и общих симптомов, а также соответствие их друг другу. Очаг фибринозно-некротического воспаления, в котором продуцируется токсин, доступен осмотру и является очень важным источником диагностической и прогностической информации.
Возможность ранней диагностики в значительной мере зависит от своевременного обращения больных к врачу. Вместе с тем именно тяжесть состояния подталкивает больных к осознанию необходимости ранней и экстренной госпитализации. Существенные различия в сроках госпитализации при ГД, ТД III и II степени (ссылка скрыта.) отражают более стремительное прогрессирование симптомов при наиболее тяжелых формах дифтерии. Например, больных гипертоксической дифтерией к ранней госпитализации (в первые 12–36 часов) вынуждают не только интенсивность интоксикации и болевых ощущений, но в значительной степени и острая обструкция верхних дыхательных путей.
1.2 Обструкция нижних дыхательных путей
1.2.1. Бронхиолит
Бронхиолит - это заболевание нижних дыхательных путей, которое прежде всего поражает грудных детей и чаще всего вызывается респираторно-синцитиальным вирусом (RSV). Тяжелое течение в основном отмечается у детей с предсуществующими поражениями легких и сердца. В качестве острой терапии показали свою эффективность дача кислорода и освобождение назофаринкса посредством отсасывания. Пульс-оксиметрическое наблюдение рационально, детей необходимо щадить, применяя «minimal handling». Активной вакцинации против RSV в настоящее время нет. Моноклональные антитела Palvizumab могут воспрепятствовать развитию тяжелых инфекций у детей группы риска в 40-80%.
Предлагаемая статья представляет обзор современного стандарта лечения и профилактики RSV-бронхиолита.
Определение
Бронхиолит - это воспалительно-обструктивное заболевание мельчайших бронхов и бронхиол. Клинически оно определяется как заболевание с хрипами, вызываемое вирусной или бактериальной инфекцией, приводящей к воспалению мельчайших дыхательных путей. В клинических исследованиях оно часто определяется как первый эпизод Giemens у ребенка в возрасте до 24 месяцев с признаками вирусной инфекции.
Эпидемиология
В более чем 50% случаев бронхиолит вызывается RSV. RSV во всем мире считается инфекцией дыхательных путей грудных и маленьких детей, представляющей основную причину поступления детей грудного возраста в больницы. RSV инфекции возникают в средней Европе в виде ежегодных эпидемий в зимние месяцы. В Германии пик частоты по времени приходится с ноября по март, в зависимости от сезона случаи заболевания могут встречаться уже в сентябре и продолжаться по июнь. В современном эпидемиологическом исследовании количество амбулаторно пролеченных детей по поводу RSV оценивается в 183.000/в год. В этом популяционном исследовании ежегодное количество госпитализаций по поводу RSV у детей до 3 лет в Германии оценивается в 26.500, частота RSV госпитализаций у детей младше 3 лет оценивается в 1117/100.000. Эти результаты несколько выше, чем частота ежегодных RSV-госпитализаций среди детей до 2 лет (725/100.000) установленная в популяционном исследовании области Киля.
Благодаря относительной защите очень мало детей в возрасте младше 1 месяца инфицируются RSV. Затем величина инфекций скачкообразно увеличивается, достигая наивысших значений на 3 и 4 месяцах жизни. Заражение RSV довольно высоко и происходит быстро, и до конца 2 года жизни почти каждый ребенок переносит RSV инфекцию.
Иммунитет к RSV не полный, часты реинфекции и в настоящее время развивающиеся в тот же сезон.
RSV передается и нозокомикально, главным образом через обслуживающий персонал и врачей.
Нозокомикальные RSV инфекции дают относительно высокую смертность, особенно у детей с основным сердечным заболеванием.
В исследовании ESPED во всех педиатрических отделениях интенсивной терапии за промежуток времени 2,5 года было выявлено 289 детей младше 4 лет с RSV-заболеваниями, связанными с проведением интубации. 20 из них умерло, из которых 12 были недоношенные, у 8 имелся порок сердца, у 10 бронхопульмональная дисплазия (BPD) и у 10 множественные пороки развития. 14 умерших детей были инфицированы нозокомикально.
^ Вирусные возбудители бронхиолита
RSV ответственно за 45-75% бронхиолитов в грудном возрасте, менее часто это связано с вирусами параинфлюецы 1-3 (14-33%), аденовирусами (3-10%), вирусами инфлюенцы (5-8%), риновирусами (3-8%), а также метапневмовирусами, энтеровирусами и Mycoplasma pneumoniae. У детей с пневмонией (50%), бронхитом (10-30%) и стенозирующим ларинготрахеитом (Krupp-Syndrome) (10%) RSV встречается реже.
Во время сезона RSV чаще всего поддаются выделению два штамма вируса RS (A и B), однако от сезона к сезону преобладают меняющиеся подтипы. Штаммы отличаются в основном по антигенной структуре G-поверхностных протеинов. Другие поверхностные протеины очень похожи. Так штаммы А и В дают 90% соответствие по протеиновой структуре F-протеинов. Антитела, такие как Palivizumab, направленные против F-протеинов, считаются перекрестно-активными, то есть они действенны против различных штаммов.
^ Группы риска
Дети с основными заболеваниями такими, например, как иммунодепрессия, недоношенные, дети с бронхо-пульмональной дисплазией или заболеваниями сердца обладают несколько повышенным риском заболеть RSV- инфекцией с тяжелым течением. Кроме того, риск считается повышенным у грудных детей мужского пола, грудных детей, имеющих братьев и сестер, посещающих детские учреждения, с экспозицией к сигаретному дыму, со стесненными жилищными условиями и низкими социально-экономическим статусом.
^ Путь инфекции
Распространение RSV происходит путем капельной инфекции и через контакт с дыхательным секретом, как грязевая инфекция. Время инкубации составляет 3-6 дней.
Как правило, инфицирование начинается через 1 день после заражения, то есть еще до начала симптомов.
Длительность инфицирования различная: у иммунокомпетентных взрослых она составляет до 7 дней, у новорожденных и недоношенных с тяжелыми RSV инфекциями до 4 недель. Иммуносупримированные могут выделять RSV до нескольких месяцев после инфекции RSV.
· На поверхностях вирус остается инфекционным до 6 часов, и до 30 минут на носовых платках и тканях.
Молодые люди и взрослые могут статься асимптоматичными или симптоматичными переносчиками. RSV часто заносится в семью одним из братьев или сестер школьного возраста.
Патофизиология
Входными воротами для RSV служит респираторный эпителий верхних дыхательных путей. RSV-инфекция может проявляться как ринит, фарингит, трахеобронхит или средний отит, или распространяться в нижних дыхательных путях и там вызывать бронхиолит или пневмонию.
У первых возникает воспаление перибронхиальной ткани с образованием отека подслизистой и адвентиции, а также чрезмерное выделение слизи. В тяжелых случаях развиваются некрозы респираторного эпителия, которые усиливают обструкцию мелких бронхов и могут привести к образованию пробки. Через механизм «air traspping» (захват воздуха), при котором во время инспирации воздух может попадать в дистальные отделы легких, а при экспирации плохо проникает через вентильный механизм, возникает перерастяжение легочной ткани. И как следствие, возможно развитие ателектазов при полной абсорбции воздуха из полностью заложенных участков легких. Грудные дети по причине относительно маленьких дыхательных путей особенно подвержены обструкции.
^ Клиническая картина
После продромальной стадии с кашлем и насморком проявляется бронхиолит с хрипами и слабой лихорадкой, а также, в зависимости от степени тяжести, проблемами с питьем, тахипное и диспное. При обследовании выявляются интер- и субкостальные втяжения, перерастянутая грудная клетка и иногда цианоз. При аускультации могут быть слышны экспираторные хрипы и удлиненный выдох.
Апное, особенно у маленьких грудных детей, может оказаться первым клиническим признаком бронхиолита.
Гипоксемия (<95% насыщения кислородом) часто может быть установлена с помощью пульсоксиметрии. При соответствующей клинике диагноз RSV-бронхиолита у грудного ребенка во время RSV-сезона устанавиливается с большой вероятностью.
Радиологические изменения легких при бронхиолите вариабельны и проявляются перерастяжениями легких, перибронхиальными уплотнениями и редкими ателектазами.
^ Специфическая диагностика
Так как кроме, вряд ли получившего широкое применение, рибаверина, нет никакой антивирусной терапии, то возникает вопрос, нужно ли и когда проводить лабораторное подтверждение RSV. В одном из системных обзорных исследований оказалось, что это ни коим образом не оказывает влияния на терапию и клинический исход RSV заболевания. Возможно раннее выявление детей инфицированных RSV особенно важно в госпиталях. Раннее тестирование, подключамая когортизация и проведение мероприятий по инфекционному контролю (см. ниже) за RSV-положительными пациентами препятствуют появлению нозокомикальных инфекций. Путем этиологического отграничения от бактериальных инфекций можно избежать ненужного назначения антибиотиков и снизить дополнительные расходы. При тяжелых RSV-заболеваниях выделение вируса с помощью положительного антигенового теста является предпосылкой для назначения рибоварина.
^ Выявление вируса
Для выявления RSV необходимо получить секрет из назофаринкса.
Из секрета назофаринкса, получаемого с помощью метода смыва, вирус выделяется лучше, чем из мазка носовой полости.
Иммунологическими методами, например, ELISA («enzyme-linked immunosorbent assay») или иммунофлюоресцентного методов, антиген RSV можно выявить с помощью моноклональных антител с чувствительностью и специфичностью 90-95% . Выявление RSV-антигена методом ELISA является быстрым тестом осуществляемым и на практике с предоставлением результатов в течение 15-30 минут.
RSV-клеточная культура в основном проводится для контроля качества других методов выделения. PCR (реакция полимеризации цепей) до сих пор рутинно не применялась. Благодаря своей высокой чувствительности и специфичности в будущем она может стать альтернативой клеточной культуре.
Терапия
Эффективность дорогого ингаляционного лечения острого RSV- бронхиолита виростатиком Ribavarin до сих не имеет достаточных подтверждений. Ингаляция исходного раствора 60 mg Ribavarin/ml проводится с помощью генератора аэрозолей 2 раза 2 часа через eine Haube.
Так как имеется существенная озабоченность в отношении потенциальной мутагенности, то это затрудняет применение ингалятивного рибаварина в практике.
Он должен приберегаться для пациентов высокого риска с тяжелейшим течение RSV- инфекции. При RSV- инфекциях у иммунносупримированных пациентов, например, после транплантации стволовых клеток, сегодня рибаварин отчасти применяется внутривенно.
Рекомендация. Широкое применение рибаварина при недостаточном проявлении эффективности и высокой стоимости может не рекомендоваться, применение у пациентов с существенными предсуществующими заболеваниями или у тяжело пораженных пациентов может проводиться после взвешивания всех за и против врачом.
^ Симптоматическое лечение
Мероприятия при стационарном лечении RSV- бронхиолита :
- «Minimal handling»
- Клиническое наблюдение
- Мониторинг (насыщение кислородом, частота сердечных сокращений)
- Дача кислорода (увлажненного, подогретого) при насыщении кислородом ниже 92% , с капиллярным контролем pCO2
- Очищение назофаринкса с помощью назофарингеального отсасывания, снижающие отек капли в нос, промывание носа 0,9% NaCl
В зависимости от степени тяжести дополнительно применяется:
интубация и искусственное дыхание,
достаточное поступление жидкости, иногда внутривенно,
Прекращение приема пищи через рот только при тяжелой симптоматике.
^ Оксигенация и искусственное дыхание
Рекомендация. Начиная с насыщения кислородом <92% должен даваться подогретый и увлажненный кислород, при этом необходим контроль СО2 в капиллярах. Перед проведением интубации и интратрахеального искусственного дыхания должна быть сделана попытка с помощью CPAP-глотка обеспечения достаточной вентиляции.
Снижение сопротивления дыхательных путей верхнего дыхательного тракта
Оно обуславливает клиническое улучшение и снижение потребности в кислороде у детей с острым бронхиолитом. Этого можно достичь путем назофарингеального отсасывания, простого с отсутствием побочных эффектов мероприятия. Клинический опыт показывает, что также при даче снижающих отек носовых капель, содержащих a-адреноэргетики, особенно перед кормлением, можно получить клиническое улучшение, даже если в отношении этого и нет никаких контролированных клинических исследований.
Рекомендация. Назофарингеальное отсасывание и применение уменьшающих отек носовых капель, снижающих сопротивление верхних дыхательных путей, могут быть рекомендованы для терапии острого бронхиолита. Обычно эти мероприятия проводятся перед применением других терапевтических средств.
b-2 миметики
В системных обзорных исследованиях и метаанализах нельзя найти какого-либо заключительного свидетельства, которое бы однозначно поддерживало эффективность b-2 миметиков в лечении острого бронхиолита. В одном из метаанализов 5 проведенных исследований амбулаторно пролеченных пациентов с бронхиолитом не было выявлено никакой эффективности b-2 миметиков по сравнению с плацебо в отношении снижения направления в госпиталь или улучшения физиологических параметров. Метаанализ исследований стационарно пролеченных пациентов провести не удалось из-за значительного методологического различия публикаций. Отдельные исследования сообщают об ухудшении клинических оценок и дыхательно-физилогических параметров.
Рекомендация. b-2 миметики обычно не рекомендуют для лечения острого бронхиолита. У детей с другими причинами обструкции дыхательного тракта (BPD, рецидивирующие хрипы, бронхиальная астма) может быть сделана попытка лечения бронходилататорами под клиническим и пульсоксиметрическим контролем. При отсутствии клинического улучшения (уменьшение частоты дыхания и втяжений, улучшение насыщения О2) попытка должна быть прекращена. Должна учитываться возможность клинического ухудшения.
^ Ингаляция эпинефрина
В современном метаанализе 14 контролированных исследований не было выявлено никакого достаточного действия ингалятивного эпинефрина в стационарном лечении бронхиолита. Ни улучшения клинических параметров, ни укорочения времени лечения не было обнаружено. Только в отдельных контролированных клинических исследованиях у амбулаторных пациентов удалось продемонстрировать существенное улучшение физиологических параметров дыхания (снижение сопротивления в основном верхних дыхательных путей) и значительное улучшение клинических параметров, как в отношении эпинефрина по сравнению с плацебо, также и эпинефрина по сравнению с b-2 миметиками. Действие ингалятивного эпинефрина при этом в основном связывалось со снижением сопротивления дыхательных путей верхнего дыхательного тракта.
Рекомендация. Применение ингалятивного эпинефрина широко не может рекомендоваться для лечения острого бронхиолита на основании недостаточности доказательств. Контролированная попытка терапии может быть взвешена в отношении тяжелого бронхиолита, когда например необходимо непосредственно избежать интубации.
Кортикостероиды
В недавно проведенном метаанализе 13 контролированных исследований по применению системных кортикостероидов не было обнаружено никакой действенности по сравнению с плацебо в острой фазе бронхиолита в укорочении сроков госпитализации или клиническом улучшении. Результаты этого метаанализа следует рассматривать прежде всего на фоне большой гетерогенности дизайна исследований. Подгрупповой анализ, например, только RSV-положительных бронхиолитов или детей на первом году жизни, оказался невозможным по причине малого количества случаев. Имеются указания на действенность на ранних стадиях заболевания. В отдельных клинических исследованиях и более старом метаанализе была установлена эффективность при тяжелых течениях бронхиолитов (с искусственным дыханием).
Рекомендация. Системные или ингаляционные кортикостероиды обычно не должны рекомендоваться для лечения острого бронхиолита. У детей с ранее имеющейся бронхиальной гиперреактивностью (BPD, рецидивирующие хрипы, бронхиальная астма), а также при тяжелых течениях можно взвешивать применение стероидов для лечения острого бронхиолита.
Профилактика
Целью профилактики RSV должно быть снижение общей заболеваемости и смертности. Наибольшее значение отводится общим гигиеническим мероприятиям, направленным на предотвращение инфекции. Кроме того, существует возможность пассивной RSV-иммунопрофилактики Palivzumab. Активная вакцинация RSV до сих отсутствует. Прежде всего, целью превентивных мероприятий являются дети с высоким риском тяжелых RSV-заболеваний, так как они, с одной стороны, чаще заболевают тяжелыми RSV-инфекциями, а с другой стороны, чаще всего по причине их основных заболеваний несут большую нагрузку в связи с заболеванием и частыми госпитализациями. Другой важной задачей профилактики является предотвращение нозокомикальных RSV-инфекций, составляющими большую часть наиболее тяжелых RSV-инфекций.
Общие мероприятия
Для профилактики RSV-заболеваний у детей с повышенным риском тяжелых RSV-инфекций служат :
1. Предотвращение экспозиции к сигаретному дыму,
2. Грудное вскармливание
3. Предотвращение экспозиции к RSV путем:
- тщательного мытья рук персонала контактирующего с инфекциями дыхательных путей
- избегание окружения с высокой экспозицией к RSV (детские сады и ясли, большие собрания персонала) во время сезона RSV.
Профилактика нозокомикальных инфекций в больницах
Для этого проводятся следующие мероприятия:
- Ранее тестирование на RSV при клиническом подозрении на RSV и планируемый прием в стационар,
- Когортизация RSV-положительных в больницах,
- Перед переводом контроль данных антигенов (из-за продолжительности выделения)
При близком контакте с больным обращать внимание на:
- Дезинфекцию рук
- Ношение халата
- Одноразовых перчаток,
- Защиту рта
- Защиту носа
- Поверхностную дезинфекция
Заключение
В терапии бронхиолита должны последовательно применяться хорошо подтвердившие свою эффективность симптоматические мероприятия: «minimal handling», клиническое и пульсоксиметрическое наблюдение, очищение назофаринегеальных дыхательных путей, достаточное поступление жидкости. В зависимости от тяжести заболевания бывает необходимо проводить ограничения в приеме пищи, своевременное вспоможение дыханию с помощью CPAP, но очень редко интубацию и искусственное дыхание. Возможно применение бронходилататоров, стероидов и Ribavarin в рамках попыток лечения по специальным показаниям, широкое применение этих препаратов при RSV-бронхиолите не рационально. У детей с риском общие инфекционно гигиенические мероприятия по предотвращению RSV-инфекции очень просты, экономичны и рациональны. Инфекционно гигиенические мероприятия и последующая когортизация могут также способствовать профилактике протекающих с высокой морбидностью нозокомикальных инфекций. Пассивная иммунопрофилактика с Palivizumab по предотвращению тяжелых RSV-инфекций ограничена по эффективности и рекомендуется преимущественно для недоношенных <28 SSW, новорожденных с бронхопульмональной дисплазией и для детей с гемодинамически значимыми пороками сердца.
1.3 ПНЕВМОНИЯ
Пневмония — это острый инфекционно-воспалительный процесс, поражающий преимущественно респираторный отдел легочной ткани, как правило, имеющий бактериальную этиологию и проявляющийся разной степени выраженности симптомами:
- общей реакцией организма на инфекцию (признаки интоксикации — ухудшение общего состояния, аппетита; лихорадка и др.);
- локальными изменениями в легких при физикальном обследовании (очаговые: укорочение перкуторного тона, ослабление дыхания, хрипы и др., см. ниже);
- инфильтративными затемнениями на рентгенограммах, обусловленными заполнением альвеол экссудатом, содержащим преимущественно полинуклеарные нейтрофилы;
- кашлем;
- дыхательной недостаточностью.
Заболеваемость пневмониями составляет в год около 15—20 на 1000 детей первых трех лет жизни и примерно 5–6 случаев на 1000 детей старше 3 лет. Предрасполагающими факторами к развитию пневмонии у детей раннего возраста являются перинатальная патология, аспирационный синдром как следствие синдрома рвот и срыгиваний, врожденные пороки сердца, рахит, другие гиповитаминозы и дефицитные состояния, в том числе иммунодефициты. Фактором, непосредственно предрасполагающим к развитию пневмонии, является охлаждение.
Этиология. Подавляющее большинство внебольничных («домашних», «уличных») пневмоний — результат активации эндогенной бактериальной флоры носоглотки, хотя возможно и экзогенное инфицирование. Многочисленные исследования показали, что клинически здоровые дети в 10—20% случаев при обследовании оказываются транзиторными носителями пневмококков, в 3—7% — гемофильной палочки или микоплазмы, хламидии пневмонии, в 20—45% — различных стафилококков. При острой респираторной вирусной инфекции (ОРВИ), охлаждении или действии других стрессорных факторов эта флора может «активироваться», приводя к развитию пневмонии.
Установление конкретной этиологии пневмонии в практической деятельности врача весьма затруднительно, поскольку пневмония — заболевание острое, лечение часто проводится на дому, и, следовательно, существуют технические трудности, связанные с забором материала для микробиологического исследования.
Частые причины пневмонии в различном возрасте
| Возраст | Бактериальные | Вирусные | Другие |
| Новорожденные | Стрептококки группы В, бактерии кишечной группы | ЦМВ, вирусы герпеса, энтеровирусы | Mycoplasma hominis, Ureaplasma urealyticum |
| 4-16 недель | Staphylococcus aureus, Haemophilus influenzae, f Streptococcus pneumoniae | ЦМВ, PC вирус, вирус гриппа, вирус парагриппа | Chlamydia trachomatis, U. Urealyticum |
| До 5 лет | S. pneumoniae, S. Aureus, H. Influenzae, стрептококки группы А | PC вирус, аденовирус, вирус грипп | |
| После 5 лет | S. pneumoniae, H. inluenzae | Вирус гриппа, ветряная оспа | Mycoplasma pneumoniae, |
| | | | Chlamydia pneumoniae, Legionella pneumophila |
- В 70-80% случаев "домашних" пневмоний возбудителем является Streptococcus pneumonia.
- Вторым по частоте возбудителем пневмонии у детей раннего возраста считают Haemophilus influenzae (около 10-15% больных). При этом у них нередко выявляется сочетанная пневмококко-гемофильная этиология пневмонии.
- В 60-70-х годах прошлого века довольно распространенными возбудителями пневмоний у детей первых месяцев жизни были стафилококки, но сейчас их как этиологический агент пневмонии идентифицируют гораздо реже.
- У 10-12% больных детей пневмонию вызывают Mycoplasma pneumoniae, Chlamydia pneumoniae или Chlamydia psitaci.
- У детей первых месяцев жизни возбудителями афебрильных, но протекающих с упорным кашлем пневмоний является Chlamydia trachomatis.
- Аспирационные пневмонии у детей раннего возраста, в частности с гастроэзофагеальным рефлюксом, которым обусловлены рвоты и срыгивания, нередко вызываются грамотрицательной флорой (E. coli и др.).
- Тяжелые пневмонии, как правило, обусловлены смешанной флорой - бактериально-бактериальной, вирусно-бактериальной, вирусно-микоплазменной.
- Вирусная пневмония - редкое заболевание. Возникает при гриппе (геморрагическая пневмония), возможна при бронхиолите аденовирусной и РС-вирусной этиологии. Диагноз вирусной пневмонии оправдан лишь при выявлении на рентгенограмме негомогенной пневмонической тени без четких контуров, сегментарных неплотных теней, быстро исчезающих без лечения; отсутствии типичных для бактериальной пневмонии сдвигов гемограммы; неэффективности лечения антибиотиками.
Классификация пневмоний у детей:
- Очаговая. Очаги чаще бывают размером 1 см и более.
- Очагово-сливная — инфильтративные изменения в нескольких сегментах или во всей доле легкого, на фоне которых могут быть видны более плотные участки инфильтрации и/или полости деструкции.
- Сегментарная — в процесс вовлекается весь сегмент, который, как правило, находится в состоянии гиповентиляции, ателектаза.
- Тяжелая форма пневмонии диагностируется в тех случаях, когда:
- больной нуждается в интенсивной терапии легочно-сердечной недостаточности или токсикоза;
- пневмония протекает с осложнениями.
Затяжные пневмонии диагностируют при отсутствии разрешения пневмонического процесса в сроки от 1,5 до 6 мес. от начала болезни. При рецидивировании пневмонии необходимо обследование ребенка на наличие муковисцидоза, иммунодефицитного состояния, хронической аспирации пищи и др.
Патогенез. Основным путем проникновения инфекции в легкие является бронхогенный с распространением инфекта по ходу дыхательных путей в респираторный отдел. Гематогенный путь возможен при септических (метастатических) и внутриутробных пневмониях. Лимфогенный путь — редкость, однако по лимфатическим путям процесс переходит из легочного очага в плевру. ОРВИ играют важную роль в патогенезе бактериальных пневмоний. Вирусная инфекция увеличивает продукцию слизи в верхних дыхательных путях и снижает ее бактерицидность; нарушает работу мукоцилиарного аппарата, разрушает эпителиальные клетки, снижает местную иммунологическую защиту, облегчая таким образом проникновение бактериальной флоры в нижние дыхательные пути и способствуя развитию воспалительных изменений в легких. Начальные воспалительные изменения при бронхогенном пути проникновения инфекции обнаруживают в респираторных бронхиолах. Далее они распространяются на паренхиму легких. При кашле инфицированная слизь из очага воспаления попадает в крупные бронхи, а затем, распространяясь в другие респираторные бронхиолы, обусловливает создание новых очагов воспаления, то есть распространение инфекции в легких, как правило, происходит бронхогенно. В участке клеточной инфильтрации возможно расплавление ткани с формированием булл или абсцессов. После их опорожнения через бронх в легком остается полость, обычно заживающая в виде небольшого рубца. Прорыв абсцесса в плевральную полость ведет к пиопневмотораксу. Полное обратное развитие изменений при катаральном и фибринозном формах воспаления занимает в среднем 3 недели. Возникновение ателектаза сегмента или доли обычно связано с выраженным воспалением ветвей приводящего бронха. Развивающаяся в условиях ателектаза сегментарная пневмония имеет тенденцию к формированию фиброзной трансформации.
^ Патогенез нарушений сердечно-сосудистой системы при пневмонии можно схематично описать следующим образом:
токсикоз и ДН ->спазм артериол малого круга кровообращения -> легочная гипертензия и повышенная нагрузка на правые отделы сердца -> снижение сократительной способности миокарда -> нарушение периферической гемодинамики, расстройство микроциркуляции. Функциональные нарушения легочного кровотока — более стойкое расстройство, чем изменение паренхимы легких (сохраняется до 6—8 недель).
При тяжелой пневмонии возникают энергетически-динамическая недостаточность миокарда (синдром Хегглина), дегенеративные изменения в мышце сердца и сосудах, повышение проницаемости капилляров.
Дыхательная недостаточность — состояние, при котором либо легкие не в состоянии поддерживать нормальный газовый состав крови, либо последнее достигается за счет ненормальной работы аппарата внешнего дыхания, что приводит к снижению функциональных возможностей организма. Закономерно у детей, больных пневмонией, нарушаются обменные процессы, и прежде всего:
- кислотно-основное состояние: метаболический либо респираторно-метаболический ацидоз с уменьшением мощности буферных оснований, накоплением недоокисленных продуктов;
- водно-солевой баланс: задержка жидкости, хлоридов; у новорожденных и грудных детей возможны обезвоживание и гипокалиемия.
Диагностика острых пневмоний
Общая симптоматика является основой клинической диагностики пневмоний, принимая во внимание то, что у детей раннего возраста на первый план при пневмониях выступают признаки ДН, интоксикации, а локальные физикальные изменения в легких чаще появляются позже.
Анализ данных относительно распространенности различных симптомов при пневмонии позволил предложить следующую диагностическую схему при первом осмотре больного с острым респираторным заболеванием (ОРЗ).
- Если при осмотре у ребенка, независимо от уровня температуры и при отсутствии обструкции, имеется:
- учащение дыхания (60 в минуту у детей первых месяцев жизни, 50 в минуту у детей 2 — 12 мес., 40 в минуту у детей 1 — 4 лет);
- втяжение межреберий;
- стонущее (кряхтящее) дыхание;
- цианоз носогубного треугольника;
- признаки токсикоза («больной» вид, отказ от еды и питья, сонливость, нарушение коммуникабельности, резкая бледность при повышенной температуре тела), то состояние расценивается как тяжелое с большой вероятностью наличия пневмонии.
- учащение дыхания (60 в минуту у детей первых месяцев жизни, 50 в минуту у детей 2 — 12 мес., 40 в минуту у детей 1 — 4 лет);
Этим больным следует назначить антибиотик (см. табл. 3.) и направлять их в стационар
- Если у ребенка нет признаков, указанных в пункте 1, но имеются:
- температура 38° C дольше 3 дней;
- локальные физикальные признаки пневмонии;
- асимметрия хрипов,
- температура 38° C дольше 3 дней;
то следует предположить наличие пневмонии.
Этим больным необходимо сделать анализ крови, направить их на рентгенографию; при невозможности ее проведения — назначить антибиотик. Госпитализации подлежат больные с признаками дыхательной недостаточности
- Если у ребенка с ОРЗ и признаками бронхиальной обструкции имеются:
- асимметрия хрипов;
- «воспалительная» гемограмма,
- асимметрия хрипов;
этом случае cледует исключить пневмонию, назначить рентгенологическое исследование. Госпитализации подлежат больные с признаками дыхательной недостаточности.
- Если у ребенка фебрильная температура в течение 1—2 дней при отсутствии указанных выше признаков, то его следует наблюдать на дому как больного ОРЗ без пневмонии.
Помимо перечисленных в схеме показаний к госпитализации, следует принимать во внимание такие факторы, как преморбидный фон (гипотрофия, аномалии конституции и др.), низкий социальный статус семьи, психологические особенности родителей.
Особенности клинических проявлений пневмонии зависят от возраста, преморбидного фона, морфологической формы заболевания и возбудителя (табл. 3).
Лечение
Пневмония — инфекционное заболевание, а потому главное в лечении больного — назначение антибиотиков.
Показаниями к госпитализации являются:
- Умеренный или тяжелый респираторный дистресс
- Недостаточность ответа на пероральные антибиотики
- Невозможность приема дома антибиотиков per os из-за рвоты или плохого самочувствия
- Долевые уплотнения более чем в одной доле
- Иммуносупрессия
- Эмпиема
- Абсцесс или пневматоцеле
- Лежащие в основе сердечно-легочные заболевания (например, бронхолегочная дисплазия или легочная гипертензия).
Основные принципы антибактериальной пневмонии следующие:
- антибиотики при установленном диагнозе или при тяжелом состоянии больного назначают незамедлительно, при сомнении в диагнозе у нетяжелого больного решение принимают после рентгенографии;
- первичный выбор антибиотика проводят эмпирически, ориентируясь на признаки, представленные в табл. 3, но, принимая во внимание этиологическую структуру «домашних» пневмоний, при наличии даже минимальных признаков бактериального токсикоза целесообразно начинать терапию с «защищенных» беталактамов — амоксиклав, аугментин и др. или цефалоспоринов II поколения, а при «атипичных» пневмониях — с современных макролидов (сумамед, макропен, кларитромицин и др.);
- макролидные антибиотики не следует назначать как препараты первого ряда при обычных — не «атипичных» пневмониях;
- показаниями к переходу на альтернативные препараты является отсутствие клинического эффекта от препарата первого выбора в течение 36–48 часов при нетяжелой и 72 часов при тяжелой пневмонии; развитие нежелательных побочных эффектов (прежде всего непереносимости — в первую очередь аллергических реакций) от препарата первого выбора;
- пневмококки устойчивы к гентамицину и другим аминогликозидам, поэтому терапия внебольничных пневмоний антибиотиками данной группы недопустима;
- при неосложненных нетяжелых пневмониях следует отдавать предпочтение назначению препаратов перорально, переходя на парентеральное введение при утяжелении течения заболевания; если терапия была начата парентерально, после снижения температуры и улучшении состояния больного следует перейти на пероральный прием антибиотика;
- после курса антибактериальной терапии целесообразно назначение биопрепаратов.
Рекомендованная антимикробная терапия для специфических патогенов
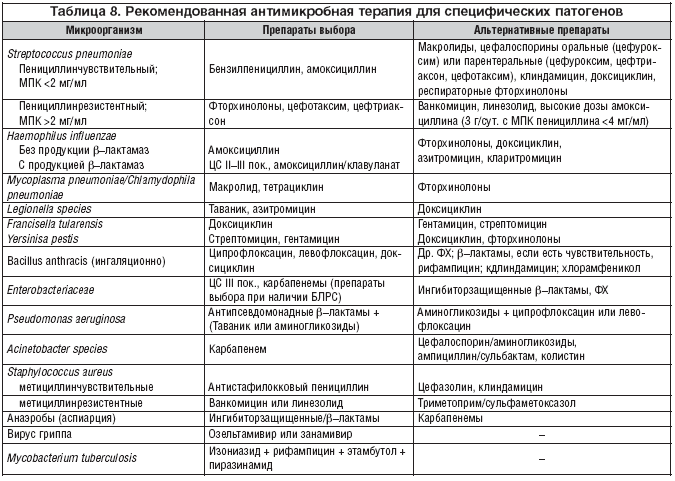
^
Другие виды лечения
- Постельный режим показан на весь лихорадочный период. Питание должно соответствовать возрасту и обязательно быть полноценным.
- Объем жидкости в сутки для детей до года с учетом грудного молока или молочных смесей составляет
- 140—150 мл/кг массы. Целесообразно 1/3 суточного объема жидкости давать в виде глюкозо-солевых растворов (регидрон, оралит) или фруктовых, овощных отваров. Диетические ограничения (химически, механически и термически щадящая пища) определяют в зависимости от аппетита и характера стула.
- В помещении, где находится ребенок, должен быть прохладный (18 — 19°С), увлажненный воздух, что способствует уменьшению и углублению дыхания, а также снижает потерю воды.
- Жаропонижающие средства систематически не назначаются, так как это может затруднить оценку эффективности антибактериальной терапии. Исключение составляют дети, имеющие преморбидные показания для снижения температуры.
Лихорадку при многих инфекционных заболеваниях, в том числе при острых респираторных инфекциях, следует рассматривать как фактор, стимулирующий защитные силы организма. Многие бактерии и вирусы быстрее гибнут при повышенной температуре, на ее фоне организм отдает полноценный иммунный ответ Th1-типа — продукцию g-интерферона, интерлейкина-2 и фактора некроза опухолей, стимулирующих продукцию IgG-антител и клеток памяти. Необоснованное и частое назначение лекарственных препаратов при любом повышении температуры может привести к различным осложнениям (сенсибилизация к лекарственным препаратам, агранулоцитоз, синдром Рея и др.).
Показаниями к медикаментозной терапии лихорадки являются:
- температура тела выше 39°С;
- плохая переносимость повышенной температуры (мышечная ломота и/или сильная головная боль и др.);
- повышение температуры до 38°С у детей младше 3 месяцев, с фебрильными судорогами в анамнезе и заболеваниями центральной нервной системы или хроническими, плохо компенсированными заболеваниями сердца, почек и др.;
- выраженная централизация кровообращения.
При «красном» типе лихорадки (горячие конечности, гиперемия лица, чувство жара) снижение температуры тела начинают с методов физического охлаждения. Тело ребенка обтирают в течение 5 минут водой 30—32°С. После обтирания ребенка не следует укутывать. Процедуру повторяют каждые 30 минут 3—4 раза.
При отсутствии эффекта от физических методов или при наличии описанных ранее показаний для медикаментозного снижения температуры назначается парацетамол (панадол, тайленол, эффералган и др.) в разовой дозе 10—15 мг/кг. Препарат дают ребенку не чаще 2—3 раз в сутки.
- Аспирин в педиатрической практике с целью снижения температуры тела при вирусных инфекциях не применяют ввиду возможного развития синдрома Рея, высокой частоты тромбоцитопатий в популяции (5%).
- Частое применение анальгина нежелательно из-за опасности развития агранулоцитоза, поражения почек.
- Из списка жаропонижающих препаратов, применяющихся у детей, в настоящее время исключен и амидопирин.
При наличии у ребенка «бледного» типа лихорадки (озноб, бледность и мраморность кожных покровов, холодные конечности) физические методы охлаждения не применяют. Лечение начинают с сосудистых препаратов в разовой дозе: никотиновая кислота — 1 мг/кг; дибазол — 0,1мг/кг; папаверин — 1 — 2 мг/кг. При потеплении конечностей, появлении чувства жара можно назначить возрастную дозу парацетамола.
При мучительном или упорном кашле у больных пневмонией широко используют мукорегуляторные средства: облегчающие эвакуацию мокроты (отхаркивающие) и разжижающие мокроту (муколитические) средства.
Отхаркивающие средства повышают секрецию жидкого компонента мокроты и улучшают транспорт мокроты за счет усиления моторики бронхов. При назначении отхаркивающих средств необходимо обеспечить достаточную гидратацию, поскольку потеря воды повышает вязкость мокроты. Применяют микстуры на основе настоя корня алтея с добавлением натрия бензоата, калия иодида и нашатырно-анисовых капель. Такие препараты, как бронхикум, «Доктор Мом», также относятся к отхаркивающим средствам.
Муколитические средства способствуют разжижению мокроты путем химического воздействия на молекулу муцина. При заболевании нижних дыхательных путей с образованием густой вязкой мокроты целесообразно использовать препараты, содержащие ацетилцистеин (АЦЦ, мукомист, флуимуцил, мукобене). Механизм действия ацетилцистеина связан со способностью свободных сульфгидрильных групп разрывать внутри- и межмолекулярные дисульфидные связи мукополисахаридов мокроты, что приводит к уменьшению вязкости мокроты. Доказано его антиоксидантное действие, способствующее поддержанию функциональной активности и морфологической целостности клеток респираторного тракта.
Муколитическим действием обладают производные алкалоида вазицина — бромгексин, бизолвон, мукосалван. Эти препараты уменьшают вязкость секрета, восстанавливают мукоцилиарный клиренс, стимулируют синтез эндогенного сурфактанта.
Карбоцистеины (мукодин, мукопронт, бронкатар) обладают одновременно мукорегулирующим и муколитическим эффектом. Под действием препаратов этой группы происходит регенерация слизистой оболочки бронхов, восстановление ее структуры, уменьшение количества бокаловидных клеток, восстановление секреции IgA, улучшение мукоцилиарного клиренса.
Ингаляции протеолитических ферментов (химотрипсин, химопсин и др.) исключены из арсенала пульмонологии, так как могут провоцировать развитие фиброзных изменений в легких.
Полезны настои трав (подорожник, крапива, мать-и-мачеха, корень ипекакуаны, плод аниса, корень солодки и др.) или лекарственных форм из них — эвкабал, мукалтин.
Ингаляции теплой водой или 2%-ным раствором натрия гидрокарбоната являются хорошими муколитиками и не намного уступают по эффективности муколитическим препаратам.
Антигистаминные препараты и средства, угнетающие кашель, не показаны.
Банки и горчичники в лечении детей раннего возраста, больных пневмониями, в настоящее время не используются.
- Массаж и ЛФК целесообразны сразу же после нормализации температуры.
- В стационаре детей помещают в отдельный бокс. Ребенок может быть выписан из стационара сразу же по достижении клинического эффекта для того, чтобы избежать суперинфекции и перекрестной инфекции. Сохранение увеличенной СОЭ, хрипов в легких или остаточных рентгенологических изменений не является противопоказанием к выписке.
Реабилитацию детей, перенесших пневмонию, обычно проводят в домашних условиях и назначая сочетанные курсы виферона-1 и бифидум-препаратов, комплекса витаминно-минеральных препаратов. У часто болеющих детей полезен курс ИРС-19 или рибомунила.
Профилактические меры включают:
- проведение комплекса социально-гигиенических мероприятий;
- рациональное питание, закаливание, улучшение экологии жилища;
- предупреждение ОРВИ, вакцинопрофилактика пневмоний, конъюгированная вакцина против H. influenzae, пневмококка, вакцинопрофилактика гриппа);
- профилактика внутрибольничных пневмоний (госпитализация в боксы, отказ от необоснованного назначения антибиотиков).
