Федеральное агентство по образованию бийский технологический институт (филиал)
| Вид материала | Учебное пособие |
- Федеральное агентство по образованию бийский технологический институт (филиал), 981.77kb.
- Федеральное агентство по образованию бийский технологический институт (филиал), 1531.98kb.
- Федеральное агентство по образованию Бийский технологический институт (филиал), 2694.55kb.
- Федеральное агентство по образованию бийский технологический институт (филиал), 2134.54kb.
- Федеральное агентство по образованию бийский технологический институт (филиал), 1660.78kb.
- Федеральное агентство по образованию бийский технологический институт (филиал), 1946.38kb.
- Решением Ученого совета, 125.93kb.
- Федеральная целевая программа "Развитие электронной компонентной базы и радиоэлектроники", 3538.74kb.
- Бийский технологический институт (филиал), 2586.35kb.
- Министерство образования и науки федеральное агентство по образованию майкопский государственный, 102.13kb.
1.9 Бризантные взрывчатые вещества [3]
По составу бризантные ВВ разделяются на две большие группы: индивидуальные вещества и взрывчатые смеси.
Наиболее распространенные индивидуальные бризантные ВВ относятся к органическим азотистым соединениям ароматического, алифатического и гетероциклического рядов, в том числе к нитросоединениям, содержащим группу NO2 (тротил, динитронафталин, тринитро-бензол, нитрометан), нитратам спиртов, содержащим группу ОNO2 (нитроглицерин, нитрогликоли, ТЭН), нитраминам, содержащим группу N-NO2 (тетрил, гексоген, октоген). Из неорганических соединений слабые взрывчатые свойства имеют аммониевые соли азотной (аммиачная селитра) и хлорной кислот (перхлорат аммония).
Вторую группу составляют взрывчатые смеси, которые состоят либо из окислителя и горючего, либо из одного или нескольких индивидуальных ВВ и различного рода добавок.
Во взрывчатых смесях типа окислитель–горючее в качестве окислителя применяют минеральные соли, способные при разложении выделять свободный кислород. К ним относятся соли кислот: азотной (нитраты аммония, калия, натрия и др.), хлорной (перхлораты аммония, натрия, калия) и хлорноватой (хлорат калия). В качестве горючего во взрывчатых смесях используют высококалорийные органические соединения (продукты переработки нефти, производные целлюлозы и др.), металлы и их соединения (алюминий, ферросилиций и др.), индивидуальные ВВ с отрицательным кислородным балансом, выделяющие при своем разложении горючие газы – оксид углерода, водород, метан и сажу (тротил, динитронафталин и др.).
На практике часто применяют смеси индивидуальных ВВ с металлами, в которых ВВ выступает в роли окислителя по отношению к металлу, например, смесь тротила с алюминием.
Взрывчатые смеси второго типа компонуются для достижения каких-либо специальных свойств ВВ, например, для снижения температуры плавления гексогена и октогена. Их смешивают с тротилом, у которого низкая температура плавления. К многим мощным индивиду-альным ВВ для снижения их чувствительности к механическим воздействиям добавляют небольшое количество низкоплавких углеводородов (воск, парафин, церезин). Такие вещества называются флегматизаторами. В другие смеси вводят вещества, повышающие чувствитель-ность к инициирующему импульсу. В данном случае эти вещества называются сенсибилизаторами. В качестве сенсибилизатора часто применяют нитроглицерин.
К важнейшим классам взрывчатых смесей относятся:
- аммониты, или аммиачно-селитренные ВВ, состоящие из смеси аммиачной селитры с нитросоединениями;
- сплавы и смеси нитросоединений;
- нитроглицериновые ВВ (динамиты);
- хлоратные и перхлоратные ВВ – смеси солей хлорноватой и хлорной кислот с нитросоединениями;
- взрывчатые смеси на основе жидких окислителей;
- смеси твердого окислителя с горючими веществами (например, аммиачная селитра с дизельным топливом).
Бризантные ВВ широко применяются в военном деле для снаряжения артиллерийских снарядов, бомб, торпед, мин и боевых частей ракет. Также ВВ используются для приготовления твердого ракетного топлива, для возбуждения взрыва атомных бомб и др. ВВ получили широкое применение в различных отраслях народного хозяйства: горной промышленности, на гидромелиоративных работах, в сельском хозяйстве, нефтедобывающей промышленности и т.д. ВВ, используемые для этих целей, называются промышленными ВВ (ПВВ).
В качестве исходных компонентов для рецептур военных ВВ используются штатные ВВ (тротил, гексоген, октоген и др.), к которым предъявляются жесткие требования по технологии производства.
Военные ВВ должны обладать высокой мощностью, бризантностью и фугасностью, большой скоростью детонации, а компоненты, входящие в состав, иметь высокую степень очистки, необходимую химическую и физическую стойкости, обеспечивающие стабильные свойства ВВ в течение длительного времени хранения боеприпасов. Данные характеристики необходимы, чтобы гарантировать максимальный разрушающий и поражающий эффекты, надежность и безотказность, высокую воспроизводимость всех параметров боеприпасов.
К промышленным ВВ таких жестких требований не предъявляют. Большинство технических задач, связанных с применением взрывчатых технологий, может быть решено менее мощными ВВ, чем военные, обладающими значительно меньшими скоростями детонации и теплотворной способностью, относительно невысокой степенью очистки компонентов. Они могут быть менее бризантными и фугасными, а в отдельных случаях иметь лишь «мягкий» раскалывающий эффект. Для ПВВ химическая и физическая стойкости не должны определяться десятилетиями, поскольку их реализация после изготовления происходит, как правило, в течение короткого промежутка времени.
Вместе с тем к ПВВ предъявляется ряд специфических требований:
- производство должно опираться на хорошо развитую и доступную сырьевую базу;
- технология производства должна быть простой и осуществляться доступными техническими средствами;
- продукты взрыва не должны быть токсичными, должны быть экологически чистыми, чтобы не оказывать вредное воздействие на окружающую среду;
- должны обладать низкой чувствительностью к механическим и тепловым воздействиям и быть безопасными при обращении и транспортировке;
- взрыв заряда не должен являться причиной возгорания или взрыва шахтных газов (например, метана), угольной пыли;
- себестоимость не должна быть высокой.
Рассмотрим некоторые виды бризантных ВВ.
1.9.1 Нитроглицерин [3, 4, 10, 11]
Нитроглицерин, или тринитрат глицерина (ТНГ), получают обработкой глицерина смесью азотной и серной кислот (47–50 % НNO3,
49–53 % H2SO4). Реакция получения ТНГ следующая:
 C3H5(OH)3 + 3HNO3 C3H5(ONO2)3 + 3H2O
C3H5(OH)3 + 3HNO3 C3H5(ONO2)3 + 3H2OЭтерификация протекает последовательно в три ступени: в первой получается мононитрат, во второй – динитрат и в третьей – тринитрат глицерина. Более 60 лет нитроглицерин получали по периодической схеме (метод Нобеля и метод Натана). При получении пери-одическими способами на фазах сепарации и очистки нитроглицерина от кислот скапливалось около 2–3 тонн нитроглицерина, что в случае аварии приводило к практически полному разрушению оборудования и производственных зданий.
В настоящее время в производстве применяются в основном непрерывные методы. При непрерывном методе в процессе находится меньшее количество ВВ, благодаря чему снижается опасность производства.
Нитрование глицерина происходит в нитраторе непрерывного действия в среде отработанной кислоты (рисунок 7).
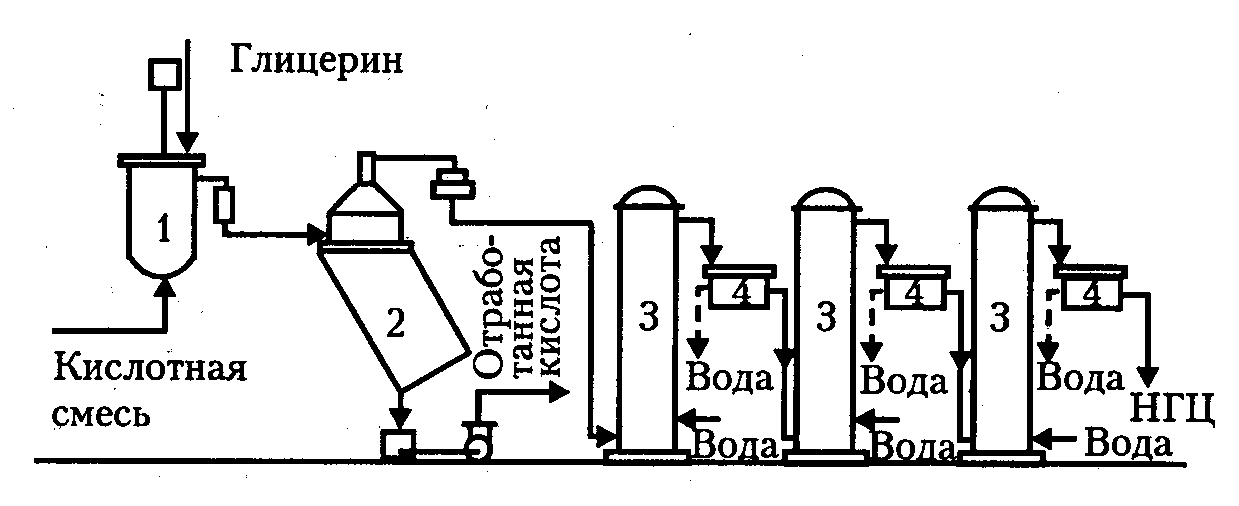
1 – нитратор; 2, 4 − сепараторы; 3 − промывные колонны
Рисунок 7 − Технологическая схема непрерывного процесса
производства нитроглицерина
После нитрации глицерина в нитраторе получается эмульсия нитроглицерина в отработанной кислоте, которую необходимо быстро отделить от отработанной кислоты. Разделение нитроглицерина и отработанных кислот основано на различии их плотностей и осущест-вляется на фазе сепарации. Возможны два способа сепарации:
1. Из концентрированных кислотных смесей, когда плотность нитроглицерина меньше плотности кислотной смеси. В этом случае нитроглицерин собирается в верхней части сепаратора и сливается через верхнюю переливную трубу за счет притока новой порции кислотной смеси. Данный способ получения нитроглицерина назван сепарационным.
2. Из разбавленной кислотной смеси. В этом случае плотность нитроглицерина оказывается больше, чем разбавленной кислотной смеси, и нитроглицерин собирается в нижней части аппарата. Этот метод получения нитроглицерина называется бессепарационным, хотя принципиально неверно, т.к. операция сепарации имеется.
Первый метод получения нитроглицерина более экономичен, т.к. отработанная кислота может быть снова использована в производстве, а второй метод является более безопасным, т.к. разбавленная отработанная кислота менее реакционноспособна.
После отделения от кислоты нитроглицерин поступает на стабилизацию для более глубокой очистки его от кислот и примесей (сульфо- и сульфонитроэфиров, неполных нитратов), которые снижают химическую стойкость основного продукта. Стабилизация заключается в проведении многократных водных и щелочных промывок.
Существует более современный метод получения нитроглицерина, который был разработан в Швеции, это инжекторный метод.
Особенностью этой технологической схемы (рисунок 8) является проведение нитрации глицерина в инжекторе при повышенной температуре (46–48 °С) под вакуумом и отделение нитроглицерина от отработанных кислот в центрифуге.
Свойства нитроглицерина. Химически чистый нитроглицерин – это маслообразная, бесцветная, прозрачная жидкость. Плотность
1600 кг/м3 (1,6 г/см3). Затвердевая, может образовывать две формы:
лабильную, с температурой затвердевания 2,1 С, и стабильную, с температурой затвердевания 13,2 °С. Нитроглицерин частично растворим в воде: при 20 °С в одном литре воды растворяется 1,8 г нитроглицерина, а при 50 °С – 2,5 г.
Нитроглицерин хорошо растворяется во многих органических растворителях: ацетоне, диэтиловом эфире, метиловом спирте, бензоле, толуоле, ксилоле, нитробензоле и многих других. Нитроглицерин сам хорошо растворяет динитротолуол и тринитротолуол, что имеет большое значение для производства пластичных и желатинирован-
ных ВВ. В нитроглицерине растворяется нитроцеллюлоза с содержанием азота около 12 % (коллоксилин). Это свойство используется при изготовлении бездымного нитроглицеринового пороха и желатин-ди-намитов.
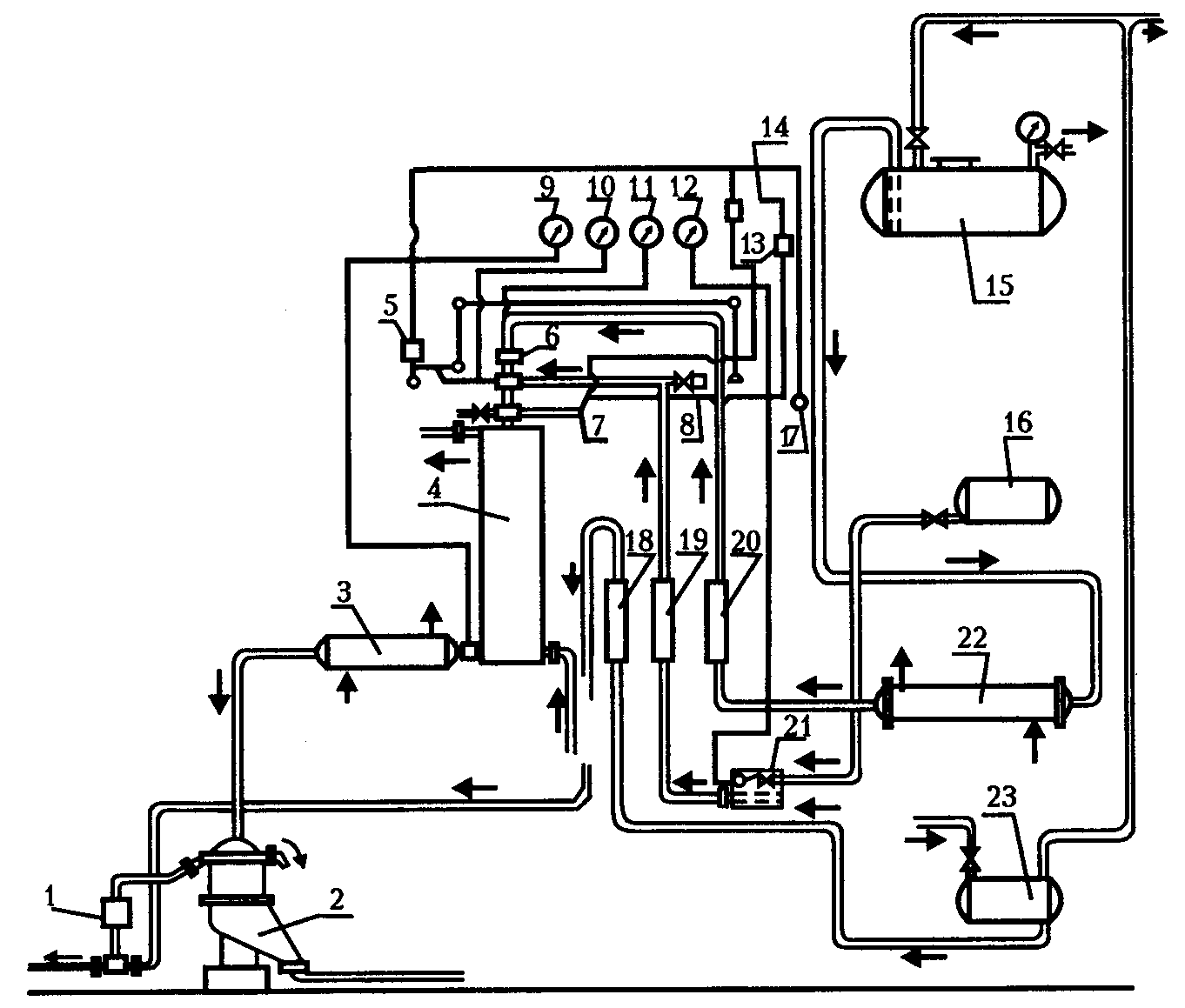
1 − инжектор для подачи водной эмульсии нитроглицерина на фазу
стабилизации в промывные колонны; 2 − центрифуга;
3, 22 − кожухотрубные теплообменники; 4 − холодильник;
5 − электромагнит; 6 − инжектор-нитратор; 7, 9, 11, 12 − термометры;
8 − игольчатый клапан для впуска воздуха в инжектор;
10 − вакуумметр; 13 − электромагнитное реле; 14 − сигнальный
колокол; 15 − хранилище кислотной смеси; 16 − хранилище глицерина; 17 − выключатель; 18 − ротамер для воды; 19 − ротамер для глицерина; 20 − ротамер для кислотной смеси; 21 − засасывающий бак
с постоянным уровнем для глицерина; 23 − хранилище воды
Рисунок 8 − Технологическая схема получения нитроглицерина
инжекторным методом (фаза нитрации и сепарации)
Нитроглицерин горит на воздухе зеленоватым пламенем со вспышками и треском. Горение большого количества нитроглицерина сопровождается взрывом. При быстром нагревании до 180 °С нитроглицерин взрывается. При медленном нагревании температура вспышки нитроглицерина 215–218 °С. Нитроглицерин очень чувствителен к удару и трению. При испытании на вертикальном копре при стандартных условиях дает 100 % взрывов. В этом случае нитроглицерин приближается к инициирующим ВВ, поэтому в чистом виде он не перевозится. Взрывчатое разложение нитроглицерина происходит по уравнению:
2C3H5(ONO2)3 = 6СО2 + 5H2O + 3N2 + 0,5О2.
Скорость детонации жидкого нитроглицерина 1100−2000 м/с. Нитроглицерин применяется в качестве пластификатора нитроцеллюлозы при изготовлении баллиститных порохов, а также для приготовления динамита, который состоит из 92−93 % нитроглицерина и 7−8 % коллоксилина. Применяется нитроглицерин для получения промышленных ВВ (угленитов). ТНГ нашел широкое применение в медицине для лечения сердечно-сосудистых заболеваний. Лекарственные препараты на его основе готовятся либо в виде таблеток, либо в виде капсул (раствор нитроглицерина в подсолнечном масле).
1.9.2 Гексоген [3,4]
Химическое название – циклотриметилентринитроамин. Химическая формула:

Получают гексоген нитрованием уротропина, причем существует несколько методов получения: окислительный, метод «К», уксусно-ангидридный.
Окислительный метод заключается в обработке уротропина концентрированной азотной кислотой, выделении гексогена из отработанной кислоты, фильтровании, промывке и сушке.
По методу «К» уротропин подвергается нитролизу раствором аммиачной селитры в концентрированной азотной кислоте.
Уксусно-ангидридный метод имеет несколько вариантов, один из которых (метод «КА») состоит из следующих операций: получение динитрата уротропина, получение тринитрата аммония и нитролиз динитрата уротропина тринитратом аммония в присутствии уксусного ангидрида.
Свойства и применение гексогена. Гексоген представляет собой кристаллическое белое вещество без запаха и вкуса. Он является сильным ядом, поэтому при работе с ним необходимо соблюдать правила техники безопасности. Плотность гексогена 1816 кг/м3 (1,816 г/см3), температура плавления 204,5–205 °С. При нагревании гексоген начинает разлагаться при 203 °С, причем при данной температуре отмечается повышенная чувствительность его к удару и трению. Поэтому снаряжение им боеприпасов производят не заливкой, а только прессованием. Для уменьшения чувствительности к удару и трению его флегматизируют парафином, воском, церезином и другими веществами.
Гексоген является мощным бризантным веществом. Скорость детонации при плотности 1700 кг/м3 (1,7 г/см3) равна 8380 м/с.
Чистый гексоген применяется для изготовления капсюлей-дето-наторов и как энергетическая добавка в некоторых составах баллиститных порохов. Гексоген в смеси с другими ВВ находит применение для снаряжения артиллерийских снарядов, авиационных бомб, морских мин, торпед.
1.9.3 Октоген [3,4]
Химическое название циклотетраметилентетранитрамин. Химическая формула:

Октоген существует в четырех кристаллических модификациях (α, β, γ, δ). Получают октоген нитролизом уротропина нитратом аммония в азотной кислоте в присутствии уксусного ангидрида и параформальдегида. Мольное соотношение компонентов подбирают так, чтобы обеспечивался максимальный выход октогена при минимальном выходе гексогена. Получают продукт, который содержит 30–40 % гексогена и 60–70 % октогена. Затем октоген отделяют от гексогена. Разделение основано на значительно большей (в четыре раза) растворимости гексогена в ацетоне, чем октогена. Проводят обработку продукта трехкратным количеством ацетона, при этом почти весь октоген отфильтровывают.
Гексоген выделяют путем разбавления ацетонового раствора водой (гексоген выпадает в осадок).
Выход чистого октогена составляет 50–55 % по уротропину.
Свойства октогена и его применение. Октоген – это высокоплавкое белое кристаллическое вещество. На практике нашла применение β-форма октогена, температура плавления которой 270 °С. По сравнению с гексогеном он более термостоек. Температура начала разложения 220 °С, поэтому октоген плавится с разложением. Скорость детонации при плотности 1900 кг/м3 (1,9 г/см3) составляет 9124 м/с.
Высокая термостойкость октогена позволяет использовать его в зарядах, подверженных воздействию высоких температур, например, при проведении взрывных работ в глубоких и сверхглубоких скважинах, в боеприпасах для сверхзвуковой авиации. По сравнению с гексогеном у октогена более высокая скорость детонации, большая бризантность и мощность.
Применяют октоген в качестве энергетической добавки в твердых ракетных топливах и артиллерийских порохах, также используют как в виде самостоятельных зарядов, так и в смеси с тротилом (октолы).
1.9.4 Нитраты целлюлозы [4, 11–16]
Нитраты целлюлозы (НЦ) получают действием на целлюлозу азотно-серной кислотной смеси с небольшим добавлением воды. Реакция протекает по следующей схеме:
[C6H7O2(OH)3]m+mnHNO3
 [C6H7O2(OH)3(ONO2)n]m+mnH2O,
[C6H7O2(OH)3(ONO2)n]m+mnH2O,где n – степень этерификации;
m – степень полимеризации.
Серная кислота необходима для активации азотной кислоты и связывания воды, выделяющейся во время реакции.
Изменяя состав кислотной смеси, можно получить нитраты целлюлозы с разной степенью этерификации, то есть с разным содержанием азота. Важными показателями являются также растворимость нитратов целлюлозы в органических растворителях (определяет расход растворителей при их переработке) и вязкость (определяет механическую прочность пленок или каких-либо изделий).
В зависимости от содержания азота в них, растворимости в спиртово-эфирной смеси и вязкости 2%-ных растворов НЦ в ацетоне выпускают марки нитратов целлюлозы, представленные в таблице 1.
Таблица 1 − Технические характеристики нитратов целлюлозы
| Вид нитрата целлюлозы | Техническое название | Содержание азота | Условная вязкость, мПа·с (оЭ − градус Энглера) | Область применения | |
| N, % | мл NO/г | ||||
| 1 | 2 | 3 | 4 | 5 | 6 |
| Лаковый высоковязкий коллоксилин | Коллоксилин ВВ | 11,91− 12,29 | 190−196 | 8,5−10,6 (1,9−2,2) | Авиалаки, изоляционные лаки |
| Лаковый средневязкий коллоксилин | Коллоксилин СВ | 11,91− 12,29 | 190−196 | 3,8−8,4 (1,31−1,89) | Лаки для дерева, искусственной кожи, клеящие составы |
| Лаковый низковязкий коллоксилин | Коллоксилин НВ | 11,91− 12,29 | 190−196 | 1,9−3,7 (1,11−1,30) | Эмали, грунтовки, шпаклевки, клеящие составы |
| Лаковый весьма низковязкий коллоксилин | Коллоксилин ВНВ | 11,91− 12,29 | 190−196 | 1,1−1,8 (1,03−1,10) | Лаки для металла, эмали для машин |
| Лаковый полусекундной вязкости коллоксилин | Коллоксилин ПСВ | 11,91− 12,29 | 190−196 | 0,6−1,0 (0,98−1,02) | Лаки для мебели, бумаги, нитропленки |
| Лакомастичный коллоксилин | Коллоксилин ЛМ | 10,66− 12,41 | 170−198 | 3,7−15,8 (1,3−3,0) | Мастика для изготовления технических тканей |
| Целлулоидный коллоксилин | Коллоксилин ЦК | 10,97− 11,22 | 175−179 | 6,2−10,6 (1,6−2,2) | Мячи для нас-тольного тенниса |
| Коллоксилин «Н» | Коллоксилин НХ, НД | 11,85− 12,29 | 189−196 | 8,5−15,8 (1,9−3,0) | Для баллиститных порохов |
Продолжение таблицы 1
| 1 | 2 | 3 | 4 | 5 | 6 |
| Пироксилин №1 | Пироксилин 1П | не менее 13,10 | не менее 209 | 8−12 | Для пироксилиновых порохов |
| Пироксилин №2 | Пироксилин 2П1, 2П2, 2П3 | 11,79−12,41 | 188−198 | 6−10 | Для пироксилиновых порохов |
1.9.4.1 Влияние некоторых факторов на процесс нитрования
целлюлозы
