Пульмонология и фтизиатрия
| Вид материала | Книга |
- Председатель Форума Российская Федерация проф. Аметов А. С., президент Международной, 74.92kb.
- И. Н. Денисов 22 декабря 2000, 2488.09kb.
- Тематический план практических занятий на 3-й кафедре внутренних болезней для субординаторов, 28.88kb.
- Тематический план практических занятий на 3-й кафедре внутренних болезней для субординаторов, 26.67kb.
- Учебно-тематический план подготовки специалистов в клинической интернатуре по программе, 213.53kb.
- Коллапсотерапия в комплексном лечении деструктивного туберкулёза лёгких 14. 00., 428.25kb.
- Учебный план цикла общего усовершенствования (ОУ) пульмонология, 984.14kb.
- Программа подготовки клинических ординаторов по специальности «фтизиатрия» (очная, 919.07kb.
- Индивидуальный план прохождения интернатуры 4 Ночные дежурства 23 Работа в поликлинике, 1477.91kb.
- Особенности клинико-лабораторных проявлений инфильтративного туберкулеза легких при, 644.41kb.
4. Радионуклидные методы исследования во фтизиатрии.
Изучение функционального состояния органов дыхания является одной из важных задач современной фтизиатрии и пульмонологии. Важная роль в диагностике туберкулеза легких принадлежит рентгенологическому методу, который остается только составной частью общеклинического обследования больных туберкулезом. Однако, традиционные клинико-рентгенологические и функциональные методы исследования у больных туберкулезом легких не всегда могут раскрыть картину вентиляционно-перфузионных нарушений, детально изучить микроциркуляцию легких, функцию внутригрудных лимфатических узлов, мукоцилиарный клиренс бронхов, и т.д. С этой целью для изучения функционального состояния органов дыхания во фтизиатрии и пульмонологии применяются современные радионуклидные методы исследования – комплексная сцинтиграфия органов дыхания и других органов. Она состоит из динамической и статической сцинтиграфии.
Статическая сцинтиграфия позволяет изучить регионарный кровоток капиллярного русла легких. С этой целью применяются частицы макроагрегата альбумина человеческой сыворотки (МАА), меченные радиоактивными элементами: технецием (Тс-99m), йодом (I–131) или индием (In-113m). Первое сообщение о сканировании легких с целью изучения легочного кровообращения при помощи частиц активированного угля, меченных золотом (Au-198), принадлежит немецким исследователям (H. Ernst et al. 1958). Детальная методическая разработка изучения регионарного кровотока легких является заслугой I.West et al (1959) в лаборатории D.Bates. В 1965 г. американский исследователь G.Taplin et al получил частицы МАА размером от 10 до 80 мкм, пригодного для сканирования легких, путем сочетания термической обработки человеческой сыворотки с подбором рН. Этот препарат привлек внимание исследователей в виду его физиологичности и быстрого выведения из легких.
Динамическая сцинтиграфия изучает регионарную вентиляцию легких с использованием воздушно-капельной смеси, меченным радиоактивным ксеноном (Хе-133) или криптоном (Кr-81). Впервые с целью изучения регионарной легочной вентиляции был применен радиоактивный газ Хе-133 профессором (W. Bolt) в клинике Книппинга (H. Knipping) в 1955 году, а через шесть лет это исследование было существенно дополнено изучением регионарного легочного кровотока с тем же Хе-133 (W. Ball et al.1961).
Методы исследования
1.Вентиляционная сцинтиграфия легких с радиоактивным ксеноном - 133 (Хе-133).
2.Перфузионная сцинтиграфия легких с водным раствором ксенона - 133 (Хе-133).
3.Сцинтиграфия регионарного кровотока легких с технецием –99м ( Тс-99m), индием – 113 м (In-113m ) или йодом – 131 (I-131).
4.Позитивная сцинтиграфия внутригрудных лимфатических узлов с цитратом галлия –67 (Ga-67).
5.Аэрозольная сцинтиграфия бронхов с макрочастицами меченные Тс-99м.( МАА Тс-99m).
6.Радионуклидная функция резорбции плевры с «технефитом» меченные Тс-99m.
Эти методы показаны и применяются, в основном, у взрослых пациентов: 1) для выявления локализации тромбоэмболии мелких ветвей легочной артерии; 2) при легочной диссеминации неясной этиологии; 3) при подозрении на скрытую форму эмфиземы легких; 4) при подозрении на врожденную легочную патологию; 5) при нарушение легочной вентиляции; 6) при подозрении на онкологию легких. 7) для контроля за эффективностью антибактериальной и патогенетической терапии; 8) для определения объема хирургического лечения; 9) для определения степени оперативного риска; 10) для контроля функционального состояния легочной ткани в послеоперационном периоде.
Радионуклидные исследования противопоказаны лицам с кровохарканием, кровотечением из легких, больным с высокой температурой тела, детям до одного года и беременным женщинам.
Сцинтиграфии органов дыхания применяется - для выявления локализации, распространенности и степени выраженности патологического процесса, а также изученияния функциональных изменений регионарного кровотока, вентиляции легких, лимфатических узлов средостения, может использоваться как тест контроля за проводимым лечением.
- Вентиляционная сцинтиграфия легких с газообразным Хе-133 ”болюсным способом” основана на ингаляционном введении радиоактивного газа с помощью резинового загубника, подключенного к любому спирографу, т.е. для создания замкнутой системы “пациент – спирограф”. Этим методом определяется состояние проходимости трахеобронхиальных путей легких, изучается время заполнения, смешивания и полувыведения газообразного Хе-133 из трахеобронхиального пространства ( Рис-1). Радиоактивный газ Хе-133 поставляется во флаконе, упакованый в свинцовый контейнер и состоит из газообразного и водного раствора. Он не имеет цвета, вкуса, запаха, в 1½ раза тяжелее воздуха, мало растворим в воде. Лучевая нагрузка на легкие составляет 0,06 мЗв. Энергия излучения гамма-квантов равна 81 кэВ, период полураспада – 5,27 дня, биологический период полувыведения около одной минуты.
- Перфузионная сцинтиграфия легких с использованием водного раствора Хе-133 основана на внутривенном введении РФП и задержки дыхания на глубоком вдохе пациента. Данная методика характеризует скорость «диффундирования» или проникновения, РФП через мембраны капиллярного русла в альвеолы легкого, бронхи и далее в трахею (Рис-2). Эта методика позволяет характеризовать перфузию капиллярного русла легкого и тем самым выявить скрытую форму эмфиземы легких, установить ее объем и локализацию. Лучевая нагрузка на легкие составляет 0,011 мЗв. Водный раствор Хе-133 имеет такие же физико-химические характеристики, что и газообразный ксенон.
- Сцинтиграфия регионарного кровотока легких проводится короткоживущими РФП (Tc-99m, или In-113m) получаемые из генератора технеция или генератора индия. В частности, Тс-99m получают из молибденового генератора в виде элюата пертехнетата натрия, используемого в качестве самостоятельного фармацевтического препарата, для приготовления специальных реагентов. Отфасованная удельная активность Тс-99m с помощью шприца переносится в специальный реагент с микросферами альбумина (МАА) – набора «ТСК-5, ТСК-8 или Pulmocis». Флакон с набором реагента Тс-99m встряхивают 2-3 раза (в руках), и взвесь готова к применению. Препарат вводится внутривенно из расчета 2-3 мкКи на 1 кг массы тела. Эта методика основана на «микроэмболизации» капиллярного русла легких и предназначена для определения локализации, распространенности и степени активности нарушения микроциркуляции легких (Рис-3, 3а). Лучевая нагрузка на легкие составляет 0,057 мЗв. Энергия излучения гамма-квантов Tc-99m равна 140 кэВ, период полураспада – 6 часов. Энергия In-113m равна 393 кэВ, период полураспада - 1,7 часа. Лучевая нагрузка равна 0,005 мЗв.
Сцинтиграфия легких может проводиться с МАА меченным I-131 (перфузионно), для этого необходима «блокада щитовидной железы, так как радиоактивный йод отщепляется от альбумина и с током крови попадает в щитовидную железу, оказывая на нее значительную лучевую нагрузку. С этой целью за 2 дня до проведения исследования и в течение недели после него, обследуемый принимает раствор Люголя по 4-5 капель два раза в день. Лучевая нагрузка составляет 1,8 мЗв. Энергия излучения I-131 равна 360 кэВ, период полураспада – 8,2 дня.
- Позитивная сцинтиграфия ВГЛУ с цитратом Ga-67 предназначена для выявления локализации, распространенности и степени активности патологического процесса в лимфатических узлах средостения, паренхиме легкого и других органов.
Данный препарат, при внутривенном введении, быстро связывается с в-глобулинами сыворотки крови и в дальнейшем избирательно накапливается в богатых лизасомами клетках, особенно в фагоцитах ретикулярной ткани. Препарат вводится внутривенно в объеме 1,0 мл. с удельной активностью 80-85 МБк, и через 48-72 часа после введения проводится исследование на гамма-камере или сканере в положении сидя или лежа, в передней и задней проекциях. В норме через 48 часов после введения цитрат Ga-67 фиксируется, прежде всего, в печени (норма), затем в убывающем порядке; в селезенке, почках, костях, кишечнике. Визуальная картина цитрата Ga-67 выявляется при аденопатии ВГЛУ средостения и легких. Особенно это отмечается при активной фазе саркоидоза органов дыхания, при затянувшейся пневмонии, при активной фазе туберкулеза или рака легких, а также и других органов. Отмечается интенсивное вкючение РФП в зависимости от гистологической структуры воспалительного процесса в легких, чаще в лимфатических узлах и при карциномах. Особое внимание обращается на бифуркационные, медиастинальные лимфоузлы, т.е. на поражение тех узлов, которые трудно поддаются клинико-рентгенологическому распознаванию (Рис 4, 4а). При доброкачественных образованиях легких, таких как; аденомы, гамартромы, туберкуломы, при отсутствии аденопатии, цитрат Ga-67 не фиксируется. Лучевая нагрузка составляет 0,07 мЗв. Энергия излучения Ga-67 имеет три уровня: 92 кэВ, 300 кэВ и 394 кэВ. Период полураспада 78,2 часа.
- Аэрозольная сцинтиграфия бронхов (исследование мукоцилиарного клиренса бронхов МЦК) с макрочастицами альбумина меченными Тс-99m (МАА-Тс-99m), предназначается для диагностики мукоцилиарной недостаточности бронхов и оценке проводимого лечения, в том числе, могут служить дополнительной информацией при определении показаний к хирургическому вмешательству на легких и бронхах.
Ингаляция с РФП может производится с помощью ультразвукового ингалятора (Тур-Узи - 50). Данный тип ингалятора позволяет под действием ультразвука образовывать «туман» размер частиц (от 10 до 50 мкм) и высокой устойчивостью аэрозольного воздушного потока в пределах 3-15 л/мин. С этой целью используется препарат МАА из набора ТСК-5 или ТСК-8, который поставляется во флаконе 5 мг в виде сухого порошка. Для маркировки макро частиц, из генератора Тс-99, получают 10 мл. стерильного элюата и вводят его во флакон с МАА. В течение 3-5 минут флакон встряхивается для получения прочной связи между частицами МАА и изотопом Тс-99м. Для одной ингаляции достаточно2-3мл взвеси РФП активностью 300-400 МБк.
Ингаляцию проводят натощак в положении больного сидя, в течении 2 минут со скоростью 10 л/мин в режиме спонтанного дыхания. За сутки до начала исследования пациенту отменяются все препараты, влияющие на мукоцилиарный транспорт: бронхолитики, адренолитики, отхаркивающие средства, а также спазмолитики. Ультразвуковой ингалятор помещается в вытяжной шкаф, сообщающийся с вентиляционной системой, в конце которой находится фильтр. Вытяжной шкаф закрыт свинцовым экраном. Для обеспечения выдыхаемого воздуха вместе с РФП в вентиляционную систему, к ультразвуковому ингалятору приспособлена специальная ингаляционная установка, которая состоит из загубника, трубки с клапаном для вдоха, зажим для носа, трубки для выдоха с обратным клапаном (Рис- 5).
С Х Е М А
ИНГАЛЯЦИОННОГО ВВЕДЕНИЯ МИКРОСФЕР
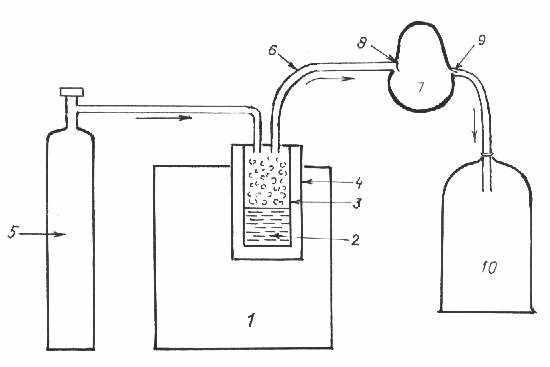
1. Ультразвуковой аппарат УЗИ-50
2. Раствор МАА меченный Тс-99m
Стаканчик с раствором МАА Тс-99m
Стаканчик свинцовый
Кислород
Воздуховод
Маска
Клапан впускной «лепесток»
Клапан выпускной «лепесток»
Пластиковый или полиэтиленовый мешок.
В связи с тем, что показатели МЦК находятся в зависимости от исходного уровня отложения РФП в дыхательных путях, больным с бронхиальной обструкцией для повышения точности исследования, во время ингаляции, задается определенный режим дыхания, т.е. через каждые 15-20 сек. спокойного дыхания предлагается проведение глубокого вдоха в такте нормального дыхания. Во время процедуры пациент заглатывает слюну, и наличие РФП в пищеводе затрудняет интерпретацию радионуклидной информации, с целью очищения пищевода предлагается пациенту выпить небольшое количество жидкости. После этого пациент укладывается на спину на каталке под детектором гамма-камеры. Правильность положения грудной клетки под детектором можно определить на экране «персистенскопа» визуально. Важное значение имеет положение грудной клетки пациента под детектором, которая не должна меняться во время всего исследования. Необходимо регистрировать каждый кашлевой толчок, если он имеет место, поскольку кашель искажает истинный клиренс бронхов. Далее, включается гамма-камера, включается персональный компьютер с программным обеспечением и через каждые 10 мин в течении одного часа фиксируется активность в бронхах. Количественную оценку МЦК осуществляли на основании изучения уменьшения активности в каждом легком отдельно. С помощью компьютера строится кривая выведения РФП за один час исследования. В качестве показателя МЦК для построения графика кривой использовали процент выведения РФП из трахеобронхиального дерева. При расчете показателей МЦК производили коррекцию кривой выведения РФП на физический распад радионуклида.
- Радионуклидная функция резорбции плевры с технефитом. Перед тем, как у пациента исследуется резорбция плевральной полости, проводится элюирование генератора Тс-99, т.е. получают свободный «пертехнетат» в объеме 10,0 мл с соблюдением полной стерильности. Полученную активность переносят во флакон с реагентом «технефита», затем, флакон встряхивается 2-3 раза и препарат готов к применению.
Выбранный РФП «технефит», меченный Тс99m, является коллоидным раствором, который диффундирует через просвет лимфатических сосудов, не проникая в норме через эндотелий капилляров, т.е. это характеризует лимфоток париетальной и висцеральной плевры. Далее, из флакона набирается в стерильный шприц 1,0 мл раствора технефита меченного радиоактивным Тс-99m с удельной активностью 100-120 МБк, производится замер импульсов под детектором гамма-камеры или под любым детектором измерительного прибора типа гамма-счетчика. Счет импульсов проводится за одну секунду, получается 4-х или 5-и значное число, и так повторяется 5-6 раз. Затем, все числа суммируются и делятся на количество повторяемого счета, и тем самым, определяется среднее количество импульсов в шприце.. Таким образом, предварительная, подготовка к исследованию плевральной полости закончена.
Далее, в процедурном кабинете, пациенту проводится плевральная пункция до полной аспирации экссудата и при необходимости - промывание плевральной полости, и через ту же иглу вводится 1,0 мл отфасованного коллоида (раствор технефита меченного Тс-99m.). Через 30 мин осуществляется забор крови из локтевой вены в объеме строго 1,0 мл. Пустой шприц и взятая кровь - повторно определяется счет импульсов под детектором гамма-камеры (Рис. Схема 6). На этом исследование резорбции плевральной полости заканчивается, и переходят к обработке полученных данных по указанной формуле ниже. Лучевая нагрузка на легкие составляет 0,057 мЗв.
Аппаратура
Для осуществления радионуклидной сцинтиграфии органов дыхания у больных туберкулезом легких и неспецифическими заболеваниями применяют радиометрическую аппаратуру типа сканеров и сцинтилляционные гамма-камеры.
Наиболее известные модели сканеров отечественного и зарубежного производства («ГТ-2», «Магносканер-500» фирмы «Picker», «Планисканер –СС-16-ДЗ-90» фирмы «Делтроникс», «Мемодат-М-8100» фирмы «Гамма» и др.) как правило, скорость сканирования 2-50 мм/с. и изображение органа производится на писчей бумаге в масштабе 1:1. Современные сканеры используют разный цвет штриховки в зависимости от учитываемой детектором скорости счета излучения, что наглядно позволяет определить рисунок распространенности и локализацию концентрации РФП в исследуемом органе. Красным цветом обозначаются максимальные уровни счета. Сканер дает относительно четкую информацию о распределении РФП, однако имеет ряд недостатков; поиск «фото-пика» производится вручную, невозможно проводить динамические исследования, для получения изображения легких, только в одной проекции, требуется 20-25 мин. и т.д.
От линейных сканеров существенно отличаются сцинтилляционные гамма-камеры типа «Энжера». Последние снабжены системами видеозаписи и компьютерного анализа, с помощью которых можно получить визуальную картину легких, выбрать зоны «интереса», дать динамическую характеристику исследуемого органа в виде графического изображения и т.д. Получение сигнала на экране осциллоскопа может регистрироваться на поляроидной пленке или с помощью «стоп» - камеры на фотопленку в реальном масштабе. Анализ сцинтиграмм полученных на гамма-камере производится с помощью ЭВМ (персонального компьютера) и программного обеспечения «Синтипро» или «Голд-рада».
Исследование органов дыхания (легких и ВГЛУ) на гамма-камере можно проводить полипозиционно в зависимости от предложенной программы и выбора положения пациента (лежа, сидя, стоя). Время исследования зависит от поставленных клиницистами цели и задач, и составляет от 1 до 10-15 мин. Таким образом, сцинтилляционная гамма-камера является универсальным прибором, позволяющим получить данные о функции исследуемого органа дыхания не только в статическом режиме, но и в динамическом режиме.
В медицинских учреждений нашей страны для изучения альвеолярной вентиляции и «диффузии газов» легких с использованием Хе-133 может еще применяться отечественная 8-детекторная установка «Ксенон-1» или «УР-1-8». Одной из последних моделей многодетекторных систем является сцинтилляционная установка «КЕФУТ В-1-1200» фирмы «Медивалмет» (Финляндия). Она имеет 16 детекторов – 8 сзади и 8 спереди. В комплект прибора входят спирограф емкостью 80 л и медицинский компьютер «Нова-2», исключающий необходимость ручной обработки получаемых данных и тем самым повышающий надежность и объективность информации. Однако, данный прибор имеет один недостаток, нет визуальной картины изображения органов дыхания.
Сцинтиграфическое описание легких в норме
Изображения легких, полученные на сцинтиграммах или сканограммах, имеют ряд особенностей и общих характеристик. На сцинтиграмме (в норме) в передней проекции интенсивность включения РФП равномерно понижается к периферии. В области верхушек обоих легких наблюдается некоторое снижение накопления РФП. Между обоими легкими имеется зона арадиоактивности, образуемая средостением и располагающимися в нем крупными сосудами, трахеей и пищеводом. Левое легкое несколько сужено, преимущественно в средне-нижних отделах за счет суперпозиции сердца. В задней проекции оба легких выглядят практически одинаковыми. Размер их заметно больше, чем в передней проекции, за счет визуализации легочной ткани, находящейся в заднем диафрагмальном синусе. Видна зона арадиоактивности, образуемая за счет позвоночника и прилегающих к ним мышц спины. В передней проекции лучше определяются верхние, а в задней - нижние зоны легких.
На сцинтиграммах боковой проекции легких отмечается снижение интенсивности включения РФП в области верхушек из-за удаленности их от детектора во время исследования. В левом легком, в данной проекции, в нижнепереднем отделе выявляется более или менее выраженный краевой дефект за счет тени сердца. Иногда на границе верхней и средней третей легких наблюдается круглый дефект накопления, возникающий в результате проекции корня с его сосудами и бронхами. Чаще это наблюдается у пациентов астенического типа сложения. В задних косых проекциях лучше определяются заднемедиальные и переднебоковые отделы легких, которые в прямых проекциях накладываются и не позволяют более точно выявить положение очагов поражения.
Степень и выраженность функциональных нарушений вентиляции и кровотока легких зависят от распространенности патологического процесса, давности его существования и имеющихся патоморфологических изменений. В результате этого варьирует и сцинтиграфическая картина, нередко превышающая рентгенологически определяемые изменения в легких.
Интерпретация полученных результатов.
Оценка функционального состояния органов дыхания с помощью радионуклидов осуществляется путем получения аналогового изображения органа, а также путем количественной регистрации излучения в каждом легком в отдельности и в «зонах интереса». Количественная оценка регионарного кровотока и вентиляции легких позволяет более точно интерпретировать полученные данные и провести их сопоставление с результатами других клинических исследований. Накопленный нами опыт радионуклидных исследований показывает, что интерпретацию полученных сцинтиграмм или сканограмм рационально начинать с текстуального описания визуально определяемых признаков легочной патологии и локального изображения органа. Визуальная оценка сцинтиграмм и сканограмм легких представлена на (схеме – рис 7.).
Оценка регионарного кровотока и вентиляции легких производится с помощью ЭВМ компьютерной обработки базы данных программного обеспечения (Голд-рада или Сцуинтипро). Схема модели регионарного кровотока и регионарной вентиляции легких в норме представлена на (схеме8), в числителе регионарный кровоток в знаменателе - регионарная вентиляция. С помощью компьютера, каждое легкое «имперически» делится на три равные зоны. Количество импульсов всех зон обеих легких суммируется и принимается за 100%, затем количество импульсов каждой зоны делится на общее количество импульсов и умножается на 100. Таким образом, определяется функциональный вклад каждой зоны легкого.
Радионуклидная информация о регионарной функции легких оценивается как по характеру нарушений, так и по распространенности патологического процесса по «зонам интереса». Она интерпретируется следующим образом: ограниченные нарушения регионарной функции легких в пределах 1-3 сегментов (одна зона); распространенные - нарушения регионарной функции легких в пределах 4-6 сегментов (две зоны); обширные – нарушения в пределах 7 и более сегментов ( 3,4 и большее количество зон).
В зависимости от ряда показателей морфо-функциональных изменений в легких по данным радиоинуклидных исследований нами выделены 4 степени нарушения регионарного кровотока и регионарной вентиляции легких, которые используются для оценки результатов радионуклидной информации. Функциональные нарушения, выявленные в какой либо зоне легкого от 0 до 25% расценивались как норма (0 – степень); от 25 до 50% - как умеренные нарушения (1 степень); от 50 до 75% - как выраженные (2 степень); от 75 и больше – как резко выраженные (3 степень).
Вместе с тем у многих больных туберкулезом органов дыхания с помощью радионуклидных исследований выявляются зоны усиления регионарного кровотока и регионарной вентиляции в виде зон «гиперрадиоактивности», это расценивается как функциональное «перераспределение» регионарного кровотока и вентиляции легких. Такое явление обусловлено увеличением фиксации РФП в легких за счет компенсаторных механизмов. Нами введено понятие «дефицит» регионарного кровотока и вентиляции по зонам легких. Этот параметр определяется в зоне локализации специфического процесса следующим образом. При радионуклидном исследовании вначале получали истинную величину процентного соотношения нарушения регионарного кровотока и регионарной вентиляции легких, в «зоне интереса», затем, зная норму процента количественной оценки в данной зоне, проводили вычитание из полученной величины, разность делили на норму и умножали на 100.
Пример. В 1 зоне правого легкого нарушение регионарного кровотока составило 7,5% (норма 12%) по формуле:
12% - 7,5%
12% х 100 = 37,5%
Таким образом, дефицит регионарного кровотока в 1 зоне правого легкого составил 37,5%. Расчет данных регионарной вентиляции легких проводится по такой же схеме.
Оценка позитивной сцинтиграфии ВГЛУ с цитратом Ga-67.
Количественная оценка сканограмм и сцинтиграмм в изучении барьерной функции внутригрудных лимфатических узлов с цитратом Ga-67 может проводиться двумя способами. Один из них: с помощью гамма - цвета на ленте сканера, другой - на гамма-камере с помощью программного обеспечения базы данных на персональном компьютере. Наш опыт показывает, что при отсутствии компьютерного обеспечения, можно получить количественную оценку сканограмм с помощью цветовой ленты сканера. Эти данные представлены в табл. 1.
Таблица 1
| Цвет на ленте сканера | % включения цитрата Gа-67 | Выраженность нарушения | Степень нарушения |
| Коричневый Зеленый | От 0 до 20 | Фоновые отметки (норма) | 0 |
| Голубой | 21-40 | Ограниченная | I |
| Желтый | 41-60 | Выраженная | II |
| Красный и малиновый | 61-100 | Резко выраженная | III |
Примечание. Красный и малиновый цвет штриховки объединены, отражают III степень и свидетельствуют о резко выраженном нарушении функции лимфоидной ткани, желтый – составляет II степень, голубой – I cтепень, зеленый и коричневый цвет объединены – 0 степень (норма).
Обработка данных сцинтиграмм с цитратом Ga-67 во многом облегчается на гамма-камере с помощью персонального компьютера программного обеспечения. Визуализация РФП на сцинтиграмме в области печени принимается за 100%, что соответствует норме. Манипулируя клавишей отсечки фона, добиваются 25% включения РФП в область средостения, что соответствует – 0 степени активности патологического процесса; включение РФП в область средостении в пределах 26-30% - I степень; 31-35% - II степень и больше 35% - III степень.
Интерпретация аэрозольной сцинтиграфии бронхов.
Оценка бронхиального клиренса выделяет две стадии нарушения МЦК, обусловленные острым или хроническим течением основного специфического или неспецифического процесса. Фаза компенсации документируется нормальными показателями МЦК, т.е. на сцинтиграммах наблюдается равномерное распределение РФП по всему трахео-бронхиальному дереву и в течение одного часа происходит относительно полное выведение РФП из бронхов. В фазе декомпенсации на сцинтиграмме, как правило, фиксируются зоны пониженного включения РФП по ходу бронхиального дерева. Они могут быть как односторонними, так и двусторонними нарушениями функции МЦК. ( Рис – пример)
Оценка плевральной резорбции.
Количественная оценка полученных данных проводится по представленной формуле:
А 3
К = ------------------ х 100%
А 1 – (А 2 +Ф)
К - плевральный клиренс в %.
А 1 –исходная удельная активность в шприце (импульсы / секунды)
А 2 – удельная активность в пустом шприце (импульсы / секунды).
А 3 - активность в крови (импульсы /секунды).
Ф - фон (импульсы /секунды)
Показатели плевральной резорбции рассчитываются по таблице 2.
Таблица 2
| Показатели резорбции | Степень | Фаза и причины резорбции |
| К - 0,77+0,01% | 0 | Резорбция плевры в норме |
| К - 0,75 до 0,18% | I | Спазм сосудов (отек, стеноз) |
| К – 0,17 до 0,09% | II | Частичная облитерация (начальная форма фиброза) |
| К – 0,08 до 0,03% | III | Полная облитерация капилляров (гиалиноз) |
| К – 0,79-0,8 до 1% и больше | IV | Повышенная резорбция плевры (полисерозит) |
Полученные данные при изучении функции плевральной полости с помощью радионуклидной диагностики позволяют считать, что при 0 и I степени активности резорбции плевральной полости может осуществляться антибактериальное или паллиативное лечение; при II и III-IV степени, где сформировался фиброз и даже гиалиноз – необходимо применить хирургическое лечение.
Таким образом, комплексное радионуклидное исследование имеет важное диагностическое значение для характеристики распространенности, локализации и степени выраженности патологического процесса у больных туберкулезом органов дыхания. Эти исследования в сопоставлении с клинико-рентгенологическими данными позволяют дополнительно выявить нарушения регионарной функции легких, как в зоне локализации специфического процесса, так и в интактных отделах. Радионуклидные методы, во фтизиопульмонологии, могут служить как тест контроля за эффективностью проводимой антибактериальной и патогенетической терапии у больных с различной формой туберкулеза легких, а также у больных подлежащих хирургическому лечению в до – и после операционном периоде. Только полное, комплексное функциональное обследование органов дыхания, включая радионуклидные методы, способно обеспечить наибольшую информацию о характере морфофункциональных нарушений в системе капиллярного кровотока и вентиляции легких, а также лимфатической системы средостения, выявить нарушения резорбции плевральной полости и бронхиального эпителия в оценке диагностики и проводимого лечения. Поэтому использование радионуклидов должно быть обязательным компонентом изучения функционального состояния легких у больных туберкулезом органов дыхания. Следовательно, клинические аспекты радионуклидных исследований во фтизиатрии являются весьма актуальной проблемой.
Глава II Непецифические заболевания бронхо-легочной системы.
. 1.Что входит в понятие « пульмонология».
В последние десятилетия одной из наиболее актуальных проблем современной медицины является пульмонология. Она включает следующие патологические состояния:
1. Пороки развития органов дыхания, которые, по данным разных авторов, составляют 2,5-18,7% от всей совокупности неспецифической легочной патологии. Столь большие колебания объясняются, с одной стороны, чрезмерным расширением понятия «врожденные аномалии», с другой - отсутствием четких морфологических критериев идентификации пороков развития. Пороки развития легких, по современным представлениям, составляют существенную часть легочной патологии.
Значительная часть пороков развития легких клинически не проявляется на протяжении жизни больного, не влияет на его самочувствие и не сказывается на функциональных возможностях дыхательной системы. К ним относятся одиночные небольшие врожденные кисты легкого, гамартохондромы, трахеальный бронх, доля непарной вены и др. Более распространены и клинически значимы пороки развития, которые сами по себе не проявляются, но, как правило, осложняются инфекционным процессом и дают достаточно определенную картину хронического неспецифического воспаления, протекающего с периодическими обострениями и постепенным прогрессированием. Это, в первую очередь, кистозная гипоплазия легкого, реже внутри- и внедолевая секвестрация и некоторые другие патологические состояния. В конечном итоге большинство легочных аномалий имеет клиническое значение главным образом потому, что является субстратом для развития хронического воспаления, в том числе туберкулеза. Это определяет основные клинические признаки, ведет к прогрессирующей инвалидности, а иногда и к смертельному исходу.
2. Острые и хронические инфекционные заболевания бронхо-легочной системы: бронхиты, пневмонии, нагноительные заболевания легких. Особую тревогу вызывает заметное увеличение распространенности хронических обструктивных болезней легких (ХОБЛ), достигающее в некоторых регионах мира 10-20%.
В Республике Беларусь среди всех ХОБЛ 70% составляет хронический обструктивный бронхит. Он занимает первое место среди поражений дыхательных путей (1550,0 на 100000 населения). Хронический обструктивный бронхит лидирует как причина смерти в структуре заболеваемости органов дыхания и составляет 65%; в 1997 году - 45,0 на 100000 населения. Средняя продолжительность жизни после установления инвалидности составляет 6 лет; стоимость полноценного лечения, по данным зарубежных исследователей, в 4 раза превышает таковую при терапии гипертонической болезни.
По-прежнему весьма распространенным заболеванием остается пневмония. По обобщенным данным пульмонологов России и Беларуси, среднестатистические показатели заболеваемости составляют 10-15%. Однако необходимо подчеркнуть, что эти цифры - лишь часть больных, с установленным и рентгенологически подтвержденным диагнозом. А сколько пациентов с «гриппом», «острым бронхитом», «простудой» переносят не диагностированные пневмонии?
Большую тревогу вызывает сохраняющаяся высокая смертность от пневмонии. В текущем десятилетии отмечается даже некоторая тенденция к ее увеличению. По данным Американского торакального общества, в США смертность от данной патологии достигает 18-20%. Европейское респираторное общество приводит данные в пределах 10%; Британское торакальное общество врачей в 1997 г. провело эпидемиологические исследования по смертности от пневмонии с тяжелым течением - показатель превысил 30%.
По инициативе врачей-пульмонологов Москвы и С.-Петербурга проведен анализ аутопсий патолого-анатомических центров. Расхождение диагнозов, по данным на 1997 г. превысило 30%.
Одним из важных путей повышения качества диагностики и лечения этого заболевания, по мнению А.Г.Чучалина, является внедрение формулярной системы: где лечить и чем лечить больного? В тех случаях, когда врач устанавливает пневмонию, необходимо стремиться к рентгенологическому подтверждению диагноза и этиологической верификации возбудителя с помощью бактериологического изучения мокроты. Однако эти исследования малодоступны, так как количество современно оборудованных лабораторий весьма невелико.
Всегда возникает вопрос о необходимости назначения антибактериальной терапии. Чтобы облегчить решение этой задачи в ряде стран приняли новую классификацию пневмоний, получившую название «альтернативной», учитывающую условия развития заболевания, особенности инфицирования легочной ткани, а также состояние иммунологической реактивности организма. Правильный учет перечисленных факторов позволяет со значительной долей вероятности установить этиологию заболевания.
3. Опухоли легких (злокачественные и доброкачественные). Во всем мире отмечается неуклонный рост онкозаболеваемости, удваивающейся каждые 10-15 лет. В Беларуси за период с 1965 по 1999 гг. абсолютное число случаев первичного рака легкого увеличилось в 5 раз. После аварии на ЧАЭС (1986) заболеваемость раком легкого в каждом из 118 пострадавших административных районов заметно превышает среднереспубликанский уровень. Есть ряд территорий на северо-востоке Гомельской области - Кормянский.Добружский, Ветковский районы, где за последние годы наблюдается «всплеск» - этот показатель достигает 80 на 100000 населения. Трудности диагностирования рака легкого обусловлены отсутствием ранних патогномоничных симптомов. От первых признаков заболевания до поступления в специализированные учреждения у 30% пациентов проходит год и более.
Различают раннюю и своевременную диагностику опухоли. Ранняя диагностика - это выявление ее на стадии интраэпителиального роста, когда можно гарантировать выздоровление. Под своевременной диагностикой понимают выявление заболевания на такой стадии развития, когда можно добиться излечения большинства больных. Применительно к новообразованиям с первичной локализацией в легких ранняя диагностика может носить лишь случайный характер, своевременное же распознавание - это задача, которая стоит перед пульмонологами. В этом плане наибольшую ценность представляет флюорографическое профилактическое обследование населения. С другой стороны, сопоставление клинических и патоморфологических данных показало, что злокачественные опухоли составляют 68% всех диагностических ошибок.
4. Аллергические заболевания легких (бронхиальная астма, преходящие легочные инфильтраты с эозинофилией в крови, псевдомембранозный бронхит).
Бронхиальная астма (БА) является серьезной проблемой медицины во всем мире. Рост заболеваемости и смертности наносит ущерб не только здравоохранению, но и обществу в целом. Медицинская статистика свидетельствует, что распространенность БА в Беларуси составляет 425,4 на 100000 человек (0,4% всего населения), а смертность - 5,3 на 100000.
В последние годы заметно изменились взгляды на концепцию заболевания: БА выделена в самостоятельную нозологическую форму. Вне зависимости от тяжести БА определяется как хроническое воспаление дыхательных путей. Это значит, что и при легком варианте течения патологический процесс в слизистой бронхов продолжается. В связи с этим впервые ставится вопрос о необходимости проведения базисной противовоспалительной терапии на всех этапах БА, что нашло отражение в «Методических указаниях по диагностике, профилактике и лечению бронхиальной астмы» (Минск, 1998 г.).
Гиперреактивность дыхательных путей и бронхообструкция - два главных проявления вентиляционных нарушений при БА. Важным компонентом заболевания является повышенный ответ бронхов на экзо- и эндогенные стимулы.
Существует 4 типа бронхиальной обструкции, каждый из которых связан с воспалительным процессом: 1) острый тип, обусловленный спазмом гладких мышц; 2) подострый - отеком слизистой оболочки дыхательных путей; 3) хронический - обструкцией бронхов, преимущественно их терминальных отделов, вязким секретом; 4) необратимый, вызванный склеротизированием в стенке бронха, возникающим на фоне неадекватного лечения.
Острый бронхоспазм быстро снимается бета-агонистами короткого действия; отек бронхиальной стенки лечится противовоспалительными препараами и бронхолитиками. Хроническая обструкция бронхов вязким секретом более тяжело поддается коррекции: для получения эффекта требуется 1,5-2 месяца терапии базисными кортикостероидами. При склерозировании стенки бронха обструкция мало поддается воздействию противовоспалительными средствами. В связи с этим актуальным остается своевременное назначение базисной противовоспалительной терапии.
5. Гранулематозы а) саркоидоз легких (болезнь Бека-Бе-нье-Шауманна); б) гистиоцитоз Х - системное заболевание, исходящее из ретикуло-гистиоцитарной ткани, обобщающее 3 формы: острый диссеминированный гистиоцитоз Х (болезнь Абта-Леттере-ра-Зиве), хронический подострый диссеминированный гистиоцитоз Х (болезнь Хенда-Шюллера-Крисчена) и очаговый гистиоцитоз (эозинофильная гранулема); туберкулез легких. Из этой группы заболеваний наиболее часто встречается саркоидоз - системное гранулематозное доброкачественное заболевание невыясненной этиологии, при котором в различных органах образуются эпителиодно-клеточные гранулёмы.
Статистические данные о распространенности этой патологии, полученные по результатам систематических профилактических флюорографических обследований, свидетельствуют, что показатели заболеваемости в различных регионах мира колеблются от 0,64 до 17 на 100000 населения. Отмечено, что заболеваемость саркоидозом выше в странах с развитой системой здравоохранения, а также в северных регионах Европы. Патоморфологическим субстратом саркоидоза является гранулема, состоящая из эпителиоидных клеток. Клинико-рентгенологическая картина зависит от стадии заболевания. Патологический процесс в легких нередко склонен к прогрессированию с развитием выраженного пневмосклероза и дыхательной недостаточности.
Почему мы включаем в пульмонологию туберкулез легких? Во-первых, он по своему клинико-рентгенологическому проявлению похож на большинство других легочных патологий; во-вторых, патоморфоз многих болезней легких нивелировал имевшееся между ними различия.
6. Альвеолиты: а) идиопатический фиброзирующий альвеолит - ИФА (болезнь Хамман-Рича); 6) экзогенный аллергический альвеолит - ЭАА; в) токсический фиброзирующий альвеолит - ТФА. ИФА - довольно редкое заболевание, оно не связано с профессиональной деятельностью человека. ЭАА - аллергическая реакция легочной ткани на органическую пыль любого характера («легкое фермера», «легкое сыроваров», «легкое рабочих солодовой промышленности» и др.). ТФА - следствие техногенных аварий, связанных с вдыханием ядовитых и раздражающих газов.
В русскоязычной литературе данные о распространенности алвеолитов отсутствуют. Это обусловленно, вероятно, неосведомленностью практических врачей, неоправданным установлением диагноза «хронический бронхит» (особенно у лиц молодого возраста), «пневмония», а также гипердиагностикой туберкулеза легких.
Многие звенья патогенеза альвеолита остаются нерасшифрованными. Однако в настоящее время доказано, что при ИФА нарушается нормальное физиологическое равновесие между растворимой и нерастворимой фракциями коллагена в пользу последней. Сдвиг этой системы, а также отсутствие контроля за синтезом и распадом соединительной ткани приводит к тому, что в процесс коллагенообразования кроме так называемых активированных фибробластов вовлекаются и другие клетки, в норме не продуцирующие коллаген. Все это приводит к разрастанию соединительной ткани, и как следствие, утолщению и уплотнению межальвеолярных перегородок, облитерации альвеол и капилляров с последующим увеличением работы дыхания и прогрессирующим ухудшением альвеолярной вентиляции и растяжимости легких.
7. Грибковые заболевания легких (пневмомикозы) играют все более значительную роль в профессиональной патологии человека (на консервном, спиртовом, витаминном, ткацком производствах, в вивариях, а также на заводах, производящих биомассу и др.). Грибки необычайно распространены в природе: на 1 г почвы приходится до 100000 спор различных грибков. Глубокие микозы могут вызываться дрожжеподобными (кандидоз, геотрихоз, криптококкоз и др.), плесневыми (аспергиллез, мукороз, пенициллиноз и др.), двухфазными грибками (адиаспиромикоз, бластомикоз, гистоплазмоз, кокцидиоидомикоз и др.). В начальном периоде пневмомикозов проведение этиологической диагностики весьма затруднено и подчас невозможно; заболевание может манифестировать грипп, острый бронхит, пневмонию, туберкулез, рак, абсцесс легкого и др. Верификация диагноза возможна только после обнаружения грибка в мокроте, гное, при биопсии легких в статистически значимом бактериологическом количестве в 1 мл субстрата (поле зрения).
8. Профессиональные запыления легких (пылевой бронхит, пневмокониозы), связанные с длительным вдыханием промышленной пыли, занимают одно из ведущих мест среди всех профессиональных заболеваний. По этиологическому признаку различают 6 групп пневмокониозов: силикоз, силикатоз, металлокониоз, карбокониоз, пневмокониоз от смешанной пыли, пневмокониоз от органической пыли. При диагностике пневмокониоза учитывают длительность контакта с производственной пылью, ее концентрацию и дисперсность, содержание в ней свободного или связанного кремния, а также санитарно-гигиенические условия труда человека. Наиболее надежным методом выявления пневмокониоза является обзорная рентгенография в прямой и боковой проекциях, томография, телерентгенография. Исследование функции внешнего дыхания позволяет определить степень дыхательной недостаточности, выраженности эмфиземы.
9. Болезни накопления - тезауресмозы (легочные альвеолярные: протеиноз, микролитиаз, гемосидероз) - редкие заболевания легких невыясненной этиологии, патологическим субстратом которых является отложение в альвеолах белково - и жироподобных веществ (протеина, липопротеина, фосфолипидов), микрокристаллов карбоната и фосфата кальция, железа в виде гемосидерина. Учитывая отсутствие при протеинозе и микролитиазе патогномоничных симптомов, диагностика возможна лишь на основании исследования биопсийного материала. Характерным признаком идиопатического легочного гемосидероза считается кашель с выделением кровянистой мокроты, причем кровохарканье иногда может быть выраженным (однако оно не всегда наблюдается). Наиболее существенным клиническим симптомом болезни является гипохромная анемия с низким содержанием железа, не поддающаяся терапии. Характерно повышение температуры до субфебрильной.
10. Микобактериозы - заболевания легких, вызванные атипичными (анонимными) штаммами микобактерий. По номенклатуре Раньона различают фотохромогенные, скотохромогенные, нефотохромогенные и быстрорастущие (большей частью непигментированные) микобактерии. Патогенными для человека являются: M.battey, kansasii, xenopi, fortuitum и некоторые другие. Частота их обнаружения в исследуемом материале колеблется в разных странах и даже отдельных районах (от 0,19-0,2% в Аргентине и Франции до 30% в штате Техас, США). Р.О.Драбкина среди 17495 культур микобактерии туберкулеза выявила 1,67% атипичных. Следует, однако, подчеркнуть, что патогенными считаются лишь те атипичные кислотоустойчивые микобактерии, которые повторно высеваются из мокроты одного и того же больного или из резецированного легкого и другого органа, образуют многочисленные колонии в культурах и вызывают патологические изменения в организме лабораторных животных, например, белых мышей. Подтверждением заражения является реакция больного на гомологичные сенситины, а также обнаружение специфических антител в сыворотке крови с помощью двойной диффузии в агаре. Источником инфицирования могут быть: крупный рогатый скот, свиньи, подстилочный торф, клещи и т.д. Атипичные микобактерии обладают сенсибилизационной способностью, но малой вирулентностью и низкой контагиозностью (описано всего 2 случая заражения в одной семье). Заболевание может проявляться в 4-х клинических формах: бронхолегочная, почечная, лимфожелезистая и кожная. Наиболее распространена бронхолегочная - проявляется как затяжная пневмония, бронхоэктатическая болезнь, пневмокониоз, плеврит, но чаще протекает под видом фиброзно-кавернозного, хронического диссеминированного, реже - очагового и ин-фильтративного туберкулеза легких. Клинически отличить данные формы микобактериозов от туберкулеза практически невозможно.
В пульмонологию мы включаем и легочные осложнения при различных болезнях (ревматизме, коллагенозе, лимфогранулематозе, иммунодефицитных состояниях и др.), наследственную патологию бронхо-легочной системы, инфаркт легкого, эмфизему, пневмосклероз, а также редкие, но весьма тяжелые заболевания - первичную легочную гипертензию, гранулематоз Вегенера, синдром Гудпасчера и др.
Таким образом, пульмонология - весьма многогранная область медицины, включающая в себя не только различные нозологические формы, синдромы, симптомы, но множество осложнений, причем большинство из них не имеет четкой патогномоничной картины, что заметно затрудняет их верификацию. Следовательно, врачам-терапевтам, пульмонологам, фтизиатрам, рентгенологам необходимо постоянно совершенствовать методы дифференциальной диагностики легочной патологии, углублять свои знания, повышать профессиональное мастерство.
2. Анализ заболеваемости и смертности от неспецифических болезней бронхо-легочной
системы легких в республике Беларусь
В последние годы в Белорусии отмечаются довольно высокие показатели распространенности болезней органов дыхания (БОД). Ежегодно в среднем регистрируется 2,5 млн. обращений, из них более 70% составляют заболевания верхних отделов дыхательных путей. Первое место в структуре патологии нижних дыхательных путей занимают острые воспалительные заболевания инфекционного генеза, в т.ч. пневмонии, регистрирующиеся в среднем у 35 000 пациентов ежегодно (табл.1).
Таблица 1
Зарегистрировано лиц (взрослые+подростки) с БОД (на 100 тыс.) в 1998-2001 гг.
-
Годы
БОД
Пневмония
1998
25211,9
443,7
1999
28400,8
471,4
2000
25762,8
440,5
2001
24093,6
392,2
Заболеваемость имеет некоторую тенденцию к снижению, но ошибки в диагностике пневмоний, составляющие более 20%, не позволяют считать ее доказательной.
Таблица 2
Смертность от болезней органов дыхания в Республике Беларусь
| | БОД | Пневмония | |||
| Годы | абс.число | на 100 тыс. | абс.число | на 100 тыс. | летальность |
| 1993 | 7103 | 68,5 | 746 | 7,2 | 1,15 |
| 1994 | 6756 | 65,2 | 691 | 6,7 | 1,10 |
| 1995 | 6776 | 65,6 | 870 | 8,4 | 1,13 |
| 1996 | 6693 | 65,0 | 846 | 8,2 | 1,31 |
| 1997 | 7024 | 68,7 | 1038 | 10,15 | 1,21 |
| 1998 | 6870 | 67,4 | 1071 | 10,5 | 0,80 |
| 1999 | 7244 | 71,0 | 1289 | 12,3 | 0,85 |
| 2000 | 6686 | 66,8 | 1030 | 10,3 | 0,75 |
| 2001 | 6515 | 65,3 | 981 | 9,8 | 0,67 |
И хотя общий уровень смертности среди больных госпитальной пневмонией может достигать 70%, все эти летальные исходы не являются прямым следствием инфекции. Смертность от госпитальной пневмонии должна определяться как доля смертельных случаев, которые не произошли бы при отсутствии этой инфекции.
Для предупреждения госпитальной пневмонии важно исключить или уменьшить влияние факторов риска.
В настоящее время становится очевидным, что в практических целях необходимо проведение мониторинга возбудителей, изучение резистентности патогенов к антибиотикам, активный поиск атипичных возбудителей, т.к. на сегодняшний день более чем у 30% больных этиологию пневмонии установить не удается.
В современных условиях особое значение приобретают фармако-эконо-мические программы для разработки рациональных схем лечения пневмонии. Финансовые затраты на антибактериальную терапию могут быть значительными. Более дорогостоящим является использование парентеральных антибиотиков. В последние годы успешно применяется ступенчатая (step down) схема (о чем подробнее будет сказано ниже): лечение начинается с внутривенного введения антибиотика; при получении эффекта (обычно через 3-4 дня) возможен переход на пероральный прием препарата.
Следует также помнить, что антибиотики не решают всех проблем, т.к. их единственной задачей является подавление инфекции. Но после эрадикции возбудителя в ряде случаев остается патоморфологический субстрат болезни, требующий применения противовоспалительных средств. К сожалению, пока мы имеем множество фактов неоправданно длительных курсов антибактериальной терапии пневмонии, которые, как правило, завершаются осложнениями. И, тем не менее, значительная часть больных действительно нуждается в интенсивной терапии, поэтому практическому здравоохранению необходимо внедрять современные методы интенсивной пульмонологии.
Важной проблемой пульмонологии остаётся лечение пациентов с хроническими обструктивными болезнями легких (ХОБЛ). Это самая многочисленная и социально значимая группа больных. В республике зарегистрировано 148633 больных с хроническим обструктивным бронхитом и эмфиземой легких (ХОБЛ). Ежегодно впервые диагноз устанавливается в среднем 8,5 тыс. больных; умирает от этой патологии приблизительно 4,5 тыс.человек , что составляет более 60% в общей структуре смертности от БОД.
Таблица 3
Смертность от болезней органов дыхания в Республике Беларусь
| | БОД | ХОБЛ | |||
| Годы | абс.число | на 100 тыс. | абс.число | на 100 тыс. | летальность |
| 1993 | 7103 | 68,5 | 4407 | 42,6 | 1,10 |
| 1994 | 6756 | 65,2 | 4385 | 42,5 | 1,08 |
| 1995 | 6776 | 65,6 | 4363 | 42,2 | 1,08 |
| 1996 | 6693 | 65,0 | 4360 | 42,2 | 0,86 |
| 1997 | 7024 | 68,7 | 4596 | 45,0 | 0,90 |
| 1998 | 6870 | 67,4 | 4699 | 45,8 | 0,96 |
| 1999 | 7244 | 71,0 | 4683 | 46,0 | 0,94 |
| 2000 | 6686 | 66,8 | 4534 | 45,3 | 0,87 |
| 2001 | 6515 | 65,3 | 4654 | 46,6 | 0,80 |
Термин «ХОБЛ» начал использоваться в отечественной пульмонологической литературе с 90-х гг. В настоящее время определение имеет двойное содержание. С одной стороны, это собирательное понятие, которое объединяет группу болезней: хронический обструктивный бронхит (ХОБ), эмфизему легких (ЭЛ) и некоторые формы бронхиальной астмы (БА). С другой стороны, ХОБЛ как нозологическая единица является конечной стадией прогрессирования ХОБ, ЭЛ, БА, когда указанные болезни теряют свою индивидуальность, осложняясь синдромом необратимой бронхообструкции и нарастающей дыхательной недостаточности. На этой стадии дифференциальная диагностика невозможна, а общий клинический синдром предполагает единую схему лечебных мероприятий. В МКБ-10 подтверждается правомочность такого подхода: рубрика Д.44.9 выделяет хроническую обструктивную болезнь легких неуточненную. Это рассматривается как терминальная фаза патологии, при которой стираются индивидуальные различия; рубрика J.44.8 выделяет хронический обструктивный бронхит без дополнительных уточнений, входящий в состав уточненной ХОБЛ. Терминологическая неопределенность, существовавшая многие годы, долго не позволяла решить вопросы, связанные с установлением болезни, её распространенностью и адекватным лечением. В частности, некорректное определение ХОБ, предложенное ВОЗ, явилось предметом длительной дискуссии: «кашель продолжительностью 3 месяца 2 года подряд» не мог стать достоверным диагностическим критерием ХОБ. В настоящее время усилиями ученых многих стран определена глобальная стратегия по диагностике, лечению и профилактике хронической обструктивной болезни легких - GOLD (Global Initiative for Chronic Obstructive Lung Disease).
Согласно указанному документу ХОБЛ - это болезнь, характеризующаяся ограничением воздушного потока, который «не полностью обратим». Ограничение воздушного потока обычно прогрессирующее и ассоциируется с гиперреактивностью дыхательных путей в присутствии вредных частиц или газов.
ХОБЛ должна быть заподозрена при наличии кашля, мокроты, одышки и/или воздействии факторов риска в анамнезе. Диагноз подтверждается с помощью спирометрии. Основными параметрами являются ФЖЕЛ, ОФВ и ОФВ/ФЖЕЛ.
Согласно GOLD лечение ХОБЛ включает четыре компонента:
- оценка и контроль состояния;
- снижение влияния факторов риска;
-терапия при стабильном состоянии;
- лечение обострений ХОБЛ.
В целом, современный подход к лечению ХОБЛ представляет собой ступенчатое повышение интенсивности терапии с учетом тяжести болезни .
Лечение обострения болезни в условиях стационара предполагает большие финансовые затраты и требует не только медикаментозных, но и вспомогательных аппаратных методов коррекции дыхания. Такие пациенты быстро становятся инвалидами (их число достаточно велико, а продолжительность жизни составляет 6 лет). Поэтому проблема раннего выявления ХОБЛ и рационального своевременного лечения с использованием современных схем - одна из главных задач пульмонологии.
Риск фатального исхода при обострении ХОБЛ прямо зависит от развития респираторного ацидоза, сопутствующей патологии и потребности во вспомогательной вентиляции. Без этих признаков прогноз более благоприятен, но при их появлении пациенты подлежат обязательной госпитализации.
Одной из важных проблем является бронхиальная астма. В республике на учете 41 тыс. больных. Ежегодно диагностируется в среднем 3000 случаев; отмечается тенденция к увеличению выявляемости астмы среди детей и подростков. Показатели смертности и летальности от астмы в последние 7 лет имеют устойчивую тенденцию к снижению (табл.4).
Таблица 4
