Особенности клинико-лабораторных проявлений инфильтративного туберкулеза легких при использовании комбинированных методов терапии 14. 00. 10 Инфекционные болезни 14. 00. 26 Фтизиатрия
| Вид материала | Автореферат диссертации |
- Коллапсотерапия в комплексном лечении деструктивного туберкулёза лёгких 14. 00., 428.25kb.
- Элективный курс по фтизиопульмонологии для студентов VI курса педиатрического факультета., 61.59kb.
- Болезни органов дыхания актуальность проблемы, 413.89kb.
- Клинико-эпидемиологические особенности гафниоза человека 14. 00. 30 эпидемиология 14., 476.36kb.
- Инсомнии у пожилых: особенности клинических проявлений и терапии, 194.69kb.
- Кравец елена владимировна, 152.52kb.
- Темы рефератов для студентов стоматологического факультета (осенний семестр), 12.86kb.
- Экзаменационные вопросы по дисциплине "Инфекционные болезни с курсом вич-инфекции, 93.5kb.
- Особенности синдрома диспепсии у детей, инфицированных микобактериями туберкулёза 14., 233.95kb.
- Индивидуальный план прохождения интернатуры по фтизиатрии Место работы, 144.75kb.
На правах рукописи
Шовкун Людмила Анатольевна
Особенности клинико-лабораторных проявлений инфильтративного туберкулеза легких при использовании комбинированных методов терапии
14.00.10 – Инфекционные болезни
14.00.26 – Фтизиатрия
Автореферат
диссертации на соискание ученой степени
доктора медицинских наук
Ростов-на-Дону
2008
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования
«Ростовский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
Научный консультант:
доктор медицинских наук, профессор Аксенова Валентина Александровна
Официальные оппоненты:
доктор медицинских наук Пшеничная Наталья Юрьевна
доктор медицинских наук, профессор Борисов Сергей Евгеньевич
доктор медицинских наук, профессор Борзенко Александр Сергеевич
Ведущая организация: ГОУ ВПО Российский государственный
медицинский университет
Защита состоится « »………… 2008г. в часов на заседании диссертационного совета Д 208.082.02. при ГОУ ВПО Ростовском государственном медицинском университете (344022, Ростов-на-Дону, Нахичеванский пер.,29).
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО Ростовском государственном медицинском университете
Автореферат разослан «____»_________________2008г.
Ученый секретарь диссертационного
совета, к.м.н. Кузина Т.Н.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы.
Туберкулез легких (ТЛ) в настоящее время продолжает оставаться одной из наиболее острых социально-экономических проблем, без решения которой нельзя прогнозировать положительное развитие государственных стратегических программ (В.Ю. Мишин с соавт, 2004; М.И. Перельман с соавт., 2006).
Наиболее распространенная форма туберкулеза легких – инфильтративная. В настоящее время для этой формы характерно быстрое возникновение деструкции легочной ткани с последующим бактериовыделением, что и объясняет эпидемическую опасность данной категории больных. Именно недостаточная эффективность терапии пациентов с инфильтративным туберкулезом легких (ИТЛ), определяет формирование бациллярного ядра и, соответственно, эпидемическую ситуацию в Российской Федерации (В.Ю.Мишин с соавт.,2001; А.Г.Хоменко с соавт., 1998; В.И.Чуканов с соавт.,2005, 2006).
Трудности лечения ИТЛ, особенно мультирезистентных форм, имеют определенные причины. Одна из самых главных - снижение или полное отсутствие эффекта от применения антибактериальных противотуберкулезных препаратов (ПТП), что обусловливает необходимость назначения их большого количества (не менее 5-6). Это, в свою очередь, способствует развитию побочных осложнений и токсических реакций со стороны различных органов и систем (С.Е.Борисов с соавт, 2001, 2006; В.В.Ерохин с соавт, 2003).
Клинические исходы ИТЛ в значительной степени зависят от состояния иммунологической реактивности организма. Центральным звеном резистентности к туберкулезу является клеточный иммунитет. Поэтому помимо назначения этиотропной и патогенетической терапии при туберкулезной инфекции используют и препараты для иммунокоррекции (В.В.Ерохин, 2003; Н.А.Жук, 2005; Л.А.Иванова,2003; В.А.Краснов с соавт., 2003.; В.А.Соколова с соавт., 2003).
Особое значение при ИТЛ имеет свободнорадикальное окисление (СРО), являющееся главным бактерицидным фактором в процессе фагоцитоза. Стимуляция СРО при ИТЛ является, несомненно, защитной реакцией организма, направленной на уничтожение возбудителя. Однако, собственные антиоксидантные системы микобактерий туберкулеза (МБТ) предотвращают их гибель, что способствует незавершенности фагоцитоза, а продолжающаяся генерация свободных радикалов, уже, не причиняя вреда МБТ, вызывает деструкцию окружающих тканей легкого. Доказана роль перекисного окисления липидов – самой распространенной разновидности СРО в формировании лекарственной устойчивости МБТ (Б.М.Малиев с соавт., 2005).
Следует отметить, что основные ПТП обладают значительной гепатотоксичностью ( А.С.Мамалат, 1970) и само противотуберкулезное лечение может стимулировать СРО (Т.И Виноградова, 1994). В этом аспекте представляется необходимым использование комплексного воздействия различных факторов патогенетической терапии, таких как иммунокоррекция и антиоксидантная терапия, которые благоприятно влияют как на специфическое, так и неспецифическое воспаление в легких (S. Ehlers et al., 2001; C. Lienhardt et al., 2002).
В последние годы доказана эффективность сверхмалых доз (СМД) лекарственных веществ (И.П.Ашмарин, 1999; Е.Б.Бурлакова, 1999; О.И.Эпштейн с соавт., 2005). В практической медицине более двухсот лет с успехом используются СМД лекарственных веществ, изготавливаемые по особой технологии, разработанной немецким врачом С.Ганеманом (1796), который не только разработал технологию, но и обосновал принципы и показания для применения этих лекарственных веществ, положенные им в основу нового направления в медицине – гомеопатии. Время подтвердило эффективность гомеопатии и в 1995 г. Минздрав РФ приказом №335 разрешил применение гомеопатического метода в практическом здравоохранении, гомеопатические препараты включены в Государственный реестр лекарственных средств РФ.
Вместе с тем, недостаточно изученным является влияние СМД лекарственных веществ (гомеопатической терапии) на эффективность лечения больных ИТЛ. Данные литературы о возможности использования гомеопатических препаратов в качестве активаторов иммунного ответа единичны и не носят концептуального характера, а данные о влиянии на процессы СРО в доступной литературе вообще отсутствуют. Совершенно не изучена регуляция гомеостаза макроорганизма на уровне воздействия СМД лекарственных веществ. Поэтому представляет интерес включение в стандартную схему лечения ИТЛ сверхмалых доз лекарственных веществ (гомеопатических препаратов), способных повысить эффективность лечения и предупредить развитие побочных явлений. Лечение ИТЛ гомеопатическим методом предполагает обязательное назначение антибактериальных противотуберкулезных препаратов.
В литературе имеются сведения об использовании сверхмалых доз лекарственных веществ в комплексном лечении ТЛ (Н.М.Вавилова,1997; В.В.Синельников, 2005). К сожалению, данные о несомненной эффективности гомеопатии, приводимые в этих работах, не позволяют выработать тактику применения гомеопатических средств для лечения ИТЛ. Все вышеизложенное диктует необходимость изучения возможности повышения эффективности лечения больных ИТЛ при использовании стандартной терапии в сочетании с гомеопатическими препаратами.
Выполнение работы осуществлялось в рамках договора № 026/211/001. Работа входит в “Отраслевую программу по традиционной медицине и гомеопатии на 2001-2005 г.г.” (Указание МЗ РФ № 468-У от 12.05.2000г.) по теме: «Научное обоснование, разработка и усовершенствование методов традиционной медицины и гомеопатии: Оптимизация противотуберкулезной терапии применением гомеопатических препаратов”.
Цель работы: Оптимизация методов повышения эффективности стандартной терапии инфильтративного туберкулеза легких с учетом особенностей патогенеза.
Задачи исследования
- Выявить клинико-иммунологические и биохимические особенности течения инфильтративного туберкулеза легких (ИТЛ) у больных с выделением лекарственно чувствительных (ЛЧ) и лекарственно устойчивых (ЛУ) штаммов микобактерий туберкулеза.
- Дать сравнительную клиническую характеристику, иммунного статуса и СРО у больных ИТЛ с выделением ЛЧ и ЛУ штаммов МБТ при назначении стандартных режимов терапии.
- Выявить особенности клинико-лабораторных проявлений у больных ИТЛ с выделением ЛЧ и ЛУ штаммов МБТ при назначении потенцированной перекиси водорода на фоне стандартных режимов терапии.
- Исследовать клинико-иммунологические особенности и СРО при ИТЛ у больных с выделением ЛЧ и ЛУ штаммов МБТ при назначении многокомпонентного препарата СМД лекарственных веществ на фоне стандартных режимов терапии.
- Провести анализ клинических особенностей, состояния иммунного статуса и СРО у больных ИТЛ с выделением ЛЧ и ЛУ штаммов МБТ при назначении потенцированной перекиси водорода и многокомпонентного препарата СМД лекарственных веществ на фоне стандартных режимов терапии.
- Дать сравнительную оценку результатам лечения при проведении стандартной противотуберкулезной терапии и комбинированных методов терапии у больных ИТЛ с выделением ЛЧ и ЛУ штаммов МБТ.
- Оценить влияние комбинированных методов терапии на развитие осложнений и токсических побочных реакций при назначении стандартной противотуберкулезной терапии у больных ИТЛ с выделением ЛЧ и ЛУ штаммов МБТ.
8. Разработать и обосновать алгоритм комбинированной терапии ИТЛ с использованием потенцированной перекиси водорода и многокомпонентного препарата СМД лекарственных веществ у больных с выделением ЛЧ и ЛУ штаммов МБТ.
Научная новизна
Впервые установлены особенности клинических проявлений, иммунного статуса и СРО у больных ИТЛ с выделением ЛЧ и ЛУ штаммов МБТ при использовании потенцированной перекиси водорода и многокомпонентного препарата СМД лекарственных веществ на фоне стандартной терапии.
Показано нормализующее влияние СМД лекарственных веществ на клиническое состояние, иммунный статус и свободнорадикальное окисление у больных ИТЛ с выделением ЛЧ и ЛУ МБТ.
Впервые разработаны научно обоснованные схемы лечения больных ИТЛ, выделяющих ЛЧ и ЛУ МБТ с использованием потенцированной перекиси водорода и многокомпонентного препарата СМД лекарственных веществ на фоне стандартной терапии и доказана их высокая терапевтическая эффективность.
Установлено, что применение СМД лекарственных веществ на фоне стандартной терапии у больных ИТЛ с выделением ЛЧ и ЛУ штаммов МБТ позволяет предупредить и устранить побочные токсические, аллергические и дисбиотические реакции на противотуберкулезные препараты (ПТП).
Практическая значимость исследования
- В результате исследования разработана тактика и алгоритм патогенетического лечения больных ИТЛ с выделением ЛЧ и ЛУ штаммов МБТ с применением потенцированной перекиси водорода и многокомпонентного препарата СМД лекарственных веществ на фоне стандартной терапии, способствующие быстрому купированию симптомов интоксикации, нормализации иммунного статуса и СРО.
- Применение потенцированной перекиси водорода и многокомпонентного препарата СМД лекарственных веществ на фоне стандартной терапии у больных ИТЛ с выделением ЛЧ и ЛЧ штаммов МБТ позволяет значительно (более чем в два раза) повысить эффективность стандартной терапии, что сопровождается сокращением сроков закрытия полостей распада и абациллирования.
3. Применение потенцированной перекиси водорода и многокомпонентного препарата СМД лекарственных веществ на фоне стандартной терапии у больных ИТЛ с выделением ЛЧ и ЛУ МБТ позволяет предупредить развитие и устранить побочные токсические, аллергические и дисбиотические реакции на ПТП, что особенно важно у больных с лекарственной устойчивостью, которые нуждаются в большей коррекции антибактериальной терапии.
Основные положение диссертации, выносимые на защиту
1. Иммунопатогенез инфильтративного туберкулеза легких характеризуется, особенно у больных с рецидивом, выраженной направленностью Th-2 иммунного ответа с наклонностью к аллергизации и аутоиммунным реакциям, на фоне угнетения клеточного звена иммунного статуса, что сопровождается достоверным уменьшением зрелых лимфоцитов СD3+, СD4+, иммунорегуляторного индекса СD4+/СD8+, увеличением в периферической крови клеток СD8+, СD16+, а также значительным снижением пролиферативной функции лимфоцитов на специфический (PPD) и неспецифический фактор (ФГА), что свидетельствует о выраженной иммуносупрессии и анергии. На фоне высокого содержания противотуберкулезных антител G, антител к нативной ДНК, ИЛ-4 и угнетения продукции ИФН-г выявлено снижение способности клеток к апоптозу (СD95+), что ведет к хронизации процесса и способствует персистенции возбудителя в организме.
2. Патоморфоз инфильтративного туберкулеза легких характеризуется распространенными формами, наличием больших деструктивных изменений в легочной ткани, быстрым возникновением выраженных симптомов интоксикации, особенно, у больных с рецидивом заболевания, что требует назначения патогенетической терапии в интенсивную фазу стандартных режимов лечения и отличается вариабельностью иммунологических параметров, интенсификацией свободнорадикального окисления.
3. У больных инфильтративным туберкулезом легких с выделением ЛЧ или ЛУ штаммов МБТ применение СМД лекарственных веществ и потенцированной перекиси водорода на фоне стандартной терапии позволяет существенно улучшить клиническое состояние больных, проводить коррекцию иммунного статуса и свободнорадикального окисления.
4. Разработаны новые методы комбинированного лечения с использованием потенцированной перекиси водорода и многокомпонентного препарата СМД лекарственных веществ для лечения больных инфильтративным туберкулезом легких с выделением ЛЧ или ЛУ штаммов МБТ, что позволяет значительно повысить эффективность стандартной терапии, более чем в два раза, сократить сроки закрытия полостей распада и абациллирования.
5. Использование СМД лекарственных веществ и потенцированной перекиси водорода на фоне стандартной терапии позволяет предотвратить и устранить побочные реакции и осложнения при проведении стандартной антибактериальной терапии и способствует лучшей переносимости антибактериальных препаратов.
Практическое использование результатов лечения
Результаты исследования внедрены в работу Ростовского областного клинического и его филиала Городского противотуберкулезных диспансеров, Областного детского туберкулезного санатория «Сосновая дача», Новочеркасской туберкулезной больницы, Таганрогского, Шахтинского, Кабардино-Балкарского Республиканского противотуберкулезного диспансера и включены в курс чтения лекций и проведения семинарских занятий со студентами, интернами и ординаторами Рост ГМУ.
Публикации
По результатам исследования опубликовано 77 печатных работ (из них 8 в изданиях, рекомендованных ВАК), включая 4 патента на изобретение, 2 монографии, 1 методическое пособие для врачей практического здравоохранения.
Изобретения по теме диссертации
Патент на изобретение № 23022251 «Способ лечения больных туберкулезом легких»; патент на изобретение № 2312673 «Способ лечения больных туберкулезом легких»; положительное решение на заявку № 2007103951/14(004254) «Способ лечения больных туберкулезом легких»; положительное решение на заявку № 2007103953/14 (004256) «Способ лечения больных туберкулезом легких»; приоритетная заявка № 2007138249 «Способ лечения больных деструктивными формами туберкулеза легких».
Объем и структура диссертации
Работа состоит из введения, аналитического обзора литературы (глава 1), результатов собственных исследований (главы 2–6), обсуждения результатов, выводов, практических рекомендаций и списка литературы. Диссертация изложена на 365 страницах компьютерного текста, включает 117 таблиц, иллюстрирована 9 рисунками. Список литературы включает 378 источников, из них 256 отечественных и 122 иностранных.
СОДЕРЖАНИЕ РАБОТЫ.
Материал и методы исследования. Под наблюдением находилось 245 больных ИТЛ в возрасте от 20 до 67 лет. Обследование пациентов осуществлялось на клинической базе кафедры туберкулеза Ростовского государственного медицинского университета – в легочно-терапевтическом отделении Ростовского филиала ГУЗ «Противотуберкулезный клинический диспансер» Ростовской области.
ИТЛ у обследованных больных диагностирован в соответствии с классификацией клинических форм туберкулеза, утвержденной приказом МЗ РФ № 109 от 21.03.03г. «О совершенствовании противотуберкулезных мероприятий в Российской Федерации», на основании типичной клинико-рентгенологической картины и подтвержден бактериоскопическим и бактериологическим обнаружением микобактерий туберкулеза. Антибактериальная противотуберкулезная терапия проводилась также согласно стандартным режимам лечения в соответствии с приказом МЗ РФ № 109 от 21.03.03г. Перед проведением обследования и лечения у всех пациентов было получено добровольное информированное согласие в соответствии с требованиями научно-доказательной медицины.
Проведено рандомизированное контролируемое клиническое исследование. Для повышения эффективности рандомизации применялась предварительная стратификация – распределение вариантов лечения осуществлялось в однородных группах больных, сформированных по признаку – «лекарственная чувствительность (устойчивость) микобактерий к противотуберкулезным препаратам». Характеристика больных, включенных в исследование, представлена в таблице 1.
На основании результатов бактериологического исследования все обследованные были разделены на группы, включающие пациентов с выделением лекарственно чувствительных (ЛЧ) - 119 чел. и лекарственно устойчивых (ЛУ) микобактерий туберкулеза (МБТ) - 126 чел.
Таблица 1
Характеристика больных, включенных в исследование
| Метод лечения | Контингент обследованных больных | |||||
| Больные с лекарственной чувствительностью микобактерий | Больные с лекарственной устойчивостью микобактерий | |||||
| муж. | жен. | Всего | муж. | жен. | Всего | |
| Стандартная терапия | 18 | 12 | 30 | 24 | 6 | 30 |
| Комбинированная терапия | 56 | 33 | 89 | 73 | 23 | 96 |
| ИТОГО | 74 | 45 | 119 | 97 | 29 | 126 |
Все больные были разделены на группы:
- Группа сравнения 1-ЛЧ - 30 больных, выделяющих ЛЧ МБТ
- Группа сравнения 2-ЛУ – 30 больных, выделяющих ЛУ МБТ
3. Основная группа 1-ЛЧ – 30 больных, с включением в стандартные режимы терапии потенцированной перекиси водорода
4. Основная группа 1-ЛУ – 30 больных, с включением в стандартные режимы терапии потенцированной перекиси водорода
5. Основная группа 2-ЛЧ – 30 больных, с включением в стандартные режимы терапии многокомпонентного препарата СМД лекарственных веществ
6. Основная группа 2-ЛУ – 30 больных, с включением в стандартные режимы терапии многокомпонентного препарата СМД лекарственных веществ
7. Основная группа 3-ЛЧ – 29 больных, с включением в стандартные режимы терапии потенцированной перекиси водорода и многокомпонентного препарата СМД лекарственных веществ
8. Основная группа 3-ЛУ – 36 больных, с включением в стандартные режимы терапии потенцированной перекиси водорода и многокомпонентного препарата сверхмалых доз лекарственных веществ
При включении пациентов в исследование оценивали основные проявления туберкулезной интоксикации, бронхолегочные симптомы, степень выраженности инфильтративных изменений в легочной ткани, наличие полостей распада и массивность бактериовыделения.
Показатели, не имеющие количественного измерения, оценивали по специально разработанной верификационной шкале баллов. Степень выраженности клинических проявлений, массивности бактериовыделения, распада легочной ткани и распространенности инфильтрации оценивали по 3-х бальной шкале (от 0 до 3-х баллов в зависимости от степени выраженности симптомов). Верификацию диагноза туберкулеза легких проводили путем исследования мокроты и смывов из бронхов с помощью бактериоскопии при окраске по Циль-Нильсону и люминесцентной микроскопии. Выделение культур M. tuberculоsis проводили с помощью посева на среду Левенштейна-Йенсена и культивирования в бактериологическом анализаторе «BACTEC». Для решения поставленных задач был использован комплекс клинических, параклинических, иммунологических, биохимических и статистических методов. Исследования иммунного статуса проведены в лаборатории иммунологии Ростовского НИИ микробиологии и паразитологии (директор проф., д.м.н. А.П. Шепелев).
Иммунологическое обследование пациентов осуществляли при поступлении в стационар и через 4 месяца от начала проведения терапии.
Определение популяций и субпопулляций иммунокомпетентных клеток осуществляли методом непрямой иммунофлюоресценции с использованием моноклональных антител (ООО «СОРБЕНТ», Россия): к CD3, CD4, CD8, CD20, CD16. Количественную оценку клеток, функционально готовых к апоптозу, определяли с помощью моноклональных антител к CD95 лимфоцитов. Результаты учитывали с помощью люминесцентного микроскопа. Функциональную активность лимфоцитов определяли по их способности пролиферировать в ответ на действие как поликлонального Т-митогена (ФГА), так и специфического антигена (PPD) в реакции бласттрансформации лимфоцитов (РБТЛ) с радиометрическим учетом по включению Ні- тимидина и с последующим расчетом индекса стимуляции (ИС – количество импульсов в минуту при стимуляции / количество импульсов в минуту при спонтанном культивировании) (В.Н. Федосеева и соавт., 1993). Определение циркулирующих иммунных комплексов в сыворотке крови производили методом селективной преципитации в 3,75% ПЭГ с последующим определением плотности преципитата (Ю.А. Гриневич, 1981). Уровень цитокинов (ИЛ-4, ИФНг) в сыворотке крови определяли с помощью иммуноферментного анализа (ИФА) (тест-системы ООО «Цитокин», г. Санкт-Петербург). Содержание иммуноглобулинов классов IgA, IgM и IgG в сыворотке крови изучали методом радиальной иммунодиффузии в геле по методу G. Manchini et al. (1965) с использованием иммуноспецифических сывороток производства «ИмБио» (Россия). Содержание IgE исследовали методом ИФА (тест-системы «Вектор-Бест», г. Новосибирск). Содержание противотуберкулезных антител, антител к ДНК нативной и денатурированной определяли с помощью ИФА (тест-системы «Вектор-Бест», г. Новосибирск). Интенсивность кислород-зависимого метаболизма нейтрофилов оценивали в спонтанном и стимулированном тесте восстановления нитросинего тетразония (НСТ) (В.В. Меньшикова и соавт., 1989; Б.В. Пинегин и соавт, 1992,). Коэффициент стимуляции НСТ-теста высчитывали по следующей формуле: К ст. = НСТ стим./НСТ сп.
Показатели СРО определяли в биохимической лаборатории Ростовского НИИ онкологии (директор действительный член АН РФ и АМН РФ, проф., д.м.н. Ю. С. Сидоренко)
Определение показателей проводили при поступлении в стационар и через 4 месяца после начала проведения терапии. Люминолзависимую хемилюминесценцию (ХЛ) плазмы крови, индуцированную перекисью водорода, проводили по методу В.А.Шестакова с соавт. (1979). Светосумму ХЛ регистрировали в течение 6 секунд и выражали в имп./6 сек. Активность супероксиддисмутазы (СОД) в эритроцитах и плазме крови определяли по методу C.C. Winterburn et al. (1975). Активность каталазы определяли по методу М.А. Королюк с соавт. (1988). Активность фермента выражали в международных единицах. Определение активности миелопероксидазы (МПО) определяли колориметрически (М.З.Саидов, Б.В.Пинегин, 1991). Результат выражали в единицах оптической плотности в расчете на 1 мг белка в минуту.
Для определения нормативных показателей иммунного статуса и СРО были обследованы 20 здоровых доноров в возрасте от 20 до 65 лет.
В работе предлагаются новые методы лечения туберкулеза легких.
МЕТОД 1. Дополнительно к стандартным режимам антибактериальной терапии (согласно приказу №109 МЗ РФ от 21.03.03г.) была назначена потенцированная перекись водорода, приготовленная на основе 3%-ного аптечного препарата (№ 74/614/30, Код АТС D08АХ01) по 5 гранул 3 раза в день, ежедневно, независимо от приема пищи в течение 10 дней – 4 курса, с интервалом 20 дней (в течение 4 месяцев). Препарат отменяют при закрытии полости распада.
МЕТОД 2. Для осуществления данного метода лечения к стандартным режимам противотуберкулезной терапии (согласно приказу №109 МЗ РФ от 21.03.03г.) дополнительно назначали многокомпонентный гомеопатический препарат следующего состава: апис меллифика (Apis mellifica) 6 (№ 95/335/135), хина оффициналис ( Quinine) 6 (№ 95/335/930), хелидониум маюс (Chelidonium majus) 6 (№ 95/335/332), станнум (Stannum metallicum) 6 (№95/335/891), сангвинария (Sangvuinaria canadensis) 6 (№95/335/990), калиум бихромикум (Potassium bichromate) 6 (№ 95/555/654), карбо вегетабилис (Carbo vegetabilis) 6 ( № 95/335/290), расторопша пятнистая (Carduus marianus) 6 (№ 95/335/297) по 5 гранул 3 раза в день, ежедневно, независимо от приема пищи в течение 4 месяцев.
МЕТОД 3. Для осуществления данного метода лечения к стандартным режимам противотуберкулезной терапии (согласно приказу №109 МЗ РФ от 21.03.03г.) дополнительно назначали препарат потенцированной перекиси водорода и многокомпонентный препарат СМД лекарственных веществ по алгоритмам указанным в методах 1 и 2.
Все компоненты комплекса СМД лекарственных веществ внесены в Государственный Реестр лекарственных средств (официальное издание по состоянию на 31 марта 2001г., том 1, Москва, 2001) согласно перечню гомеопатических препаратов, разрешенных к применению в соответствии с приказом Минздравмедпрома России от 29.11.95г.№ 335 (приложение 4).
Выбор лекарственных веществ в СМД определялся наличием многообразных симптомов туберкулеза легких, связанных с нарушением гемодинамики бронхолегочной системы, отечного синдрома (в стадии экссудации), выраженной дыхательной и сердечной недостаточностью, нарушением обезвреживающей функции печени.
Статистическую обработку полученных данных проводили с использованием компьютерной программы Statistica 6,0. Уровень статистической значимости различий (p) определяли с помощью доверительного критерия Стьюдента для абсолютных и относительных величин (при числе наблюдений больше 30) и критерия Фишера (при числе наблюдений меньше 30).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Установлено, что особенностью современного течения ИТЛ являются распространенные формы, которые чаще встречаются у неработающих (67,0 %) мужчин трудоспособного и репродуктивного возраста. Среди больных преобладали лица социально неблагополучные (низкое материальное обеспечение, отсутствие санитарной культуры, хронический алкоголизм, пребывание в ИТУ в анамнезе). При обращении выявлено 63,3% больных (155 чел.) и только 36,7% больных (90 чел.) – при профосмотрах, что свидетельствует о несвоевременном выявлении ИТЛ, большую часть больных составили мужчины - 69,8% больных.
При анализе клинической картины ИТЛ у больных, выделяющих ЛЧ и ЛУ штаммы МБТ, установлено, что подавляющее большинство (90,6%) больных находилось в трудоспособном возрасте (20-60 лет) – 222 чел., с преобладанием лиц молодого и среднего возраста (20-40 лет), что определяет социальную значимость проблемы.
Патоморфоз ИТЛ характеризовался преимущественно верхнедолевой локализацией. У впервые выявленных больных с выделением ЛЧ МБТ чаще наблюдались ограниченные процессы: бронхонодулярные и округлые инфильтраты (89,4 ± 8,9%), размер полостей распада составлял до 2-х см и от 2-х до 4-х см, а клиническая картина ИТЛ у больных с выделением ЛУ МБТ сопровождалась более выраженными симптомами интоксикации, большим объемом поражения легочной ткани и наличием больших деструктивных изменений распада. ЛУ МБТ были выделены у 126 пациентов, в том числе монорезистентность выявлена у 36 пациентов (28,6%), полирезистентность – у 56 пациентов (44,4%) и множественная лекарственная устойчивость выявлена у 34 пациентов (27,0%). У больных ИТЛ выявлена устойчивость к ПТП: к изониазиду (10 мкг/мл) – у 42 больных (33,3%), рифампицину (80 мкг/мл) – у 46 (36,5%), стрептомицину (10мкг/мл) – у 38 (30,2%), канамицину (50мкг/мл) – у 21 (16,7%), к этамбутолу (2мкг/мл) – у 13 больных (10,3%).
Установлено, что у больных ИТЛ как у впервые выявленных, так и у больных с рецидивом заболевания, отмечены нарушения в Т-клеточном звене иммунной системы, более выраженные у больных с рецидивом и выделяющие ЛУ МБТ. Имело место снижение функциональной (в группе сравнения -1-ЛЧ – СД4+/СД8+ - 1,16±0,13 и в 2-ЛУ– 0,94±0,02, контроль 1,98±0,14, р<0,05) и пролиферативной активности лимфоцитов (индекс РБТЛ с ФГА в 1-ЛЧ – 60,5±5,2 и PPD – 1,5±0,3, контроль – 104,7±26,6 и 2,7±0,3 соответственно, р<0,05). У всех больных была снижена способность клеток к апоптозу, особенно у пациентов с выделением ЛУ МБТ (в группе сравнения 2-ЛУ – СД95+ - 7,69±0,53%, у здоровых – 17,7±0,97%, р<0,05). Количество СД16+ и СД20+ было повышенным у всех больных и достоверных различий между пациентами, выделяющими ЛЧ МБТ и ЛУ МБТ, не установлено. Уровень СД16+ в группе сравнения 1-ЛЧ был 17,5±1,46%, в 2-ЛУ – 18,52±0,57%, у здоровых – 8,9±1,11%, (р<0,05). Отмечено повышенное содержание СД20+ в 1-ЛЧ группе сравнения до 25,21±1,19%, в 2-ЛУ сравнения – 28,10±0,70%, у здоровых – 18,2±1,02%, (р<0,05). На фоне гиперактивации гуморального звена иммунного ответа отмечены аутоиммунные (АТ к ДНК нативной в группе сравнения 1-ЛЧ 50,00±9,10%, у здоровых - 15,00±5,3%, р<0,05) и аллергические реакции (в группе сравнения 1-ЛЧ – общий JgE 397,62±44,84 МЕ/мл, у здоровых – 64,12±4,89 МЕ/мл, р<0,05). Кроме этого отмечался высокий уровень образования активных форм кислорода (АФК), что проявлялось повышенным цитолизом клеток и распадом легочной ткани. Полученные нами результаты совпадают с данными литературы о стимуляции процессов СРО при развитии туберкулеза (В.А.Краснов с соавт., 2005; О.Б.Нечаева, Е.И.Скачкова, 2003; И.А.Сиренко, С.А.Шматько, 2004,).
Известно, что ведущая роль в противомикробной защите принадлежит процессам СРО. Микробицидное действие фагоцитов на 90% связано с продукцией АФК (Д.Н.Маянский, И.Г.Урсов, 1997),. Однако МБТ характеризуются высокой устойчивостью к действию in vitro супероксидного анион-радикала, перекиси водорода и гипохлорит-иона (В.А.Краснов с соавт., 2005).
До начала лечения нами обнаружены существенные нарушения между антиоксидантными и прооксидантными системами организма как у впервые выявленных больных с выделением ЛЧ МБТ, так и у пациентов с рецидивами туберкулеза с ЛУ МБТ. Эти исследования подтверждали наличие значительных деструктивных изменений в легких у всех больных, особенно с ЛУ МБТ. Распад легочной ткани наблюдался у 83,2±3,4% при ЛЧ МБТ и у 100,0±5,3 % пациентов при ЛУ МБТ. У всех больных с выделением ЛЧ и ЛУ МБТ до начала терапии интенсивность спонтанного свечения крови значительно превышала нормальные величины, характеризующие контрольную группу здоровых доноров. Показатель интенсивности ХЛ в группах сравнения 1-ЛЧ был 4753,24±221,15имп./6сек., в 2-ЛУ – 4442,23±334,21 имп./6сек., в контроле – 3310,00±219,04 имп./6сек. (р<0,05). Эти данные свидетельствуют о стимуляции процессов СРО в организме больных ИТЛ, что может быть проявлением защитной реакции организма, связанной с активированием фагоцитов. Защиту от повреждающего действия АФК обеспечивают в первую очередь антиоксидантные ферменты – СОД и каталаза. Снижение активности этих ферментов влечет за собой не только повреждение микобактерий, но и лизис окружающих тканей. Активность СОД больных с ЛЧ МБТ была почти в два раза ниже показателя у здоровых доноров ( в группе сравнения 1-ЛЧ – 6,08±1,43, в контроле – 11,46±0,83 у.е./мгНв, p < 0,05) и не обеспечивала сохранения равновесия между анти- и прооксидантными системами организма. У всех больных ИТЛ до начала противотуберкулезной терапии активность каталазы эритроцитов была снижена: у больных группы сравнения 1-ЛЧ уровень был 94,75 ± 2,36 мкМ Н2О2/мин*мгНв, более выраженное снижение активности фермента (61,21±1,54 мкМ Н2О2/мин*мгНв) наблюдалось у больных в 2-ЛУ группе сравнения (p < 0,05), у здоровых – 133,5±11,77 мкМ Н2О2/мин*мгНв. Активность каталазы плазмы у всех больных ИТЛ, независимо от лекарственной чувствительности возбудителя, была повышена по сравнению с показателями здоровых доноров (в группах сравнения 1-ЛЧ – 45,01±3,42 и 2-ЛУ – 46,85±2,67, у здоровых – 32,43±2,53 мкМ Н2О2/мин*л, р<0,05). Это расценено нами как следствие деструктивных процессов в клетках. Каталаза является внутриклеточным ферментом и считается, что внеклеточная защитная роль каталазы незначительна (Н.К.Зенков с соавт., 2001).
Все впервые выявленные больные ИТЛ с ЛЧ МБТ получали стандартную терапию согласно интенсивной фазе 1 режима химиотерапии, а больные с рецидивом ИТЛ с ЛУ МБТ получали стандартное лечение в соответствии с характером лекарственной устойчивости микобактерий туберкулеза к противотуберкулезным препаратам (приказ № 109 от 21.03.03 г. МЗ РФ).
Проведенный нами ежемесячный анализ клинических проявлений ИТЛ показал медленную динамику их регрессии. Так, за первые два месяца в группах пациентов с выделением ЛЧ и ЛУ МБТ достоверного уменьшения количества больных с выраженными симптомами заболевания не отмечалось, а некоторое улучшение клинической картины ИТЛ произошло только к 4-му месяцу лечения (общая слабость наблюдалась в группах сравнения 1-ЛЧ у 34,7 ± 8,7% и в 2-ЛУ – у 91,7 ± 5,0% больных). Бронхолегочные симптомы одышка, кашель, отхождение мокроты и сухие хрипы отмечались в 1- ЛЧ группе в среднем у 40,0% больных, в 2-ЛУ – у 87% пациентов. Особенно малозначительная динамика наблюдалась у больных с ЛУ МБТ. Выраженность клинических симптомов по бальной шкале сохранялась на уровне 2,0-2,5 баллов.
При проведении стандартной терапии у больных с ЛУ и ЛЧ МБТ отмечены побочные реакции на ПТП: у больных с ЛУ МБТ в 40,00% случаев, а у больных с ЛЧ МБТ в 26,7%. Наиболее часто встречались гепатотоксические и дисбиотические реакции. Появление побочных реакций в процессе лечения ПТП требовало коррекции схем лечения, замены препаратов и проведения корригирующей терапии для ликвидации этих осложнений. Недостаточная эффективность стандартных режимов терапии выражалась и в отсутствии нормализации иммунного статуса, особенно у больных с выделением ЛУ МБТ. Противотуберкулезная терапия согласно стандартным режимам у всех больных, а особенно у пациентов с ЛУ МБТ не сопровождалась нормализацией функциональной и пролиферативной активности лимфоцитов (в группе сравнения 1-ЛЧ СD4+ до лечения – 33,01±1,68% и после лечения – 32,05±1,65%; в группе сравнения 2-ЛУ – 29,15±0,75% и 29,08±1,40% соответственно, р>0,05), наблюдалась активация гуморального звена иммунного ответа и снижение активности кислородзависимого метаболизма нейтрофилов (НСТ ст./сп. до лечения – 1,61±0,13у.е, после лечения– 1,64±0,09 у.е.; в 2-ЛУ – 1,44±0,07у.е. и 1,39±0,14 у.е соответственно, р>0,05). На этом фоне наблюдалось сниженное количество клеток, экспрессирующих СD95+ (в группе 1-ЛЧ – 10,2±1,11%, а в 2-ЛУ – 8,23±0,49%, у здоровых – 17,7±0,97%, р<0,05). Изучение пролиферативной функции лимфоцитов в РБТЛ выявило отсутствие нормализации индекса пролиферативной активности при стимуляции ППД и ФГА, по сравнению с показателями до лечения, что свидетельствовало о значительной функциональной недостаточности лимфоцитов, связанной, вероятно, с супрессивным действием антибактериальных препаратов. Кроме того, в среднем у 50% пациентов с ЛЧ МБТ и у 100% больных с ЛУ МБТ в сыворотке крови не отмечалось снижения уровня противотуберкулезных IgG, а уровень общего IgЕ значительно превышал значения аналогичных показателей у здоровых доноров ( в 1 ЛЧ – 389,5±78,3, в 2 ЛУ – 372,00±31,80 МЕ/мл, у здоровых – 64,12±±4,89 МЕ/мл, р<0,05). На этом фоне отсутствовала нормализация в показателях ИЛ-4 у всех пациентов, а уровень ИФН г оставался ниже, особенно у больных с ЛУ МБТ, чем у здоровых доноров (в группах сравнения в 1-ЛЧ – 14,32 ± 3,83 пг/мл, в 1-ЛУ – 2,19±0,15 пг/мл, у здоровых – 22,14±4,73пг/мл, р<0,05. Исследование аутоиммунных реакций показало наличие антител к нативной ДНК в 1-ЛЧ у 43,33 ± 7,30%, в 2- ЛУ – 63,33±3,6%, у здоровых – 15,05±5,3%, (р<0,05).
Данные, полученные нами при изучении СРО через 4 месяца после проведения противотуберкулезной терапии согласно стандартным режимам, также свидетельствовали об отсутствие положительных изменений у всех больных 1-ЛЧ и 1-ЛУ групп сравнения, но особенно у пациентов с ЛУ МБТ. Интенсивность ХЛ не изменилась и составила до лечения в 1 ЛЧ – 4442,23 ±334,21, а после лечения – 4612,23 ± 276,31 имп./6 сек., и ее уровень оставался выше аналогичного показателя у здоровых доноров (3310,00 ± 219,04 имп/6сек, p<0,05). Активность СОД также достоверно не изменилась (в 1-ЛЧ до лечения – 6,08 ± 2,13, после лечения в течение 4-х месяцев – 6,78 ± 1,97 у.е./мгНв) и была существенно ниже, чем у здоровых доноров (11,46 ± 0,83 у.е/мгНв) (p<0,05). Активность каталазы эритроцитов также не изменилась и сохранялась на сниженном уровне (у больных 2-ЛУ группы 61,65 ± 4,54 – до лечения и 63,32 ± 5,94 мкМ Н2О2/мин* мг Нв – после лечения) (p> 0,05).
МПО активность у больных после проведения стандартной терапии осталась также на прежнем уровне: 2,721 ± 0,31 у.е./мг * мин. – до лечения и 2,622 ± 0,22 у.е./мг * мин. после лечения; (p > 0,05). При сравнении эффективности лечения у больных, получавших только стандартную терапию, установлено, что у больных 1-ЛЧ группы сравнения показатель закрытия полостей распада составил всего 32,1±8,5%, прекращения бактериовыделения – 58,3±9,0%, рассасывания инфильтративных изменений – 26,7±8,1%, а у пациентов 2-ЛУ группы сравнения – 13,3±6,1%, 40,0±8,9% и 16,7±6,8% соответственно, что свидетельствовало о недостаточной эффективности стандартной терапии.
Недостаточная эффективность стандартных режимов антибактериальной терапии, высокая частота побочных реакций на ПТП, отсутствие положительных изменений в иммунном статусе и системе СРО диктовали настоятельную необходимость применения патогенетических методов терапии, направленных на повышение эффективности лечения, нормализацию иммунных нарушений и усиление роли антиоксидантной системы организма в интенсивную фазу стандартной терапии.
В соответствии с Методическими рекомендациями МЗ РФ «Методика дифференцированного использования антиоксидантов и других патогенетических средств в комплексном лечении больных туберкулезом легких» (приложение №4 к приказу МЗ РФ №291 от 19.07.1996) мы использовали в стандартной терапии ИТЛ альфа-токоферол. По данным литературы (С.Б.Вольф с соавт.,2003; Н.В. Кузьмина, В.Ю.Мишин,2003;), альфа-токоферол способствует прекращению бактериовыделения, сокращает сроки заживления полостей распада и предотвращает формирование выраженных фиброзных изменений в легочной ткани. Однако результаты наших исследований не показали существенного повышения эффективности стандартной антибактериальной терапии в сочетании с альфа-токоферолом. По нашему мнению, отсутствие выраженного эффекта может быть связано с тем, что, хотя альфа-токоферол и является одним из самых мощных природных антиоксидантов, при его взаимодействии с радикальными структурами образуются довольно активные хроманоксильные радикалы самого токоферола, способные вести дальше цепи СРО. По мнению Н.К.Зенкова с соавт. (2001), двойственность анти- и прооксидантного действия альфа-токоферола, позволяет рассматривать его не только как антиоксидант, но и как соединение, поддерживающее процессы СРО на определенном стационарном уровне. Находясь в силу гидрофобности в липидной части биомембран, альфа-токоферол предотвращает разрушение мембранных фосфолипидов свободными радикалами, но не защищает от свободнорадикальной деструкции белковые и углеводные молекулы.
Известно, что при фагоцитозе в результате респираторного взрыва образуется большое количество эндогенной перекиси водорода, являющейся основой для образования самых агрессивных АФК – гидроксильного радикала и гипохлорит иона. Уровень эндогенной перекиси водорода контролируется активностью каталазы. Исходя из основного принципа гомеопатии - принципа подобия, нам представляется, что потенцированный раствор перекиси водорода должен либо ингибировать процессы генерации перекиси водорода, либо, что более вероятно, активировать системы утилизации самой перекиси водорода. В организме перекись водорода разлагается на воду и молекулярный кислород одним из самых мощных и распространенных ферментов – каталазой. Следует отметить, что активность внутриклеточной каталазы регулируется уровнем перекиси водорода (В.З.Ланкин с соавт., 2001). Это дает возможность полагать, что воздействие потенцированной перекиси водорода должно стимулировать собственные защитные маханизмы организма и повысить активность каталазы. Нами было показано, что активность каталазы можно значительно повысить введением в организм потенцированной перекиси водорода (А.П.Шепелев, Л.А.Шовкун, 2007).
Это послужило основанием для включения в стандартные режимы антибактериальной терапии потенцированной перекиси водорода, приготовленной на основе 3% - ного аптечного препарата.
При сравнительной ежемесячной оценке клинических проявлений ИТЛ и эффективности лечения у всех больных в основных группах 1-ЛЧ и 1-ЛУ, которым к стандартным режимам антибактериальной терапии был добавлен потенцированный препарат перекиси водорода, установлены однонаправленные изменения. Уже в первые два месяца лечения отмечены положительные изменения не только общего состояния и бронхолегочных симптомов, но и улучшение показателей бактериовыделения, распада легочной ткани и инфильтрации легочной ткани. Так, если до лечения общая слабость отмечена у 78,3% в основной группе 1-ЛЧ, то уже через месяц лечения – у 45,5% пациентов. Также уменьшилась выраженность симптомов интоксикации и бронхолегочных проявлений с 1,53 до 1,28 баллов. В дальнейшем, через 3 и 4 месяца лечения при оценке результатов лечения наблюдалось повышение эффективности лечения, по сравнению с пациентами, получавшими только стандартную терапию.
При анализе показателей иммунного статуса у больных, получавших на фоне стандартного лечения потенцированную перекись водорода, установлено, что показатели состояния иммунного статуса претерпели некоторые положительные изменения, которые можно связать не только с непосредственным влиянием на образование эндогенной перекиси водорода, но и опосредованным повышением активности каталазы.
Выявленная активация апоптической активности лимфоцитов СD95+ (в 1-ЛЧ – с 8,78±0,35% до – 16,6±0,47%, в 1-ЛУ – с 7,12±1,41% до – 15,1±0,73%, р<0,05), по нашему мнению, свидетельствует об усилении процессов элиминации МБТ и уменьшении микробной популяции в организме, что согласуется с данными В.А. Краснова, (2003), А.В. Пичугина, А.С. Апт, (2005). Однако достоверного увеличения количества лимфоцитов, экспрессирующих СD4+ (в 1 ЛЧ - до лечения – 32,12±1,4%, после лечения – 32,30±2,13%, р>0,05 ) и снижения уровня СD8+ (в 1-ЛЧ до лечения – 29,31±1,1, после лечения – 27,68±1,12%, р>0,05), не произошло, что выразилось в отсутствии нормализации индекса СD4+/СD8+ (в 1-ЛЧ до лечения – 1,09±0,18, после лечения – 1,17±0,32, р>0,05). В то же время установлено уменьшение содержания натуральных киллеров СD16+ (в 1-ЛУ – с 17,73±1,12% до 12,54±1,32%, р<0,05) и СD20+ (в 1-ЛУ с – 25,41±1,01% до 17,11±1,41%, р<0,05), которое можно связать с уменьшением деструктивных процессов в легочной ткани вследствие регулирующего действия потенцированной перекиси водорода на антиоксидантные системы организма. На этом фоне выявлено уменьшение активности гуморального иммунного ответа, которое сопровождалось уменьшением пролиферации В-клеток (в 1-ЛЧ СD20+ – с 24,31±1,31% до 18,31±1,21%, р<0,05), снижением синтеза IgA, IgM и IgG, что свидетельствовало об уменьшении активности туберкулезного воспаления. Указанные изменения приводили к уменьшению содержания ЦИК в сыворотке крови (в 1-ЛЧ – с 164,00±5,00 у.е. до 83,53±4,73 у.е., р<0,05) и сопровождалось повышением активности нейтрофильного звена иммунитета, усилением кислородзависимого метаболизма (в 1-ЛЧ НСТ ст./сп. – с 1,40±0,15 у.е. до 2,68±0,35 у.е., р<0,05) и нейтрализацией токсических соединений.
У больных групп 1-ЛЧ и 1-ЛУ на фоне уменьшения активности гуморальных факторов иммунного ответа и отдельных звеньев клеточного иммунитета произошло некоторое увеличение индекса пролиферации в РБТЛ, как специфической, так и неспецифической активности лимфоцитов. Это отразилось и в повышении их способности продуцировать один из важнейших цитокинов - ИФН г, (в 1-ЛЧ с 9,39±2,25 до 16,45±3,48 пг/мл, в 1-ЛУ с 3,36±0,25 до 1,45±3,43пг/мл, р<0,05), без которого невозможна полноценная реализация иммунологических реакций. Средний уровень ИЛ-4 и ИФНг у всех пациентов приблизился к нормальным значениям здоровых доноров, что свидетельствовало о положительной тенденции в превалировании Тh-1 иммунного ответа при данном методе лечения. При исследовании аутоиммунных реакций выявлено снижение количества больных с наличием АТ к нативной ДНК, в среднем в 2 раза в обеих группах 1- ЛЧ и 1-ЛУ. Количество больных с АТ к ДНК денатурированной в процессе заболевания достоверно не изменилось. На фоне уменьшения аутоиммунных реакций организма снизился уровень противотуберкулезных IgG, свидетельствующий об уменьшении активности туберкулезного процесса у пациентов основных групп 1-ЛЧ и 1-ЛУ в процессе лечения (в 1-ЛЧ с 70,00±8,38% до 43,33±5,32%, в 1-ЛУ с 100,00±9,18% до 43,33±4,12%, р<0,05). Аналогичная тенденция была обнаружена и при изучении уровня общего IgЕ (в 1-ЛУ с 412,73±51,81 до 277,41±21,11 МЕ/мл), что свидетельствовало об уменьшении аллергизации пациентов, получавших комбинированное лечение.
По-видимому, регулирующее действие СМД перекиси водорода на тканевой гомеостаз организма запускает целую цепь клеточных и гуморальных механизмов, связанных с предотвращением некроза легочной ткани и уменьшением активности прооксидантных систем организма, в результате чего нормализуются показатели гуморального иммунитета, аутоиммунных и аллергических реакций.
Возможно, положительное действие потенцированной перекиси водорода на иммунный статус больных туберкулезом связано не только с восстановлением клеточных мембран, что привело к повышению активности фагоцитирующих клеток и выразилось в нормализации НСТст./спонт., но и с тем, что повышение активности СОД повлияло на апоптическую активность клеток (СD95+), что выразилось повышением готовности к апоптозу (в 1-ЛЧ с 8,78±2,35% до 16,9±0,47% в 1-ЛУ с 7,12±1,41% до 15,1±0,73%, р<0,05). Это в свою очередь вызвало усиление иммунных реакций, направленных на ликвидацию и выведение МБТ.
Таким образом, применение потенцированной перекиси водорода не только обеспечивает подавление СРО у больных ИТЛ, но и, предотвращая развитие аутоиммунных реакций и иммунного ответа по Th-2 типу, способствует в определенной степени, нормализации иммунного ответа по клеточному типу Th-1.
Можно полагать, что терапевтический эффект потенцированной перекиси водорода проявляется не только в стимуляции антиоксидантной системы организма путем снижения уровня эндогенной перекиси водорода, но и, возможно, действием на уровне транскрипции генов. Известно, что АФК, наряду с антигенами бактериального и вирусного происхождения, цитокинами, активаторами кальциевых каналов стимулируют группу ядерных белков, ответственных за транскрипцию генов, участвующих в воспалении и кодирующих синтез реактантов острой фазы (Е.Е.Дубинина, 2001). По мнению В.П.Скулачева (2001) и К.Т.Турпаева (2002), АФК являются частью физиологического пути передачи сигнала к клетке, ведущего к активации ядерного фактора, транслокации его в ядро и связыванию с ДНК. Антиоксиданты блокируют активацию белков ядерного фактора, тем самым, останавливая транскрипцию генов, ответственных за реализацию воспалительного ответа.
После проведения стандартной терапии с включением потенцированной перекиси водорода в течение 4-х месяцев у больных 1-ЛЧ и 1-ЛУ групп выявлены существенные положительные изменения в системе СРО. Выявлено снижение интенсивности ХЛ (в 1-ЛЧ с 4438,51±271,02 до 3402,55±210,40 имп./6сек; в 1-ЛУ с 4778,63±222,02 до 3428,14±161,17 имп./6сек., р<0,05). ХЛ, как известно, является интегральным показателем и ее интенсивность зависит от активности процессов СРО, содержания перекисных продуктов и уровня антиоксидантной защиты (Ю.А.Владимиров , 2000). Можно полагать, что под влиянием потенцированной перекиси водорода существенно возрастает активность антиоксидантых ферментов и снижается интенсивность СРО. Выявлено повышение активности СОД, ее уровень после лечения достоверно отличался от уровня до начала терапии и не имел существенных отличий от аналогичного показателя в контрольной группе здоровых доноров (в 1-ЛЧ – 12,51±1,96 у.е./мгНв, в 1-ЛУ – 11,21±1,84 у.е./мгНв, контроль – 11,46±0,83 у.е./мгНв, p > 0,05). Следует особо отметить повышение активности каталазы эритроцитов, которая в основной группе 1-ЛУ после проведенного лечения возросла с 93,94±2,12 до 133,21±5,73 мкМ Н2О2/мин*мгНв, в 1-ЛЧ с 94,21±2,85 до 134,53±5,06 мкМ Н2О2/мин*мгНв (p < 0,05). На фоне повышения активности каталазы отмечено существенное снижение активности МПО в 1-ЛЧ с 2,647±0,25 до 1,275±0,31 у.е./мг٭мин. и в 1 –ЛУ с 2,785±0,24 до 1,127±0,23 у.е./мг٭мин., (р<0,05) (рис.1).
В серии работ В.К.Гусака с соавт. (1986) также было показано, что внутриартериальное введение слабых растворов перекиси водорода приводит к повышению напряжения кислорода в тканях и интенсификации тканевого дыхания, при этом повышается активность каталазы, а уровень МДА снижается.
Известно, что активность МПО системы прямо зависит от концентрации перекиси водорода (Меньщикова Е.Б. с соавт.,1994), поэтому снижение содержания перекиси водорода вследствие активирования каталазной активности неизбежно приводит к уменьшению активности МПО и соответственно продукции гипохлорит-иона, разрушающего белковые структуры вследствие их окисления и хлорирования, что также положительно отразилось на закрытии полостей распада в легочной ткани. Кроме этого, стимуляция активности каталазы способствует повышению эффективности лечения вследствие усиления превращения изониазида в активную форму и снижает лекарственную устойчивость МБТ (B. Bloom, 2002). Поэтому особенно важным является факт уменьшения устойчивости к изониазиду у 50,0% больных. Известно, что устойчивость микобактерий к изониазиду, одному из основных антибактериальных противотуберкулезных препаратов, обусловлена способностью микобактерий подавлять процесс превращения изониазида в активную форму.
Рис.1
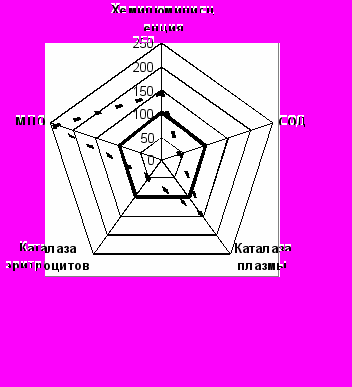
 A B
A B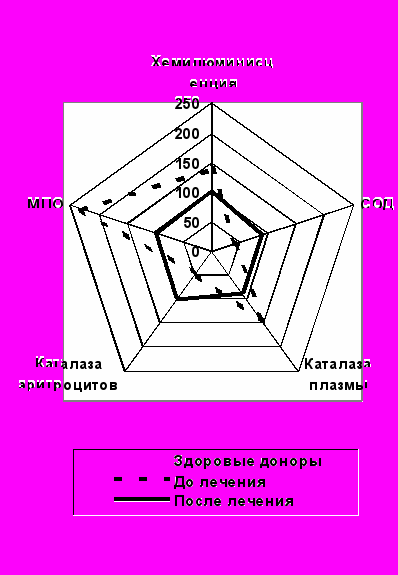
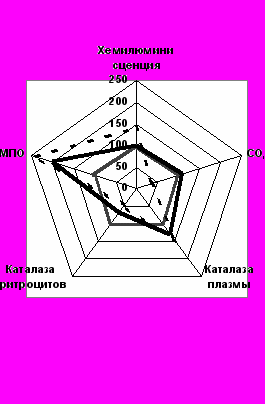
C D
Рис. 1 Показатели СРО у больных ИТЛ с выделением ЛУ МБТ до и после лечения (А - группа сравнения 2-ЛУ, В - основная группа 1-ЛУ, С – основная группа 2-ЛУ, D – основная группа 3-ЛУ)
Процесс реализуется активированием каталазы, которая окисляет восстановленный изониазид (пролекарственная форма), переводя его в активную форму, способную ингибировать активность ферментов, обеспечивающих синтез главного компонента клеточной стенки микобактерий – миколовой кислоты (В.А.Краснов с соавт., 2005; Bulatovic V. et al.. 2002; Quemard I. et al., 1991). Вследствие этого МБТ теряют один из важных факторов собственной защиты от неблагоприятных факторов окружающей среды – гидрофобность, которую обеспечивают мембранные миколовые кислоты. Это приводит к усилению проникновения из окружающей среды в МБТ лекарственных препаратов с одновременным выходом из клеток низкомолекулярных веществ (И.И.Белянин, Е.Н.Шмелев, 2007). Кроме этого показано, что окисление изониазида сопровождается генерацией NO-радикалов, которые также оказывают микробицидное действие и повышают способность клеток к апоптозу (В.А.Краснов с соавт., 2005).
Таким образом, положительный эффект препарата потенцированной перекиси водорода в нашем случае обусловлен индукцией синтеза каталазы в фагоцитирующих клетках с последующей активацией изониазида и повышением чувствительности микобактерий к лекарственным препаратам. Повышение активности каталазы в организме больных ИТЛ, с одной стороны, сопровождается снижением лекарственной устойчивости МБТ, с другой стороны, значительно уменьшается угроза деструкции легочной ткани вследствие снижения продукции АФК. Последнее обстоятельство, вероятно, не отражается на общем микробицидном эффекте, так как, по мнению многих авторов, АФК (супероксидный анион-радикал, перекись водорода, гипохлорит-ион, гидроксильный радикал) не играют ведущую роль в цитотоксическом действии против МБТ (В.А.Краснов с соавт., 2005; Чан Дж., Кауфман, 2002).
Наши данные о сниженной способности клеток крови больных ИТЛ к апоптозу совпадают с данными литературы (С.В.Бойчук с соавт., 2003; Б.М. Малиев с соавт., 2006). Однако под влиянием противотуберкулезного лечения в сочетании с потенцированной перекисью водорода способность к апоптозу восстанавливается. Это обстоятельство следует расценивать как прогностически благоприятный признак, так как элиминация клеток, пораженных МБТ, уменьшает персистенцию и обсемененность организма патогенными бактериями.
Таблица 2
