Особенности клинико-лабораторных проявлений инфильтративного туберкулеза легких при использовании комбинированных методов терапии 14. 00. 10 Инфекционные болезни 14. 00. 26 Фтизиатрия
| Вид материала | Автореферат диссертации |
- Коллапсотерапия в комплексном лечении деструктивного туберкулёза лёгких 14. 00., 428.25kb.
- Элективный курс по фтизиопульмонологии для студентов VI курса педиатрического факультета., 61.59kb.
- Болезни органов дыхания актуальность проблемы, 413.89kb.
- Клинико-эпидемиологические особенности гафниоза человека 14. 00. 30 эпидемиология 14., 476.36kb.
- Инсомнии у пожилых: особенности клинических проявлений и терапии, 194.69kb.
- Кравец елена владимировна, 152.52kb.
- Темы рефератов для студентов стоматологического факультета (осенний семестр), 12.86kb.
- Экзаменационные вопросы по дисциплине "Инфекционные болезни с курсом вич-инфекции, 93.5kb.
- Особенности синдрома диспепсии у детей, инфицированных микобактериями туберкулёза 14., 233.95kb.
- Индивидуальный план прохождения интернатуры по фтизиатрии Место работы, 144.75kb.
Сравнительная эффективность лечения в зависимости от проводимой терапии (%)
| Показатели | Группа сравнения P ± mp | Основная группа 1 P ± mp | Основная группа 2 P ± mp | Основная группа 3 P ± mp | |
| Закрытие полостей распада | ЛЧ | 32,1±8,5 | 54,6±9,1* | 66,7±8,6* | 76,0±7,8* |
| ЛУ | 13,3±6,1 | 23,3±7,7 | 30,0±8,4* | 38,9±8,1* | |
| Абациллирование | ЛЧ | 58,3±9,0 | 68,5±8,5 | 80,0±7,3* | 84,6±4,9* |
| ЛУ | 40,0±8,9 | 53,3±9,1 | 63,3±8,8* | 77,8±7,9* | |
| Рассасывание инфильтрации | ЛЧ | 26,6±8,1 | 60,0±8,9* | 73,3±8,1* | 79,4±7,4* |
| ЛУ | 16,7±6,8 | 23,3±7,7 | 33,3±8,5* | 44,5±8,3* | |
p < 0,05 – уровень статистической значимости различий между группами сравнения и основными группами
Таким образом, у больных основной группы 1-ЛЧ через 4 месяца лечения показатель закрытия полостей распада стал равен - 54,6 ± 9,1% , абациллирования - 68,5 ± 8,5%, а рассасывания инфильтративных изменений в легких - 60,0 ± 8,9%, что в среднем превышало показатели у больных, получавших только стандартную терапию в 1,7; 1,2; 2,2 раза соответственно. Такая же закономерность выявлена у больных основной группы 1-ЛУ: показатель закрытия полостей распада стал равен - 23,3 ± 7,7%, абациллирования - 53,3 ± 9,1%, а рассасывания инфильтративных изменений в легких - 23,3 ± 7,7%, что также превышало показатели у больных, получавших только стандартную терапию в 1,8; 1,3; 1,4 раза соответственно (табл. 2).
Однако, несмотря на положительные изменения в показателях эффективности лечения и клинических проявлений заболевания, у больных, получавших на фоне стандартных режимов потенцированную перекись водорода, сохранялись побочные реакции на антибактериальную терапию, изменения клеточного звена иммунного ответа, проявляющиеся в отсутствии нормализации CD4+, CD8+, индекса СD4+/СD8+, снижении пролиферативной и функциональной активности лимфоцитов, что послужило основанием для дополнительного назначения к стандартной терапии многокомпонентного гомеопатического препарата СМД лекарственных веществ.
Исходя из вышеизложенного, больным основных групп 2-ЛЧ и 2-ЛУ к стандартным режимам терапии дополнительно назначали многокомпонентный препарат СМД лекарственных веществ. Выбор лекарственных веществ в СМД определялся наличием многообразных симптомов ИТЛ, связанных с нарушением гемодинамики бронхолегочной системы, отечного синдрома (в стадии экссудации), выраженной дыхательной и сердечной недостаточности, нарушением процессов обезвреживания токсических продуктов в печени.
При составлении многокомпонентного препарата СМД лекарственных веществ руководствовались системной теорией, предложенной и обоснованной А.Н. Кудриным (1974). Суть ее заключается в одновременном применении препаратов из трех основных фармакологических групп, направленных на устранение (ослабление) причины заболевания, уменьшение патогенетических изменений и усиление (мобилизацию) защитных, компенсаторно-приспособительных механизмов организма. Для реализации этого положения в состав многокомпонентного препарата были включены лекарственные вещества, действующие на главные звенья патогенеза в пределах соответствующих физиологических и биохимических систем.
Воздействие многокомпонентного препарата СМД лекарственных веществ многогранно и зависит в первую очередь от монокомпонентов, которые входят в препарат. Каждое растительное лекарственное средство гомеопатия рассматривает как сложный лекарственный комплекс, в состав которого входят различные микроэлементы, алкалоиды, сапонины, гликозиды, эфирные масла и т.д. От качественного и количественного соотношения веществ, входящих в состав растений, зависит характер их лечебного действия.
Все клинические проявления ИТЛ тесным образом связаны не только с патогенезом заболевания, но и указывают на ключевые симптомы (патогенезы) СМД лекарственных веществ, действующих по принципу подобия. По мнению многих авторов, СМД лекарственных веществ действуют не только на определенный симптом заболевания, но и на гомеостаз всего организма (Е.Б.Бурлакова, 1999; В.Г.Зилов с соавт.,2001; А.А.Кондрадов, Е.Л.Мальцева, 2004). Воздействие лекарственных веществ, большую часть которых составляют лекарственные растения, обусловлено тем, что биологически активные вещества растений влияют на синтез белков (создают условия для синтеза иммунных тел) и, следовательно, усиливают защитные силы организма. Кроме того, многие гомеопатические препараты, состоящие из СМД лекарственных веществ, приготовленные из растений, богатых флавоноидами, каротиноидами, аскорбиновой кислотой, способны сами проявлять либо стимулировать антиоксидантную активность (H.Heine, 2005)
Нельзя исключить, что некоторые гомеопатические препараты, использованные нами и издавна применяемые в лечении бронхолегочных заболеваний, такие как апис меллифика (Apis mellifica), сангвинария канаденсис (Sangvuinaria cаnаdensis), карбо вегетабилис (Carbo vegetabilis) наряду с другими свойствами обладают антиоксидантной активностью (Э.Бьюри, 1993, С.А.Небера, 2001). В этом отношении особый интерес представляет расторопша пятнистая (Carduus marianus – гомеопатический препарат, применяемый для лечения бронхолегочной системы и болезней печени (Л.Френкель, 1993).
Так, например, салимарин – активный ингредиент Расторопши пятнистой обладает способностью нейтрализации свободных радикалов и иммуномодуляции. Его применение препятствует перекисному окислению липидов, способствует пролиферации лимфоцитов, улучшает функциональные печеночные тесты и гистологическую картину печени (М.В.Маевская, 2001).
На структурном или молекулярном подобии комплекса презентируемого антигенного пептида с МНС II и соответствующего рецептора СД4+ – Т-лимфоцитов построена теория механизма действия гомеопатических препаратов Х.Хайне (1999). По мнению автора этой теории, в основе механизма действия гомеопатических препаратов, полученных из сырья растительного или животного происхождения, лежит «вспомогательная иммунологическая реакция», заключающаяся в подавлении аутоиммунных процессов посредством регулирования выделения воспаления про- и противовоспалительных цитокинов. Основным медиатором этой реакции является ингибирующий воспаление медиатор – трансформирующий фактор TGF-Я, продуцируемый клонами специфически активированных регуляторных Th3 лимфоцитов.
В экспериментальных исследованиях был установлен стимулирующих эффект потенцированных гомеопатических препаратов животного и растительного происхождения на синтез TGF-Я в культуре цельной крови (H.Heine, 1998). Известно, что TGF-Я ингибирует активность провоспалительных лимфоцитов. Среди классических гомеопатических препаратов наибольшую стимуляцию в отношении продукции TGF-Я проявляют Aconitum napellus, Apis mellifica, Arnica montana, Atropa belladonna, Brionia cretica, Conium maculatum, Echinacea angustifolia, Euphorbium, Potassium bichromate. Rhus toxicodendron, Hepar sulfur, Chelidonium majus, Pulsatilla, Sanguinaria Canadensis, Carduus marianus (Т.И. Гаращенко и др., 2005; H.Heine, 1998). Установлено, что эти гомеопатические препараты стимулируют фагоцитарную активность (H.Wagner, 1993). Эти данные также учитывались нами при подборе препаратов для лечения больных туберкулезом легких.
Таким образом, повышение эффективности лечения у больных 2-ЛЧ и 2-ЛУ групп связано с тем, что в многокомпонентном препарате действие одного средства, имеющего определенную направленность, дополняется или усиливается действием другого вещества, что вызывает мощный противовоспалительный эффект. При включении в схему стандартной терапии многокомпонентного препарата СМД лекарственных веществ у всех больных основных групп 2-ЛЧ и 2-ЛУ выявлено более существенное уменьшение симптомов туберкулезной интоксикации и бронхолегочных проявлений независимо от лекарственной чувствительности МБТ. Уже через 1, а затем и спустя 2 месяца после начала лечения симптомы интоксикации наблюдали только у 10,0 ± 5,5% больных 2-ЛЧ группы, а у больных 2-ЛУ – у 40,0 ± 8,9% , что было значительно меньше, чем в группах сравнения. Эта тенденция выявлена и в отношении средних значений бальной выраженности клинических проявлений. Так, в 2-ЛЧ группе через два месяца лечения количество больных с клиническими проявлениями ИТЛ уменьшилось в среднем до 10%, а выраженность симптомов до 1,00 балла, в 2-ЛУ группе число больных с клиническими симптомами не превышало 20%, а выраженность их снизилась в среднем до 1,3 балла. Через 2 месяца комбинированной терапии у больных 2-ЛЧ группы бактериовыделение определялось у 20,0 ± 7,3% больных, тогда как в группе сравнения 1-ЛЧ – у 83,3 ± 6,8%; у больных 2-ЛУ – у 80,0 ± 6,8% , а в группе сравнения 2-ЛУ - у 100,0 ± 8,6% пациентов. В дальнейшем при оценке результатов лечения через 3 и 4 месяца комбинированной терапии выявлена дальнейшая быстрая положительная динамика ежемесячного уменьшения клинических проявлений туберкулеза по сравнению с больными, получавшими стандартные режимы терапии. Закрытие полостей распада в основной группе 2-ЛЧ отмечено у 66,7 ± 8,6% больных, что в 2 раза превышало этот показатель в группе сравнения 1-ЛЧ - 32,2 ± 8,5%; прекращение бактериовыделения составило 80,0 ± 7,3%, а в группе сравнения 1 ЛЧ – 58,3 ± 9,0%, что в 1,4 раза ниже; рассасывание инфильтративных изменений у больных основной группы 2-ЛЧ достигнуто в 73,3 ± 8,1% случаев, что превышало данный показатель у больных группы сравнения 1-ЛЧ в 2,7 раза (26,7 ± 8,1%). Аналогичные положительные результаты проводимой комбинированной терапии наблюдали у пациентов основной группы 2-ЛУ: закрытие полостей распада в 2,3 раза превышало этот показатель у больных группы сравнения 2-ЛУ (30,7 ± 8,4% и 13,3 ± 6,1% соответственно), прекращение бактериовыделения достигнуто у 63,3 ±8,8% больных основной группы 2- ЛУ и у 40,0 ±8,9% больных группы сравнения 2-ЛУ, что больше в 1,6 раза, инфильтративные изменения в легких рассосались у 36,7 ± 8,5% больных основной группы 2-ЛУ, аналогичный показатель у больных группы сравнения 2-ЛУ был в 2,2 раза ниже (16,7 ± 6,8%)(табл. 2 ).
Кроме того, при лечении многокомпонентным препаратом СМД лекарственных веществ также выявлено снижение устойчивости к изониазиду с 24,2% до 18,4% случаев. Показательным является то, что при включении в схему стандартной терапии многокомпонентного препарата СМД лекарственных веществ значительно снизилась частота побочных реакций на противотуберкулезные препараты. Особенно это было выражено в 2-ЛЧ группе больных. Если в группе сравнения 1-ЛЧ побочные явления наблюдали у 26,7±4.1% пациентов, то в основной группе 2-ЛЧ – у 7,0 ± 4,7% больных (в 3,8 раз меньше). Аналогичные результаты получены и в основной группе 2-ЛУ, где побочные реакции проявлялись значительно реже, чем в группе сравнения 2-ЛУ (7,0 ±4,7% и 40,0 ± 5,2% соответственно).
При добавлении к стандартным режимам антибактериальной терапии многокомпонентного препарата СМД лекарственных веществ произошли положительные изменения и в иммунном статусе. В основных группах 2-ЛЧ и 2-ЛУ при изучении иммунных показателей у больных ИТЛ после лечения выявлено улучшение показателей иммунного статуса, особенно клеточных факторов иммунного ответа.
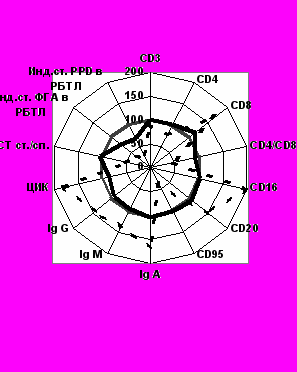
По нашему мнению, более выраженные положительные изменения в иммунном статусе по сравнению с применением потенцированной перекисью водорода связаны с многогранным действием многокомпонентного препарата СМД лекарственных веществ, как уже было отмечено выше, на разные звенья патогенеза ИТЛ. Воздействие на иммунный статус проявилось в увеличении зрелых Т-лимфоцитов у больных основной группы 2-ЛУ: до лечения лимфоциты СD3+ составляли 58,14 ±1,43%, после лечения – 65,81 ± 0,23%, что было достоверно выше, чем при стандартных методах лечения (р<0,05). Также установлено, что нормализация иммунорегуляторных субпопуляций (СD4+, СD8+) сопровождалась повышением иммунорегуляторного индекса СD4+/СD8+ в 2-ЛЧ группе с 1,07±0,15 до 1,94± 0,12; в 2-ЛУ – с 0,97±0,02 до 1,81±0,07, (р<0,05). Положительный эффект проявился также в способности лимфоцитов к пролиферации, особенно у больных, у которых мы наблюдали анергию при оценке р.Манту с 2 ТЕ. В 2-ЛУ группе индекс стимуляции в РБТЛ с PPD повысился с 0,8±0,2 до 1,8±0,2, в 2-ЛЧ с 1,8±0,1 до 2,3±0,1 (р<0,05), Это свидетельствовало об усилении специфических иммунных реакций и уменьшении анергии иммунокомпетентных клеток, что подтверждалось увеличением р.Манту с 2ТЕ у больных данных групп.
В основных группах 2-ЛЧ и 2-ЛУ на фоне нормализации клеточных факторов иммунного ответа, более выраженное у больных, выделяющих ЛУ МБТ, произошло восстановление апоптической активности лимфоцитов. Так, у больных основной группы 2-ЛЧ выявлено увеличение СD95+ с 8,72 ± 2,41% до 17,4 ± 0,46%, в 2-ЛУ – с 6,74±0,35% до 17,86±0,54%, (р<0,05), что свидетельствовало об активизации процессов, направленных на элиминацию МБТ из организма. Наряду с этим отмечена положительная динамика в содержании СD16+ лимфоцитов и, что особенно важно, в показателях лимфоцитов, экспрессирующих СD20+. Изменения, связанные с подавлением Th 2 иммунного ответа, сопровождались в 2-ЛЧ группе снижением синтеза IgA с 2,94±0,11г/л до 1,92±0,11г/л, IgM с 2,53±0,22г/л до 1,43±0,13г/л, IgG с 16,12±0,39г/л до 13,73±0,43г/л, что свидетельствовало об уменьшении активности туберкулезного процесса и служило благоприятным прогнозом заболевания. Подобные изменения наблюдались и в 2-ЛУ группе. Это сопровождалось значительным уменьшением количества ЦИК в обеих основных группах и отразилось на усилении кислородзависимого метаболизма. Выраженный позитивный эффект многокомпонентного препарата СМД лекарственных веществ выразился в существенной стимуляции функциональной активности нейтрофилов и возрастании их адаптационных резервов как у больных 2-ЛЧ (НСТ ст./сп. с 2,56 ± 0,26 у.е. до 1,60 ± 0,15у.е.). В среднем в 2,0 раза также увеличился этот показатель у больных 2-ЛУ группы. Регулирующее влияние СМД лекарственных веществ проявилось в восстановлении равновесия в цитокиновой системе и подтверждалось понижением уровня ИЛ-4 в 2-ЛЧ группе с 12,96±2,29пг/мл до 4,83±1,24 и одновременным повышением уровня ИФНг с 10,36±3,55пг/мл до 21,87±3,76; в 2-ЛУ с 23,63±2,54 пг/мл до 4,64±0,42 и с 2.02±0,14пг/мл до 19,97±4,84 соответственно, (р<0,05). Уровень IgE снизился в 2-ЛЧ группе с 412,73±51,81МЕ/мл до 97,91±21,11МЕ/мл, (р<0,05), но не достиг показателей у здоровых доноров (64,12±4,89МЕ/мл). Аналогичные изменений наблюдались и в 2-ЛУ группе пациентов. Сопоставление клинических проявлений ИТЛ с динамикой изменения уровня IgE позволяет заключить, что повышение уровня IgE характерно для инфильтрации и распада, и связано с активностью процесса. В дальнейшем, при уменьшении активности процесса, ликвидации распада в легочной ткани происходит снижение уровня IgE, что отражает остроту патологического процесса, развивающегося в местах концентрации туберкулезных антигенов. Снижение аутоиммунных реакций и аллергизации организма подтверждалось понижением уровня противотуберкулезных IgG в 2-ЛУ группе в 2 раза с 100,00±2,22% до 50,00±9,30%, уменьшением содержания АТ к ДНК нативной, особенно у больных с выделением ЛУ МБТ с 66,66±12,71% до 16,66±3,7%, что свидетельствовало об уменьшении активности туберкулезного процесса.
При включении многокомпонентного препарата СМД лекарственных веществ в стандартные режимы терапии у больных групп 2-ЛЧ и 2-ЛУ отмечены изменения в системе СРО, однако положительные изменения наблюдались лишь в показателях интенсивности ХЛ и активности СОД. Интенсивность ХЛ уменьшилась в обеих основных группах 2-ЛЧ и 2-ЛУ: в 2-ЛЧ – с 4398,73±301,01 до 3323,18±252,28 имп./6сек., в 2-ЛУ – с 4699,21±220,18 до 3317,23±241,22имп./6сек. (p<0,05). Отмечено повышение активности СОД в 2-ЛЧ группе с 6,27±0,97 до 13,51±2,15 у.е./мгНв, в 2-ЛУ – с 4,28±0,85 до 12,52±1,14 у.е./мгНв, (p<0,05). Возможно, это связано с детоксикацией, выведением токсических соединений, нормализацией метаболических процессов в печени, что может быть обусловлено действием монопрепаратов Chelidonium majus, Apis mellifica, Potassium bichromate, Carduus marianus, входящих в использованный нами комплекс. Известно, что эти препараты содержат алкалоиды хелидонин, холеритрин и др. и оказывают выраженное нормализующее действие на функцию печени. В частности, Chelidonium majus стимулирует иммунные механизмы защиты при острых воспалительных заболеваниях желчного пузыря и желчевыводящих протоков, оказывает детоксицирующее действие, нормализует микроциркуляцию и гемодинамику в гепатобилиарной зоне, активирует лимфодренаж паренхимы печени и поджелудочной железы, уменьшает венозный стаз в системе воротной вены и венозной системе печени (А. Макоцци, 2007). Другой монопрепарат Carduus marianus в качестве активного ингредиента содержит салимарин, обладающий иммуномоделирующей активностью и способностью к нейтрализации свободных радикалов (М.В.Маевская, 2001).
Установленное нами повышение активности СОД под влиянием СМД лекарственных веществ, может быть обусловлено тем, что Quinine, Chelidonium majus, Carbo vegetabilis, содержащиеся в многокомпонентном препарате, имеют в своем составе микроэлементы медь и цинк (Н.М.Вавилова, 1992), входящие в активный центр СОД, что позволяет предположить возможность избирательного регулирующего влияние этих препаратов на активность СОД, направленное на обезвреживание супероксидных анионрадикалов, способных вести цепные реакции СРО. Следует особо отметить, что повышение активности каталазы произошло в незначительной степени и это можно связать с отсутствием целенаправленного воздействия на избыток эндогенной перекиси водорода, нормализация количества которой происходит при введении потенцированной перекиси водорода. МПО активность осталась на уровне показателей до лечения и была выше показателей здоровых доноров (р<0,05). Эффективность МПО системы прямо зависит от концентрации перекиси водорода (Зенков Н.К. с соавт., 2001), поэтому отсутствие снижение содержания перекиси водорода не привело к снижению активности МПО и соответственно к уменьшению продукции гипохлорит иона, разрушающего белковые структуры вследствие их окисления и хлорирования. Однако снижение интенсивности ХЛ свидетельствует об уменьшении общего количества АФК, что может быть обусловлено антиоксидантным действием СОД, результатом чего явилось повышение эффективности лечения.
Таким образом, нами установлено, что включение многокомпонентного препарата СМД лекарственных веществ положительно влияет на иммунный статус и антиоксидантную активность организма. Выявленные нами положительные изменения в системе СРО в основных группах 2- ЛЧ и 2- ЛУ, хотя и не были столь значительными как при назначении потенцированной перекиси водорода, однако, эффективность лечения в виде закрытия полостей распада, уменьшения инфильтрации легочной ткани и абациллирования были достаточно выраженными, что может свидетельствовать о многогранном, универсальном и регулирующем механизме многокомпонентного препарата СМД лекарственных веществ, действие которого направлено также и на повышение антиоксидантной защиты организма.
Эти и другие данные послужили основанием для одновременного сочетанного применения потенцированной перекиси водорода и многокомпонентного препарата СМД лекарственных веществ, что, по нашему мнению, должно способствовать большей нормализации СРО, иммунного статуса и устранению побочных реакций антибактериальной терапии вследствие стимуляции антитоксической и дренажной функции организма.
При ежемесячной оценке степени изменения клинических проявлений и показателей эффективности лечения больных основных групп 3-ЛЧ и 3-ЛУ с включением в схему стандартной терапии потенцированной перекиси водорода и многокомпонентного препарата СМД лекарственных веществ обнаружена выраженная быстрая положительная динамика (табл.2, рис.2).
Рис.2
 Рис.2 Выраженность клинических симптомов в баллах у больных 3-ЛЧ группы
Рис.2 Выраженность клинических симптомов в баллах у больных 3-ЛЧ группы Так, уменьшение симптомов в первый месяц лечения произошло в среднем у 75% больных 3-ЛЧ группы, а выраженность симптомов через 1 месяц лечения уменьшилась с 1,75 ± 0,14 до 1,13 ± 0,12 баллов, в дальнейшем, уже через 2 месяца до 1,00 ± 0,01 баллов; в 3-ЛУ группе с 2,21 ± 0,13 до 1,3 ± 0,12 баллов через 1 месяц лечения, а через 2 месяца до 1,2 ±0,11 баллов. Через 4 месяца лечения в 3-ЛЧ группе клинические симптомы наблюдались у единичных больных, выраженность их составляла не более 1,00 ± 0,05 балла, тогда как в группе сравнения 1-ЛЧ число больных, имеющих клинические проявления заболевания превышало 50%, а выраженность симптомов была в среднем 1,70 ± 0,11 баллов; в 3-ЛУ – 1,1±0,11 балла, а в группе сравнения 2-ЛУ – у 90% больных выраженность клинических проявлений была в среднем 1,8±0.12 баллов ( рис.3).
Рис.3
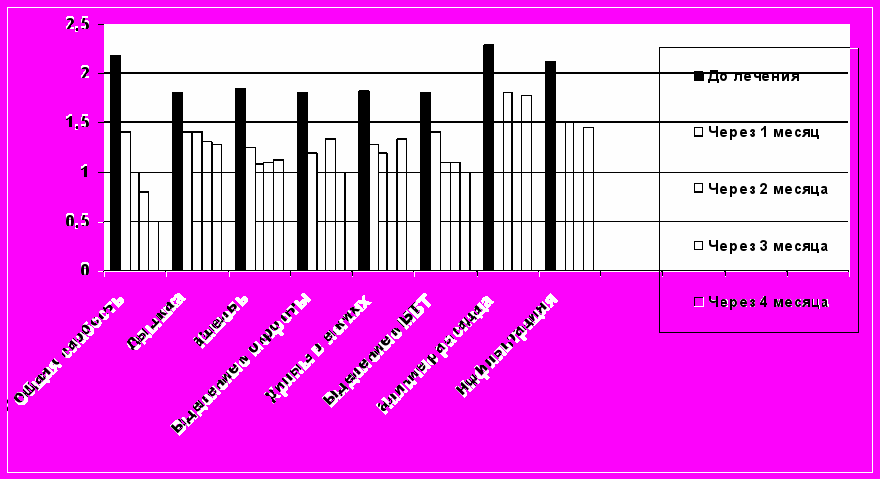 Рис. 4 Выраженность клинических симптомов в баллах у больных 3-ЛУ группы
Рис. 4 Выраженность клинических симптомов в баллах у больных 3-ЛУ группыТаким образом, через 4 месяца лечения у всех больных 3-ЛЧ и 3-ЛУ групп наблюдали значительное улучшение общего состояния, выраженное уменьшение бронхолегочных симптомов по сравнению с группами сравнения 1-ЛЧ и 2-ЛУ, получавших только стандартную терапию. Анализ выделенных штаммов МБТ выявил улучшение в показателях устойчивости к изониазиду: так если до лечения устойчивость к изониазиду отмечена у 8 чел. (26,7%), то после комбинированного лечения – у 5 больных (11,5%), к остальным препаратам устойчивость существенно не изменилась.
У больных 3-ЛЧ и 3-ЛУ групп, получавших комбинированную терапию, показатели эффективности лечения через 4 месяца были значительно выше, чем у больных, находившихся на стандартных режимах и на режимах с добавлением только потенцированной перекиси водорода или многокомпонентного препарата СМД лекарственных веществ. Закрытие полостей распада в основной группе 3-ЛЧ составило 76,0 ± 7,8%, что превысило аналогичный показатель у больных группы сравнения 1-ЛЧ в 2,4 раза (32,2 ± 8,5%), абациллирование достигнуто у 84,6 ± 4,9% больных и это в 1,6 раза выше, чем в группе сравнения 1- ЛЧ (58,3 ± 9,0%), инфильтративные изменения в легочной ткани рассосались у 79,4 ± 7,4% больных, а в группе сравнения 1- ЛЧ - лишь в 26,7 ± 8,1% случаев, что 2,9 раза больше (табл. 2). Показатель закрытия полостей распада у больных группы 3 - ЛУ превысил в 2,9 раза аналогичный показатель у больных, получивших стандартное лечение (38,9 ± 8,1% и 13,3 ± 6,1% соответственно), прекращение бактериовыделения у больных основной группы 3 - ЛУ составило 77,8 ± 4,9%, что в 1,9 раза больше, чем у больных группы сравнения 2 - ЛУ, где этот показатель составил – 40,0 ± 8,9%, а инфильтративные изменения в легочной ткани рассосались у 44,5 ± 8,3% больных и у 16,7± 6,8% больных группы сравнения 2 -ЛУ, что в 2,7 раза ниже. Существенным положительным эффектом применения комбинированной терапии явилось снижение частоты побочных реакций на прием ПТП, как у больных с лекарственной чувствительностью (в 3,8 раз), так и у больных с лекарственной устойчивостью (в 7,2 раз). Кроме того, у больных с ЛЧ к противотуберкулезным препаратам не наблюдали аллергических и дисбиотических явлений.
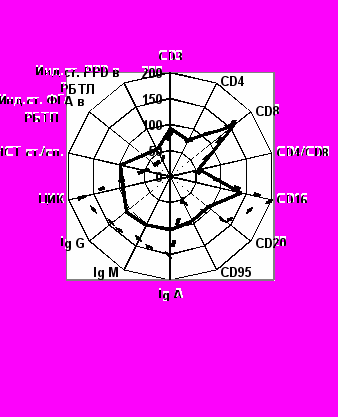
В основных группах 3-ЛЧ и 3-ЛУ установлено значительное улучшение показателей иммунного статуса, связанное по нашему мнению, с одновременным воздействием на разные звенья патогенеза туберкулезного заболевания. Следует отметить выраженный позитивный эффект, заключающийся в увеличении зрелых Т-лимфоцитов (СD3+) в 3- ЛУ группе с 58,21 ±1,31% до 67,31 ± 0,73%, (p < 0,05), содержания СD4+ в 3-ЛЧ – с 32,22±1,21% до 39,31±1,52%; в 3-ЛУ – с 28,94±0,74% до 38,65±1,69%, уменьшении СD8+ -лимфоцитов в 3-ЛУ – с 31,91±0,53% до 21,43±0,98% (р<0,05), показателей цитотоксических лимфоцитов – СD16+ в 3-ЛЧ с 17,93±1,14% до 9,89±1,21%; в 3-ЛУ с 18,69±0,57% до 10,25±0,58% (р<0,95). Выявлено повышение количества лимфоцитов, экспрессирующих СD95+ в 3-ЛЧ с 9,16±0,31 до 16,4±0,56% и в 3-ЛУ с 7,72±0,54% до 16,89±0,44% (р<0,05). Установлено восстановление продукции ИФНг (в 3-ЛУ группе с 3,02±0,18 до 19,41±5,72 пг/мл, р<0.05) и ИЛ-4, противотуберкулезных IgG-антител и IgЕ, на фоне нормализации содержания антител к нативной (16,66±3,8%) и денатурированной ДНК (p<0,05). Еще более выраженный положительный эффект проявлялся в способности лимфоцитов к пролиферации (повышение индекса РБТЛ на PPD в 3-ЛУ с 0,9±0,2 до 2,6±0,2, p < 0,05), особенно у больных с ЛУ МБТ, у которых мы наблюдали анергию при оценке р.Манту с 2 ТЕ. Это свидетельствовало об усилении специфических иммунных реакций и уменьшении анергии. После проведения стандартной терапии с включением потенцированной перекиси водорода и многокомпонентного препарата СМД лекарственных веществ в течение 4-х месяцев у больных 3-ЛЧ и 3-ЛУ выявлены значительные положительные изменения в системе СРО по сравнению с показателями до лечения. Установлено снижение интенсивности ХЛ в 3-ЛЧ группе – с 4408,61±256,02 до 3354,24±243,54имп./6сек., в 3-ЛУ – с 4568,43± 219,14 до 3392,51± 134,22имп./6сек. (p< 0,05), что свидетельствует об уменьшении активности свободнорадикальных процессов и может служить благоприятным признаком для прогноза заболевания. Возросла активность СОД в 3-ЛУ с 4,64±0,32 до 10,28±2,97у.е./мгНв, (p < 0,05). Активность каталазы также повысилась с 47,36±2,96 до 131,34±25,87 мкМ Н2О2/мин*мгНв, (p> 0,05), что способствует переходу неактивной формы изониазида в активную, уменьшению или предупреждению лекарственной устойчивости МБТ (B. R. Bloom, 2002).
Рис.4

A В