Федеральной целевой программы «Научные и научно-педагогические кадры инновационной России» на 2009-2013 годы (г. Уфа, 29 сентября 5 октября 2010 г.) Уфа 2010
| Вид материала | Программа |
СодержаниеУдк 663.421/.432(470.57) применение скарификации для повышения качества солода Материалы и методы. Результаты исследований. Материалы и методы Результаты исследований. |
- Концепция федеральной целевой программы «Научные и научно-педагогические кадры инновационной, 238.28kb.
- Программа "научные и научно-педагогические кадры инновационной россии", 777.29kb.
- Приглашаем Вас принять участие, 41.95kb.
- Управление научных исследований, 848.86kb.
- Российский новый университет, 29.94kb.
- Российский новый университет, 27.25kb.
- О проведении открытого конкурса, 71.41kb.
- Уважаемые коллеги!, 67.96kb.
- Российский новый университет, 26.29kb.
- Российский новый университет, 81.02kb.
УДК 663.421/.432(470.57)
ПРИМЕНЕНИЕ СКАРИФИКАЦИИ ДЛЯ
ПОВЫШЕНИЯ КАЧЕСТВА СОЛОДА
APPLICATION OF SCARIFICATION FOR
IMPROVEMENT OF MALT QUALITY
Будакова Э.Д., Некрасов С.В.
Budakova E.D., Nekrasov S.V.
Башкирский государственный аграрный университет, г. Уфа, Россия, e-mail alvira2879@rambler.ru
Ячмень, солод, травмированное зерно, скарификация, стимулятор, ингибитор
Barley, malt, damaged grain, scarification, stimulant , inhibitor
В процессе уборки и хранения зерно неоднократно подвергается ударам, сжатию и трению, что сопровождается травмированием поверхностных и внутренних тканей зерновок. В последние годы для физической характеристики ячменя был введен термин «премалтинг», отражающий, в том числе, растрескивание и прорастание [1]. Растрескивающиеся зерна в ходе солодоращения перерастворяются или недорастворяются. Кроме того, известно, что проращивание травмированного зерна ячменя заметно сокращает длительность солодоращения. Нарушение целостности или частичное удаление оболочки зерна способствует лучшему доступу воды и кислорода к зародышу зерна и алейроновому слою в процессе замачивания и проращивания, что приводит к активации биохимических процессов, происходящих в зерне при производстве солода.
Нами была проведена оценка степени травмированности зерна, выращенного в Башкортостане, сорта Одесский 100. Метод окрашивания позволил выявить внешние дефекты зерна, степень травмированности при этом составила 29%от общей массы. Интроскопия показала наличие внутренних дефектов, таких как трещиноватость эндосперма (69,4% зерен) и дефекты зародыша (17,6 %). В процессе солодоращения сортированного ячменя травмированное зерно достигает необходимой степени замачивания на 24 ч быстрее, чем целое. Продолжительность проращивания травмированного зерна сокращается на 2 сут. Такая разница приводит к неравномерному растворению веществ эндосперма зерна и не позволяет полностью осуществить растворение зерна и накопить достаточную активность ферментных систем в готовом солоде или к перерастворению части зерна и, соответственно, к увеличению потерь сухих веществ (СВ) на дыхание.
В ходе дальнейших исследований для улучшения качества солода подвергли зерно механической скарификации. Так как поврежденность ячменя способствует увеличению степени растворения солода в недостаточной мере для получения солода хорошего качества, нами предложен способ производства солода с использованием активатора роста и ингибитора дыхания, применение которых способствует ускорению протекания биохимических процессов в прорастающем зерне и, в то же время, предотвращает перерастворение солода и возникновение больших потерь СВ веществ при солодоращении. Повреждение плодовой и цветочной оболочки зерна перед солодоращением позволяет более эффективно использовать свойства регуляторов роста.
Учитывая известный факт, что гибберелловая кислота (ГК) индуцирует образование ферментов, а NaCl ингибирует действие протеаз, установили взаимосвязь между их дозировками и прорастаемостью, а также изменением накопления аминного азота в солоде, характеризующего степень растворения белковых веществ (рисунки 1 и 2).
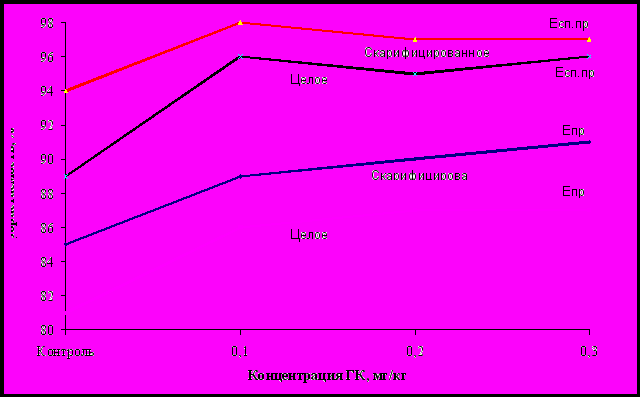
Рисунок 1 Влияние концентрации ГК на энергию прорастания
ячменя: Епр – энергия прорастания, %;
Есп.пр – способность прорастания, %.
При внесении ГК в концентрации 0,1 мг/кг наблюдалось максимальное значение энергии и способности прорастания зерна, как целого, так и скарифицированного. Дальнейшее увеличение концентрации ГК существенно не изменило показатели их способности прорастания. При этом на скарифицированное зерно внесение ГК оказало больший эффект, чем на целое. В дальнейшей работе приняли концентрацию ГК 0,1 мг/кг.
Активная жизнедеятельность зародыша предполагает его высокую протеолитическую активность, использование продуктов протеолиза на построение новых тканей ростка и корешков. Обработка зерна ГК усиливает поступление азотистых веществ в зародыш ячменя, что увеличивает потери на дыхание и рост корешков. Для устранения этих недостатков между фазой замачивания и проращивания зерна вносили NaCl, который подавляет протеолитическую активность в эндосперме зерна при прорастании, вызывающую увеличение растворимости азотистых веществ и потемнение солода, сдерживает растворение белка, ускоряя вместе с тем распад в эндосперме некрахмальных полисахаридов.
Учитывая результаты влияния ГК на прорастаемость, при обработке образцов замоченного ячменя раствором NaCl при проращивании, определяли количество аминного азота в готовом солоде (рисунок 2).
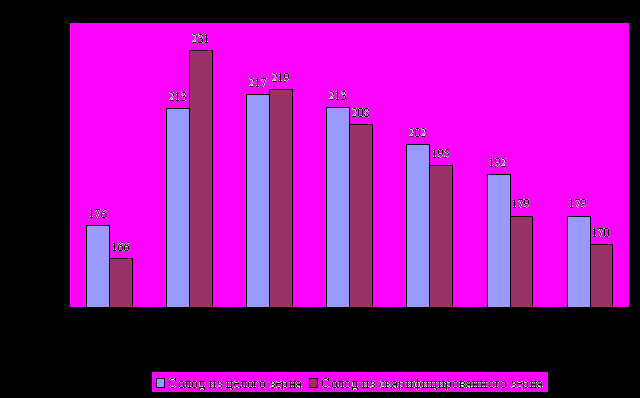
Рисунок 2 Влияние концентрации NaCl на накопление аминного азота в солоде
Известно, что хорошо растворенный солод должен содержать 180-230 мг аминного азота в 100 г экстракта. Внесение ГК и минимальной концентрации NaCl при получении солода из целого зерна привело к резкому увеличению количества аминного азота до предела, граничащего с состоянием перерастворения. Дальнейшее увеличение концентрации соли способствовало снижению его накопления. В результате, при концентрации NaCl 0,4% к массе зерна солод обоих образцов накапливал необходимое количество аминного азота (в интервале 190-200 мг/100 г экстракта), соответствующее хорошему растворению.
Образцы скарифицированного ячменя (как с регуляторами роста, так и без них) достигли необходимой степени замачивания за более короткий срок (46 и 50 ч соответственно) по сравнению с нескарифицированным ячменем, чему способствовало нарушение целостности оболочек и трещиноватость эндосперма. Сократилась продолжительность проращивания и усилилось растворение эндосперма (таблица 1).
Таблица 1 Показатели качества солода
| Показатель | Скарифицирован-ный | Целый | ||
| ячмень | ячмень + ГК + NaCl | ячмень | ячмень + ГК + NaCl | |
| Экстрактивность, % от СВ | 81,4 | 84,5 | 78,7 | 80,8 |
| Разность массовых долей экстракта в сухих веществах солода тонкого и грубого помола, % | 2,0 | 1,7 | 2,9 | 2,3 |
| Белок, % от СВ | 11,3 | 11,5 | 11,5 | 11,5 |
| Число Кольбаха, % | 44,7 | 40,0 | 38,0 | 41,2 |
| Аминный азот, мг/100 г экстракта | 173 | 195 | 188 | 204 |
| Продолжительность осахаривания, мин | 15 | 10 | 26 | 20 |
Солод из скарифицированного ячменя отличался высокой активностью амилолитических ферментов, по сравнению с солодом из целого ячменя, о чем свидетельствует более высокие значения экстрактивности, низкие показатели разности экстрактов и более короткая продолжительность осахаривания.
Наибольшей экстрактивностью обладал солод, приготовленный из скарифицированного ячменя с обработкой ГК и NaCl, а меньшей – солод из необработанного целого зерна. Это объясняется тем, что через поврежденную оболочку зерна не только вода и кислород поступают к зародышу лучше, но и ГК, способствующая более быстрому образованию и накоплению ферментов, а трещиноватость эндосперма позволяет ферментам более глубоко и равномерно растворить белково-гемицеллюлозный каркас. Проникновение же NaCl способствовало последующему ингибированию жизнедеятельности зародыша, что не допустило перерастворения.
Разработанный технологический прием производства солода из скарифицированного ячменя с применением гибберелловой кислоты и хлорида натрия, может быть рекомендована для ячменя, возделываемого в Башкирии, так как он способствует сокращению продолжительности замачивания и проращивания на 3 сут и улучшению показателей качества солода за счет выравнивания свойств скарифицированного и травмированного зерна.
Литература
- Кунце В., Мит Г. Технология солода и пива. – СПБ.: Профессия, 2001.
- Ермолаева Г.А., Колчева Р.А. Технология и оборудование производства пива и безалкогольных напитков.- М.: ИРПО; Изд.центр «Академия», 2000.
УДК 636.237.23:575
создание системы скрининга аллелей гена
BoLA-DRB3.2, обуславливающЕго потенциальную устойчивость КРУПНОГО РОГАТОГО СКОТА к вирусу лейкоза
DEVELOPMENT OF system for SCREENING BOLA-DRB3.2 alleles provided the potential resistanse to the bovine leukemia virus
Быкова А.С., Гладырь Е.А., Зиновьева Н.А.
Bykova A.S., Gladyr E.A., Zinovieva N.A.
Всероссийский научно-исследовательский институт животноводства Россельхозакадемии (ГНУ ВИЖ Россельхозакадемии), пос. Дубровицы Подольского р-на Московской обл., Россия, e-mail n_zinovieva@mail.ru
Устойчивость к лейкозу, аллель-специфичная ПЦР, КРС
Resistance to leukemia, allele-specific PCR, cattle
Лейкоз КРС – инфекционное заболевание, наносящее значительный экономический ущерб хозяйствам вследствие снижения продуктивности животных, их преждевременной выбраковки, запрета на продажу молодняка из неблагополучных по лейкозу хозяйств, дополнительных расходов на проведение ветеринарных мероприятий. Было показано, что некоторые аллели (*11, *23, *28 =*7А) гена BoLA-DRB3.2 главного комплекса гистосовместимости обуславливают устойчивость животных к ВЛКРС, в то время как другие аллели (*8 =*22, *16, *24), наоборот, связаны с повышенной чувствительностью к лейкозу [Эрнст Л.К., Сулимова Г.Е., и др. 1997]. Анализ последовательностей в генном банке показал, что все вышеназванные аллели в отличие от других аллелей характеризуются полиморфизмом 71E / 72R. В этой связи целью настоящих исследований является разработка и экспериментальная апробация тест-системы на основе аллель-специфичной ПЦР (АС-ПЦР) для определения полиморфизма 71E / 72R гена BoLA-DRB3.2, соответствующего аллелям *11, *23, *28 =*7А, потенциально связанным с устойчивостью к ВЛКРС.
Материалы и методы. Выделение ДНК проводили по методикам Центра биотехнологии и молекулярной диагностики ГНУ ВИЖ. Для выявления референтных образцов была амплифицирована часть экзона 2 гена BoLA-DRB3 по методике Van Eijk с соавторами [1992]. Далее было проведено пиросеквенирование продуктов амплификации и найдены референтные образцы, после чего был осуществлен подбор праймеров для проведения аллель-специфичной ПЦР, позволяющей выявить аллели, обуславливающие устойчивость к лейкозу. Результаты АС-ПЦР визуализируют в 3% агарозном геле.
Результаты исследований. На первом этапе с помощью пиросеквенирования были найдены референтные генотипы. Последующая экспериментальная апробация разработанной тест-системы показала 100% совпадение результатов с данными пиросеквенирования.
Последующий скрининг 1244 голов крупного рогатого скота 11 пород Разработанная система была апробирована на 1244 головах крупного рогатого скота, в том числе 1223 головах скота культурных пород, 19 головах зебувидного скота и 4-х головах буйволов показала частоту встречаемости аллелей ER от 0% у животных красно-пестрой породы до 21,7% у животных симментальской породы (табл. 1).
Таблица 1 Частоты встречаемости аллелей гена BoLA-DRB3.2.
| Порода скота | N, гол. | Частота аллелей, % | |
| ER | -/-* | ||
| Черно-пестрая | 417 | 12,11 | 87,89 |
| Красно-пестрая | 5 | 0,00 | 100,00 |
| Холмогорская | 83 | 21,69 | 78,31 |
| Айрширская | 53 | 16,04 | 83,96 |
| Ярославская | 203 | 13,79 | 86,21 |
| Красная горбатовская | 167 | 5,09 | 94,91 |
| Бестужевская | 28 | 7,14 | 92,86 |
| Костромская | 121 | 19,83 | 80,17 |
| Бурая швицкая | 21 | 7,14 | 92,86 |
| Сычевская | 29 | 6,90 | 93,10 |
| Симментальская | 94 | 27,13 | 72,87 |
| Зебувидный скот | 19 | 23,68 | 76,32 |
| Буйволы | 4 | 0,00 | 100,00 |
| Всего | 1244 | | |
-/- * - нейтральные и чувствительные аллели
Таким образом, разработанная тест-система является универсальной, высокопроизводительной и достаточно информативной и может быть использована для выявления животных, являющихся носителями аллелей, потенциально способствующих повышению устойчивости животных к лейкозу КРС.
Литература
- Эрнст Л.К., Сулимова Г.Е., Орлова А.Р., Удина И.Г., Павленко С.П. Особенности распространения антигенов BoLA-DRB3 у черно-пестрого скота в связи с ассоциацией с лейкозом // Генетика. - 1997. - Т. 33. - №1. - c. 87-95.
- Van Eijk M.J., Stewart-Haynes J.A., Lewin H.A. Extensive polymorphism of the BoLA-DRB3 gene distinguished by PCR-RFLP // Animal Genetics, 1992. – 23. – p. 483-496.
УДК 619:616.155:636.2
применение различных молекулярно-генетических методов диагностики вируса лейкоза крупного рогатого скота
Application of different molecular genetic methods of DNA diagnostics of bovine leukemia virus
Виноградова И.В., Гладырь Е.А., Зиновьева Н.А.
Vinogradova I.V., Gladyr E.A., Zinovieva N.A.
ГНУ ВИЖ Россельхозакадемии, п. Дубровицы Московской обл., Россия, e-mail n_zinovieva@mail.ru
Вирус лейкоза крупного рогатого скота, «гнездовая» ПЦР, ПЦР «в реальном времени»
Bovine leukemia virus, “nested-PCR”, Real-Time PCR
Введение. Полимеразная цепная реакция (ПЦР) – современный прямой метод диагностики многих инфекций, в том числе лейкоза крупного рогатого скота. Метод обладает высокой чувствительностью и специфичностью, и позволяет обнаруживать вирус, как у взрослых животных, так и у молодняка уже через 1-2 недели после заражения.
Следует отметить, что традиционным методом диагностики ВЛКРС является метод РИД. Однако результаты ряда исследований показывают наличие ПЦР-позитивных особей среди РИД-отрицательных животных и ПЦР-негативных - среди РИД-позитивных [Макаров В.В., Гринишин Д.П., 2005]. Вполне вероятно, что, несмотря на высокую чувствительность ПЦР, в развитии лейкозного процесса бывают такие периоды, когда уровень провирусной ДНК минимален. Выводя из стада РИД-позитивных животных, теоретически возможно добиваться полного оздоровления хозяйства от лейкоза, но в оздоровленных стадах, не имевших контактов с другими, через несколько месяцев, или даже лет, выделяют животных с антителами к ВЛКРС. Такой факт можно объяснить характерным для лейкоза явлением иммунологической толерантности, когда наблюдают вирусоносительство без антителообразования или уровень антител, находится ниже порога чувствительности РИД [Beier D. et al., 1992; Blankenstein P. et al., 1998].
В настоящее время разработан целый ряд модификаций классического метода ПЦР [Saiki R.K. et al., 1988], в том числе «гнездовая» ПЦР, ПЦР-ПДРФ анализ, ПЦР в «реальном времени». Предполагают, что применение комплекса методов позволит получить более полную информацию о распространении вируса лейкоза крупного рогатого скота (ВЛКРС) в организме животных и, возможно, решить проблему несовпадения результатов РИД и ПЦР-анализа.
Материалы и методы. В исследованиях были использованы животные черно-пестрой породы крупного рогатого скота из экспериментальной популяции (n=572). Выделение ДНК проводили по методикам Центра биотехнологии и молекулярной диагностики ГНУ ВИЖ. Для выявления наличия провирусной формы ВЛКРС использовали методы «гнездовой» ПЦР, ПЦР-ПДРФ анализа и ПЦР в «реальном времени». Диагностику ВЛКРС с использованием РИД проводили в ВИЭВ имени Я.Ф. Коваленко. Статистическую обработку результатов проводили по стандартной методике [Меркурьева и др., 1979].
Результаты исследований. На первом этапе нами была изучена возможность максимально раннего выявления ВЛКРС. С этой целью выполнялись исследования телят, начиная с 10-и дневного возраста, с использованием метода «гнездовой» ПЦР [Гладырь Е.А. и др., 2006]. По результатам анализа ПЦР-положительных животных изолировали от ПЦР-отрицательных. Оценку результативности «гнездовой» ПЦР для ранней диагностики проводили на основании повторного анализа телят по достижении ими 6-и месяцев с использованием РИД.
Таблица 1 Результативность ранней диагностики провирусной
формы ВЛКРС с использованием метода «гнездовой» ПЦР
| Временной интервал | До внедрения ранней диагностики | Через 3 месяца после внедрения ранней диагностики | ||||
| Всего РИД, гол. | Из них BLV+ | % BLV+ | Всего РИД, гол. | Из них BLV+ | % BLV+ | |
| 3 смежных месяца | 364 | 57 | 15,7 | 208 | 5 | 2,4 |
Как следует из данных, представленных в таблице 1, вследствие применения ранней диагностики ВЛКРС произошло снижение инфицированности 6-ти месячного молодняка в 6,5 раза, что позволяет сделать вывод о высокой результативности метода «гнездовой» ПЦР.
Несмотря на высокую результативность, метод «гнездовой» ПЦР не позволяет диагностировать серотип вируса. В этой связи, в сотрудничестве с коллегами из Польского национального ветеринарного института было проведено исследование ВЛКРС с использованием метода ПЦР-ПДРФ. Результаты исследований показали наличие двух серотипов вируса, относящихся к Австралийской и Бельгийской подгруппам.
Таким образом, результаты проведенных нами исследований показывают, что использование различных молекулярно-генетических методов на основе ПЦР открывают новые возможности в характеристике лейкоза крупного рогатого скота.
Литература
1. Гладырь Е.А., Зиновьева Н.А., Ермилов А.А., Виноградов В.Н., Эрнст Л.К. Создана и экспериментально апробирована высокочувствительная тест-система диагностики лейкоза крупного рогатого скота // Ветеринарный консультант, 2006, № 5, с. 3-4.
2. Макаров, В.В. Эпизоотологические перспективы лейкоза крупного рогатого скота / Макаров В.В., Гринишин Д.П.// Вестник Российской академии сельскохозяйственных наук. – 2005. –№ 2. – С. 70-73
3. Меркурьева Е.А., Абрамова З.В., Бакай А.В. и др. Генетика. М., 1979.
4. Beier, D. Possibilities and limitations for use of the polymerase chain reac-tion (PCR) in the diagnosis of bovine leukemia virus (BLV) infection in cattle / Beier D., Blankenstein P., Fechner H.// Zentralbl. Veterinarmed. B. -1992. -V. 39 (1). -P. 69-77.
5. Blankenstein, P. Polymerase chain reaction (PCR) for detection of BLV pro-viruses a practical complement BLV diagnostics / Blankenstein P., Fechner H., Looman A., Beier A., Marguardt A., Ebner D. // Berl. Munch. Tierarztl. Wo-chenschr. -1998.- V. 111. - P. 180-186.
6. Saiki R.K., Gelfand D.H., Stoffel S., Scharf S.J., Higuchi R., Horn G.T., Mullis K.B., Erlich H.A. Primer-directed enzymatic amplification of DNA with a thermostable DNA-polimerase // Science, 1988, 239, 487-491.
УДК 338.436.33
