Федеральной целевой программы «Научные и научно-педагогические кадры инновационной России» на 2009-2013 годы (г. Уфа, 29 сентября 5 октября 2010 г.) Уфа 2010
| Вид материала | Программа |
СодержаниеЧистокровная арабская Применение биотехнологических методов Производственная и экономическая эффективность применения пробиотиков в кормлении молодняка свиней Of young growth of pigs |
- Концепция федеральной целевой программы «Научные и научно-педагогические кадры инновационной, 238.28kb.
- Программа "научные и научно-педагогические кадры инновационной россии", 777.29kb.
- Приглашаем Вас принять участие, 41.95kb.
- Управление научных исследований, 848.86kb.
- Российский новый университет, 29.94kb.
- Российский новый университет, 27.25kb.
- О проведении открытого конкурса, 71.41kb.
- Уважаемые коллеги!, 67.96kb.
- Российский новый университет, 26.29kb.
- Российский новый университет, 81.02kb.
Результаты. Эффективность контроля происхождения определяется рядом факторов. Первичным из них является число аллелей в локусе, характерное для каждой из исследованных пород и являющееся показателем информативности локусов. На основании информативности были рассчитаны величины эффективности контроля происхождения для отдельных локусов по Джемисону. В среднем для всех исследованных пород лошадей минимальная эффективность зарегистрирована для локуса HTG4 - 0,353. Наиболее эффективным был локус ASB2 (0,602 в среднем для всех исследованных пород). Средние для выборки значения эффективности для отдельных локусов можно условно разделить по значению эффективности на три группы локусов, в пределах каждой из них значение эффективности плавно повышается. В первую группу входят локусы HTG4, HTG7, HMS1, HMS6 и HTG6 (эффективность от 0,353 до 0,4), во вторую - HMS2, CA425, AHT4, HMS3, AHT5 и HMS7 (от 0,462 до 0,505) и в третью - ASB23, LEX3, HTG10, VHL20, ASB17 и ASB2 (от 0,548 до 0,602). В отношении отдельных пород были выявлены специфические особенности отдельных локусов в контроле происхождения (табл. 1).
Для чистокровной верховой породы наибольшая эффективность при контроле происхождения отмечена для локуса ASB2 (0,659). Этот локус также был наиболее эффективен у ахатекинской и тракененской пород (0,711 и 0,702 соответственно), а также у забайкальской породы (0,656). У чистокровной арабской породы наиболее эффективным (0,573) был локус HMS7.
В целом при использовании 17 локусов микросателлитов ДНК эффективность контроля происхождения у исследованных пород составила 99,987% у чистокровной арабской, 99,999% у ахалтекинской, тракененской, забайкальской, хакасской, тувинской пород. Эффективность контроля происхождения бурятской породы составила 99,998%. Наиболее востребован контроль происхождения для чистокровной верховой породы. Для нее эффективность составила 99,991%.
Полученные данные наглядно демонстрируют преимущества контроля происхождения по микросателлитам ДНК перед традиционными иммуногенетическими и белковыми маркерами. Совокупная эффективность использования трех генетических систем белков (Tf, Al, Es) и семи систем групп крови(A, D, C, K, Q, V, P) в контроле происхождения составляет 88,8-97,4% [15], по данным Bowling A.T., совокупная эффективность по 7 группам крови и 11 полиморфным системам белков – 97,3%.
Таблица 1 Эффективность контроля происхождения у исследованных пород лошадей
| Локус | Популяции лошадей заводских пород | Популяции лошадей местных пород | ||||||
| Чистокровная арабская | Ахалтекинская | Чистокровная верховая+ | Тракененская | Забайкальская | Тувинская | Хакасская | Бурятская | |
| AHT4 | 0,565 | 0,385 | 0,477 | 0,459 | 0,575 | 0,599 | 0,380 | 0,465 |
| AHT5 | 0,385 | 0,489 | 0,460 | 0,551 | 0,598 | 0,568 | 0,553 | 0,348 |
| ASB17 | 0,381 | 0,635 | 0,530 | 0,677 | 0,624 | 0,559 | 0,719 | 0,547 |
| ASB2 | 0,505 | 0,711 | 0,659 | 0,702 | 0,656 | 0,516 | 0,579 | 0,491 |
| ASB23 | 0,481 | 0,449 | 0,578 | 0,511 | 0,548 | 0,635 | 0,590 | 0,590 |
| CA425 | 0,464 | 0,430 | - | 0,237 | 0,520 | 0,532 | 0,499 | 0,606 |
| HMS1 | 0,385 | 0,372 | 0,339 | 0,316 | 0,441 | 0,322 | 0,391 | 0,383 |
| HMS2 | 0,368 | 0,594 | 0,329 | 0,387 | 0,612 | 0,493 | 0,473 | 0,439 |
| HMS3 | 0,431 | 0,508 | 0,444 | 0,536 | 0,571 | 0,618 | 0,557 | 0,271 |
| HMS6 | 0,262 | 0,462 | 0,314 | 0,351 | 0,559 | 0,417 | 0,355 | 0,413 |
| HMS7 | 0,573 | 0,553 | 0,580 | 0,611 | 0,499 | 0,437 | 0,475 | 0,311 |
| HTG10 | 0,484 | 0,442 | 0,604 | 0,552 | 0,600 | 0,593 | 0,621 | 0,628 |
| HTG4 | 0,412 | 0,263 | 0,243 | 0,335 | 0,274 | 0,408 | 0,335 | 0,554 |
| HTG6 | 0,347 | 0,333 | 0,336 | 0,510 | 0,295 | 0,558 | 0,402 | 0,421 |
| HTG7 | 0,230 | 0,257 | 0,361 | 0,318 | 0,484 | 0,402 | 0,369 | 0,455 |
| LEX3 | 0,570 | 0,654 | - | 0,571 | 0,422 | 0,628 | 0,544 | 0,559 |
| VHL20 | 0,527 | 0,631 | 0,505 | 0,500 | 0,488 | 0,690 | 0,663 | 0,613 |
| По 17 локусам | 0,99987 | 0,99999 | 0,99991 | 0,99999 | 0,99999 | 0,99999 | 0,99999 | 0,99998 |
Примечание: + - по локусам CA425 и LEX3 данные исключены с целью унификации результатов по всему обследованному поголовью.
УДК 581.143.6
ПРИМЕНЕНИЕ БИОТЕХНОЛОГИЧЕСКИХ МЕТОДОВ
ДЛЯ РАЗМНОЖЕНИЯ РАСТЕНИЙ
APPLICATION OF BIOTECHNOLOGICAL METHODS
FOR DUPLICATION OF PLANTS
Зарипова А.А.
Zaripova A.A.
Учреждение Российской академии наук Ботанический сад-институт Уфимского научного центра РАН, Уфа, Россия, e-mail: zaripova.al@mail.ru
Культура органов и тканей, морфогенез, каллусогенез, соматический эмбриогенез, клональное микроразмножение
Тissue and organ culture, morphogenesis, callusogenesis, somatic embryogenesis, clonal micropropagation
Биотехнология как область прикладной биологии играет все возрастающую роль в различных отраслях растениеводства, открывая новые возможности в размножении растительных организмов. Наибольшее распространение в практике в настоящее время получают результаты исследований по тканевой и клеточной биотехнологии растений. Принципиально новым методом вегетативного размножения с широкими возможностями и преимуществами перед традиционными методами является клональное микроразмножение, т.е. получение в условиях in vitro генетически однородного материала с высоким коэффициентом размножения и ускорением этого процесса.
Целью работ лаборатории биотехнологии растений Ботанического сада, является разработка технологий клонального микроразмножения редких и исчезающих видов, ценных гибридов, перспективных сортов для сохранения и восстановления их генофонда.
Морфогенез, лежащий в основе микроразмножения, является одним из наиболее сложных процессов жизнедеятельности растительных организмов и находится под влиянием большого числа взаимодействующих факторов, таких как генотип, сортовая и родовая специфика исходного экспланта, физиологический возраст, сезонность изоляции исходного экспланта, гормональные, трофические и физические факторы среды. С учетом перечисленных факторов в лаборатории биотехнологии растений изучены морфогенетические потенции эксплантов, введены в культуру, размножены и созданы технологии и способы клонального микроразмножения ряда древесных, кустарниковых, лекарственных и цветочно-декоративных видов растений.
Использование методов биотехнологии имеет ряд преимуществ: получение генетически однородного посадочного материала; освобождение растений от вирусов за счёт использования меристематической культуры; высокий коэффициент размножения (105-107 растений в год); ускорение перехода растений от ювенильной к репродуктивной фазе развития; размножение растений, трудно размножаемых традиционными способами; возможность проведения работ в течение круглого года; экономия площадей, необходимых для выращивания посадочного материала.
Однако следует иметь в виду, что в начальный период работ не следует ожидать немедленного высокого экономического эффекта. Для широкого внедрения клонального микроразмножения в практику растениеводства необходимо создавать биотехнологические лаборатории при научно-производственных объединениях, а также в специализированных предприятиях по выращиванию древесных и сельскохозяйственных культур. Создание рентабельных биотехнологий микроразмножения полезных человеку растений и широкое внедрение новых методов в практику приведет к значительной интенсификации сельскохозяйственного производства, повышению его эффективности.
УДК 636.84.25
ПРОИЗВОДСТВЕННАЯ И ЭКОНОМИЧЕСКАЯ ЭФФЕКТИВНОСТЬ ПРИМЕНЕНИЯ ПРОБИОТИКОВ В КОРМЛЕНИИ МОЛОДНЯКА СВИНЕЙ
INDUSTRIAL AND ECONOMIC EFFICIENCY
OF APPLICATION ПРОБИОТИКОВ IN FEEDING
OF YOUNG GROWTH OF PIGS
Злобин С.В.
Zlobin S.V.
ООО «Прайм-М», г. Курск, Россия
Молодняк свиней, неспецифическая резистентность, падеж, биохимические и морфологические показатели крови.
Young growth of pigs, nonspecific resistance, a pas-dezh, biochemical and morphological indicators of blood.
Исследования российских и зарубежных ученых показывают, что включение пробиотиков в систему выращивания молодняка животных снижает заболеваемость желудочно-кишечными болезнями, сокращает продолжительность выращивания, снижает затраты кормов, повышает сохранность животных. Однако актуальным остается определение оптимальных доз и режимов использования пробиотических препаратов.
Целью наших исследований явилось комплексное изучение влияния пробиотического препарата Субтилис на сохранность, продуктивные качества, послеубойные показатели молодняка свиней, а также определить экономическую эффективность производства при различных его дозах включения в корм. В условиях промышленной технологии свинокомплекса было сформировано 5 групп молодняка свиней в цехе репродукции по 70 голов в каждой. Опыт продолжался по достижении животными возраста 180 дней (табл. 1).
Таблица 1 Схема опыта
| Периоды, дни | Группа | ||||
| Контроль | I опытная | II опытная | III опытная | IV опытная | |
| 0-60 | СК-3, СК-4 (ОР) | ОР+пробиотик 0,4 г/кг | ОР+пробиотик 0,4 г/кг | ОР+пробиотик 0,2 г/кг | ОР+пробиотик 0,6 г/кг |
| 61-120 | СК-5 (ОР) | ОР+пробиотик 0,4 г/кг | ОР+пробиотик 0,3 г/кг | ОР+пробиотик 0,2 г/кг | ОР+пробиотик 0,6 г/кг |
| 121-180 | СК-6 (ОР) | ОР+пробиотик 0,4 г/кг | ОР+пробиотик 0,2 г/кг | ОР+пробиотик 0,2 г/кг | ОР+пробиотик 0,6 г/кг |
В кормлении поросят контрольной группы использовали полнорационные гранулированные комбикорма заводского производства (ОР). Молодняк I опытной группы дополнительно к ОР в дозе 0,4г/кг корма получал пробиотический препарат Субтилис на протяжении всего периода выращивания и откорма. Молодняк II опытной группы к ОР получал препарат Субтилис в дозировке от 0,4 г до 0,2 г/кг корма согласно периодам выращивания. Молодняк III опытной группы получал к ОР по 0,2 г/кг корма препарата Субтилис. Молодняк IV опытной группы на протяжении всего периода выращивания получал пробиотик Субтилис в дозе 0,6 г/кг корма.
Таблица 2 Биохимические и морфологические показатели крови поросят в 60 дней
| Показатель | Группа | ||||
| Контроль | I опытная | II опытная | III опытная | IV опытная | |
| Общий белок, г/л | 62,26±0,31 | 66,46±0,73 | 66,92±1,02 | 63,12±0,14 | 66,22±0,76 |
| Альбумины, г/л | 26,40±0,45 | 27,89±0,66 | 27,74±1,31 | 26,75±0,21 | 27,17±0,66 |
| Глобулины,г/л | 35,47±0,19 | 38,10±1,25 | 38,27±0,36 | 36,07±0,21 | 38,54±0,89 |
| А/Г-коэф. | 0,74±0,04 | 0,73±0,03 | 0,72±0,05 | 0,74±0,09 | 0,70±0,08 |
| Гемоглобин, г/л | 98,94±0,89 | 106,68±1,03 | 106,51±0,63 | 100,20±1,75 | 105,95±1,31 |
| Эритроциты, млн./мкл | 6,44±0,33 | 6,98±0,08 | 7,01±0,24 | 6,67±0,18 | 6,95±0,14 |
| Лейкоциты, тыс./мкл | 9,08±0,18 | 9,29±0,14 | 9,31±0,23 | 9,16±0,16 | 9,54±0,14 |
| АСТ, нкат/л | 362±15 | 332±12 | 330±6 | 354±4 | 343±16 |
| АЛТ, нкат/л | 461±20 | 449±9 | 450±12 | 458±16 | 433±15 |
| Общий кальций, моль/л | 2,32±0,12 | 2,39±0,08 | 2,37±0,11 | 2,32±0,09 | 2,37±0,06 |
| Фосфор, моль/л | 2,48±0,14 | 2,89±0,07 | 2,82±0,09 | 2,52±0,10 | 2,76±0,12 |
| Бактерицидная активность, % | 70,78±2,76 | 76,42±3,65 | 77,43±3,47 | 71,90±3,56 | 76,97±3,05 |
| Лизоцимная активность, % | 43,50±2,49 | 54,23±2,68 | 53,98±3,67 | 46,21±3,43 | 55,14±2,77 |
| Фагоцитарная активность нейтрофилов, % | 15,34±1,56 | 20,32±1,60 | 20,45±1,21 | 18,87±1,08 | 21,76±2,01 |
Из таблицы 2 следует, что содержание общего белка и белковых фракций возрастает в опытных группах животных по сравнению с контролем. Так, содержание общего белка в I опытной группе было выше контроля на 6,75% (Р<0,01), во II опытной – на 7,48% (Р<0,01), в III опытной – на 1,38% (Р<0,01), в IV опытной – на 6,36% (Р<0,05) соответственно.
Пробиотический препарат «Субтилис» в большей степени усиливает синтез общего белка и белковых фракций сыворотки крови, что соответственно активизирует процессы нормализации рН крови, транспорта биологически активных веществ к тканям и органам и повышает неспецифическую резистентность организма молодняка.
Гематологические показатели животных опытных групп были выше, по сравнению с контролем, в течение всего опыта и находились в пределах физиологической нормы. Так, содержание гемоглобина в I опытной группе было выше контроля на 7,82% (Р<0,01), во II опытной – на 7,65% (Р<0,05), в III опытной – на 1,27 % (Р<0,05), в IV опытной – на 7,08% (Р<0,01) соответственно. По содержанию эритроцитов I опытная группа превышала контроль на 8,38% (Р<0,01), II опытную – на 8,85% (Р<0,01), III опытную – на 3,57% (Р<0,001), IV опытную – на 7,92% (Р<0,05) соответственно. Концентрация лейкоцитов также в I опытной группе была выше контроля на 2,31% (Р<0,001),во II опытной – на 2,53% (Р<0,001), в III опытной – на 0,88% (Р<0,01), в IV опытной – на 5,06% (Р<0,01).
В
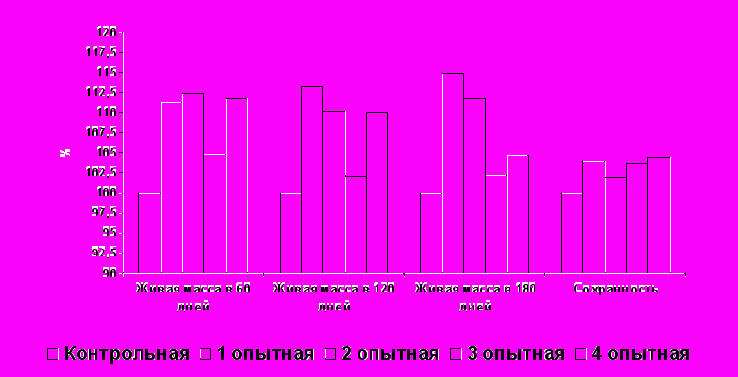 Рисунок 1 Сохранность и интенсивность роста животных
Рисунок 1 Сохранность и интенсивность роста животныхцелом, из вышеперечисленных показателей видно, что применение препарата «Субтилис» вызывает значительное увеличение количества эритроцитов, гемоглобина и лейкоцитов у опытных животных, по сравнению с их контрольными сверстниками, не получавшими пробиотический препарат.
Использование препарата «Субтилис» в опытных группах молодняка свиней привело к усилению неспецифической резистентности организма, о чем свидетельствуют показатели бактерицидной, лизоцимной и фагоцитарной активности сыворотки крови. В опытных группах наблюдается достоверная разница в увеличении этих показателей по сравнению с контролем.
Из данных рисунка 1 следует, что включение препарата Субтилис в дозе 0,4 г/кг корма в I опытной группе способствовало максимальному увеличению прироста живой массы животных по сравнению с аналогами контрольной, II, III. Включение препарата «Субтилис» в дозе 0,6г/кг корма в IV опытной группе привело к снижению интенсивности роста животных.
Сохранность поросят достоверно увеличивалась в опытных группах. Однако статистической разницы между опытными группами по показателю сохранности не установлено.
По окончании периода откорма животные поступали в цех первичной переработки свинокомплекса. Послеубойные и мясные качества оценивали у четырех боровков каждой группы (табл. 3).
Таблица 3 Убойные и мясные качества молодняка свиней
| Показатель | Группа | ||||
| Контроль | I опытная | II опытная | III опытная | IV опытная | |
| Предубойная живая масса, кг | 95,25±0,56 | 107,63±0,49 | 105,30±0,34 | 97,90±0,65 | 98,50±0,26 |
| Масса парной туши со шкурой, кг | 66,43±0,37 | 76,58±0,32 | 74,57±0,66 | 69,14±0,34 | 69,28±0,43 |
| Убойный выход, % | 69,74±0,32 | 71,15±0,27 | 70,81±0,13 | 70,62±0,22 | 70,33±0,26 |
| Длина туши, см | 96,16±0,17 | 98,31±0,38 | 97,05±0,33 | 96,43±0,29 | 97,03±0,21 |
| Содержание в туше мышечной ткани, % | 56,03±0,29 | 57,63±0,45 | 57,77±0,30 | 56,57±0,18 | 57,05±0,18 |
| Содержание в туше сала, % | 26,87±0,53 | 27,54±0,32 | 27,17±0,28 | 27,78±0,32 | 27,35±0,32 |
| Толщина шпика на холке, мм | 2,42±0,06 | 2,32±0,06 | 2,35±0,03 | 2,41±0,03 | 2,41±0,04 |
| Толщина шпика на уровне 6-7 грудного позвонка, мм | 2,37±0,09 | 2,33±0,09 | 2,30±0,03 | 2,30±0,07 | 2,34±0,05 |
| Толщина шпика на крестце, мм | 2,09±0,09 | 2,13±0,07 | 2,08±0,06 | 2,07±0,07 | 2,11±0,06 |
| Масса задней трети полутуши, кг | 10,63±0,24 | 11,96±0,26 | 11,65±0,16 | 11,13±0,27 | 11,04±0,13 |
| Площадь «мышечного глазка», см² | 32,90±0,21 | 36,46±0,23 | 36,70±0,12 | 33,97±0,31 | 35,34±0,65 |
По данным таблицы 3 убойный выход у животных опытных групп был выше контрольной группы на 2,02% в I опытной, на 1,53% во II, на 1,26% в III и на 0,84% в IV опытных группах.
Подсвинки опытных групп имели большую длину туши, чем аналоги контрольной группы. Так, в I опытной группе длина туши составила на 2,23% больше контроля, во II опытной – на 0,92%, в III опытной – на 0,28% и в IV опытной – на 0,90% соответственно.
Высоким выходом мышечной ткани характеризовались свиньи I и II опытных групп, превосходившие аналогов из III и IV опытных групп на 1,87 и 1,01% в I опытной и 2,12 и 1,26% во II опытной соответственно. Во всех группах содержание сала в туше было практически одинаковым.
У подсвинков опытных групп толщина шпика над 6-7 грудным позвонком была меньше, чем в контроле.
Наибольшая масса задней трети полутуши среди животных опытных групп была у подсвинков I опытной группы. У животных контрольной группы этот показатель был на 12,51% меньше, II опытной – на 2,66%, III опытной – на 7,46%, IV опытной – на 8,33% соответственно (Р<0,01).
Важным показателем в оценке свиней по мясным качествам является площадь «мышечного глазка». Среди опытных групп он был самым высоким в I и II опытных группах. Их превосходство над III и IV опытными группами составило соответственно 7,33 и 3,17 % в I опытной и 8,03 и 3,85 % во II опытной (Р<0,01). Площадь мышечного глазка у животных контрольной группы была самая наименьшая.
Таблица 4 Экономическая эффективность результатов
исследования
| Показатель | Группа | ||||
| Контроль | I опытная | II опытная | III опытная | IV опытная | |
| Абсолютный прирост за живой массы, кг | 92,91 | 106,96 | 103,98 | 95,05 | 97,34 |
| Возраст достижения живой массы 100 кг, дней | 190,3 | 170,2 | 173,5 | 185,6 | 183,7 |
| Конверсия корма, кг | 3,11 | 2,72 | 2,81 | 3,05 | 3,00 |
| Себестоимость 1 кг прироста живой массы, руб. | 58,25 | 52,32 | 53,60 | 57,77 | 58,37 |
| Уровень рентабельности, % | 11,59 | 24,23 | 21,27 | 12,51 | 11,36 |
