Структурно-кинетические закономерности и механизм термораспада полифункциональных нитро- и азидосоединений 02. 00. 04 физическая химия
| Вид материала | Закон |
СодержаниеТаблица 4.4 Избранные длины С-С и N-NO2 связей, Å, молекул XXVII.2, 3, 5 4.4 Восьмичленные циклические нитрамины Кинетические и термодинамические параметры распада нитраминов XXVIII |
- Синтез и исследование полифункциональных люминофоров на основе алюминатов стронция, 307.95kb.
- Рабочая программа дисциплины (модуля) «математический анализ», 424.74kb.
- Рабочая программа дисциплины (модуля) «Уравнения математической физики», 266.58kb.
- Рабочая программа дисциплины «физическая химия», 80.79kb.
- Рабочая программа дисциплины (модуля) «Линейная алгебра и аналитическая геометрия», 275.82kb.
- Программа дисциплины дпп. Ф. 05 Физическая химия, 267.17kb.
- «Кинетика и механизм реакции поликонденсации аминокислот» 02. 00. 04 физическая химия, 332.67kb.
- И в свет разрешаю на основании "Единых правил", п 14 Заместитель первого проректора-, 350.14kb.
- Физико-химические закономерности удерживания производных адамантана в высокоэффективной, 432.05kb.
- Физико-химические закономерности формирования и деградации органосиликатных покрытий, 977.75kb.
Таблица 4.4
Избранные длины С-С и N-NO2 связей, Å, молекул XXVII.2, 3, 5
Связь | 2 | 3 | 3 | 5 | Связь | 2 | 3 | 3 | 5 |
* С-С | 1.574(5) | 1.568(3) | 1.561(3) | 1.578(3) | ***N-NO2 | 1.421(4) | 1.421(3) | 1.448(5) | 1.390(3) |
** С-С | 1.555(5) | 1.558(4) | 1.558(6) | 1.553(3) | ****N-NO2 | 1.421(4) | 1.438(3) | 1.396(5) | - |
* - соединяющая два пятичленных цикла в каркасе; ** - общая связь в пятичленном и шестичленном циклах; *** - в шестичленном цикле; **** - в пятичленном цикле
Все аминные атомы азота молекул XXVII.2, 3, 5 в отличие от молекул XXVII.1 имеют пирамидальное строение. В молекуле XXVII.1 -модификации один из аминных атомов азота шестичленного цикла идеально плоский, остальные атомы азота – пирамидальные. Средняя СВУ шестичленных циклов в молекулах XXVII.2, 3, 5 равна 345.2, а в пятичленных – 337.6°. В пяти исследованных нитраминах XXVII.1 аминные атомы азота более планарны, средние СВУ равны 355.0 ° и 346.7 ° для шестичленных и пятичленных циклов, соответственно [Nielsen A.T. и др., 1998].
Если в соединениях XXVII.1 в разных полиморфных модификациях нитрогруппы имеют псевдоаксиальные и псевдоэкваториальные положения, то в молекулах XXVII.3 (табл. 4.4) нитрогруппы в пятичленниках - и -форм занимают псевдоаксиальное положение. Внутримолекулярные различия в - и -формах сводятся к разным поворотам нитрогрупп в шести- и пятичленниках [торсионные углы равны, соответственно, -1.6(3), 25(3)° и -30.2(5), 36.7(5)°]. При переходе от XXVII.3 к изомеру XXVII.2 конфигурация аминных атомы азота не меняется: нитрогруппы в шестичленниках псевдоэкваториальны, а в пятичленниках – псевдоаксиальны.
Учитывая вышеизложенное и анализируя данные табл. 4.3, совместно с табл. 4.4, можно заключить, что реакционная способность молекул XXVII.2 и 3 зависит от длины наименее прочной связи N-NO2, на которую влияет конформация нитрогруппы. Такими в соединениях XXVII.3 и XXVII.3 являются связи псевдоаксиальная [d=1.438(3) Å] в пятичленнике и псевдоэкваториальная [d=1.448(5) Å] в шестичленнике, соответственно (табл. 4.4). В молекуле XXVII.2 реакционным центром может быть аминный азот как в пяти-, так и в шестичленнике.
Совершенно иная картина наблюдается, если нитрогруппу в пятичленном цикле соединения XXVII.3 заместить на R = H, NO, CH2N(NO2)CH3, COCH3 (табл. 4.3).
Когда R = H, скорость распада соединения XXVII.4a увеличивается, соответственно, в 1,5 и 2,2 раза по сравнению с нитрамином XXVII.3, что, скорее всего, обусловлено кислотным катализом NH-функцией (аналогия с соединениями I.3, I.5, табл. 1.1). Если R = NO, то скорость распада соединения XXVII.4b, практически, совпадает с таковой для соединения XXVII.3, поскольку при постоянстве всех структурных факторов энергия диссоциации связей N-NO и N-NO2 примерно одинакова. При R = CH2N(NO2)CH3 и COCH3 скорость распада нитраминов уменьшается в растворе, соответственно, в 2,6 и 7,0 раз по сравнению с соединением XXVII.3.
Последующая замена еще двух нитраминных групп в пятичленниках соединений XXVII.2 и XXVII.3 на окса-функции приводит к уменьшению скорости распада соединения XXVII.5, приблизительно, на два порядка (табл. 4.3), и она становится соизмеримой в растворе с таковой для соединения XXVI.4 (табл.4.2). Уменьшение скорости логично связать с уменьшением длины наименее прочной связи N-NO2 [1.390 (3)Å] в молекуле XXVII.5 (табл. 4.4), обусловленным псевдоэкваториальной нитрогруппой.
В заключение отметим, что для разных по строению нитросоединений (табл. 3.2, 4.1 и 4.3) отношение kр-р/kтв находится в пределах 0,5-100, где kр-р и kтв – константы скорости термораспада в растворе и твердой фазе, найденные при температуре на 20 ниже точки плавления, когда отсутствуют подплавление вещества в ходе распада [Буров Ю.М., 2006]. Судя по величине отношения kр-р/kтв, термораспад в твердой фазе протекает на дефектах кристаллов, размеры блоков которых, в среднем, не превышают 100 нм [Бон С., 1961; Назин Г.М., 2006]. При этом наблюдается тенденция увеличения kр-р/kтв с ростом молекулярной массы нитросоединения от 114 до 310 г/моль, что позволяет проводить предварительную оценку торможения реакции в твердой фазе:
lg (kр-р/kтв) = 0,0045Мм + 0,2855 (65)
r=0,967; n=14
Подобной тенденции в изменении kр-р/kтв от вариации температуры плавления соединений не наблюдается.
4.4 Восьмичленные циклические нитрамины
Кинетика термораспада восьмичленных циклических N-нитраминов, за исключением НМХ, в литературе практически не рассматривалась. Особенно это относится к нитраминам, содержащим другие потенциально реакционные группы. В связи с этим нами изучен термораспад широкой серии нитраминов XXVIII с несколькими потенциальными реакционными центрами
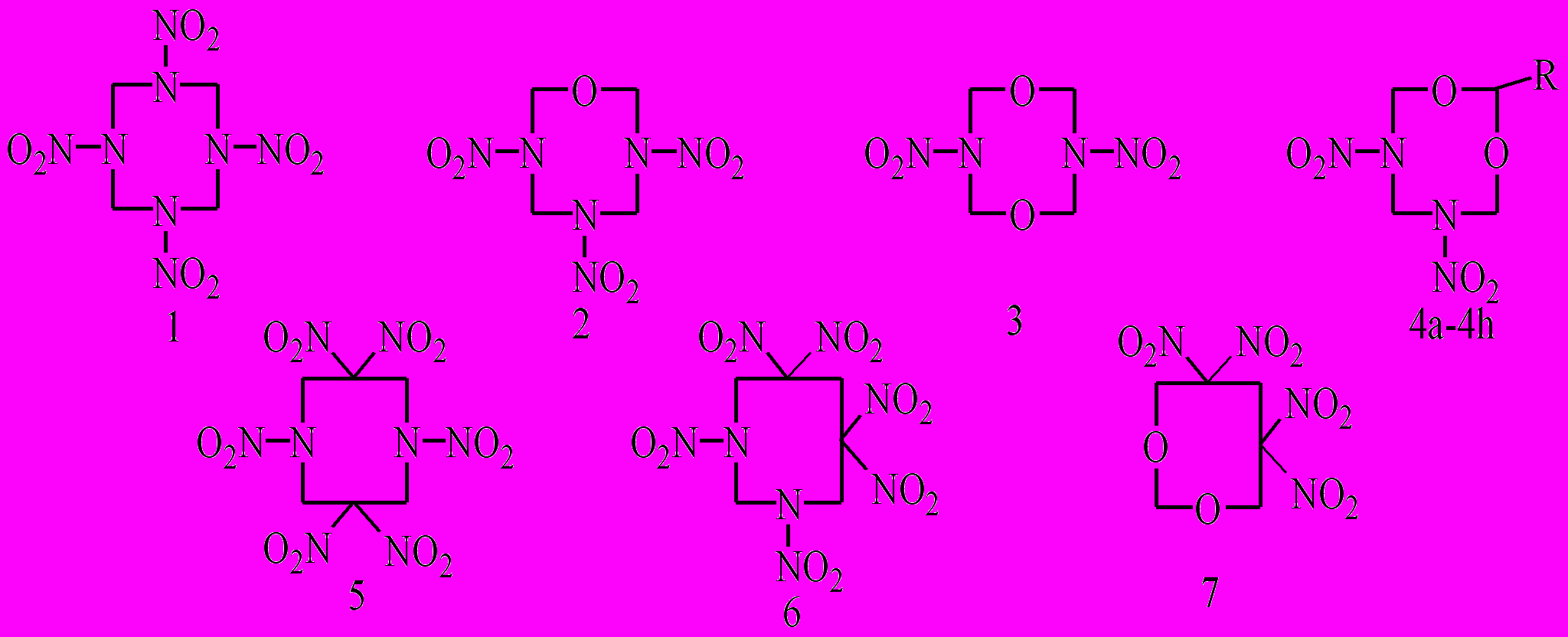
где R = H (4a), 4-NO2-C6H4 (4b), 5-нитротетразол-2-ил-метилен (4c), 5-нитротетразол-2-ил-этилен (4d), (CH2)2C(NO2)2CH3 (4e), (CH2)2C(NO2)3 (4f), CH2N3 (4g), (CH2)2N3 (4h), с целью выяснения взаимного влияния функциональных групп и их положения в молекуле на скорость и активационные параметры.
Исследование показало, что распад большинства соединений в расплаве и растворе протекает с ускорением и сходен с таковым для нитраминов XXV и XXVI. Кинетические и термодинамические параметры термораспада приведены в табл. 4.5.
Термораспад соединений XXVIII.4с и XXVIII.4d может лимитироваться как разрывом N-NO2 связи, так и раскрытием тетразольного цикла. Такая же проблема существует в определении реакционного центра при термораспаде соединения XXVIII.4e. В соединениях XXVIII.4f-h наблюдается заметное уменьшение энергии активации и увеличение скорости разложения. Для соединения XXVIII.4f, где имеются N-NO2 и –C(NO2)3 группы, предпочтителен мономолекулярный гомолиз по связи C-NO2.
Таблица 4.5
Кинетические и термодинамические параметры распада нитраминов XXVIII
| Соеди- нение | Условия распада | ΔТ, C | Еa, кДж/моль | lgA | k200C·105, с-1 | S200C, Дж/мольК |
| XXVIII.1, HMX | расплав* раствор в ДНБ* раствор в ДБФ | 271-314 171-215 180-225 | 220,6 188,1 193,8 | 19,70 16,0 16,76 | 2,2 1,8 2,3 | 120,2 49,3 63,9 |
| XXVIII.2 | раствор в ДНБ раствор в ДБФ | 190-225 190-225 | 190,1 188,4 | 16,37 16,22 | 2,4 2,6 | 56,4 53,5 |
| XXVIII.3 | раствор в ДНБ раствор в ДБФ | 200-230 195-225 | 184,6 186,8 | 15,37 15,57 | 0,9 0,9 | 37,3 41,1 |
| XXVIII.4a | расплав раствор в ДНБ раствор в ДБФ | 180-225 195-230 190-225 | 186,7 188,0 187,1 | 15,80 15,87 15,81 | 1,5 1,3 1,4 | 45,5 46,8 45,7 |
| XXVIII.4b | раствор в ДБФ | 195-225 | 186,2 | 15,65 | 1,2 | 42,6 |
| XXVIII.4c | раствор в ДНБ раствор в ДБФ | 195-225 195-220 | 183,8 185,0 | 15,92 15,70 | 2,5 1,9 | 47,8 43,6 |
| XXVIII.4d | раствор в ДБФ | 195-220 | 185,3 | 15,6 | 1,4 | 41,7 |
| XXVIII.4e | расплав раствор в ДБФ | 190-220 195-225 | 179,5 182,8 | 15,33 15,66 | 3,2 3,0 | 36,5 42,8 |
| XXVIII.4f | раствор в ДНБ раствор в ДБФ | 160–185 150-190 | 170,0 168,2 | 15,97 15,82 | 158,0 176,9 | 48,7 45,9 |
| XXVIII.4g | расплав раствор в ДНБ | 155-175 150-175 | 161,3 162,1 | 14,14 14,58 | 53,7 48,0 | 13,7 22,1 |
| XXVIII.4h | расплав раствор в ДНБ | 160-180 150-180 | 162,7 163,4 | 14,63 14,69 | 46,3 44,4 | 23,1 24,2 |
| XXVIII.5, HNDZ | расплав** раствор в ДБФ раствор в ДНБ | 170-210 175-205 180-205 | 162,0 164,1 165,1 | 14,50 14,65 14,70 | 41,7 33,9 30,0 | 20,6 23,5 24,4 |
| XXVIII.6 | раствор в ДНБ раствор в ДБФ | 160–185 160-180 | 152,1 153,0 | 14,44 14,42 | 442,0 336,0 | 19,5 19,1 |
| XXVIII.7 | расплав раствор в ДБФ | 170-190 175-195 | 154,2 151,2 | 14,26 13,83 | 179,4 136,4 | 16,0 7,8 |
* - [Максимов Ю.Я., 1967]; ** - [Назин Г.М. и др., 2000]
В случае соединений XXVIII.4g-h на глубине превращения 7-10% единственным газообразным продуктом термораспада является молекулярный азот. Поэтому можно считать, что реакционный центр расположен на азидной группе, что хорошо согласуется с активационными параметрами термораспада азидной группы в азидонитраминах IV. Для соединения XXVIII.4f, где имеются N-NO2 и –C(NO2)3 группы, в растворе при повышенных температурах 180-190С распад протекает в две стадии.
ВЫВОДЫ
- Впервые раскрыты структурно-кинетические закономерности и определены активационные параметры для лимитирующей стадии термораспада в конденсированной фазе полифункциональных нитро-, нитрамино- и азидосоединений на основе различных базовых структур: алифатических, полиазотистых ароматических пятичленных гетероциклов (1,2,4-, 1,2,3-триазолов и 1,2,3,4-тетразолов), насыщенных пяти-, шести-, восьмичленных и каркасных гетероциклов. Внутри каждой базовой структуры найдены зависимости между реакционной способностью и константами заместителей, а в случае насыщенных гетероциклов – конформацией нитраминной группы, которые позволяют проводить целенаправленный синтез соединений с заданными параметрами по термостабильности, а также оценивать безопасность изготовления и применения энергоемких соединений. Выявлено влияние молекулярной массы на отношение констант скорости распада в растворе и твердой фазе для циклических нитросоединений, что необходимо учитывать при прогнозе их реакционной способности в твердой фазе.
- Показано, что термораспад вторичных диалкил- и алкилпикрилнитраминов лимитируется гомолизом N–NO2 связи. Разложение нитраминокислот протекает быстрее их эфиров. Впервые предложен механизм термораспада нитраминокислот, объясняющий увеличение скорости и образование продуктов распада. Для нитраминов с γ-тетразольными функциями возможен альтернативный механизм с первичным разрывом N2–N3 связи в цикле. Скорость распада нитраминов коррелирует с * Тафта.
- Введение азидогруппы в молекулу алкилнитрамина или нитроалкана приводит к смене реакционного центра. Распад инициируется на азидогруппе и протекает со скоростью на 1-2 порядка больше с выделением N2 и образованием нитрена. Впервые установлен механизм стабилизации нитрена при распаде полифункциональных алкилазидонитраминов. Найдено, что скорость и энергия активации коррелируют с расчетной длиной наименее прочной связи N1–N2 и стерическими константами Es (V).
- Впервые установлено, что термораспад β-мононитроэтилацетатов в газовой фазе протекает квазигетеролитически с первичным разрывом связи С–О нитроалкил с образованием нитроэтилена и соответствующей кислоты. Скорость распада слабо зависит от рКа кислоты.
- Впервые показано, что термораспад 3-нитропроизводных 1,2,4-триазола в зависимости от природы заместителя R в положении 1 цикла протекает по разным механизмам. Если R=Н, CH2NO2, то распад соединений происходит по механизму основного катализа с первичной ионизацией N–H или С–Н связи. Впервые предложен механизм автопротолиза, объясняющий образование продуктов распада. Для R=CH2NO2 в растворе фенилбензоата возможен первичный гомолиз –H2C–NO2 связи. В обоих случаях лимитирующая стадия распада согласуется с первичным актом фрагментации под действием электронного удара. При R=C2H5 распад в газовой фазе лимитируется гомолитическим разрывом C–NO2 связи. Когда R=CH3 и в положении 3 и 5 цикла NO2, первичной стадией распада является передача протона метильной группы на кислород нитрогруппы с последующим окислением-восстановлением до 3-нитро-5-амино-1,2,4-триазола. В случае R=CH2CH2–Tetr–NO2 распад лимитируется раскрытием тетразольного цикла по механизму, свойственному 2,5-замещенным тетразолам.
- Впервые показано, что полифункциональные динитрометильные производные триазолов и тетразола разлагаются гомолитически с первичным разрывом связи С-NO2 в динитрометильной группе. Увеличение объема азольного цикла или введение объемных заместителей (Cl, Br, I) в динитрометильную группу увеличивает реакционную способность соединения. Наличие азидогруппы в триазольном цикле в этом случае не влияет на скорость и механизм термораспада, в то время как присутствие метильной группы или атома фтора в динитрометильной группе инициирует термораспад на азоте азидогруппы. Впервые найдено, что термораспад 2-замещенных 5,5-динитро-1,3-диоксанов протекает с первичным разрывом связи N–NO2. Термораспад C,N-дизамещенных гем-динитроэтилнитраминов при постоянстве стерического окружения гем-тринитроэтильной группы лимитируется гомолизом связи С–NO2 и описывается корреляционным уравнением Тафта. Для всех замещенных гем-динитрометильных соединений установлена корреляция между скоростью (энергией активации) и стерическими константами Еs (V), позволяющая прогнозировать не только термостабильность неизученных соединений, но и смену механизма.
- Термораспад пяти-, шести-, восьмичленных циклических и каркасных нитраминов в кинетическом отношении имеет много общего с алкилнитраминами и лимитируется, в основном, гомолизом связи N–NO2. Скорость распада зависит от оптимальной конформации цикла и нитраминной группы. Полуэмпирические квантово-химические расчеты показали, что моноциклические пятичленные нитрамины менее термостабильны, чем бициклические. Экспериментально установлено, что для твердой фазы это выполняется, а в растворах не наблюдается. Сочетание нитраминной с гем-динитро- и оксо-группами не изменяет лимитирующей стадии в шести- и восьмичленных циклах. Однако азидная и гем-тринитроэтильная группы в восьмичленных и азидная в шестичленных нитраминах приводят к смене лимитирующей стадии. В случае 5-нитротетразольной функции в восьмичленных нитраминах возможен распад по двум направлениям: гомолиз N–NO2 и N2–N3 связи в цикле. Впервые установлена корреляция между константой скорости, активационными параметрами и длиной наименее прочной N–NO2 связи, найденной методом РСтА.
- Впервые методом РСтА определено строение 3-нитро-1,2,4-триазолил-1-нитрометана, 5-нитро-1,2,3,4-тетразолил-2-нитрометана, 5-ацетиламино-3-нитро-1,2,4-триазола. Установлены основные типы напряжений в этих соединениях.
Автор выражает глубокую признательность учителю и наставнику д.х.н., профессору Р.С. Степанову за всестороннюю поддержку и помощь при выполнении настоящей работы, обсуждение результатов и ценные критические замечания.
