Структурно-кинетические закономерности и механизм термораспада полифункциональных нитро- и азидосоединений 02. 00. 04 физическая химия
| Вид материала | Закон |
- Синтез и исследование полифункциональных люминофоров на основе алюминатов стронция, 307.95kb.
- Рабочая программа дисциплины (модуля) «математический анализ», 424.74kb.
- Рабочая программа дисциплины (модуля) «Уравнения математической физики», 266.58kb.
- Рабочая программа дисциплины «физическая химия», 80.79kb.
- Рабочая программа дисциплины (модуля) «Линейная алгебра и аналитическая геометрия», 275.82kb.
- Программа дисциплины дпп. Ф. 05 Физическая химия, 267.17kb.
- «Кинетика и механизм реакции поликонденсации аминокислот» 02. 00. 04 физическая химия, 332.67kb.
- И в свет разрешаю на основании "Единых правил", п 14 Заместитель первого проректора-, 350.14kb.
- Физико-химические закономерности удерживания производных адамантана в высокоэффективной, 432.05kb.
- Физико-химические закономерности формирования и деградации органосиликатных покрытий, 977.75kb.
4 ТЕРМИЧЕСКОЕ РАЗЛОЖЕНИЕ ЦИКЛИЧЕСКИХ НИТРАМИНОВ
4.1 Пятичленные циклические нитрамины
Структурно-кинетические закономерности и механизм термораспада пятичленных моно- и бициклических нитраминов до настоящей работы оставались не раскрытыми.
Нами изучены кинетические закономерности термораспада широкого ряда пятичленных гетероциклических нитраминов XXV.1-XXV.6:

Предварительно методом молекулярной механики в приближении MNDO AM1 и PM3 нами исследовано электронное и геометрическое строение соединений XXV.2, XXV.3, XXV.5 и XXV.6. Сравнение соответствующих моно- и бициклических нитраминов показало, что они аналогичны в структурных зависимостях и различаются лишь длинами связи при постоянстве валентных углов. Если принять во внимание, что реакционная способность при гомолизе соединений XXV.2, XXV.6 и XXV.3, XXV.5 зависит от прочности разрываемой связи N-NO2, которая, согласно расчетам, уменьшается с увеличением ее длины с 1,39 до 1,43 Å, то наибольшей реакционной способностью будут обладать моноциклические нитрамины XXV.2, XXV.6, а наименьшей – бициклические нитрамины XXV.3, XXV.5.
Термораспад нитраминов XXV.1-XXV.2, XXV.6 в 2 % (мас.) растворах ДБФ протекает по реакции первого порядка, а для соединений XXV.4, XXV.5 наблюдается слабое ускорение.
В твердой фазе нитрамины XXV.1-XXV.6 разлагаются с ярко выраженным ускорением и характеризуются S-образными кинетическими кривыми.
На скорость распада не влияет S/V, а с увеличением m/V начальная скорость распада уменьшается и увеличивается время до наступления ускорения. Последнее является признаком того, что реакция распада протекает в двух фазах – в твердой и сублимированной. Изучение температурной зависимости скорости распада нитраминов проводили при близких значениях m/V=(1,1-1,3)·10-3 г/см3.
Наблюдаемое ускорение твердофазного термораспада, вероятно, имеет топохимическую природу, поскольку разложение, например, XXV.5, в динамических условиях (дериватография) начинается при 207С и сопровождается экзопиком вплоть до вспышки при 220-223С, подплавления вещества не зарегистрировано.
Величина kр-р/kтв для соединений составляет 1,1-100,7 (таблица 4.1) и превышает таковую для нитроазолов (табл. 3.2).
Таблица 4.1
Кинетические и термодинамические параметры термораспада соединений XXV
| Шифр | Тпл, С | Мол. масса | Агрегатное состояние | ΔТ, С | Еa, кДж/моль | lg A | k150C, с-1 | S150C, __Дж_ мольК | 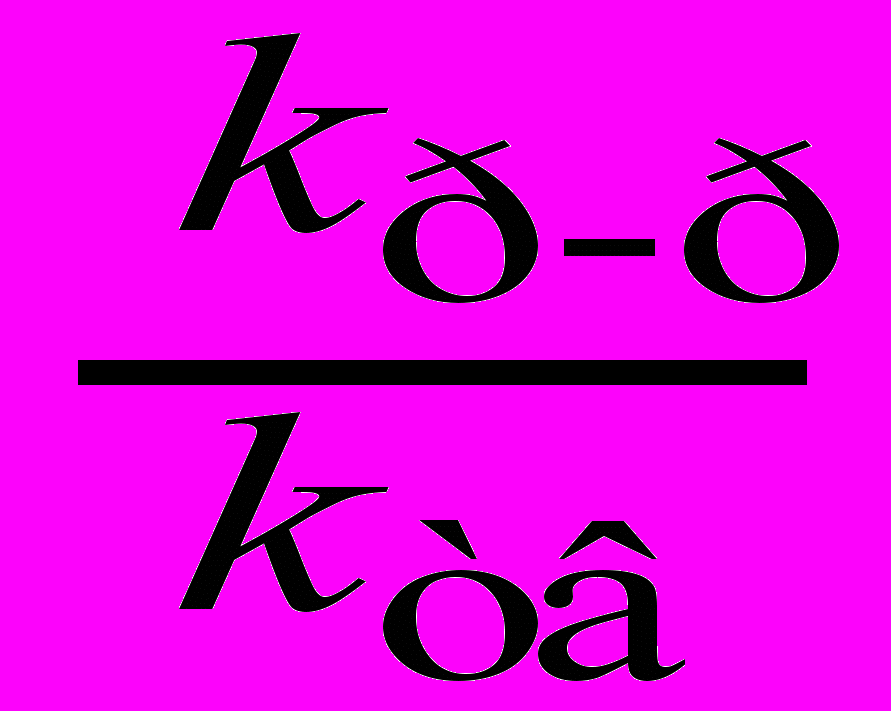 |
| XXV.1 | 135-137 (c разл) | 131 | тв. фаза р-р в ДНБ | 110-120 110-140 | 193,4 131,1 | 20,40 13,25 | 3,34·10-4 1,16·10-3 | 134,3 -2,6 | 16,4 |
| XXV.2 | 211-212 (c разл) | 176 | тв. фаза р-р в ДБФ | 160-185 150-190 | 192,1 154,1 | 18,01 13,78 | 1,85·10-6 5,67·10-6 | 88,6 7,6 | 1,1 |
| XXV.3 | 249 (c разл) | 232 | тв. фаза | 185-210 | 203,0 | 18,46 | 2,48·10-7 | 97,2 | |
| XXV.4 | 160 | 250 | тв. фаза р-р в ДБФ | 135-155 145-190 | 203,9 168,7 | 18,22 15,30 | 1,11·10-7 2,96·10-6 | 92,6 36,7 | 34,0 |
| XXV.5 | 243-246 (c разл) | 294 | тв. фаза р-р в ДНБ р-р в ДБФ | 180-200 145-190 140-185 | 210,2 170,0 165,0 | 18,00 15,77 14,96 | 1,11·10-8 6,03·10-6 3,87·10-6 | 88,4 45,7 30,2 | 100,7 52,4 |
| XXV.6 | 132-133 | 162 | р-р в ДБФ тв. фаза* р-р в ДНБ** р-р в ТНБ*** | 150-190 110-130 170-210 120-210 | 160,0 197,8 155,9 158,6 | 14,25 18,69 13,60 14,00 | 3,1·10-6 1,85·10-6 2,25·10-6 2,62·10-6 | 16,6 101,6 4,1 11,8 | 3,9 4,2 2,8 |
*[Oxley J.C. и др., 1994], **[Корсунский Б.Л. и др., 1979], ***[Лурье Б.А. и др., 1979]
В газообразных продуктах распада соединения XXV.5 методами хроматографии и ИК-спектроскопии обнаружены NO и NO2, H2O, N2O и N2. Основными газообразными продуктами при полном разложении нитрамина XXV.5 являются N2 (38%), CO2 (31%) и N2O (18%). Фотоэлектроколориметрически найдено, что количество NO2 в продуктах распада на глубине превращения 5 % при температуре 190ºС составляло 0,94 моля на моль разложившегося вещества. В ИК-спектре конденсированного продукта распада (в вазелиновом масле) отсутствуют полосы поглощения нитрогруппы (1560, 1290 см-1) и цикла (1600, 1530, 1305 см-1). В ПМР-спектре конденсированного остатка (диметилсульфоксид d6) имеются три широкие полосы ( 2,41, 2,66, 3,60 м.д.) в соотношении 1:2:34. Полосы поглощения исходного нитрамина в ПМР-спектре отсутствуют. Идентифицировать конденсированный остаток не удалось, но можно полагать, что он представляет собой полимерное вещество линейного строения.
В отличие от соединения XXV.5 основным газообразным продуктом распада нитрамина XXV.1 является N2O. Ее содержание в конце распада достигает 0,97 молей на моль вступившего в реакцию вещества. Кроме этого, если при полной конверсии нитрамина XXV.5 выделяется 8,5 молей газообразных продуктов, не конденсирующихся при комнатной температуре, то в случае соединения XXV.1 эта цифра составляет примерно один моль.
Резюмируя вышеизложенное, с учетом аналогии с соединениями I, можно принять для нитраминов XXV.2-XXV.5 гомолитический механизм распада с первичным разрывом связи N-NO2. Анализируя активационные параметры термораспада в растворе (табл. 4.1), следует отметить их хорошее согласие с этим механизмом.
Наименьшую термостабильность имеют соединения XXV.2 и XXV.5, а наибольшую – XXV.3, XXV.6, что расходится с расчетом. Причина этого видится в том, что в использованных квантово-химических методах расчета недостаточно учитывается вклад валентных углов и, в особенности, аминного азота, в энтальпию образования циклического N-нитрамина.
Скорость распада нитраминов XXV.1- XXV.6 изменяется в твердой фазе примерно на четыре порядка (табл. 4.1). Такое различие в скоростях распада может быть обусловлено, вероятно, не только механизмом термораспада, но и разной стабильностью молекулярных кристаллов. Чем больше температура плавления кристалла и молекулярная масса молекул в кристалле, тем больше требуется тепловой энергии для возбуждения движения молекул. При этом следует учитывать не только массу, но и поверхность молекул. Чем она больше, тем сильнее ван-дер-ваальсовы связи в молекулярных кристаллах.
Попытка скоррелировать скорость распада нитраминов XXV.1-XXV.6 с температурой плавления или молекулярной массой показала лишь наличие тенденции уменьшения скорости распада с увеличением температуры плавления и молекулярной массы.
На первый взгляд может показаться, что температура плавления и термическая стабильность молекулярных кристаллов зависит от наличия межмолекулярных водородных связей. Поэтому интересно хотя бы качественно рассмотреть влияние на скорость распада межмолекулярных водородных связей в ряду родственных по химическому строению нитраминов XXV.1-XXV.3. По данным рентгеноструктурного анализа [Васильев А.Д. и др., 2002, George C., etc., 1990, Allen F. H., 2002] кристаллическая структура этих нитраминов имеет разную симметрию и разные межмолекулярные связи. В отличие от соединения XXV.3, в ячейке которого все атомы кислорода (карбонильного и нитрогруппы) участвуют в образовании водородных связей, атомы кислорода нитрогруппы соединения XXV.1 не задействованы. Менее развитая система водородных связей в последнем соединении ведет к меньшей температуре его плавления и, соответственно, большей (примерно на 3,5 порядка) скорости распада по сравнению с соединением XXV.3 (табл. 4.1). В то же время скорость распада соединения XXV.1 примерно на 1,5 порядка больше, чем соединения XXV.2, где межмолекулярные связи отсутствуют. На основании вышеизложенного нельзя сделать какое-либо заключение о влиянии водородных связей на скорость твердофазного термораспада родственных по химическому строению нитраминов.
Термораспад соединения XXV.1 в силу отмеченных выше причин происходит не по гомолитическому механизму. Его кинетические параметры практически совпадают с таковыми для 1-нитро-2-нитриминоимидазолидина [Astachov A. M. И др., 2002], термораспад которого включает первичный внутримолекулярный перенос аминного протона на нитриминную группу. Аналогичный механизм можно предложить и для соединения XXV.1:
Термическое разложение аналога соединения XXV.1, нитрамина XXV.3, геометрические параметры которого (длины связей, валентные углы и торсионные углы) незначительно отличаются от таковых для соединения XXV.1, может протекать параллельно двумя путями: гомолитически с первичным разрывом связи N-NO2 и, по аналогии с соединением XXV.1, с разрывом связи N-C(O).
4.2 Шестичленные циклические нитрамины
В настоящее время наиболее подробно изучены кинетические закономерности и установлен механизм термораспада, включающий первичный гомолиз связи N-NO2, только для соединения XXVI.8. Сведения по кинетике термораспада шестичленных циклических нитраминов, дополнительно содержащих другие реакционноспособные функции, практически отсутствуют в литературе. Нами исследовано термическое разложение соединений XXVI.1-XXVI.9 с целью выявления влияния строения на скорость и механизм термораспада.
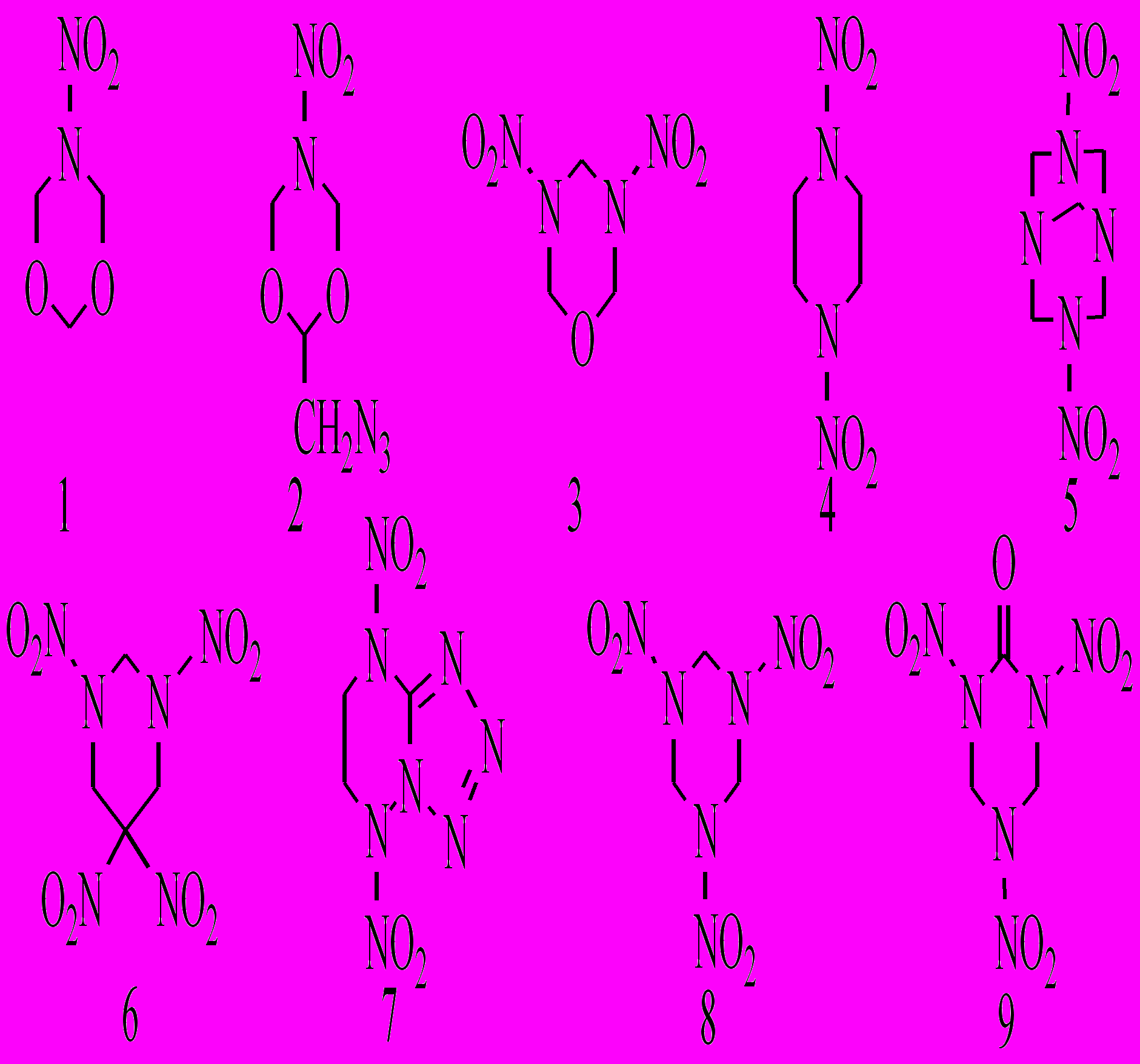
Термораспад нитраминов XXVI.1-9 протекает с ускорением, которое в растворе выражено слабее, чем в расплаве. Увеличение m/V приводит к увеличению индукционного периода и уменьшению начальной скорости распада, что свидетельствует о вкладе газофазной реакции в общую скорость процесса. Поэтому кинетику термораспада изучали при постоянном m/V=(1,1-1,3)10-3 г/см3. В то же время при распаде нитрамина XXVI.5 в твердой фазе увеличение m/V в 20 раз, наоборот, приводит к сокращению индукционного периода и практически не влияет на начальную скорость распада, что связано с протеканием реакции исключительно в конденсированной фазе. В разных агрегатных состояниях нитраминов XXVI.1-9 (расплав, газовая и твердая фаза) реакция не осложняется гетерогенными и цепными процессами, о чем можно судить по независимости скорости распада от изменения S/V. На начальную скорость и период индукции распада нитрамина XXVI.5 не влияет размер кристаллов (0,01-0,2 мм), что указывает на отсутствие роли топохимии в ускорении твердофазного распада, которое, скорее всего, связано с каталитическим действием продуктов реакции на исходный нитрамин. Кинетические параметры распада нитраминов XXVI приведены в табл. 4.2.
Как видно из табл. 4.2, различие в скоростях распада составляет 7 порядков. Энергия активации в жидкой фазе (расплав, раствор) варьирует от 123,1 до 198,4 кДж/моль, а предэкспоненциальный множитель в пределах 12,00-17,30.
Известно, что лимитирующей стадией термораспада RDX (XXVI.8) является гомолитический разрыв связи N-NO2. Этот процесс характеризуется параметрами, найденными в растворе, Ea=166,3–167,5 кДж/моль, lgA=14,30–14,62.
Судя по активационным параметрам, гомолиз по связи N-NO2, как лимитирующая стадия термораспада, реализуется также в случае нитраминов XXVI.1, XXVI.3, XXVI.4 и XXVI.10. При термораспаде соединения XXVI.7 в твердой фазе первично обнаруженным продуктом был диоксид азота, что позволило авторам работы [Gao A. и др., 1991] также предложить в качестве первичной стадии гомолиз по связи N-NO2. Можно полагать, что и в растворе этот механизм сохраняется. Качественный состав газообразных продуктов распада для соединений XXVI.1, XXVI.3 и XXVI.8 практически одинаков и содержит N2, N2O, NO, CH2O, CO, CO2, H2O и HCN (следы). Из-за быстрых окислительно-восстановительных реакций обнаружить образующийся в первичном акте распада NO2 не всегда удается.
