Структурно-кинетические закономерности и механизм термораспада полифункциональных нитро- и азидосоединений 02. 00. 04 физическая химия
| Вид материала | Закон |
СодержаниеТаблица 4.2 Кинетические и термодинамические параметры термораспада нитраминов XXVI 4.3 Каркасные нитрамины |
- Синтез и исследование полифункциональных люминофоров на основе алюминатов стронция, 307.95kb.
- Рабочая программа дисциплины (модуля) «математический анализ», 424.74kb.
- Рабочая программа дисциплины (модуля) «Уравнения математической физики», 266.58kb.
- Рабочая программа дисциплины «физическая химия», 80.79kb.
- Рабочая программа дисциплины (модуля) «Линейная алгебра и аналитическая геометрия», 275.82kb.
- Программа дисциплины дпп. Ф. 05 Физическая химия, 267.17kb.
- «Кинетика и механизм реакции поликонденсации аминокислот» 02. 00. 04 физическая химия, 332.67kb.
- И в свет разрешаю на основании "Единых правил", п 14 Заместитель первого проректора-, 350.14kb.
- Физико-химические закономерности удерживания производных адамантана в высокоэффективной, 432.05kb.
- Физико-химические закономерности формирования и деградации органосиликатных покрытий, 977.75kb.
Таблица 4.2
Кинетические и термодинамические параметры термораспада нитраминов XXVI
| Шифр | Формуласоединения | Условия распада | T, С | Еa, кДж/моль | lgA | k200C, с-1 | S200C, __Дж_ мольК | d, Å |
| XXVI.1 |  | газ. фаза р-р в ДБФ р-р в ДНБ | 200-230 185-220 185-225 | 168,7 174,6 173,9 | 13,95 14,46 14,40 | 2,1·10-5 1,5·10-5 1,6·10-5 | 10,0 19,8 18,6 | |
| XXVI.2 | 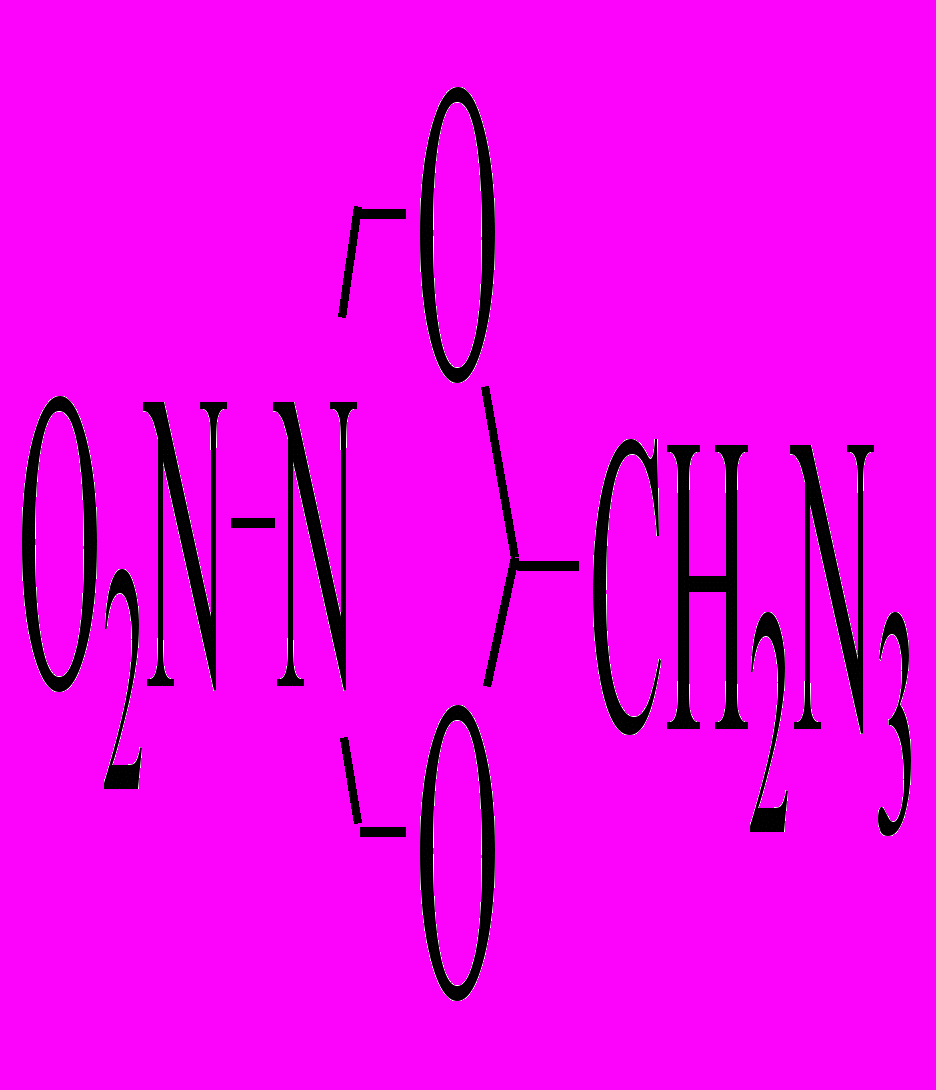 | р-р в ДБФ р-р в ДНБ | 175-210 180-220 | 163,9 162,3 | 14,38 14,29 | 1,9·10-4 2,3·10-4 | 18,2 16,5 | |
| XXVI.3 | 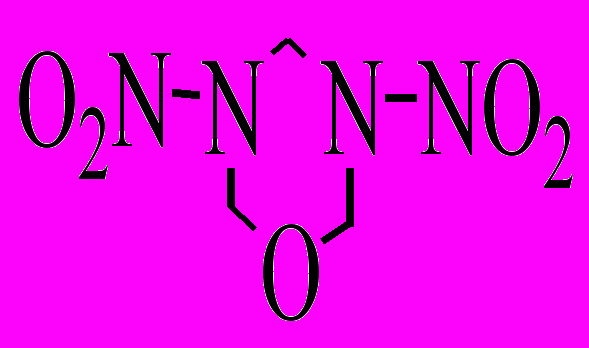 | р-р в ДБФ расплав | 170-210 180-220 | 169,2 171,2 | 14,71 14,93 | 1,1·10-4 1,1·10-4 | 24,5 28,7 | |
| XXVI.4 |  | р-р в ДНБ а расплав а р-р в ТНБ б расплав | 225-245 216-250 230-245 180-220 | 155,3 198,4 191,7 177,1 | 12,00 17,30 15,70 14,86 | 7,0·10-6 2,5·10-5 3,0·10-6 2,0·10-5 | -27,4 74,2 43,5 27,4 | 1,37 |
| XXVI.5 | 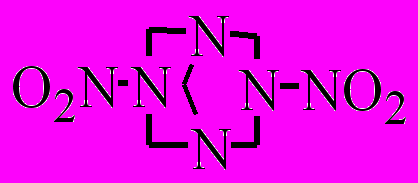 | р-р в ДБФ р-р в ДНБ твердая фаза | 150-185 150-180 150-180 | 148,7 153,2 172,9 | 13,38 13,91 15,64 | 9,1·10-4 9,9·10-4 3,5·10-4 | -0,9 9,2 42,4 | 1,375 |
| XXVI.6 | 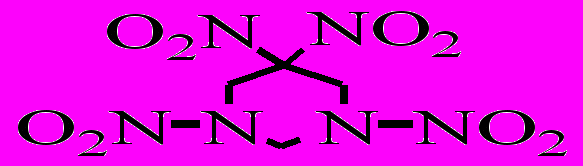 | р-р в ДБФ р-р в ДНБ | 145-170 150-175 | 157,9 160,4 | 14,47 14,78 | 1,1·10-3 1,2·10-3 | 19,9 25,9 | 1,408 |
| XXVI.7 | 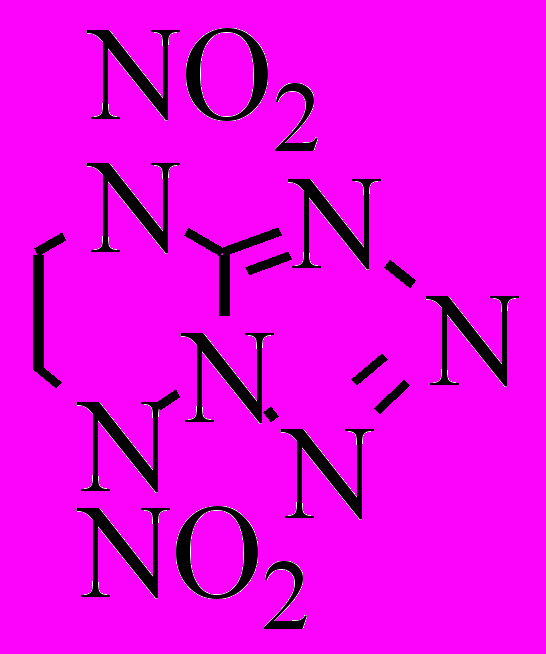 | р-р в НБ р-р в ДБС | 50-70 50-75 | 123,1 128,8 | 16,25 16,87 | 4,55·102 4,45·102 | 54,0 65,9 | 1,494 |
| XXVI.8 |  | р-р в ДНБ в р-р в ДБФ расплав | 160-200 170-210 205-224 | 166,3 167,5 176,3 | 14,30 14,62 15,95 | 8,7·10-5 1,3·10-4 3,0·10-4 | 16,7 22,8 48,3 | 1,398 |
| XXVI.9 |  | р-р в ДБС р-р в ДНБ | 160-180 160-180 | 149,3 150,6 | 14,53 14,74 | 1,1·10-2 1,3·10-2 | 21,1 25,1 | 1,434 |
| 10 | 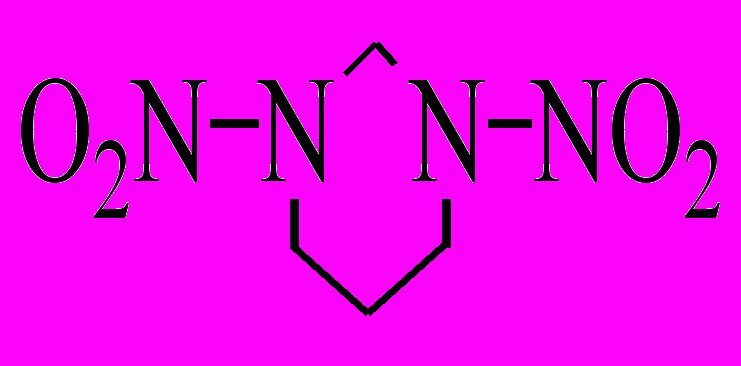 | р-р в EtOH г расплав б | 200-300 240-260 | 167,4 175,4 | 14,60 15,40 | 1,3·10-4 1,1·10-4 | 22,4 37,8 | 1,388 |
| XXIII.1 | 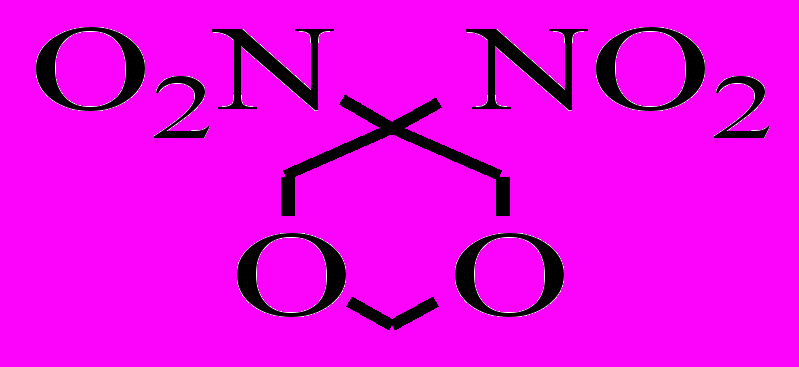 | р-р в ДБФ расплав | 195-215 180-200 | 174,6 176,8 | 14,75 15,09 | 3,0·10-5 3,7·10-5 | 25,3 31,8 | |
EtOH-этанол; а[Корсунский Б.Л. и др, 1979], б[Лурье Б. А. и др., 1979], в[Максимов Ю.Я. и др., 1967], г[Oxley J.C. и др., 1994]
В ИК-спектрах продуктов термораспада соединения XXVI.2 в расплаве с увеличением глубины превращения уменьшается интенсивность полосы поглощения азидной группы (2130 см-1) при практически неизменной интенсивности полос N-NO2 группы (1555,1295см-1). При глубине превращения 1-3 % были обнаружены лишь молекулярный азот и 5-нитро-5-аза-1,3-диокса-2-метилениминциклогексан, NO2 появляется на более поздних глубинах превращения. Все это свидетельствует о том, что распад соединения XXVI.2 начинается с разрыва связи N–N в азидогруппе.
Из табл. 4.2 видно, что динитрометильная группа в цикле (соединение XXIII.1) по стабильности близка к нитраминной группе (соединение XXVI.1). При переходе от соединения XXVI.10 к соединению XXVI.8 скорость распада изменяется незначительно, а для соединения XXVI.6 скорость на порядок больше, что можно связать со стерическим влиянием динитрометильной группы на одну из нитраминных групп [Oyumi Y. и др., 1985]. Аналогичное влияние наблюдалось нами при замене одной метильной группы в диметил-N-нитрамине на 2,2-динитропропильную группу (см. табл. 3.6). Таким образом, можно констатировать, что термораспад соединения XXVI.6, так же как и RDX, протекает с первичным гомолитическим разрывом связи N-NO2.
Результаты анализа не конденсирующихся в обычных условиях газообразных продуктов термораспада соединения XXVI.5 при разных температурах показывают, что основным компонентом является N2O, а NO отсутствует. Отношение N2/N2O примерно на два порядка меньше, чем у соединения XXVI.3 и RDX. Учитывая это, можно считать, что термораспад соединения XXVI.5 лимитируется гомолизом N-NO2 связи. Образовавшийся NO2 быстро окисляет промежуточные продукты распада и исходный нитрамин, генерируя конечные продукты и воду. Появившаяся вода включает автокатализ термораспада соединениями с аминными группами. Нельзя полностью исключать также автокатализ аминными группами с самого начала термораспада, поскольку кристаллы нитрамина могут содержать влагу, захваченную при кристаллизации. Аналогичный сценарий автокатализа, возможно, реализуется и в растворе. Опыты по распаду нитрамина XXVI.5 подтверждают это предположение. Так, добавление 3-6 % воды (от массы растворителя ДБФ и ДНБ) в 1 % (масс.) раствор увеличивает скорость распада.
Основными продуктами распада соединения XXVI.9 являются CH2O, N2O и CO2, а содержание NO2, NO и CO незначительно [Bulusu S. и др., 1996 (кинетические параметры не определялись)]. Это позволило предположить протекание лимитирующей реакции между нитрамидной и карбонильной группами через четырехчленное циклическое переходное состояние. Однако если принять во внимание активационные параметры, то в сочетании с составом продуктов распада можно ожидать гомолиз по связи N-NO2.
Соединения XXVI.3, XXVI.8 и XXVI.10 имеют в растворе практически одну и ту же скорость распада, несмотря на, казалось бы, их разное химическое строение. Ранее в литературе отмечалось, что скорость распада нитраминов, в основном, зависит от конформации нитраминной группы.
В кристалле наиболее устойчивой -конформации RDX три нитрогруппы пространственно неэквивалентны: две их них находятся в аксиальном положении, а третья - в экваториальном [Choi C.S. и др., 1972]. Такая неэквивалентность, обусловленная требованиями плотной упаковки в кристалле, ведет к заметному различию в длине, а следовательно, и прочности N-NO2 связей. Длина наименее прочной связи N-NO2 1,398 Å, сумма валентных углов (СВУ) у аминного азота 347.9. По данным [Шишков И.Ф. и др., 1991], в газовой фазе все нитраминные фрагменты в молекуле RDX эквивалентны, и их геометрия близка к планарной (СВУ у аминного атома азота 356.3). Длина связей N-NO2 возрастает до 1,413 Å. В растворе реализуется промежуточная ситуация между сильным влиянием межмолекулярного взаимодействия в кристаллическом состоянии и его отсутствием в газовой фазе. Судя по величине дипольных моментов RDX и соединения XXVI.3 в растворе должна наблюдаться эквивалентность нитраминных групп. Что же касается конформации аминного азота, то, по-видимому, он в большей степени пирамидален, чем в газовой фазе. Такой вывод следует из сравнения скоростей термораспада RDX, нитраминов XXVI.3, XXVI.10 и XXVI.4. Длины связей N-NO2 1,37 Å в соединении XXVI.4 короче, чем в RDX и у других рассматриваемых нами нитраминах, а его конформация кресло на 16 кДж выгоднее ванны [Потапов В.М., 1976], и это определяет его более высокую термическую стабильность.
Соединение XXVI.9 содержит уплощенный сопряженный фрагмент динитромочевины и имеет общую конформацию полукресло (полуванна) [Anderson J. L. и др., 1990]. Длины всех связей N-NO2 (наибольшее значение 1,434 Å) больше, чем в RDX, что, в принципе, объясняет меньшую его термическую стабильность по сравнению с RDX.
В отличие от соединения XXVI.4 в нитрамине XXVI.10 [Pickering и др., 1991] одна из нитраминных групп, практически, планарна (сумма валентных углов у аминного атома азота 356.5) и длина связи N-NO2 составляет 1,345 Å. Другая нитраминная группа пирамидальная, где сумма валентных углов у атома азота 344.4, а длина N-NO2 связи, равная 1,388 Å, больше, чем в соединении XXVII.4. Это находит свое отражение в большей величине скорости термораспада нитрамина XXVI.10 (табл. 4.2).
Скорость распада соединения XXVI.5 в растворе близка к таковой для соединения XXVI.6. В кристалле соединения XXVI.5 реализуется конформация кресло-кресло [Choi C.S. и др., 1974]. Угол между плоскостями нитрогрупп и CNC цикла составляет, соответственно, 34.0 и 26.0, как и у RDX. Углы CNC в шестичленных циклах равны 113.0-118, т.е. близки к таковым в RDX, но меньше, чем в молекуле 1,3,5,7-тетранитро-1,3,5,7-тетраазациклооктана (НМХ). Конформация соединения XXVI.5 более жесткая, чем структура RDX и HMX, т.е. конверсия циклов затруднена. Длина наибольшей N-NO2 связи в нитрамине XXVI.5 равна 1,375Å.
Соединения XXVI.2 и XXVI.6 содержат два потенциальных реакционных центра. Если для соединения XXVI.2 отсутствуют сведения о его конформации, то согласно рентгеноструктурным данным в соединении XXVI.6 нитраминные группы неэквивалентны [Oyumi и др., 1985]. Длина наименее прочной связи N-NO2 составляет 1,408 Å, а сумма валентных углов у аминного атома азота равна 349.7.
Для соединения XXVI.7 самая большая скорость распада обусловлена жестко-напряженной конформацией шестичленного цикла и строением нитраминной группы. Шесть атомов азота в бицикле за счет растяжения и сжатия химических связей, а также изменения валентных углов вносят существенный вклад в увеличение конформационной энергии молекулы. Это соединение имеет рекордное значение длины 1,494 Å одной из N-NO2 связей [Gao A. и сотр., 1991] (нитраминная группа, в которой пирамидальный аминный азот непосредственно связан с одним из атомов азота тетразольного цикла). При этом сумма валентных углов аминного азота составляет 329.0, что также является наименьшим значением по сравнению с рассмотренными выше нитраминами.
Резюмируя вышеизложенное, можно считать, что скорость гомолиза по связи N-NO2, в основном, зависит от конформации цикла, которая отражается на длине наименее прочной связи. Нами обнаружена корреляционная зависимость, описываемая уравнением регрессии
lg k200C = (62,894±2,912)dN-NO2 – (91,576±4,111) (62),
r=0,992; Sy=0,627; n=6
где dN-NO2 – длина наименее прочной N-NO2 связи.
Из зависимости (62) выпадает точка для соединения XXVI.5. Вероятно, это связано с тем, что его термораспад наряду с гомолизом связи N-NO2 включает автокатализ.
В ряду нитраминов (для которых имеются рентгеноструктурные данные) наблюдается тенденция уменьшения энергии активации и увеличения предэкспоненциального множителя с увеличением длины наименее прочной N-NO2 связи:
Ea = -391,73dN-NO2 + 711,58 r=0,996; n=6 (63)
lgA = 20,79dN-NO2 - 14,68 r=0,949; n=7 (64)
Таким образом, сочетание вторичных нитраминных групп с оксо-, гем-динитро- и тетразольной группами в шестичленном гетероцикле не изменяет лимитирующей стадии термораспада – гомолиза N-NO2 связи, но может приводить к увеличению скорости распада на 2-7 порядков. При наличии азидной, аминной и карбонильной функций возможна смена лимитирующей стадии термораспада.
4.3 Каркасные нитрамины
Кинетические закономерности термического разложения изучены только для гексанитроизовюрцитана (HNIW, CL-20) [Oxley J.С., 1994; Lobbecke S., 1999; Корсунский Б.Л. и др., 1999]. Нами исследовано влияние структуры и агрегатного состояния нитраминов XXVII.1-5 на скорость и механизм термораспада:
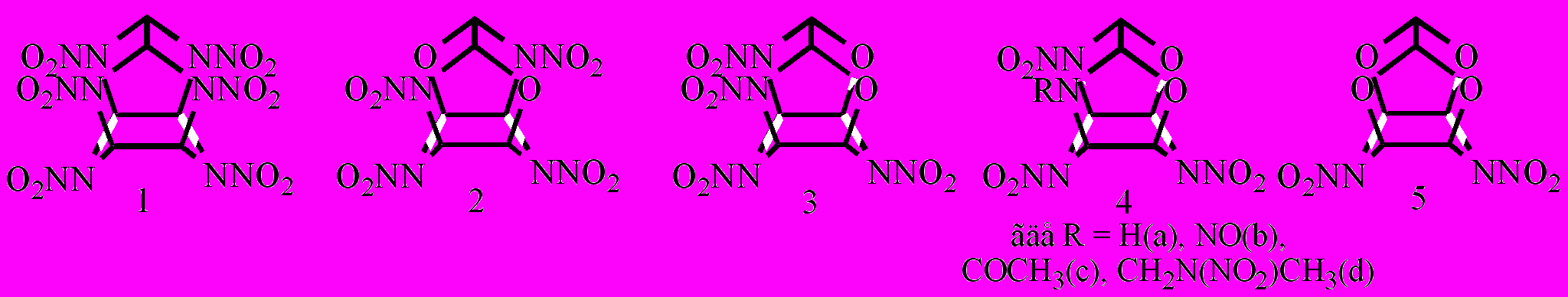
Изучение кинетических закономерностей, влияние m/V, S/V и концентрации вещества в растворе на скорость термораспада соединений XXVII показало, что они аналогичны таковым для нитраминов XXV и XXVI.
Кинетические параметры термораспада нитраминов XXVII представлены в табл. 4.3. Анализируя данные табл. 4.3, можно заметить, что энергия активации в растворе, в пределах ошибки ее определения, близка к энергии диссоциации связи N-NO2 и изменяется в относительно узком интервале 154,1-171,7 кДж/моль, зато логарифм предэкспоненциального множителя варьирует в широких пределах 13,49-16,8. Из этого следует, что реакция термораспада каркасных нитраминов в значительной степени контролируется энтропийным фактором. Активационные параметры разложения в твердой фазе больше: Еа=162,2-206,4 кДж/моль, lgA=14,94-19,79. Однако, несмотря на существенный разброс в параметрах, скорость распада нитраминов XXVII.1-XXVII.3, XXVII.4b изменяется незначительно. В целом, основные закономерности по влиянию структуры на скорость распада, найденные для раствора, сохраняются для твердой фазы. В то же время значение lgA13,5, что, по аналогии с нитраминами XXVI, позволяет предположить гомолитический механизм распада с разрывом связи N-NO2 для первичной стадии. Качественный состав газообразных продуктов при 3-5 %-ной конверсии нитраминов XXVII.1, XXVII.3 показал, что независимо от условий распада (раствор, твердая фаза) образуются N2, N2O CO, CO2 и NO, что не противоречит гомолизу N-NO2 связи.
Таблица 4.3
