Структурно-кинетические закономерности и механизм термораспада полифункциональных нитро- и азидосоединений 02. 00. 04 физическая химия
| Вид материала | Закон |
- Синтез и исследование полифункциональных люминофоров на основе алюминатов стронция, 307.95kb.
- Рабочая программа дисциплины (модуля) «математический анализ», 424.74kb.
- Рабочая программа дисциплины (модуля) «Уравнения математической физики», 266.58kb.
- Рабочая программа дисциплины «физическая химия», 80.79kb.
- Рабочая программа дисциплины (модуля) «Линейная алгебра и аналитическая геометрия», 275.82kb.
- Программа дисциплины дпп. Ф. 05 Физическая химия, 267.17kb.
- «Кинетика и механизм реакции поликонденсации аминокислот» 02. 00. 04 физическая химия, 332.67kb.
- И в свет разрешаю на основании "Единых правил", п 14 Заместитель первого проректора-, 350.14kb.
- Физико-химические закономерности удерживания производных адамантана в высокоэффективной, 432.05kb.
- Физико-химические закономерности формирования и деградации органосиликатных покрытий, 977.75kb.
3 ТЕРМИЧЕСКОЕ РАЗЛОЖЕНИЕ НИТРОСОЕДИНЕНИЙ
3.1 Сложные эфиры нитроэтанола и алифатических кислот
Нами впервые изучен термораспад в газовой фазе нитроэтиловых эфиров общей формулы RCOOCH2CH2NO2 (V), где R = изо-C3H7 (V.1), н-C3H7 (V.2), CH3(V.3), CH2Cl (V.4), CCl3 (V.5), а также CH3COOCH2C(NO2)2H (V.6), с целью выяснения механизма и влияния заместителя R на скорость распада.
На скорость распада не влияют начальное давление паров вещества (в пределах 100-320 мм рт.ст.) и наличие типичных ингибиторов возможных радикальных и цепных процессов – толуола и оксида азота.
Активационные параметры термораспада, рассчитанные по константам, найденным при S/V 0,50-0,55 см-1, представлены в табл. 3.1. Здесь же приведены параметры для соединений V.2 и V.5, вычисленные по константам, найденным при S/V 3,0 см-1.
Таблица 3.1
Кинетические параметры термического разложения нитроэтиловых эфиров V
| Шифр | Интервал температур,С | S/V, см-1 | k225C105, с-1 | Ea, кДж/моль | lg A | S225C, Дж/(мольК) | рКа |
| V.1 | 215-240 | 0,54 | 5,6 | 159,5 | 12,45 | -19,2 | 4,86 |
| V.2 | 205-225 205-225 | 0,53 3,00 | 6,0 9,6 | 162,9 124,5 | 12,84 9,04 | -11,7 - | 4,82 |
| V.3 | 215-245 | 0,54 | 6,3 | 162,0 | 12,74 | -13,6 | 4,76 |
| V.4 | 205-225 | 0,54 | 9,7 | 158,3 | 12,84 | -11,7 | 2,85 |
| V.5 | 205-225 205-225 | 0,54 3,00 | 14,1 17,1 | 157,4 109,1 | 12,64 7,68 | -15,5 - | 0,66 |
| V.6 | 220-250 | 0,55 | 6,4 | 198,2 | 16,59 | 60,1 | 4,76 |
| Этил-ацетат* | - | - | 3,3110-4 | 200,0 | 12,5 | -18,2 | - |
* [Smith G.G., 1963]
Основными продуктами разложения эфиров V, как было установлено с помощью хромато-масс-спектрометрии и ИК-спектроскопии, являются нитроэтилен и карбоновые кислоты. Их образование хорошо объясняется в рамках механизма (17)

С уменьшением рКа кислоты (табл. 3.1), что вызвано увеличением электроотрицатель-ности заместителя у карбонильной группы, константа скорости разложения увеличивается. Однако это увеличение не столь велико, как это можно ожидать исходя из значений рКа соответствующих кислот. Подобная тенденция отмечалась ранее при разложении этилбензоатов, этилацетатов и объясняется тем, что в циклическом переходном состоянии связь О-С-алкоксил разрывается гетеролитически с образованием контактной ионной пары (18), в которой -углеродный атом приобретает характер иона карбония [Maccol A., 1963].

В целом, нитроэтилацетаты имеют более высокую скорость разложения по сравнению с этилацетатами, что связано с более сильной поляризацией связи О-С-алкоксил -нитрогруппой.
Соединение V.6, судя по активационным параметрам, распадается гомолитически с первичным разрывом связи С-NO2 аналогично гем-динитроалканам [Назин Г.М., 1994].
3.2 Некоторые нитропроизводные триазола и тетразола
Изучено термическое разложение следующих азолов:
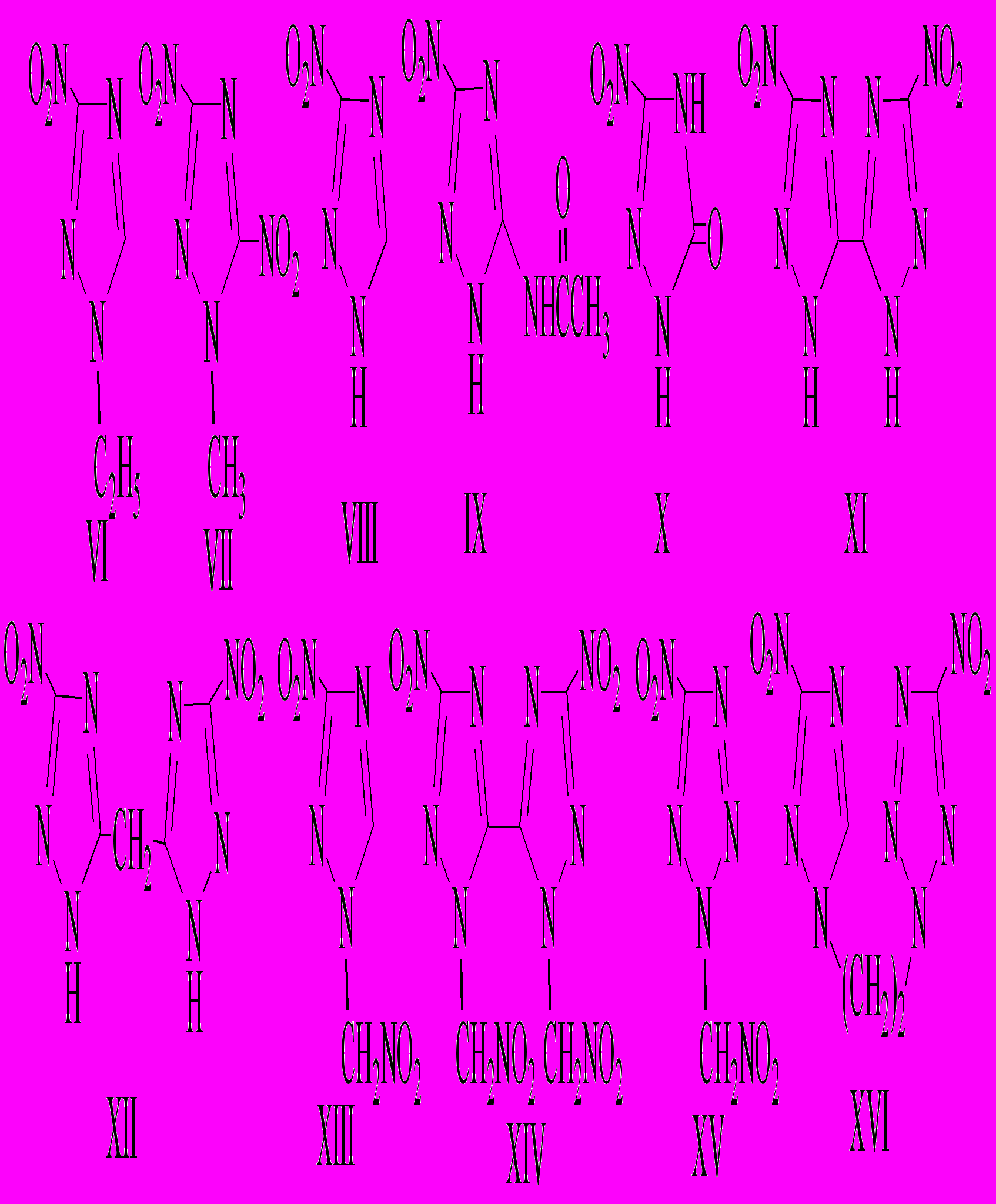
Все соединения, кроме VI, VII и XVI, являются N-H или С-Н кислотами, плавятся с разложением (кроме XV), растворяются при нагревании в воде и плохо или вообще не растворяются в органических растворителях.
Термическое разложение соединения VI в газовой фазе при начальных давлениях паров Ро=125-230 мм рт. ст. и S/V=0,50-0,55 см-1 в температурном интервале 380-410С протекает по реакции первого порядка.
Кинетику термораспада соединений VII-XIII, XV исследовали в одном или нескольких (в зависимости от растворимости) инертных растворителях с низкой диэлектрической проницаемостью: ДНБ (=20,6), ТНБ (=7,21), ДБФ (=6,44), ДБС (=6,1), а также ФБ (=3,5) соединений XIII, XV и ДФЭ (=3,7) соединения XIII. Исследование показало, что реакция термораспада соединений VIII-XIII имеет псевдопервый порядок. Константа скорости в растворе уменьшается с разведением раствора. Поэтому кинетику изучали в 1-2 % (масс) растворах. Логарифмическая зависимость константы скорости от концентрации является линейной и для соединений VIII в ДБФ и XIII в ДБС передается уравнениями:
lg kVIII230C = 0,793 lgC – 4,286 (r=0,997) (19); lg kXIII200C = 0,715 lgC – 4,355 (r=0,996) (20)
Влияние диэлектрической проницаемости растворителей на скорость распада соединений VIII, XIII описывается, соответственно, уравнениями:
lg k230CVIII = – (3,020,03)/ – (3,600,09) (r=0,996; Sy=0,09; n=4) (21)
В изодиэлектрических растворителях ДНБ-ДФЭ
lg k200CXIII = – (4,510,06)/ – (3,460,02) (r=0,999; Sy=0,02; n=6) (22)
Наблюдаемые зависимости (21) и (22) хорошо объясняются в рамках чисто электростатического взаимодействия между ионами и молекулами растворителя в исходном и переходном состояниях. С ростом диэлектрической проницаемости растворителя увеличение скорости не так велико, как следует из этих уравнений, вероятно, из-за повышенной температуры (200-230С) эксперимента, где процессы сольватации исходного и переходного состояний нивелируются.
В отличие от раствора термораспад соединений VIII, X, XI-XIV в твердой фазе протекает с ускорением, и кинетические кривые имеют S-образный вид. На скорость реакции, за исключением соединения XIV, оказывают влияние m/V, S/V, размер кристаллов, газообразные и конденсированные продукты, образующиеся в ходе разложения. Все это свидетельствует о сложном течении процесса распада. Кинетические параметры изученных нитросоединений сведены в табл. 3.2.
При анализе данных табл.3.2 бросаются в глаза относительно малые величины активационных параметров (Еа и lgA), существенно отличающиеся от таковых для соединения VI, близкие значения констант скорости термораспада для нитроазолов VIII-XII в ДБФ и малые различия констант скорости XIII в ДНБ, ДБФ и ДБС, которые не могут быть объяснены гомолизом C-NO2 связи или азольного цикла.
Таблица 3.2
Кинетические параметры термораспада нитроазолов VI-XVI
| Шифр | Условия распада | Интервал температур,С | Еа, кДж/моль | lg A | k200С, с-1 | S200C, Дж/мольК | 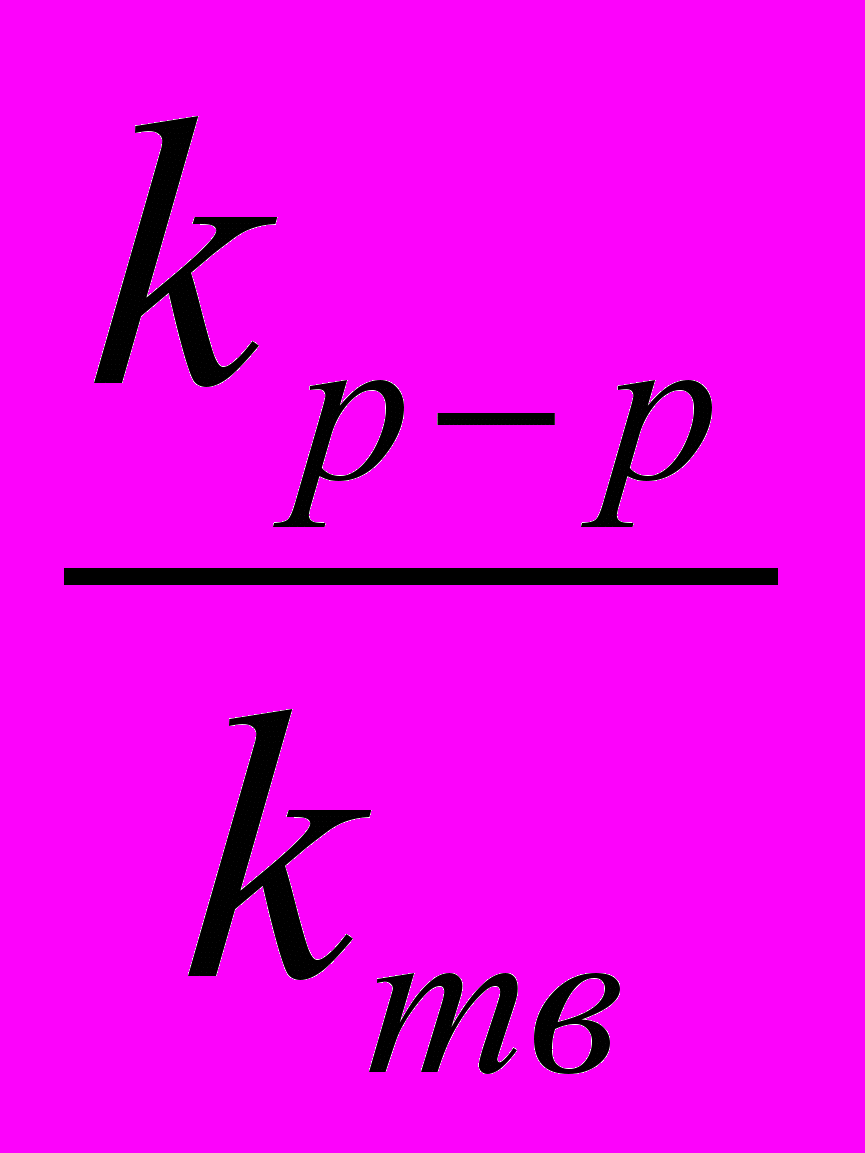 | Тпл, С |
| VI | Газ | 380-410 | 272,6 | 16,81 | 5,110-14 | 64,9 | | |
| VII | Расплав | 200-230 | 136,2 | 10,73 | 4,910-5 | -51,6 | | |
| Р-р в ДБФ | 220-245 | 166,8 | 13,10 | 4,810-6 | -6,2 | | | |
| VIII | Тв. | 180-200 | 160,4 | 12,82 | 1,310-5 | -11,6 | 1,1 | 211,5 |
| Р-р в ДБФ | 210-250 | 123,1 | 8,66 | 1,210-5 | -91,3 | |||
| IX | Р-р в ДБФ | 220-245 | 124,2 | 8,83 | 1,310-5 | -88,0 | | |
| X | Р-р в ДБФ | 205-245 | 125,5 | 9,07 | 1,610-5 | -83,4 | | |
| XI | Тв. Р-р в ДБФ | 220-240 200-240 | 163,3 127,7 | 12,49 9,40 | 2,910-6 2,010-5 | -17,9 -77,1 | 5,1 | 237,5 |
| XII | Тв. | 220-250 | 165,8 | 11,97 | 4,610-7 | -27,9 | 4,7 | 308,5 |
| Р-р в ДБФ | 200-240 | 122,7 | 8,63 | 1,210-5 | -91,8 | |||
| XIII | Тв. | 140-155 | 155,5 | 13,32 | 1,410-4 | -2,0 | | 180 |
| Р-р в ДНБ | 200-220 | 125,2 | 10,13 | 2,010-4 | -63,1 | 2,9 | | |
| Р-р в ДБС | 200-230 | 129,4 | 9,88 | 3,910-5 | -67,9 | 0,5 | | |
| Р-р в ДБФ | 200-230 | 143,6 | 11,34 | 3,010-5 | -39,9 | | | |
| Р-р в ДФЭ | 200 | - | - | 2,010-5 | | | | |
| Р-р в ФБ | 210-240 | 172,6 | 14,25 | 1,510-5 | 15,8 | | | |
| XIV | Тв. | 230-270 | 153,0 | 11,53 | 4,310-6 | -36,3 | | 320 |
| XV | Распл. | 140-160 | 152,3 | 15,30 | 3,110-2 | 35,9 | | |
| Р-р в ДНБ | 170-190 | 153,2 | 13,79 | 7,510-4 | 7,0 | | | |
| Р-р в ДБФ | 170-200 | 156,1 | 14,01 | 5,910-4 | 11,2 | | | |
| Р-р в ФБ | 160-180 | 154,7 | 13,98 | 7,910-4 | 10,6 | | | |
| XVI | Р-р в ДБФ | 170-200 | 163,3 | 13,46 | 2,710-5 | 0,7 | | |
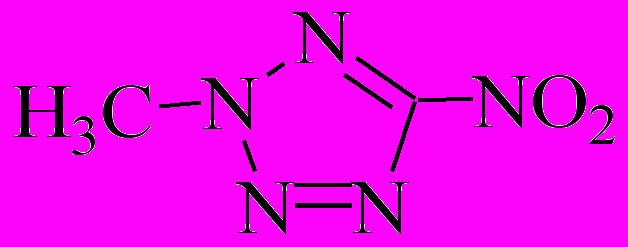 | газ* | 170-200 | 156,8 | 13,03 | 5,210-5 | | | |
* [Kolesov V.I. и др., 2001]
Рентгеноструктурное исследование соединения IX показало, что независимая часть кристаллической ячейки содержит две молекулы одинаковой плоской формы с близкими значениями геометрических параметров (длины связей, валентные углы). Наличие ацетильной группы ослабляет взаимодействие аминного азота в положении 5 с -электронной системой триазольного кольца. Однако это не приводит к удлинению связи C-NO2, а также N-N и C-N связей в цикле. Все это, а также отмеченное выше влияние концентрации вещества в растворе и диэлектрической проницаемости растворителей на реакционную способность указывает на автопротолитический механизм распада нитроазолов. В этих условиях соединения VIII-XII существуют, вероятно, в виде ионных пар и более тяжелых ионных агрегатов, находящихся в равновесии с сольватированными ионами.
Представить себе во всех деталях автопротолитический механизм термораспада в твердом теле нелегко. Однако ясно, что ионизация N-H кислот происходит в жидкости, которая не только образуется в ходе распада, но и присутствует с самого начала разложения, например, соединение XI содержит внутрикристальную влагу [Никитина Е.В. и др., 1982] или исследуемое вещество может захватить растворитель при кристаллизации [Збарский В.Л. и др., 1967]).
При термораспаде соединения VIII выделяется 1,0-1,25 моля газа на моль вещества.
Масс-спектр исходного соединения VIII содержит пики с m/e (Iотн, %): 114 (30) [M]+, 98 (2,3) [M-O]+, 86 (9,0) [M-N2]+, 69 (20) [M-N2-OH]+, 68 (2,3) [M-N2-H2O]+, 55 (2,0) [M-N2-H2NO]+, 53 (3,6)[ M-N2-NO2]+, 46 (1,5) [NO2]+, 45 (3,1) [M-CN=NH]+, 44 (5,5) [N2O]+, 43 (4,3), 42 (0,5) [NCO]+, 41 (16) [HN=CN]+, 40 (11) [CN2]+, 30 (100) [NO]+.
Масс-спектр газообразных продуктов распада для соединения VIII при 195С и глубине превращения 6-8 % (за вычетом масс-спектра исходного VIII) был следующим, m/e (Iотн, %): 52 (25,1) [(CN)2]+, 46 (1,8) [NO2]+, 44 (57) [СO2]+, [N2 O]+, 43 (67,1) [HNCO]+, 42 (7,8) [NCO]+, 30 (100) [NO]+, 28 (50) [N2]+, 27 (10,1) [HCN]+, 26 (1,6) [CN]+, 18 (28) [H2O]+, 17 (56) [OH]+, [NH3]+, 16 (39,5) [NH2]+, 15 (4,5) [NH]+, 14 (1,1) [N]+.
Отметим параллелизм между ионизацией 3-нитро-1,2,4-триазола при электронном ударе и термораспаде, приводящей в обоих случаях к «раскалыванию» триазольного кольца.
ИК-спектры соединения VIII и его конденсированного остатка, образующегося при глубине превращения 96-98 % (200С), обнаруживают их некоторое сходство и различие. Характерной особенностью спектра конденсированного остатка по сравнению с исходным веществом является незначительное уменьшение интенсивности полосы поглощения в области 1560 см-1 (антифазное симметричное колебание C-N в нитрозо- и нитрогруппе), а также исчезновение полос в области 1487 и 1387 см-1. В то же время резко уменьшается интенсивность полосы 1427 см-1 (плоскостное валентное колебание нитрогруппы и фрагмента триазольного кольца). Сохраняются скелетные колебания триазольного кольца 1027, 887, 840 см-1. Предположительно, в конденсированной фазе могут быть олигомеры [-N=C(NO2)-N=N-C(NO2)=N-]n, (1560, 1427, 1360 см-1), [-N=CH-]n (1140, 1100 см-1 (CN), 740 см-1) и 3-нитрозо-1,2,4-триазол (1560, 1520, 1027, 840 см-1).
Образование продуктов распада соединения VIII можно объяснить в рамках механизма основного катализа:
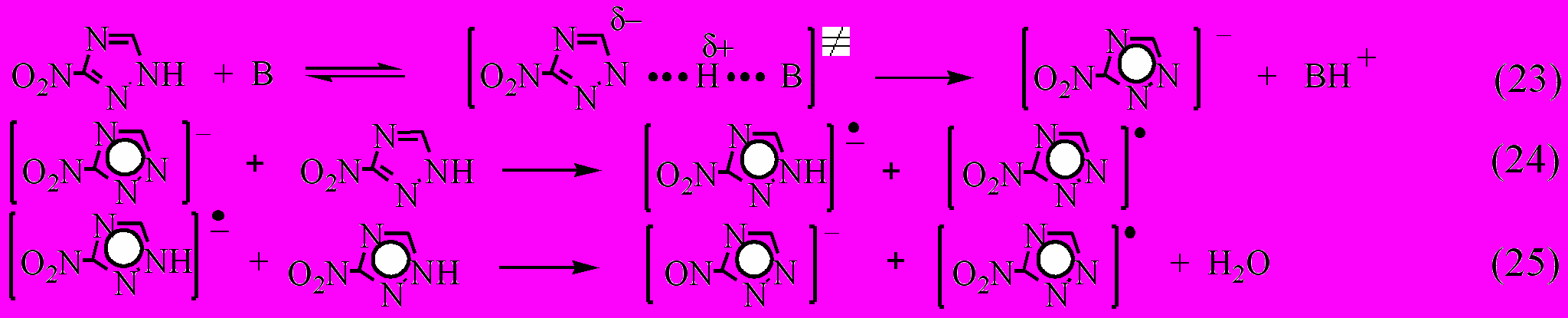
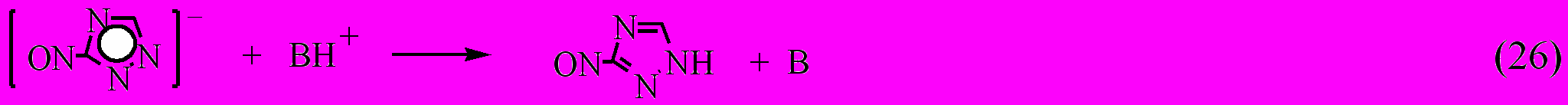
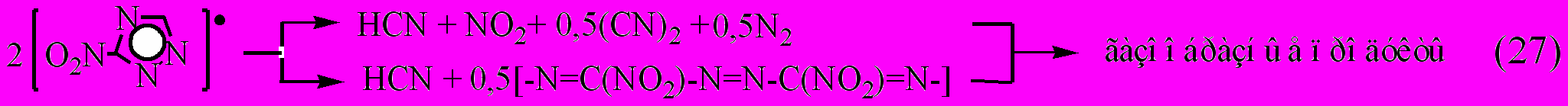
где В – Н2О, 3-NO2-1,2,4-триазол.
В механизме (23-26) катализатор лишь способствует переходу молекулы соединения VIII в реакционноспособную форму аниона нитротриазола, который затем без непосредственного участия катализатора, превращается в соответствующий радикал, приводящий к раскрытию триазольного кольца и окислительно-восстановительным реакциям. Этот механизм реализуется также при термораспаде соединений XI и XII.
Скорость реакции (23) в апротонных растворителях с =(10-30) весьма мала [Денеш И., 1971] и обычно лимитирует процесс в целом [Улашкевич Ю.В. и др., 1977].
Полезную информацию о динамике термораспада соединений VIII, XI, XII и сопровождающих его тепловых эффектов можно получить из данных дифференциально-термического анализа. Термораспад соединений VIII, XI, XII в температурном интервале 20-500С протекает в три стадии, которые для первых двух соединений являются термонейтральными, а для соединения XII первая стадия сопровождается экзотермическим пиком с максимумом при 278С. На первой стадии (до 35 % потери массы) разложение соединения VIII сопровождается плавлением, о чем свидетельствует эндотермический пик на кривой ДТА. Остальные соединения разлагаются без видимого плавления. На втором этапе термораспад образующихся на первой стадии конденсированных продуктов (для соединения VIII – это предполагаемые осколочные олигомеры сим-динитротетразина, триазина и 3-нитрозо-1,2,4-триазола), протекает с небольшим газовыделением до 390-400С. Потеря массы на этой стадии составляет 65-70 % от начальной массы вещества. Полное разложение и испарение жидких и летучих продуктов происходит на третьей стадии. Результаты исследования ДТА согласуются с предложенным механизмом термораспада соединений VIII, XI, XII.
На основании качественного анализа газообразных продуктов распада соединения XIII в твердой фазе при 150С, найденного ИК-спектроскопически при глубине превращения 5-9 % (CH2 O, CNCN, HCN, NO2, NO, N2, CO, CO2, H2O), и ИК-спектров исходного вещества и конденсированного остатка твердофазного распада соединений XIII и XIV предложена схема разложения, в которой термораспад соединений XIII и XIV затрагивает не только фрагмент CH2NO2, но и приводит к разрушению нитротриазольного кольца. Лимитирующей стадией этого процесса является ионизация нитросоединения.
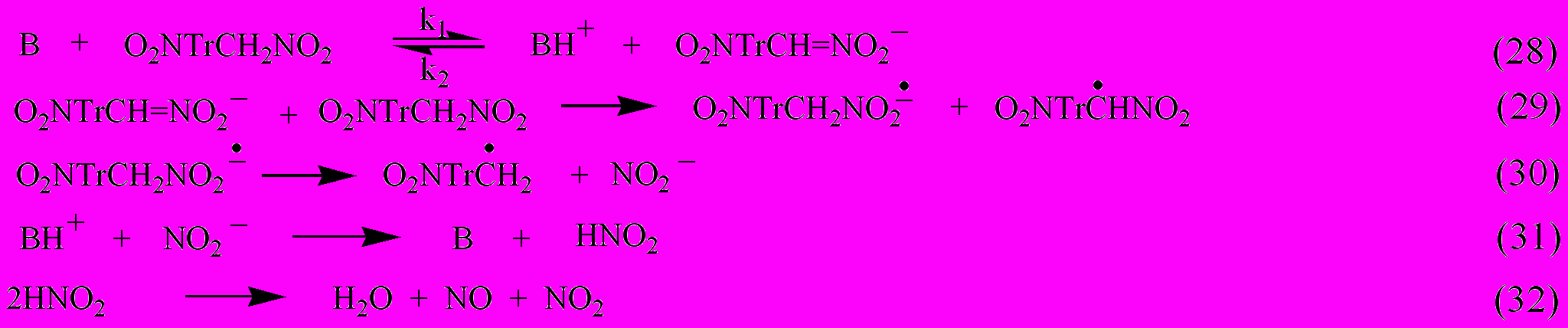
где В – Н2О, O2NTrCH2NO2.
CH2O, (CN)2, HCN, CO, CO2 появляются в результате окислительно-восстановительных реакций.
Термическое разложение соединения XV в расплаве протекает на 1,5 порядка быстрее, чем в растворе (табл.3.2). В то же время скорость распада соединения XV в растворах ДНБ и ФБ и соединения XIII в ФБ не зависит от концентрации и полярности растворителя. Это означает, что, в целом, гомолиз протекает значительно медленнее, чем автопротолиз. Для соединений XIII, XV, в принципе, можно предположить несколько альтернативных путей термораспада: 1) первичный гомолиз связи СгетероциклNO2; 2) первичный гомолиз связи СNO2 в нитрометильном фрагменте; 3) первичный гомолиз связи NгетероциклаСH2NO2.
Полуэмпирическими квантово-химическими методами были рассчитаны параметры оптимальной геометрии молекулы XIII, из которых следует, что наибольшая длина связи CNO2 наблюдается в H2CNO2 фрагменте. Предположительно можно ожидать ее меньшую прочность и большую реакционную способность при распаде по сравнению с другими вариантами гомолитического разрыва связи CN.
Для арилалкилнитросоединений, в которых нитрогруппа находится не в ароматическим кольце, наблюдается симбатность между первичным актом термораспада и основным направлением диссоциативной ионизации при электронном ударе. В обоих случаях первичный акт распада затрагивает наименее прочную связь CNO2. Масс-спектр соединения XIII [m/e (Iотн, %)]: 127 (97,4) [M-NO2]+, 113 (33), 100 (5,7), 86 (7,0), 73 (13,2), 69 (100), 58 (17,3), 53 (12,0), 52 (59,8), 46 (95,3), свидетельствует о том, что электронно-ударная фрагментация соединения протекает с первичным разрывом связи С-NO2 в алкильном фрагменте, о чем можно судить по отсутствию молекулярного иона.
В масс-спектре 3-нитро-1,2,4-триазола (см. выше) присутствует пик с m/e 114 (30) [M]+ и отсутствует значительное количество ионов с m/e 68 (2,3) [M-NO2]+, что подтверждает первичную фрагментацию нитроалкильного фрагмента в молекуле XIII.
Данные рентгеноструктурного анализа соединений XIII и XV свидетельствуют, что в молекулах обоих соединений азольное кольцо и связанная с ним нитрогруппа лежат в одной плоскости, а нитрометильный фрагмент расположен ортогонально к этой плоскости. Длины связей C-N в молекулах XIII, XV сведены в табл.3.3. Из табл.3.3 видно, что для соединений XIII и XV расчетные значения длин связей в молекуле, в основном, завышены по сравнению с экспериментальными. В отличие от последних, полуэмпирические расчеты показывают большую предпочтительность ортогонального расположения нитрогруппы, связанной с триазольным (тетразольным) кольцом, относительно плоскости гетероцикла. На наш взгляд, это расхождение связано не с влиянием кристаллической решетки, а с недооценкой полуэмпирическими методами эффекта сопряжения между азольным кольцом и нитрогруппой.
Таблица 3.3
Длины связей C-N в соединениях XIII и XV
| Связь | Длина связи, Å (в скобках - расчетная) | |
| XIII | XV | |
| Cгетероцикл-NO2 CH2-NO2 N-CH2NO2 | 1,450 (1,482) 1,509 (1,571) 1,426 (1,454) | 1,441 (1,478) 1,503 (1,567) 1,430 (1,465) |
Наиболее длинной связью C-N в обеих молекулах является связь C-NO2 в алкильном фрагменте. Поэтому можно считать, что отрыв группы СН2NO2 не является первичной реакцией при распаде соединений XIII и XV. Полученные структурные и кинетические данные позволяют предположить в качестве лимитирующей стадии для соединения XIII гомолитический разрыв связи C-NO2 в нитроалкильном фрагменте

Появление Н2О при окислении азольного радикала сразу включает автокатализ (уравнение 28). Реакция (33) совпадает с первичным актом фрагментации под действием электронного удара, что находится в полном соответствии с данными о прочности связей в молекуле, полученными рентгеноструктурным анализом и квантово-химическими расчетами.
Относительно соединения XV заметим, что его аномально высокие по сравнению с соединением XIII скорости термораспада не могут быть объяснены в рамках механизма (33). Поэтому можно предположить, как и в случае соединения XVI, что первичным актом термораспада этих соединений является гомолитический разрыв связи N2-N3 в тетразольном кольце по механизму, свойственному 2,5-замещенным тетразолам [Прокудин В.Г., 1996]:
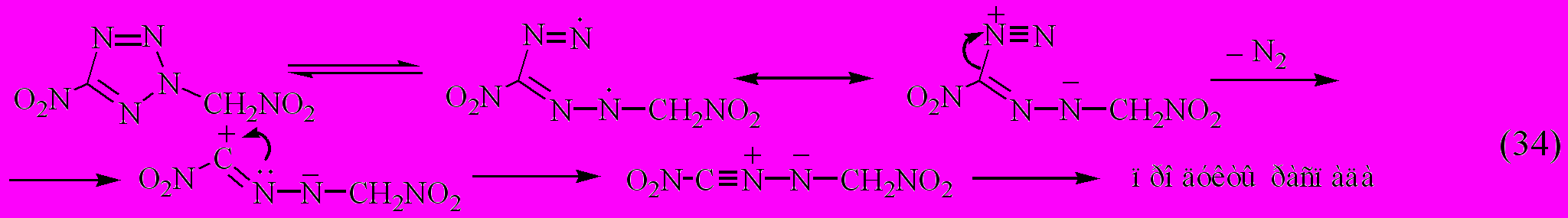
Термическое разложение соединения VII по кинетическим параметрам существенно отличается от соединения VI (табл. 3.2).
Исследованиями разных авторов было показано, что термораспад о-нитротолуолов протекает в жидкой фазе и растворе по окислительно-восстановительному механизму с участием метильной функции и нитрогруппы. Не исключено, что и в нашем случае при термораспаде соединения VII в расплаве и растворе реализуется аналогичный механизм
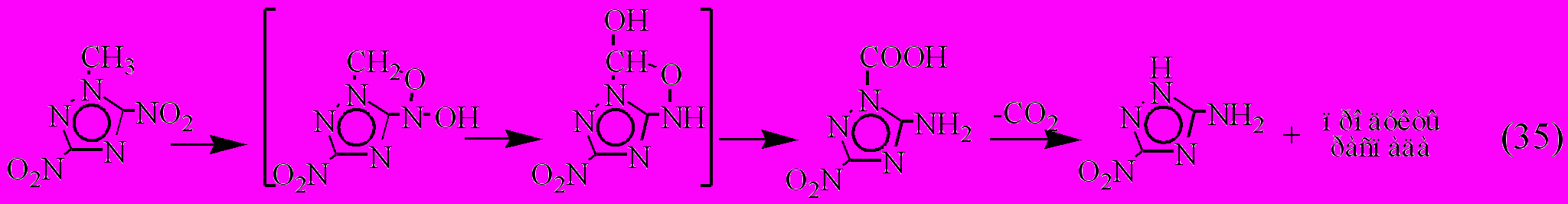
В механизме (35), как и в случае о-нитротолуолов, лимитирующей стадией процесса является внутримолекулярный и межмолекулярный перенос протона метильной группы на атом кислорода соседней нитрогруппы. Здесь, так же как и для изученных выше соединений VIII, XI, XIII, наблюдается уменьшение скорости термораспада с уменьшением его концентрации в растворе вследствие подавления межмолекулярных взаимодействий между CH3 и NO2 группами. Аналогичная зависимость была ранее найдена для тринитротолуола, тринитроксилола и тринитромезитилена [Максимов и др., 1974]. В целом, скорость распада соединения VII в растворе меньше примерно на порядок по сравнению с расплавом, что хорошо согласуется с литературными данными по термораспаду о-нитротолуолов. Наблюдается также близость в активационных параметрах термораспада соединения VII и о-нитротолуолов, что указывает на единство механизмов их термораспада.
Основными газообразными продуктами термораспада соединения VII, найденными хроматографическим методом при 200С на глубине превращения 8-10 %, являются N2 (17,8), NO (6,8), CO (7,8), CO2 (12,9) (в скобках – объемные доли, в %). Эти данные близки к таковым для ТНТ [Максимов и др., 1974].
Масс-спектр конденсированного остатка, образующегося на глубине превращения 93-95 % при термораспаде соединения VII, является достаточно сложным из-за фрагментации под действием электронного удара исходного соединения (m/e=173, M+), тем не менее, он свидетельствует о наличии 3-нитро-5-амино-1,2,4-триазола (m/e=129, M+), O2N-C=N-N+ (m/e=86), C2N2O+ (m/e=68), CN2O+ (m/e=56), NH2C=N+ (m/e=42).
Резюмируя вышеизложенное, можно констатировать, что при термораспаде соединения VII реализуется автопротолитический механизм. Лимитирующей стадией этого процесса, как и в соединениях XIII-XIV, является ионизация связи С-Н метильной группы и перенос протона на соседнюю нитрогруппу.
3.3 Геминальные динитросоединения на базе азолов, 1,3-диоксанов и алкилнитраминов
В последнее время достигнуты значительные успехи в изучении термораспада гем-динитроалканов. Однако несмотря на энергетическую привлекательность гем-динитроазолов их термораспад практически не исследовался. Нами изучен термораспад в конденсированном состоянии гем-динитроазолов следующего строения:
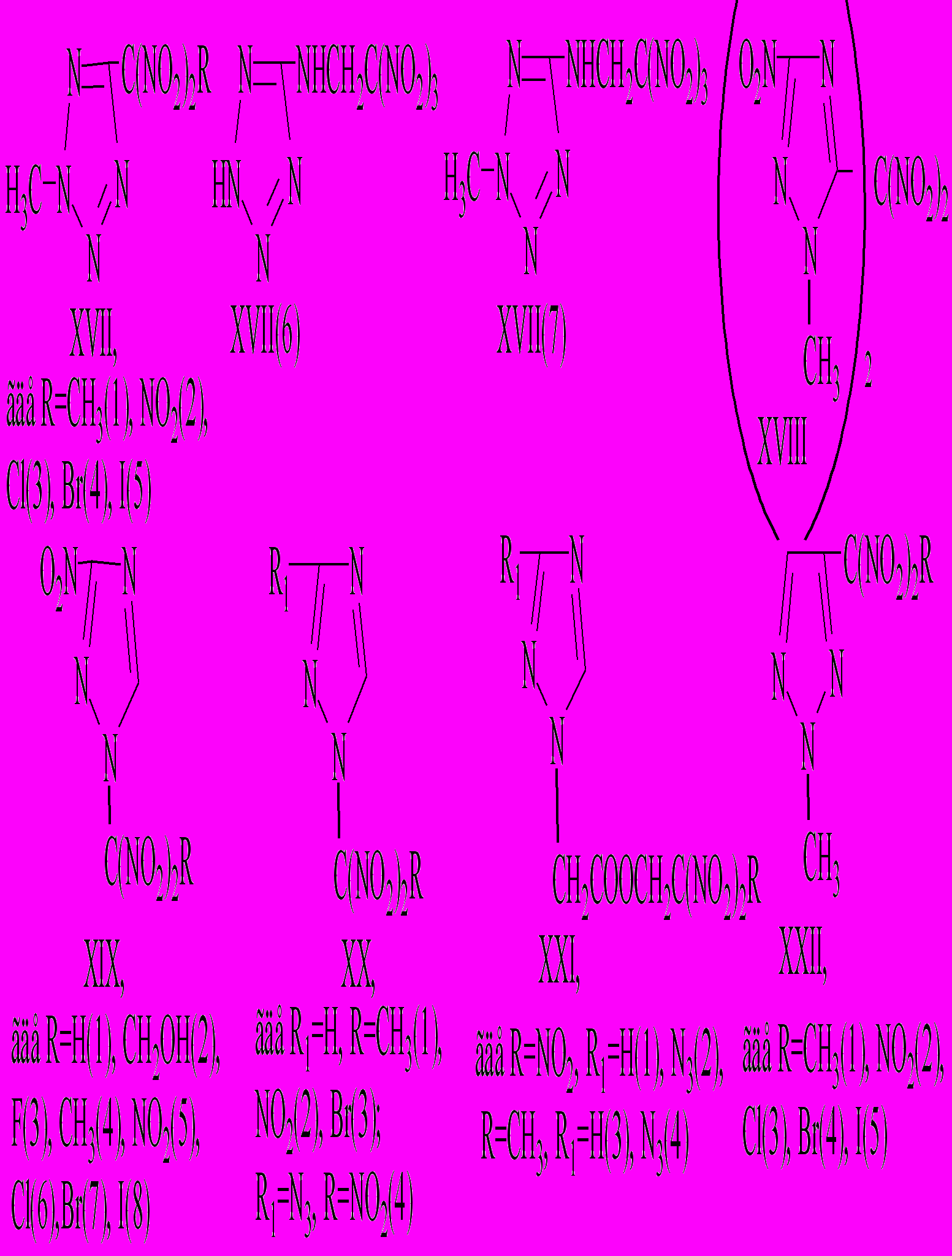
В расплаве и растворе термораспад большинства гем-динитроазолов до выделения газов в количестве 45-55 % от общего газообразования описывается уравнением реакции первого порядка. На скорость распада в расплаве не влияет отношение m/V (3,110-4-1,710-2 г/см3), а также отношение S/V (2,7-4,1 см-1). Все это свидетельствует, что реакция в расплаве не осложняется гетерогенными процессами на стенках реакционного сосуда и протекает гомогенно. Концентрация вещества в растворе (1-5 %) практически не влияет на константу скорости распада. Основными газообразными продуктами распада являются NO2, NO, N2O, N2, CO, CO2. Величины активационных параметров для соединений XVII- XXII приведены в табл. 3.4.
Из табл. 3.4 видно, что активационные параметры для ряда соединений в расплаве, найденные двумя независимыми методами (по общему газовыделению и накоплению NO2), удовлетворительно согласуются. Это позволяет считать, что распад соединений XVII.1-5 протекает гомолитически с первичным разрывом связи C-NO2 в замещенном динитрометильном фрагменте. Другой путь распада соединений XVII.1-XVII.5, характерный для 2,5-замещенных тетразолов [см. механизм (41)], не реализуется из-за большей устойчивости тетразольного цикла в температурных условиях эксперимента.
Анализируя влияние заместителей на скорость распада, можно заметить, что наличие объемных заместителей (Cl, Br, I) в динитрометильной функции приводит к закономерному изменению скорости и энергии активации (уравнения 36-45).
lg k100С = (3,2690,461)V (5,5930,285); r=0,971; Sy=0,195; n=4 (XVII.2-5) (36)
Ea = (21,191,69)V + (146,522,73); r=0,977; Sy=1,12; n=4 (XVII.2-5) (37)
lg k100С = - (0,704±0,040)Es - (5,722±0,122); r=0,999;Sy=0,262;n=5 (XVII.1-5) (38)
Ea = (5,50±0,35)Es + (150,26±0,95); r=0,996; Sy=2,07; n=5 (XVII.1-5) (39)
lg k100C = (0,8060,021)Es (6,7020,115); r=0,999; Sy=0,263; n=6 (XIX.3-XIX.8) (40)
Ea = (6,61 ±0,46)Es + (154,99 ±2,59); r=0,988; Sy=5,98; n=6 (XIX.3-XIX.8) (41)
lg k100C = (0,782±0,009)Es (4,983±0,025); r=0,999; Sy=0,530; n=5 (XXII.1-XXII.5)(42)
Ea = (6,67±0,17)Es - (140,75±0,49); r=0,999; Sy=1,04; n=5 (XXII.1-XXII.5) (43)
Таблица 3.4
Кинетические, термодинамические параметры термораспада азолов XVII-XXII и стерические константы заместителей
| Шифр | Условия распада | ΔТ, С | Еа, кДж/моль | lg A | k100С 105, с-1 | S100C, Дж_ мольК | V | ES | Es |
| XVII.1 | р-р в ДБФ | 130-160 | 150,7 | 15,38 | 0,19 | 39,4 | 0,52 | 0 | |
| XVII.2 | расплав расплав(ФЭК)* р-р в ДБФ | 90-125 90-120 90-130 | 135,2 133,1 137,6 | 14,80 14,62 15,07 | 7,45 9,66 6,40 | 28,3 24,9 33,4 | 0,45 | -2,14 | |
| XVII.3 | р-р в ДБФ | 70-110 | 134,3 | 15,06 | 18,0 | 33,2 | 0,55 | -2,81 | |
| XVII.4 | р-р в ДБФ | 70-110 | 132,2 | 15,19 | 47,8 | 35,7 | 0,65 | -3,44 | |
| XVII.5 | р-р в ДБФ | 70-110 | 130,5 | 15,14 | 73,4 | 34,8 | 0,78 | -3,62 | |
| XVII.6 | р-р в НБ р-р в ДБФ | 60-80 80-100 | 106,7 109,3 | 12,12 11,47 | 151,3 14,7 | -23,1 -35,5 | | | |
| XVII.7 | р-р в НБ р-р в ДБФ | 60-80 80-100 | 112,6 114,4 | 12,75 12,01 | 96,35 9,81 | -11,0 -25,2 | | | |
| XVIII | р-р в ДБФ | 90-130 | 143,6 | 16,45 | 22,04 | 59,9 | | | -7,50 |
| XIX.1 | р-р в ДБФ тв | 100-130 80-95 | 74,9 177,3 | 5,81 21,43 | 2,10 40,20 | -143,9 155,3 | | | |
| XIX.2 | р-р в ДБФ тв | 130-170 105-120 | 84,9 209,7 | 7, 01 23,58 | 1,33 0,17 | -120,9 196,5 | | | |
| XIX.3 | расплав р-р в ДНБ | 150-195 160-200 | 166,6 164,5 | 15,05 14,75 | 5,2810-4 5,2110-4 | 33,1 27,3 | | | -1,94 |
| XIX.4 | расплав р-р в ДБФ | 140-180 140-180 | 152,4 155,9 | 14,77 15,11 | 2,6910-2 1,9110-2 | 36,1 27,7 | | | -3,50 |
| XIX.5 | расплав р-р в ДБФ | 105-125 100-140 | 146,5 143,4 | 15,50 15,14 | 0,97 1,15 | 41,7 34,8 | | | -5,64 |
| XIX.6 | расплав р-р в ДБФ | 125-80 110-150 | 134,3 132,6 | 14,51 14,16 | 5,07 3,92 | 22,7 16,0 | | | -6,31 |
| XIX.7 | р-р в ДБФ тв | 110-150 105-120 | 133,4 185,0 | 14,65 20,20 | 9,36 0,20 | 25,4 131,7 | | | -6,94 |
| XIX.8 | р-р в ДБФ | 100-140 | 131,1 | 14,62 | 18, 34 | 24,8 | | | -7,12 |
| XX.1 | расплав р-р в ДБФ | 140-180 140-180 | 154,8 153,9 | 15,07 14,84 | 2,4810-2 1,9610-2 | 33,4 29,0 | | | -3,50 |
| XX.2 | расплав распл ФЭК р-р в ДБФ | 120-140 110-150 90-150 | 137,3 139,8 135,7 | 14,39 14,71 14,12 | 1,48 1,37 1,31 | 20,4 26,6 15,2 | | | -5,64 |
| XX.3 | р-р в ДБФ | 110-140 | 131,2 | 14,35 | 9,53 | 19,7 | | | -6,94 |
| XX.4 | р-р в ДБФ | 100-150 | 140,6 | 14,76 | 1,18 | 27,5 | | | -5,64 |
| XXI.1 | р-р в ДБФ | 150-180 | 165,1 | 15,35 | 1,7110-3 | 38,8 | | | -2,15 |
| XXI.2 | р-р в ДБФ | 150-180 | 159,9 | 15,37 | 9,60×10-3 | 39,2 | | | -2,15 |
| XXI.3 | р-р в ДБФ | 180-220 | 178,7 | 15,47 | 2,81×10-5 | 41,1 | | | -0,01 |
| XXI.4 | р-р в ДБФ | 150-180 | 161,2 | 15,62 | 1,10×10-2 | 44,0 | | | -0,01 |
| XXII.1 | р-р в ДБФ расплав | 120-155 135-155 | 140,8 143,4 | 14,74 15,19 | 1,06 1,29 | 38,0 46,7 | | | -5,26 |
| XXII.2 | р-р в ДБФ расплав | 70-120 80-115 | 126,0 128,5 | 14,32 14,92 | 47,60 68,04 | 30,0 41,5 | | | -7,4 |
| XXII.3 | р-р в ДБФ расплав | 70-110 80-110 | 122,5 123,7 | 14,36 14,61 | 161,6 194,8 | 30,8 35,6 | | | -8,07 |
| XXII.4 | р-р в ДБФ | 70 - 105 | 118,3 | 14,24 | 473,9 | 17,5 | | | -8,70 |
| XXII.5 | р-р в ДБФ | 70 - 100 | 116,0 | 14,13 | 772,3 | 15,4 | | | -8,88 |
lg k100C = - (0,776±0,027) Es - (9,291±0,144) (44)
r=0,990; Sy=1,281; n=24 (XVII.1-5, XVIII, XIX.3-8, XX.1-4, XXI.1-3, XXII.1-5)
Ea = (6,38±0,36) Es + (177,04±2,19) (45)
r=0,966; Sy=4,93; n=24 (XVII.1-5, XVIII, XIX.3-8, XX.1-4, XXI.1-3, XXII.1-5)
Для соединений XVII.1-XVII.5 при гомолитическом распаде полуэмпирическими квантово-химическими методами MNDO, AM1 и PM3 была рассчитана оптимальная геометрия молекул XVII.1-XVII.5. Сопоставление скорости распада соединений XVII.1-XVII.5 с расчетными длинами связи C-NO2 показало, что последняя изменяется незначительно, а кроме этого, отсутствует зависимость между скоростью распада и длиной связи C-NO2.
Кинетическое поведение соединений XVII.6, XVII.7 в реакции термораспада сильно отличается от соединений XVII.1-XVII.5. Они имеют неподеленную электронную пару на аминном азоте и относятся к основаниям Манниха. Разложение в разбавленных растворах НБ и ДБФ идет с выраженным ускорением, носит сложный характер, сопровождается образованием реакционноспособных промежуточных продуктов, обуславливающих протекание вторичных окислительно-восстановительных реакций. Лимитирующей стадией процесса по аналогии с -полинитроариламинами и амидами является гетеролитический разрыв С-С связи с образованием карбоний-иммониевого катиона и аниона полинитросоединения [Гидаспов Б.В. и др., 1972]. Качественный состав газообразных продуктов распада соединений XVII.6 и XVII.7: NO2, NO, N2O, N2, CO, CO2, H2O, CH2O, из конденсированного остатка хроматографически выделен 5-нитриминотетразол (Тпл=132С). С учетом этого можно записать предположительную схему распада, объясняющую качественный состав продуктов реакции:
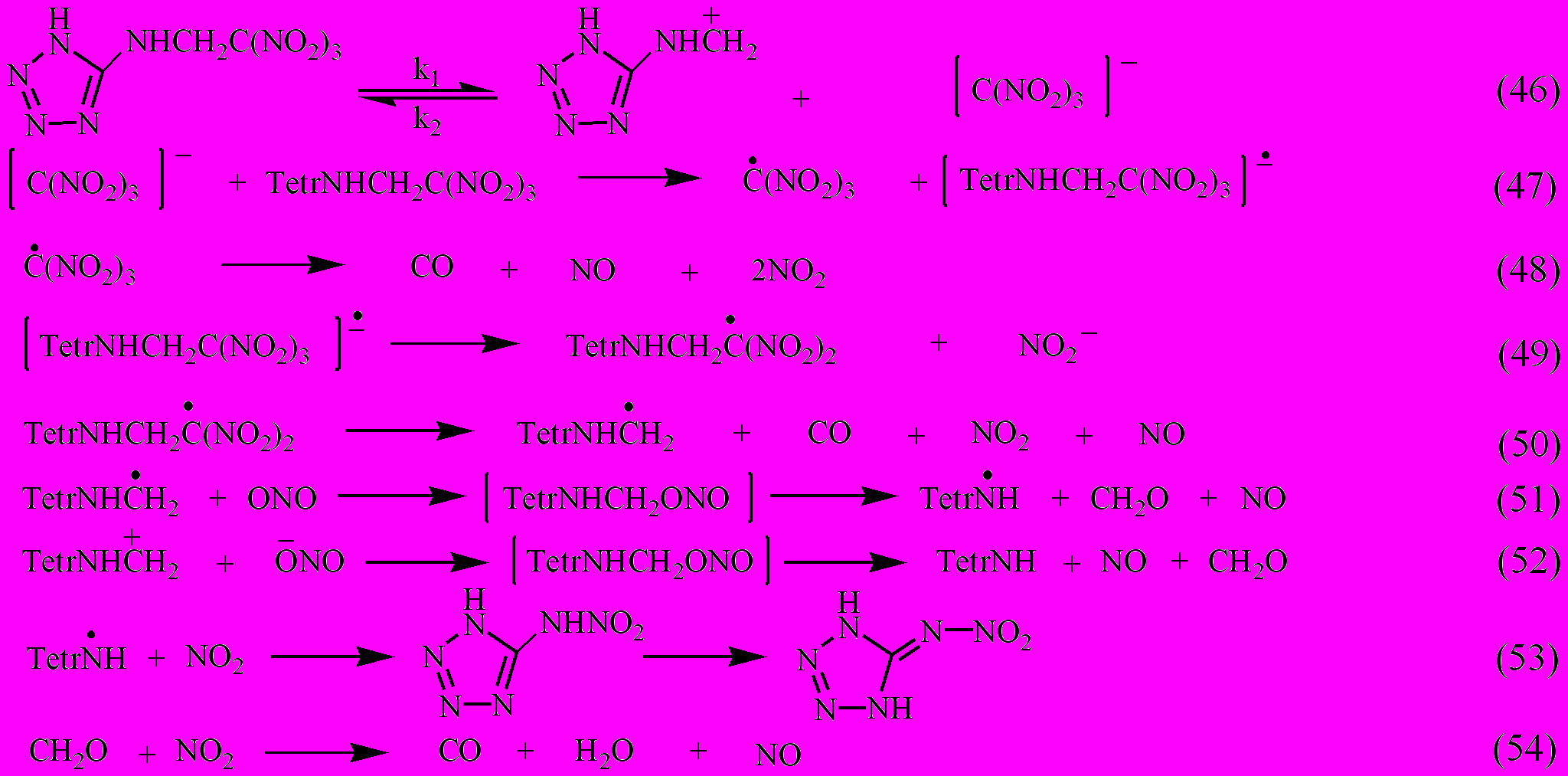
Термическая стабильность 5-нитриминотетразола несколько больше, чем исходного соединения, поэтому его разложение начинается позже, т.е. разделено во времени, вследствие этого наблюдается эффект монотонного газовыделения N2, N2O и CO2 в конце превращения исходного вещества.
При полном разложении одного моля соединения XVIII (табл. 3.4) образуется примерно два моля газообразных продуктов и конденсированное вещество белого цвета. Основными газообразными продуктами являются окись и двуокись азота, причем их содержание на разных глубинах превращения (5-10 %) в количественном отношении к исследуемому XVIII остается практически эквимольным. Конденсированное вещество оказалось бис(1-метил-3-нитро-1,2,4-триазол-5-ил)кетоном (Тпл 150-152С), структура которого была подтверждена элементным анализом, встречным синтезом и ИК-спектрами, содержащими полосу поглощения 1665 см-1, а также оксимированием кетогруппы и последующей идентификацией образовавшегося оксима. По аналогии с распадом 2,2-динитропропана [Flournoy J.M., 1962] можно предположить гомолитический механизм термораспада соединения XVIII и других гем-динитропроизводных триазолов в жидкой фазе, где проявляется клеточный эффект
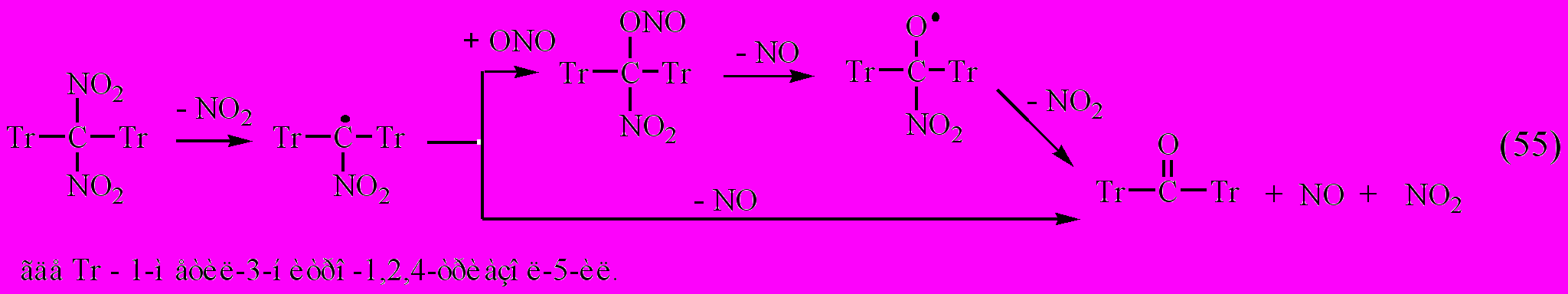
В ряду соединений XIX.3-XIX.8 (табл. 3.4) константа скорости в растворе увеличивается в 3104 раз. Это увеличение происходит, в основном, за счет уменьшения энергии активации на 30 кДж/моль. В соединениях XX.2 и XX.4 природа заместителя в цикле практически не влияет на скорость термораспада, чего нельзя сказать о соединениях XXI.2 и XXI.3; в первом реакционный центр смещен на азидогруппу, а в соединениях XXI.1 и XXI.2 он находится на углероде тринитрометильной группы. Термораспад соединений XIX.1, XIX.2 осложняется ионизацией и протекает по основному каталитическому механизму [гл. 3.2, уравнение (28)].
Дифференциальным термическим анализом (ДТА) найдено, что термораспад соединения XIX.1 начинается при температуре 78С, задолго до плавления (Тпл=115-116С), протекает с большим экзоэффектом (аналогия со вспышкой), что в итоге приводит к вырождению эндотермического пика. Это объясняет большую по сравнению с раствором константу скорости термораспада в твердом состоянии.
Нами установлена единая корреляционная зависимость для всех изученных динитрометильных производных азолов общей формулы R1C(NO2)2R2 между суммой стерических констант заместителей Es и константой скорости (энергией активации) термораспада (уравнения 44-45). Из зависимостей (44), (45) выпадает точка для соединения XXI.4, что свидетельствует о предпочтительном распаде азидогруппы в триазольном цикле.
Резюмируя, отметим, что на термостабильность гем-динитрогруппы, введенной в базовый азольный гетероцикл (общей формулы R1AzC(NO2)2R), влияет не только природа заместителя R1, но и объем заместителя R, а также объем гетероцикла, что необходимо учитывать при конструировании подобных структур.
Термораспад соединений в жидкой фазе 2-замещенных 5,5-динитро-1,3-диоксанов общей формулы,
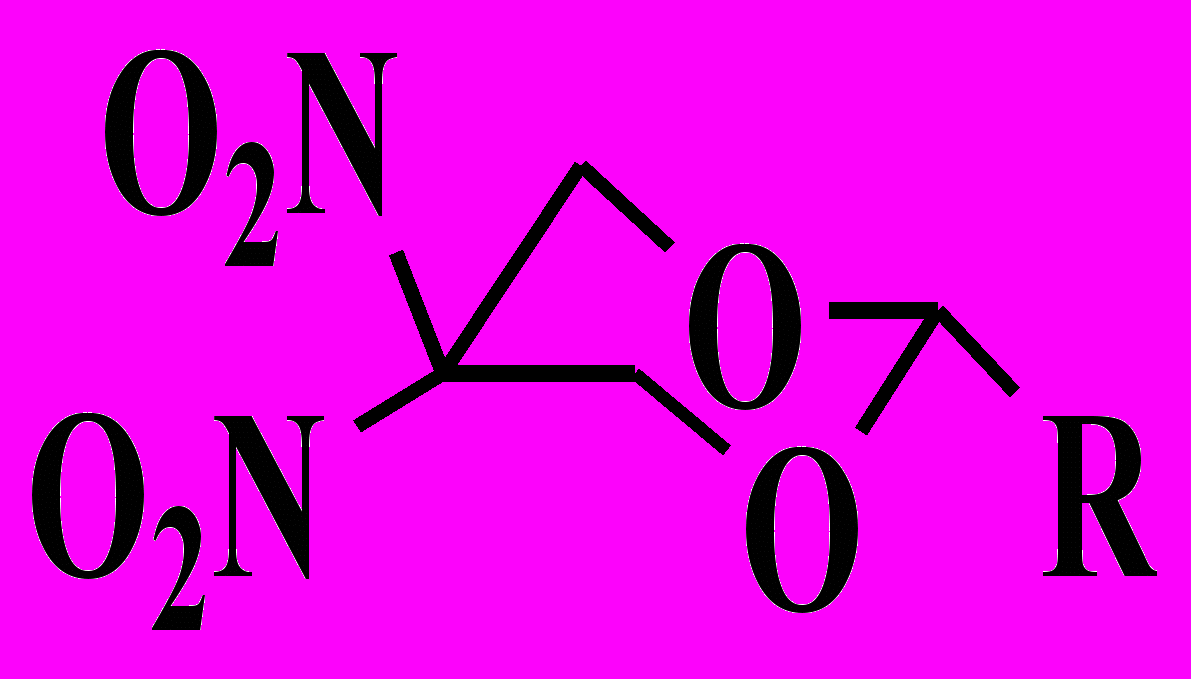 (XXIII), где R = H (1), CH3 (2), C6H5 (3), p-O2N-C6H4 (4),
(XXIII), где R = H (1), CH3 (2), C6H5 (3), p-O2N-C6H4 (4),  (5), CH2CH2N(NO2)CH3 (6), CH2CH2C(NO2)2CH3 (7) в расплаве протекает с ускорением и характеризуется S-образными кинетическими кривыми. Начальная скорость распада соединений XXIII.1–XXIII.3 не изменяется с изменением m/V и S/V. Ускорение распада замещенных 5,5-динитро-1,3-диоксанов XXIII является результатом взаимодействия образующегося в ходе распада диоксида азота с исходным соединением. Разложение динитродиоксанов в разбавленных (2–5 масс.%) растворах ДБФ и ДНБ, где исходные молекулы изолированы друг от друга и продуктов распада, а растворимость диоксида азота при 190–210C мала, описывается уравнением реакции первого порядка. На скорость распада не влияют концентрация вещества в растворе (2–8 масс.%) и диэлектрическая проницаемость растворителя, что хорошо согласуется с первичным гомолизом связи C-NO2 в цикле. В пользу этого свидетельствует также анализ продуктов распада. Активационные параметры представлены в табл. 3.5.
(5), CH2CH2N(NO2)CH3 (6), CH2CH2C(NO2)2CH3 (7) в расплаве протекает с ускорением и характеризуется S-образными кинетическими кривыми. Начальная скорость распада соединений XXIII.1–XXIII.3 не изменяется с изменением m/V и S/V. Ускорение распада замещенных 5,5-динитро-1,3-диоксанов XXIII является результатом взаимодействия образующегося в ходе распада диоксида азота с исходным соединением. Разложение динитродиоксанов в разбавленных (2–5 масс.%) растворах ДБФ и ДНБ, где исходные молекулы изолированы друг от друга и продуктов распада, а растворимость диоксида азота при 190–210C мала, описывается уравнением реакции первого порядка. На скорость распада не влияют концентрация вещества в растворе (2–8 масс.%) и диэлектрическая проницаемость растворителя, что хорошо согласуется с первичным гомолизом связи C-NO2 в цикле. В пользу этого свидетельствует также анализ продуктов распада. Активационные параметры представлены в табл. 3.5. 