Структурно-кинетические закономерности и механизм термораспада полифункциональных нитро- и азидосоединений 02. 00. 04 физическая химия
| Вид материала | Закон |
- Синтез и исследование полифункциональных люминофоров на основе алюминатов стронция, 307.95kb.
- Рабочая программа дисциплины (модуля) «математический анализ», 424.74kb.
- Рабочая программа дисциплины (модуля) «Уравнения математической физики», 266.58kb.
- Рабочая программа дисциплины «физическая химия», 80.79kb.
- Рабочая программа дисциплины (модуля) «Линейная алгебра и аналитическая геометрия», 275.82kb.
- Программа дисциплины дпп. Ф. 05 Физическая химия, 267.17kb.
- «Кинетика и механизм реакции поликонденсации аминокислот» 02. 00. 04 физическая химия, 332.67kb.
- И в свет разрешаю на основании "Единых правил", п 14 Заместитель первого проректора-, 350.14kb.
- Физико-химические закономерности удерживания производных адамантана в высокоэффективной, 432.05kb.
- Физико-химические закономерности формирования и деградации органосиликатных покрытий, 977.75kb.
Методика эксперимента
Исследуемые соединения были синтезированы известными методами, некоторые впервые, очищены подходящими способами и были хроматографически чистыми. Вещества, используемые в качестве растворителей – дибутилфталат (ДБФ), дибутилсебацинат (ДБС), нитробензол (НБ), м-динитробензол (ДНБ), 1,3,5-тринитробензол (ТНБ), 2,4,6-тринитротолуол (ТНТ), дифенил (ДФ), дифениловый эфир (ДФЭ) и фенилбензоат (ФБ) – также подвергались предварительной очистке.
Кинетику термического разложения в изотермических условиях исследовали манометрическим методом с использованием стеклянных мембранных манометров типа Бурдона при остаточном давлении воздуха в реакционном сосуде 10-1-10-2 мм рт. ст. Температура в термостате поддерживалась с точностью ± 0,2С. Кинетику образования азота в ходе распада изучали волюмометрически, а диоксида азота - ампульным методом фотоэлектроколориметрически. Термораспад в неизотермических условиях осуществляли на дериватографе Q-1500 системы Паулик-Паулик-Эрдей. Навески образцов составляли от 20 до 100 мг, скорость нагревания 1,25, 2,5 и 5 град/мин, температура изменялась от комнатной до 250 или 500С.
Анализ газообразных продуктов разложения проводили на хроматографе ЛХМ-80, ИК-спектрометре Specord 75 IR, масс-спектрометре МХ-1303, а конденсированные - на эффузио-хромато-масс-спектрометре МХ-1312, ИК-спектрометре Specord 75 IR и масс-спектрометре МИ-12-01-Т. В необходимых случаях использовали ПМР-спектроскопию.
Погрешность при расчете констант скорости по уравнению реакции первого порядка составляла 5-7 %, а при определении их из начальных скоростей распада – 10-12 %. Для энергии активации среднеквадратичная ошибка не превышала 6,2 кДж/моль, а логарифма предэкспоненциального множителя 0,6 лог.ед.
Во введении обоснована актуальность темы, сформулированы цель и задачи исследования, отмечена практическая значимость полученных результатов, дана методологическая основа анализа реакционной способности полифункциональных нитро- и азидосоединений в реакции термораспада.
1 ТЕРМИЧЕСКОЕ РАЗЛОЖЕНИЕ ВТОРИЧНЫХ НИТРАМИНОВ
До начала нашей работы данные по кинетике термораспада полифункциональных алкилнитраминов в расплаве в литературе были ограничены. В этой связи мы исследовали кинетику термического разложения нитраминов общей формулы R1N(NO2)R2 (I), где R1=C6H2(NO2)3, R2=(CH2)2COOH (I.1); R1=C6H2(NO2)3, R2=(CH2)2COOCH3 (I.2); R1=R2=(CH2)2COOH (I.3); R1=R2=(CH2)2COOCH3 (I.4); R1=(CH2)2N(NO2)CH2COOH, R2=(CH2)2COOH (I.5); R1=(CH2)2N(NO2)CH2COOCH3, R2=(CH2)2COOCH3 (I.6); R1=R2=(CH2)2CN (I.7); R1=C6H2(NO2)3СH2CH2, R2=CH3 (I.8); R1=CH3N(NO2)CH2, R2=CH3 (I.9); R1=CH3N(NO2)CH2CH2, R2=CH3 (I.10); R1=R2=CH3N(NO2)CH2 (I.11), а также (RCH2)2NNO2 (II), где R = 3-NO2-Tr-1 (II.1), 5-(CH2)2OH-Tetr-2 (II.2), 3-NO2-Tr-1-CH2- (II.3), 5-(CH2)2OH-Tetr-2-CH2- (II.4), 5-CH3-Tetr-2-CH2- (II.5) (Tr –1,2,4-триазол-1-ил; Tetr – 1,2,3,4-тетразол-2-ил). При этом особое внимание было уделено структурно-кинетическим закономерностям и механизму термораспада нитраминов с карбоксильными функциями.
В зависимости от структуры нитраминов I, II их распад в расплаве протекает либо по закону первого порядка, либо с небольшим ускорением. На скорость распада нитраминов, за исключением соединения I.7, не влияет m/V (степень заполнения сосуда веществом) и S/V (отношение поверхности реакционного сосуда к его объему), что свидетельствует об отсутствии гетерогенных и цепных процессов.
В продуктах распада соединения I.3 были зафиксированы пики с m/e 73, 72, 71, 55, 44, 26 (CH2 =CHCOOH), 46 (NO2), 44 (N2O+CO2), 29 и 15 (CH2=NH), 28 (N2, CO), 18 и 17 (H2O). В конденсированном остатке – темно-коричневая смола, предположительно,

В растворе ДБФ ускорение распада наблюдается только для соединений I.3 и I.5, а разложение всех остальных нитраминов описывается уравнением реакции первого порядка.
Активационные параметры термораспада соединений I и II представлены в табл. 1.1.
Таблица 1.1
Кинетические и термодинамические параметры термического разложения
вторичных нитраминов I и II
| Шифр | Условия распада | Интервал, температур,С | Еа, кДж/моль | lg A | k200C105, с-1 | S200C, Дж/мольК |
| I.1 | расплав | 140-160 | 138,6 | 13,96 | 4531 | 10,2 |
| I.2 | расплав | 140-160 | 137,3 | 13,31 | 1412 | -2,3 |
| I.3 | расплав расплав по NO2 раствор в ДБФ* | 200-230 200-230 200-240 | 167,9 168,7 170,8 | 13,76 13,89 14,07 | 1,66 1,87 1,62 | 6,3 8,8 12,3 |
| I.4 | расплав расплав по NO2 раствор в ДБФ* | 200-230 200-230 210-250 | 172,9 169,6 170,4 | 14,02 13,70 13,70 | 0,85 0,94 0,77 | 11,3 5,2 5,2 |
| I.5 | расплав раствор в ДБФ | 220-235 210-240 | 167,1 170,4 | 13,88 14,23 | 2,69 2,60 | 8,6 15,3 |
| I.6 | расплав раствор в ДБФ | 220-240 210-240 | 171,2 167,9 | 13,84 13,46 | 0,86 0,83 | 12,1 4,2 |
| I.7 | расплав расплав по NO2 раствор в ДБФ* | 200-250 200-230 210-250 | 169,6 170,8 172,9 | 13,75 13,95 13,92 | 1,10 1,23 0,67 | 6,2 10,0 9,5 |
| I.8 | раствор в ДБФ | 200-230 | 167,0 | 13,50 | 1,15 | 1,4 |
| I.9 | расплав раствор в ДБФ | 180-230 180-230 | 169,6 176,0 | 13,48 14,08 | 0,57 0,44 | 1,0 12,5 |
| I.10 | раствор в ДБФ | 210-240 | 173,8 | 14,19 | 1,00 | 14,6 |
| I.11 | расплав раствор в ДБФ | 180-230 180-230 | 178,4 171,9 | 14,95 14,20 | 1,79 1,66 | 29,1 14,8 |
| II.1 | раствор в ДБФ | 160-200 | 158,3 | 14,20 | 52,61 | 14, 8 |
| II.2 | раствор в ДБФ | 160-200 | 160,4 | 14,52 | 64,44 | 20,9 |
| II.3 | раствор в ДБФ | 210-240 | 171,9 | 13,85 | 0,74 | 8,1 |
| II.4 | расплав раствор в ДБФ | 210-250 220-250 | 174,3 169,6 | 14,12 13,54 | 0,75 0,65 | 13,2 2,1 |
| II.5 | расплав раствор в ДБФ | 210-250 220-250 | 176,3 174,6 | 14,68 14,42 | 1,64 1,38 | 24,0 18,0 |
*[Степанов Р.С. и др., 1977]
Наблюдаемые активационные параметры логично объясняются в рамках гомолитического механизма распада с первичным разрывом связи N-NO2. Пикрильный и азольные заместители в - и -положениях проявляют стерический эффект, увеличивая константу скорости на 2-3 порядка.
Константы скорости распада нитраминокислот (соединения I.1, I.3, I.5) в расплаве и растворе практически одинаковы и в 2-3 раза больше, чем у соответствующих им сложных эфиров метилового спирта (соединения I.1, I.4, I.6). Близость констант в расплаве и растворе обусловлена, вероятно, внутримолекулярной ассоциацией в клетке. С учетом этого лимитирующую стадию можно представить
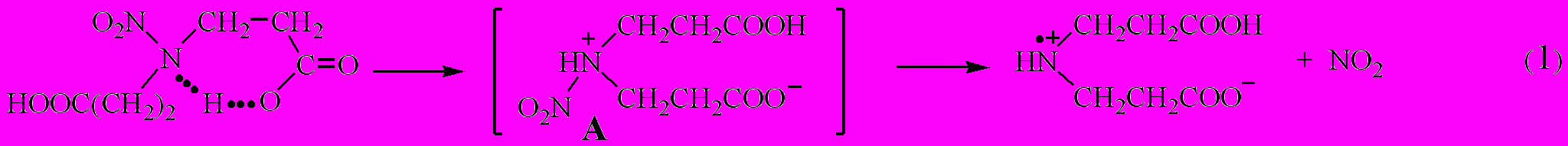
Прямым подтверждением механизма (1) является образование диоксида азота и совпадение активационных параметров для соединения I.3 по накоплению основного продукта реакции - диоксида азота и общему газообразованию (табл. 1.1).
С позиций механизма (1) логично объясняется появление экспериментально найденных продуктов в ходе распада соединения I.3:
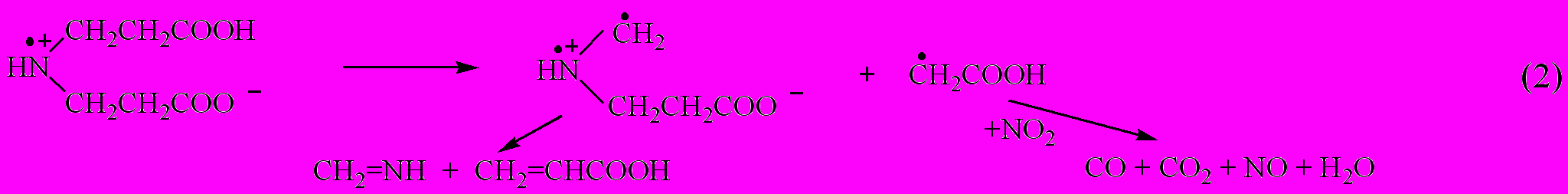
Другой путь распада промежуточного продукта А можно записать
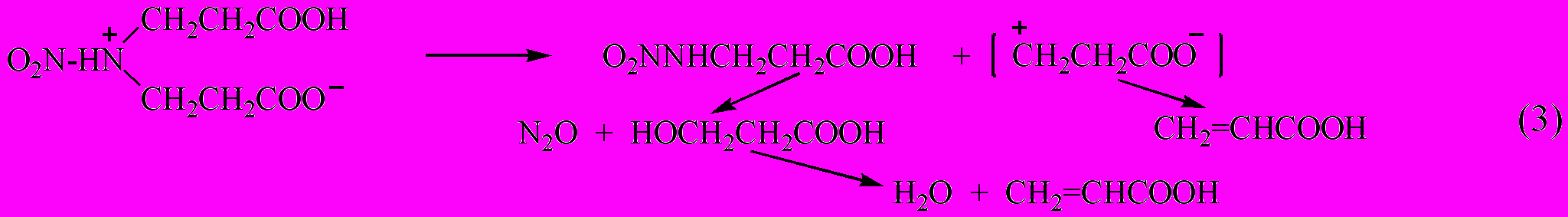
Таким образом, увеличение скорости распада нитраминокислот по сравнению с их сложными эфирами объясняется большей реакционной способностью протонированной нитраминной функции в термической реакции ион-радикального разрыва связи NNO2.
В соединениях II в качестве альтернативы распаду по связи N-NO2 можно предположить разрыв C-NO2 связи в кольце или связи N-N в гетероцикле. Хроматографический анализ продуктов разложения нитраминов II.1-II.5 не позволяет определить лимитирующую стадию, поскольку из-за быстропротекающих вторичных окислительно-восстановительных реакций конечный состав продуктов будет одинаковым в обоих случаях. Нами было показано, что термическое разложение 1-этил-3-нитро-1,2,4-триазола протекает гомолитически с первичным разрывом связи C-NO2 (Ea=272,6 кДж/моль, lg A=16,81, k200C=5,110-14 c-1). Поэтому, исходя из кинетических параметров соединений II.1, II.2 и II.3, их распад может происходить только с разрывом N-NO2 связи. В то же время 2,5-замещенные тетразолы (разложение которых протекает по схеме: тетразол↔азидоазометин→продукты распада [Прокудин В.Г. и др., 1996]) по уровню термической стабильности достаточно близки к вторичным нитраминам с плоской нитраминной группой. Так, для 2,5-диметилтетразола Ea=177,0 кДж/моль, lgA=15,00, k200C=2,910-5 c-1. Поэтому термораспад соединений II.4 и II.5 может лимитироваться как разрывом связи N-NO2, так и раскрытием тетразольного цикла.
Константы скорости в растворе коррелируют с индукционной константой заместителей *. Для корреляции использовали также литературные данные [Степанов Р.С. и др., 1977; Корсунский Б.Л. и др., 1964].
lg k200C = (0,407±0,047)* (4,795±0,033) (r=0,949; Sy=0,158; n=11) (4)
Корреляционное уравнение (4) может быть использовано для прогнозирования реакционной способности вновь синтезируемых нитраминов.
2 ТЕРМИЧЕСКОЕ РАЗЛОЖЕНИЕ ПОЛИФУНКЦИОНАЛЬНЫХ АЗИДОСОЕДИНЕНИЙ
Предварительные сведения о строении замещенных азидосоединений (23 структуры) получены из расчетов оптимальной геометрии молекул полуэмпирическими квантово-химическими методами АМ1, MNDO, РМ3. Установлено, что при большой разнице электроотрицательности и объема -заместителей у азидной группы наблюдаются относительно небольшие различия в длинах связи N1N2, равных 1.251-1.268 Å. Если электроотрицательность и объем заместителей изменяется незначительно, их влияние на длину связи нивелируется. Более сильно меняется длина СN1 связи с 1.402 до 1.475 Å, а угол СN1N2 варьирует в пределах 116.7-121.3.
Изучено влияние строения на кинетические закономерности термического разложения широкой реакционной серии азидосоединений общей формулы R-N3 (III), где R = CH3COCH2 (III.1), C2H5OCOCH2 (III.2), цикло-C6H11 (III.3), C6H5 (III.4), C6H5CH2 (III.5), 4-NO2-C6H4CH2 (III.6), ClCH2CH2 (III.7), CH3CH(NO2) (III.8), 1,2,4-Tr-3- (III.9), 1,2,4-Tr-1-CH2CH2 (III.10), и азидонитраминов общей формулы N3CH2[N(NO2)CH2]nR (IV), где n=1 R=H (IV.1), CH2CN (IV.2), N3 (IV.3), CH2N(NO2)CH2N3 (IV.4); n=2 R=N3 (IV.5); n=3 R=N3 (IV.6), а также соединений (N3CH2CH2)2N(NO2) (IV.7), N3CH2CH2OCH2N(NO2)CH3 (IV.8) и 3-N3-1,2,4-триазолил-1-CH2N(NO2)CH3 (IV.9) в газовой фазе, расплаве и растворах. На термическое разложение в газовой фазе не оказывает влияния величина начального давления паров вещества (от 15 до 200 мм рт. ст.). В расплаве на скорость процесса практически не влияет изменение m/V (от 10-4 до 10-2 г/см3). В газовой фазе и расплаве термораспад не осложняется цепными и гетерогенными процессами, о чем можно судить по отсутствию влияния поверхности реакционного сосуда (S/V=1,9–9,2 см–1) и ингибиторов цепных процессов (толуола, фенола, ксилола, оксида азота) на константу скорости. На скорость распада практически не влияют диэлектрическая проницаемость растворителя (ДФ, =2,53; ДБФ, =6,44; ДНБ, =20,6) и концентрация вещества в растворе (2–25 % масс.). Это указывает на гомолитический характер разложения.
До глубины превращения 40-50 % термораспад азидов в газовой и жидкой фазах описывается уравнением реакции первого порядка. Исключение составляют соединения IV.2 и IV.4, где кинетические кривые имеют S-образный вид. Такой же вид имеют кинетические кривые по выделению диоксида азота при термораспаде соединений IV.2 и IV.6. Активационные параметры распада азидосоединений представлены в табл. 2.1.
Из табл.2.1 видно, что скорость распада азидосоединений, имеющих заместитель в -положении к азидной группе, на 1-2 порядка больше, чем с заместителем в -положении.
Основным газообразным продуктом разложения всех соединений является молекулярный азот, а в случае III.1 и III.2 даже при небольших глубинах превращения наблюдается деструкция углеродного скелета молекулы. При разложении азидоацетона (III.1) и 1-азидо-2-нитро-2-азапропана (IV.1) на глубине превращения 2-5 % зафиксировано образование иминов (CH3COCH=NH и CH3N(NO2)CH=NH) и их димеров.
Таблица 2.1
Кинетические и термодинамические параметры термораспада соединений III и IV
| Шифр | Соединение | Условия распада | ΔТ, С | k160C105, с-1 | Ea, кДж/моль | lg A | S160C, Дж/мольК |
| III.1 | CH3COCH2N3 | газ.фаза | 170-210 | 0,93 | 161,9 | 14,51 | 21,4 |
| III.2 | C2H5OCOCH2N3 | газ.фаза | 180-220 | 0,35 | 162,8 | 14,17 | 14,9 |
| III.3 | цикло-C6H11N3 | раствор | 170-220 | 0,79 | 160,1 | 14,21 | 15,6 |
| III.4 | C6H5N3 | раствор | 130-170 | 15,0 | 157,7 | 15,17 | 34,0 |
| III.5 | C6H5CH2N3 | раствор | 160-200 | 0,46 | 163,2 | 14,34 | 18,1 |
| III.6 | 4-NO2-C6H4CH2N3 | раствор | 160-200 | 0,41 | 165,3 | 14,55 | 22,1 |
| III.7 | ClCH2CH2N3 | газ.фаза | 160-200 | 0,55 | 160,7 | 14,13 | 14,1 |
| III.8 | CH3CH(NO2)N3 | газ.фаза | 120-160 | 92,58 | 134,7 | 13,25 | -2,7 |
| III.9 | 1,2,4-Tr-3-N3 | расплав раствор распл. по N2 | 130-170 130-170 150-170 | 45,42 22,05 42,60 | 139,3 159,4 140,7 | 13,49 15,56 13,59 | 1,8 41,5 3,8 |
| III.10 | 1,2,4-Tr-1-CH2CH2N3 | расплав | 150-190 | 0,83 | 163,6 | 14,65 | 24,0 |
| III.11 | CH3N3* | газ.фаза | 155-200 | 0,07 | 170,7 | 14,45 | 20,2 |
| III.12 | C2H5N3** | газ.фаза | 180-230 | 0,19 | 167,8 | 14,51 | 21,4 |
| III.13 | н-C3H7N3** | газ.фаза | 180-230 | 0,20 | 164,8 | 14,18 | 15,1 |
| III.14 | изо-C3H7N3** | газ.фаза | 180-230 | 0,27 | 161,1 | 13,86 | 8,9 |
| IV.1 | N3CH2N(NO2)CH3 | газ.фаза раствор | 130–170 140–180 | 10,49 6,52 | 151,0 147,3 | 14,24 13,53 | 16,3 2,68 |
| IV.2 | N3CH2N(NO2)CH2CH2CN | расплав раствор распл.по NO2 | 140–180 140–180 140-180 | 6,60 6,21 0,64 | 152,7 150,2 167,8 | 14,22 13,96 15,05 | 15,9 10,9 31,8 |
| IV.3 | N3CH2N(NO2)CH2N3 | расплав раствор | 130–170 140–180 | 29,16 23,61 | 152,3 144,8 | 14.85 13,90 | 27,9 9,8 |
| IV.4 | N3CH2[N(NO2)CH2]2N3 | расплав раствор | 110–150 130–170 | 28,14 23,16 | 151,0 145,2 | 14,92 13,74 | 29,3 6,7 |
| IV.5 | [N3CH2N(NO2)CH2]2 | расплав раствор | 130–170 140–170 | 12,05 6,77 | 151,9 152,7 | 14,33 14,26 | 18,0 16,7 |
| IV.6 | N3CH2[N(NO2)CH2]3N3 | расплав раствор распл.по NO2 | 136–170 136–170 150-180 | 25,86 20,00 3,37 | 149,8 146,0 168,1 | 14,47 13,88 15,75 | 20,7 9,4 45,2 |
| IV.7 | (N3CH2CH2)2NNO2 | расплав раствор | 150–190 150–190 | 2,54 1,80 | 162,3 161,9 | 14,97 14,80 | 30,3 27,0 |
| IV.8 | N3(CH2)2OCH2N(NO2)CH3 | раствор | 170-210 | 0,12 | 166,5 | 14,16 | 14,8 |
| IV.9 |  | расплав раствор | 130-170 140-170 | 41,21 20,73 | 141,8 154,4 | 13,70 14,92 | 5,9 29,2 |
* [O’Dell M.S., etc., 1970], **[Geiseler G., etc., 1964]
С учетом состава конденсированной фазы продуктов распада стабилизацию нитрена, образующегося в первичной реакции
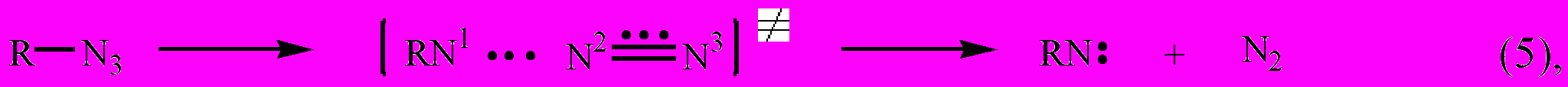
на примере азидоацетона (III.1), можно представить следующим образом:
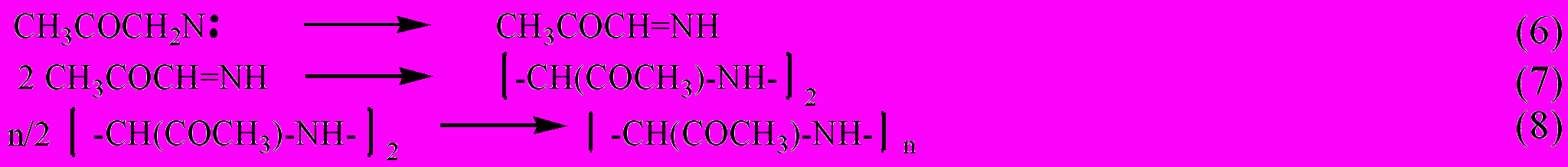
а в случае азидонитраминов:
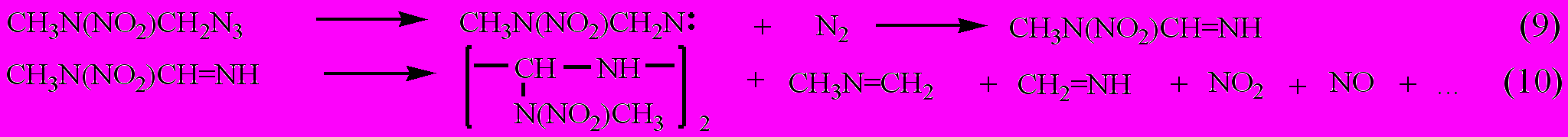
Лимитирующей стадией при распаде полифункциональных азидов является реакция (5), на которую оказывает влияние природа -заместителя.
Образование нитрена доказано опытами по разложению соединения IV.1 в избытке оксида углерода и оксида азота. При полной конверсии полоса поглощения азидной группы (2130 см–1) в ИК-спектре исчезает, а появляются, соответственно, полосы поглощения изоцианатной (2200 см–1) и нитрозоаминной (1550, 1450 см–1) групп.
Параметры уравнения Аррениуса, найденные для соединений IV.2, IV.3 по выделению диоксида азота, больше соответствующих величин по манометрическим измерениям, а константы скорости на порядок меньше (табл. 2.1). Монофункциональные алкилнитрамины на порядок стабильнее монофункциональных алкилазидов. Однако азидонитрамины на 2-3 порядка менее стабильны монофункциональных алкилазидов и алкилнитраминов, что обусловлено внутримолекулярным взаимодействием азидной и нитраминной групп, приводящим к уменьшению двоесвязанности N–N связи в азидной группе. Взаимодействие ослабевает, если азидная и нитраминная функции разделены этиленовым мостом (соединение IV.7). В этом случае константа скорости на порядок меньше, чем соединения IV.3. Накопление нитраминных групп в молекуле (соединения IV.3, IV.5, IV.6) не приводит к изменению термостабильности азидонитраминов.
Константа скорости и энергия активации термораспада большинства азидосоединений хорошо коррелируют с длиной связи N1-N2.
lg k160С = (130,757±26,439)d(N1-N2) (169,370±33,226) (r = 0,978; Sy = 1,512; n = 11) (11)
Ea = (2157,50±268,66)d(N1-N2) + (2870,94±337,83) (r = 0,957; Sy = 9,67; n = 9) (12)
Попытка применить для корреляции индукционную константу * Тафта в нашем случае оказалась безуспешной. Анализ табл. 2.1 показывает, что на скорость распада большее влияние оказывают стерические эффекты -заместителей, чем полярные. Поэтому для корреляции реакционной способности азидосоединений были использованы стерические константы заместителей V, Eso. Хорошие корреляции достигаются лишь для ограниченного ряда азидосоединений по причине отсутствия табличных данных для констант V, Eso:
lg k160С = (2,130±0,114)V (7,011±0,102) (r=0,972; Sy=0,741; n=12) (13)
lg k160С = (0,829±0,096)Eso (6,082±0,072) (r=0,940; Sy=0,347; n=8) (14)
Зависимость энергии активации от V и Eso дается соотношениями
Ea = (27,74±3,26)V + (183,89±2,33) (r=0,949; Sy=2,99; n=8) (15)
Ea = (9,35±0,30)Eso + (170,22±0,20) (r=0,963; Sy=0,60; n=8) (16)
Корреляционные уравнения (11)-(16) можно использовать для предсказания термостабильности еще не изученных полифункциональных азидосоединений.
