Системный подход к банкированию пуповинной крови для восстановительной медицины 14. 03. 11 «Восстановительная медицина, спортивная медицина, лечебная физкультура, курортология и физиотерапия»
| Вид материала | Автореферат диссертации |
- Комплексная оценка эффективности патогенетической и восстановительной терапии больных, 611.78kb.
- Структурно-резонансная электромагнитотерапия и жидкие синбиотики в восстановительном, 348.4kb.
- Восстановительное лечение детей первого года жизни с врожденной патологией тазобедренных, 535.09kb.
- Восстановительное лечение больных затяжной пневмонией с использованием природного нафталана, 299.26kb.
- Дыхательная гимнастика в комплексной реабилитации детей больных аллергическим ринитом, 264.09kb.
- Стабилометрия в диагностике и лечении детей с гемипаретической формой детского церебрального, 219.34kb.
- Оценка и коррекция функциональных нарушений у детей раннего возраста в зависимости, 319.48kb.
- Электропунктурная диагностика в системе дифференцированного применения немедикаментозных, 669.64kb.
- Квч-пунктура в комплексном восстановительном лечении пациентов с вирусными заболеваниями, 249.31kb.
- Системный подход к организации лечения и управлению деятельностью в санаторно-курортном, 514.41kb.
Известно несколько методов редукции объема ПК и некоторые их недостатки, такие как длительный процесс центрифугирования и недостаточная надежность, сильно связанная с опытом и квалификацией оператора. Внедрен в эксплуатацию принципиально новый клеточный сепаратор, адаптированный к клеточным суспензиям малого объема (Sepax, Biosafe S.A., Eysins/Nyon, Швейцария). Эта система состоит из процедуры цитафереза с эффективной редукцией объема в функционально замкнутой системе. Конечный продукт собирается прямо в мешки для замораживания и может быть заморожен немедленно после добавления диметилсульфоксида (ДМСО). Ряд факторов, влияющих на клеточный состав и характеристики клеток ПК, может выходить за стандартные рамки программирования процесса сепарации. Эффективность метода автоматического выделения и метода двойного центрифугирования сравнили в условиях ситуаций, равных для каждого из методов.
Проводимая для уменьшения объема ПК крови процедура лейкоконцентрации, влияет на соотношение количества клеток ПК. Полученные данные представлены в таблице 8.
Таблица 8.
Клеточный состав ПК и концентрата (х 109/л) (n=3964)
| | WBC | NEU | LYM | MON | EOS | BAS |
| Клеточный состав ПК (х 109/л) | ||||||
| M+m | 17,24+0,48 | 8,41+0,10 | 5,54+0,06 | 2,42+0,03 | 0,64+0,01 | 0,23+0,01 |
| Клеточный состав концентрата ПК (х 109/л) | ||||||
| M+m | 39,00+0,48 | 18,30+0,27 | 13,10+0,19 | 5,20+0,08 | 1,10+0,01 | 0,20+0,01 |
Показано, что при проведении процедуры концентрации ПК, основанной на процессе седиментации эритроцитов под действием гидроксиэтилкрахмала, доля нейтрофилов не изменяется, доля лимфоцитов статистически значимо повышается (рис.3) за счет того, что доля моноцитов, эозинофилов и базофилов статистически значимо снижается (рис.4). Это, по-видимому, связано с большей потерей этих клеток при концентрации.

р = 0,0001
р = 0,7
Рисунок 3. Доля нейтрофилов и лимфоцитов в пуповинной крови и
концентрате мононуклеарной фракции ПК
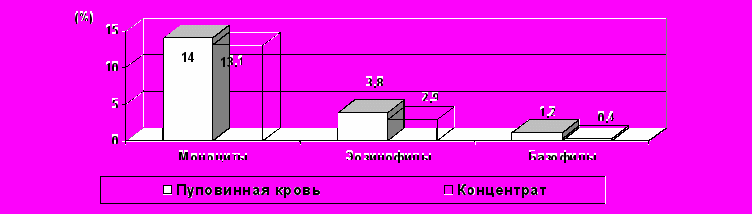
р = 0,0001
Рисунок 4. Доля моноцитов, эозинофилов и базофилов в ПК и
концентрате мононуклеарной фракции ПК.
Абсолютное количество субпопуляций лимфоцитов (CD3+клетки, CD19+клетки, CD3+CD4+клетки, CD3+CD8+клетки, CD16+CD56+клетки, HLA-DR+клетки) также повышается в процессе процедуры концентрации, но статистически незначимо. Степень повышения повторяет динамику лимфоцитов, определенную при помощи автоматического счетчика клеток крови.
Полученные данные позволили охарактеризовать состав лимфоцитов ПК и продемонстрировали отсутствие влияния процедуры концентрации ПК на количество и состав CD3+лимфоцитов в сочетании с достоверным увеличением после концентрации доли NK-клеток и CD33+CD13+клеток. Доля натуральных киллеров (NK) CD16+CD56+клеток среди ядросодержащих клеток пуповинной крови составила 5,97 ± 0,67% и статистически значимо увеличилась после процедуры концентрации – 8,54 ± 0,91% (р = 0,027). Такое соотношение связано с тем, что при проведении процедуры концентрации лейкоцитов ПК, происходит статистически незначительная потеря лейкоцитов вместе с седиментирующимися эритроцитами, за счет эозинофилов, базофилов и моноцитов и, следовательно, относительное количество NK-клеток и миелоидных предшественников возрастает. Количество CD3+ лимфоцитов, опосредующих развитие РТПХ, в результате процедуры лейкоконцентрации практически не менялось и составило 17,9 ± 1,44% и 19,2 ± 1,4% от всех ядросодержащих клеток соответственно. Количество и соотношение субпопуляций CD3+лимфоцитов – CD3+ CD4+ клеток и CD3+CD8+клеток в процессе концентрации также не изменилось и составило до концентрации CD3+CD4+клетки – 12,62 ± 1,12%, CD3+CD8+клетки – 5,62 ± 0,53%; после концентрации CD3+CD4+клетки – 13,23 ± 1,12%, CD3+CD8+клетки – 5,52 ± 0,48% от всех ядросодержащих клеток. Относительное количество предшественников миелопоэза – D33+ CD13+ клеток составило 12,5 ± 0,76% и статистически значимо увеличилось 15,82 ± 0,81% (р=0,005) после процедуры выделения, что может быть связано с большей потерей гранулоцитов при проведении процедуры выделения. Доля активированных лимфоцитов в результате лейкконцентрации также не изменилась и составила 0,40 ± 0,08% до выделения и 0,38 ± 0,09% после выделения. Количество CD14+клеток не увеличилось и составило 8,65 ± 1,58% до выделения и 9,11 ± 1,76% после. Количество CD15+клеток имело тенденцию к снижению, по-видимому, вследствие большей потери при процедуре выделения по сравнению с остальными субпопуляциями лейкоцитов и составило 39,32 ± 3,45% до выделения и 35,23 ± 3,26% после. Процедура лейкоконцентрации не влияет на количество CD3+клеток, в том числе CD3+CD4+клеток и CD3+CD8+клеток и активированных лимфоцитов – CD25+клеток. В результате процедуры лейкоконцентрации статистически значимо увеличилась доля CD19+клеток и натуральных киллеров (NK) CD16+CD56+клеток. Процедура лейкоконцентрации не влияет на содержание CD34+клеток CD133+клеток и субпопуляций. Полученные данные имеют важное практическое значение при проведении планирования технологического процесса, так как показано, что при проведении процедуры концентрации ПК, доля нейтрофилов не изменяется, доля лимфоцитов статистически значимо повышается за счет снижения доли моноцитов, эозинофилов и базофилов.
Выделение лейкоцитов в целом меньше при аппаратном методе обработки пуповинной крови (МАВК), чем при двойном центрифугировании (МДЦ) (70,28±0,51, 72,4±0,45 – соответственно; p=0,002), а выделение мононуклеаров и лимфоцитов выше, (MNC: 77,94±0,53 70,11±0,49; p<0,0001; лимфоциты: 80,73±0,58 71,7±0,54–соответственно; p<0,0001). Редукция же эритроцитов при МАВК выше, чем при МДЦ (20,85±0,5; 36,45±0,51 – соответственно, p<0,0001).
Оптимизация исследования HLA–типирования ПК и периферической крови у пациентов при различных заболеваниях.
Типирование ПК по HLA-системе имеет свои специфические особенности: необходимость быстрой обработки большого количества биоматериала при ограниченном количестве каждого образца и невозможности его повторного сбора. Поэтому использование чувствительных методов HLA-типирования, требующих для исследования минимального количества ДНК, являются критическим фактором.
Проведение HLA–типирования с использованием двух методов молекулярной биологии. В ГУЗ «БСК ДЗМ» впервые в России была апробирована и успешно внедрена технология обратной дот-блот гибридизации с олигонуклеотидными зондами (SSO) в автоматическом режиме на процессоре Dynal autoRELI™ 48 mk, позволяющая проводить скрининговое HLA-типирование большого количества образцов. Для разрешения неоднозначной интерпретации результатов типирования этих образцов проводилось повторное типирование с применением метода ПЦР с аллель-специфическими праймерами (SSP), что позволило достичь 100% однозначности результатов.
Генетический полиморфизм HLA-системы в московской популяции здоровых детей.
В настоящее время в ГУЗ «БСК ДЗМ» хранится около 4000 образцов ПК, типированных по пяти локусам системы HLA-A, -B, -C, -DRB, -DQB1. Установлены 17 специфических групп аллелей локуса HLA-A, 32 специфичности локуса HLA-B, 14 специфичностей локуса HLA-C, 14 специфичностей гена HLA-DRB1 и 5 специфичностей гена DQB1. Частота тех или иных генов гистосовместимости среди доноров стволовых клеток во многом зависит от этнических признаков входящих в неё лиц. Анализ распределения HLA-специфичностей по локусам класса I и класса II (специфических групп аллельных вариантов) определил наиболее часто и наиболее редко встречаемые варианты в московской популяции.
Анализ распределения HLA-специфичностей у московской популяции определил, что наиболее часто встречаемыми по локусам класса I являются (в долях): HLA-A*02 (0,288), A*03 (0,134), A*01 (0,114), A*24 (0,096); HLA-B - B*07 (0,120), B*35 (0,0793), B*44 (0,101), B*18 (0,084), B*08 (0,067), B*13 (0,066); Cw*07 (0,257), Cw*12 (0,134), Cw*06 (0,130), Cw*04 (0,0128).
По классу II c наибольшей частотой встречаются следующие группы аллелей гена DRB1 – *07 (0,143), *13 (0,139), *15 (0,133), *11 (0,130), *01 (0,110), *04 (0,110) и группы аллелей гена DQB1 – *03 (0,330), *06 (0,222). Наиболее редко встречающимися группами аллелей были выявлены следующие: A* 69 (0,0033), A*34 (0,00035), A*80 (0,00035), B*47 (0,0036), B* 45 (0,002), B*46 (0,002), B*53 (0,0017), B* 73 (0,0015), B*54 (0,0003) и B*78 (0,0003).
Проведенные исследования и анализ литературных данных (Зарецкая Ю.М., 2008) свидетельствуют, что характер распределения генных частот HLA класса I и II в популяции московского региона в целом соответствуют таковому для европеоидов.
Характер распределения встречаемости генов HLA-системы у детей с ОЛЛ. Были обследованы 187 детей с ОЛЛ из различных регионов России. Для изучения характера распределения генов HLA-системы пациенты, больные ОЛЛ, были разделены в зависимости от их иммунологического варианта на 2 группы: на В-ОЛЛ и Т-ОЛЛ. Была исследована группа из 98 детей с В-ОЛЛ (57 мальчиков и 41 девочка), в возрасте от 6 мес. до 17 лет (средний возраст составил 8,2 лет ± 4,8). Особенности характера распределения генов гистосовместимости в этой группе больных по сравнению с группой сравнения здоровых детей представлены на рис. 5.
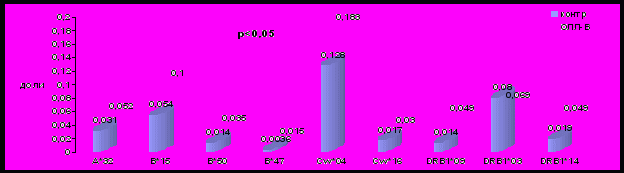
Рисунок 5. Частота встречаемости HLA-специфичностей у детей, больных В-ОЛЛ.
Для изучения факторов риска развития заболевания использовали метод случай-контроль. Если этот показатель превышал OR > 2, то он считался значимым (Зарецкая Ю.М., 1983). Частота встречаемости генов HLA-системы была высокой в группе больных В-ОЛЛ по сравнению со здоровыми детьми по локусу HLA-A - A*32; по локусу HLA-B – B*15, B*50; В*47 по локусу HLA-C – Cw*04; Сw*16 по локусу HLA-DRB – DRB1*09 и DRB1*14. Наиболее высокий риск развития В-ОЛЛ был выявлен у детей носителей DRB1*09 и DRB1*14 (ОR = 3,1 и 3,5 соответственно), но наиболее высокие показатели EF ассоциировались со специфичностью Cw*04 (ОR=1,9). Следовательно, при наличии аллельных специфичностей DRB1*09, DRB1*14 у индивида риск развития В-ОЛЛ возникал с большей вероятностью, чем со специфичностью HLA-Cw*04, однако, на популяционном уровне заболевание ассоциировалось в большей степени с HLA–Cw*04 (17,4 % детского населения имеет риск заболеть) и cо специфичностью HLA-В*15 (EF составляет около 12%), чем с DRB1*09 и DRB1*14 (EF=6,3 % и 6,6 % соответственно). Следует также отметить, что, несмотря на обнаруженный высокий показатель риска развития В-ОЛЛ у детей, несущих в своем HLA-генотипе В*50 (OR=2,6), процент больных, у которых развитие заболевания связано с этой группой аллелей составляет всего лишь 4,3%, т. е, ассоциации с ним на популяционном уровне слабая. Были исследованы 37 детей больных Т-ОЛЛ (25 мальчиков и 12 девочек) в возрасте от 1 года до 17 лет (средний возраст составил 10,1 лет ± 4,9). Отличительные особенности характера распределения HLA-генов в этой группе по сравнению со здоровыми детьми представлены на рис.6

Рисунок 6. Частота встречаемости специфичностей HLA у детей больных Т-ОЛЛ
Было выявлено достоверное увеличение частоты встречаемости специфичностей HLA-В*14, DRB1*01, DRB1*13 и DQB1*05 у больных детей с T-ОЛЛ по сравнению со здоровыми. При этом относительные показатели, характеризующие риск развития острого лейкоза Т-ОЛЛ у детей, имеющих эти группы аллелей, составляли от OR=2,2 для HLA-DRB1*13 до OR=3,0 для HLA-В*14. Показатель же этиологической фракции, указывающей на силу ассоциации маркера с заболеванием, оказался невысоким (EF=9,5%) для HLA-В*14. Для специфических аллельных вариантов DRB1*01, DRB1*13 и DQB1*05 показатели этиологической фракции имели среднюю величину силы их ассоциации с данным заболеванием (EF=19,8%, EF=25,5% и EF=34,4% соответственно). Высокий уровень достоверности различия между группой сравнения и группой больных с Т-ОЛЛ детей (р=0,0035, p=0,002 и p=0,002 соответственно), следовательно, их можно рассматривать маркерами развития Т-ОЛЛ у детей. Можно заключить, что иммунные варианты В-ОЛЛ и Т-ОЛЛ имеют разные иммуногенетические маркеры предрасположенности и устойчивости к данным заболеваниям. Более того, выявленные маркеры имеют разную силу ассоциации с заболеванием.
Характер распределения частот встречаемости генов HLA у детей с ОМЛ.
Были исследованы 146 детей, больных ОМЛ, в возрасте от 6 мес. до 17 лет (средний возраст составил 8,9 лет ± 5,2), по этническим признакам относящиеся к популяции европеоидов и разделенные на группы: ОМЛ М2 (28 детей), ОМЛ М4 (26 детей), ОМЛ М5 (28 детей) и ОМЛ М7 (18 детей). Дети с М0, М1и М6 вариантами в исследование не были включены из-за их малочисленности (всего 14 детей). Исследования по выявлению HLA–ассоциированных генов с вариантом промиелоцитарного лейкоза (М3) не проводились, так как типирование антигенов гистосовместимости у них не осуществлялось. У 32 детей больных ОМЛ морфологические варианты не были выявлены. В результате проведенных исследований у больных детей с ОМЛ были обнаружены достоверные отклонения распределения HLA-генов от общепопуляционного распределения.
Можно заключить, что различные морфологические варианты ОМЛ, имеющие разнообразные хромосомные аномалии, в результате которых экспрессируются разнообразные опухолевые белки на лейкозных клетках, имеют и многообразные иммуногенетические маркеры предрасположенности и устойчивости к этому заболеванию (рис. 7-10).
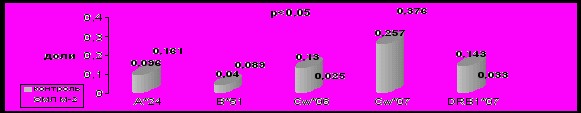
Рисунок 7. Частота встречаемости HLA-специфичностей у детей, больных ОМЛ М-2.

Рисунок 8. Частота встречаемости HLA-специфичностей у детей, больных ОМЛ М-4.

Рисунок 9. Частота встречаемости HLA-специфичностей у детей, больных ОМЛ М5.
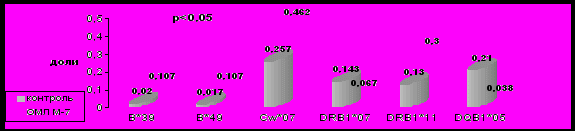
Рисунок 10. Частота встречаемости HLA-специфичностей у детей, больных ОМЛ М7.
С целью выявления «общего маркера» для миелобастного лейкоза (ОМЛ) была исследована общая группа всех больных детей (146 пациентов) с ОМЛ, независимо от варианта. Из них было 88 мальчиков и 58 девочек. Был обнаружен целый ряд аллелей HLA-генов с достоверно аномальным их распределением у детей, больных ОМЛ, по сравнению с группой здоровых детей. Это специфичности относящиеся, как к классу I – A*24, A*68, C*05, Cw*07, так и к классу II – DRB1*11, DRB1*07, DQB1*02. Следовательно, специфичности Cw*05 и HLA-Cw*07 являются маркерами риска развития ОМЛ у детей, а HLA-DRB1*07 – маркером устойчивости к этому заболеванию у детей. Причем специфичность Сw*07 имеет высокой силы ассоциацию и предрасположенность к заболеванию ОМЛ у детей. Полученные данные представлены в таблице 9.
Таблица 9.
Иммуногенетические факторы предрасположенности и устойчивости
к развитию ОМЛ у детей (n=146).
| HLA-специфичности | Маркеры риска | Маркеры устойчивости | ||||||
| р | OR | CI | EF, % | р | OR | CI | PF, % | |
| A*24 | 0,02 | 1,820 | 1,08-2,41 | - | - | - | - | - |
| A*68 | 0,04 | 1,8 | 1,06-3,06 | - | - | - | - | - |
| Cw*05 | 0,05 | 2,2 | 1,26-4,09 | 7,8 | - | - | - | - |
| Cw*07 | 0,0001 | 2,1 | 1,45-3,22 | 35,5 | - | - | - | - |
| DRB1*11 | 0,05 | 1,5 | 1,02-2,08 | - | - | - | - | - |
| DRB1*07 | - | - | - | - | 0,001 | 0,6-In:1,7 | 0,36-0,88 | 11,0 |
| DRQB1*02 | - | - | - | - | 0,03 | 0,6-In:1,7 | 0,41-0,93 | 15,0 |
Примечание: р – уровень достоверности; OR (odds ratio) – отношение шансов; CI (confidence interval) – доверительный интервал, EF/PF – этиологическая /превентивная фракция.
Частота встречаемости специфичностей локусов HLA у пациентов с ГЦ.
В настоящее время роль генетической предрасположенности в развитии ГЦ не вызывает сомнения. Для изучения генетической предрасположенности к ГЦ был проведен сравнительный анализ как отдельных аллельных вариантов всех генов HLA, так и их межлокусных сочетаний в генотипе больных и в группе сравнения.
По литературным данным стойкую ассоциацию с ГЦ чаще всего связывали с антигенами HLA-DQ (Парфенов А.И., 2007). В наших исследованиях был изучен локус HLA-DQB1*. Статистически значимая положительная ассоциация с ГЦ была выявлена для специфичности HLA-DQB1*02, которая составила 42,86% (f=0,4286) основной группы в отличие от 21,14% (f=0,2114) группы сравнения, р=0,011; z=2,538. Достоверного отличия, позволяющего исключить «нулевую гипотезу» по специфичность HLA-DQB1*03, выявлено не было, однако была выявлена статистически значимая отрицательная ассоциация с ГЦ для специфичности HLA-DQB1* 06 (основная группа – 7,14% (f=0,0714); группа сравнения – 22,24% (f=0,2224), р=0,002.
Риск развития заболевания ГЦ.
Достоверно значимыми можно считать только специфичности HLA-DQB1*06 и HLA-DQB1*05. Сочетание низкого уровня показателей относительного риска и отношения шансов с высокими показателями превентивной фракции позволяет говорить об устойчивости к развитию ГЦ при наличии в HLA-фенотипе данных специфичностей.
В результате проведенных исследований генотипов детей и взрослых пациентов, больных ГЦ, были выявлены статистически значимые HLA-специфичности и их сочетания, являющиеся иммуногенетическими маркерами данного заболевания. Помимо этого, были выявлены HLA-специфичности, достоверно подтверждающие отсутствие ГЦ. Впервые, помимо DQ. были выявлены HLA-специфичности, которые можно характеризовать, как генетические маркеры этого заболевания: HLA-B*08; HLA-Cw*07; HLA-DRB1*03; HLA-DRB1*07 и HLA-DQB1*02.
