Системный подход к банкированию пуповинной крови для восстановительной медицины 14. 03. 11 «Восстановительная медицина, спортивная медицина, лечебная физкультура, курортология и физиотерапия»
| Вид материала | Автореферат диссертации |
- Комплексная оценка эффективности патогенетической и восстановительной терапии больных, 611.78kb.
- Структурно-резонансная электромагнитотерапия и жидкие синбиотики в восстановительном, 348.4kb.
- Восстановительное лечение детей первого года жизни с врожденной патологией тазобедренных, 535.09kb.
- Восстановительное лечение больных затяжной пневмонией с использованием природного нафталана, 299.26kb.
- Дыхательная гимнастика в комплексной реабилитации детей больных аллергическим ринитом, 264.09kb.
- Стабилометрия в диагностике и лечении детей с гемипаретической формой детского церебрального, 219.34kb.
- Оценка и коррекция функциональных нарушений у детей раннего возраста в зависимости, 319.48kb.
- Электропунктурная диагностика в системе дифференцированного применения немедикаментозных, 669.64kb.
- Квч-пунктура в комплексном восстановительном лечении пациентов с вирусными заболеваниями, 249.31kb.
- Системный подход к организации лечения и управлению деятельностью в санаторно-курортном, 514.41kb.
Сбор ПК проводили после пережатия и пересечения пуповины производили пункцию сосудов пуповины специальной закрытой системой для забора ПК фирмы Green Cross объемом 250 мл, содержащей 35,5 мл антикоагулянта CPDA. Сбор крови осуществляли в течение 2–15 минут после родов (менее 5 минут – 3345 случаев (84,4%), от 5 до 10 минут – 345 случаев (8,7%) и более 10 минут – 274 (6,9%)), до отделения плаценты (n=3904 (98,5%)). В случае сбора крови после отделения плаценты (n=50 (1,5%)), последняя помещалась в специальную стерильную стойку и проводилась аналогичная процедура сбора. Полученный материал хранили в темном месте при комнатной температуре и подвергали анализу не позднее 36 часов после процедуры сбора ПК.
Особенности течения беременности проанализированы у 1564 роженицы, среди которых - полностью здоровыми были 248. Из 3964 новорожденных 2261 родились в результате первых родов, 1136 – вторых, 350 – третьих и 100 – роды четвертые и более (90 человек – 4-е роды, 14 – 5-е и 13 – 6-е). Процент мальчиков и девочек среди групп, составленных по порядковому номеру родов, не отличался. В каждой из групп девочек и мальчиков было приблизительно поровну. Масса плаценты проанализирована в 3299 случаях. Средняя масса плаценты в группе составила – 580,57±4,92, диапазон: 77,0 г – 1138,0 г. Течение и осложнение родов прослежены у 1331 новорожденного. Все новорожденные были разделены на группы согласно способу родоразрешения: самостоятельные роды и роды путем кесарева сечения. Медиана длительности безводного промежутка составила 5 часов (от 20 минут до 19 часов 20 минут). Медиана длительности II периода родов (от начала потуг до рождения ребенка) составила 30 минут (от 10 минут до 1 часа 35 минут). Из 3964 образцов, для которых доступны данные относительно пола ребенка, мальчиков и девочек было 2069 (52,2%) и 1895 (47,8%), соответственно. Средняя масса при рождении была несколько выше у мальчиков (3629,24±18,25 г.; диапазон 2270-5000 г.), чем у девочек (3467,23±18,17 г.; диапазон 2300-4650 г.) (р<0,0001). Из 1564 новорожденных у 232 отмечалось изменение цвета околоплодных вод (224 – зеленые воды и 8 – кровянистые), что является косвенным признаком внутриутробной гипоксии плода, у 180 – во время беременности была диагностирована внутриутробная гипоксия плода, у 361 – отмечалось обвитие пуповины при рождении, у 109 – отмечалась внутриутробная задержка развития плода. Медиана гестационного возраста в группе без внутриутробной задержки развития составила 40 недель (диапазон 33-42), а в группе с задержкой развития – 38 недель (диапазон 37-41). Все новорожденные, у которых имелись сведения о степени зрелости плаценты на момент родов, были разделены на три группы по степени зрелости плаценты.
Выделение клеточного концентрата, содержащего стволовые клетки, проводилось в асептических условиях, в «чистом» помещении класса D двумя методами: методом двойного центрифугирования и аппаратным методом с помощью клеточного сепаратора «Sepax S100», Biosafe, Switzerland (1986 и 1978 образца, соответственно). Все обработанные образцы были подвергнуты криоконсервации в роботизированном криокомплексе “BioArchive®”, ThermoGenesis, USA. Непосредственно перед криоконсервацией, в каждый образец добавлялся криопротектор DMSO в смеси с декстраном-40 в количестве 20% от объема конечного продукта для предотвращения разрушения клеток концентрата ПК под воздействием сверхнизких температур.
Степень разведения образцов ПК антикоагулянтом была различна и зависела от объема собранной крови. Объем антикоагулянта в системе постоянный и составляет 35,5 мл, объем собранной крови колебался в пределах от 20,0 до 170,0 мл. Пересчет результатов автоматического анализа крови проводился с учетом степени разведения каждого образца для каждого показателя.
Подсчет клеток ПК производился двумя методами:
- все 3964 образцов ПК были подвергнуты анализу на автоматическом счетчике клеток крови ABX Pentra 60 C+ в режиме автоматической аспирации с определением 26 параметров;
- для точной морфологической характеристики клеток ПК использовали мазки, окрашенные по методу Паппенгейма-Крюкова (комбинированная окраска фиксатором-красителем Мая-Грюнвальда и краской Романовского). Количество нормобластов определяли при подсчете лейкоцитарной формулы на 200 последовательно встречающихся лейкоцитов с дальнейшим пересчетом на 100 (нормобласты/100лейкоцитов).
Количество субпопуляций лейкоцитов и гемопоэтических стволовых клеток определялось по экспрессии мембранных маркеров (CD – clusters of differentiation) в реакции прямой иммунофлюоресценции с моноклональными антителами CD3, CD4, CD8, CD13, CD14, CD16, CD19, CD25, CD30, CD31, CD33, CD34, CD38, CD44, CD45, CD56, CD61, CD62L, CD62E, CD71, CD90, CD106, CD117, CD133, HLA-DR «Becton Dickinson», США при помощи проточной цитометрии на приборе FACSCalibur «Becton Dickinson», США.
Колониеобразующую активность лейкоцитарной фракции ПК определялась двумя методами:
1. культивирование в течение 14 суток в метилцеллюлозе (готовая среда, содержащая факторы роста «MethoCult 4338, StemCellTehnologies, Canada) с подсчетом количества КОЕ-mix, КОЕ-ГМ, КОЕ-Г, КОЕ-М, КОЕ-Э.
- Эффективность клонирования (ЭК) определяли как общее число КОЕ на 1 х 105 эксплантированных клеток
- Для определения абсолютного количества гемопоэтических предшественников в 1 мл ПК, полученные величины эффективности клонирования умножали на число мононуклеарных клеток в 1 мл крови.
2. Культивирование в течение 7 суток в полутвердой среде в системе «агаровая капля – жидкая среда» в с расчетом следующих показателей:
- колониеобразующая (КОС) и кластерообразующая (КлОС) способность – число колоний (малые-20-40 клеток, средние- 41-100 клеток и большие – более 100 клеток) и кластеров (малые – 5-9 клеток, большие – 10-19 клеток) на 1 х 105 эксплантированных клеток.
- эффективность клонирования (ЭК) – общее число колоний и кластеров на 1 х 105 эксплантированных клеток
- для определения абсолютного количества гемопоэтических предшественников в 1 мл крови, полученные величины эффективности клонирования умножали на число мононуклеарных клеток в 1 мл крови.
- пролиферативный потенциал (ПП) – отношение числа колоний к кластерам в культуре.
Уровень некроза и спонтанного апоптоза лейкоцитов, гранулоцитов и лимфоцитов ПК. Исследование проводилось при помощи проточной цитофлюориметрии двумя методами: определение количества клеток с гиподиплоидным содержанием ДНК при окрашивании Propidium iodid (PI) и определение числа локусов связывания мембранного фосфатидил-серина в реакции прямой иммунофлюоресценции с использованием Annexin V FITC ("Phar Mingen"), согласно инструкциям производителей. Результаты реакции анализировали на проточном цитофлюориметре FACScan ("Becton Dickinson”, США). Обработку полученных данных производили при помощи программы WinMDI 2.8 for Windows. Уровень спонтанного апоптоза лейкоцитов, гранулоцитов и лимфоцитов клеток ПК определяли как сумму PI+/Annexin V+ и PI-/Annexin V+ клеток, а уровень некроза, как количество PI+/Annexin V- клеток.
Исследование генетического полиморфизма HLA системы ПК. Были исследованы образцы пуповинной крови условно здоровых детей. Геномная ДНК выделялась из образцов ПК методом сепарации на магнитных частицах. Характеристики выделенной ДНК, её концентрацию и степень чистоты, измеряли с помощью спектрофотометра. Концентрация ДНК измерялась против чистого элюирующего раствора по оптической плотности OD260/280 . Образцы для исследования соответствовали предъявляемым стандартным требованиям: концентрация ДНК была > 50 нг/мкл, и А260/280 составляло 1,7-1,9. Генотипирование проводили методом гибридизации с помощью олигонуклеотидных зондов. Считывание и интерпретация результатов проводилась с помощью сканирующего устройства и компьютерной программы PMP. Данным методом выявлялись HLA-специфичности по всем исследуемым локусам на уровне групп аллелей. Образцы, у которых были получены двойные интерпретации результатов, дополнительно типировали методом ПЦР с помощью аллель-специфических праймеров. Регистрация сигналов электрофореграммы, фотографирование изображения и документирование их в электронном виде осуществлялось с помощью гельдокументирующей системы «ДиДжиДок» (США) и с использованием компьютерной программы UPV. Интерпретацию результатов проводили с помощью таблиц фирмы – производителя праймеров.
2. Образцы периферической крови 187 детей с диагнозом ОЛЛ и 146 детей с диагнозом ОМЛ (112 мальчиков и 75 девочек, в возрасте от 6 мес. до 17 лет, средний возраст составил 8,3 лет ± 4,6) и 146 детей, больных ОМЛ (88 мальчиков и 58 девочек, в возрасте от 6 мес. до 17 лет, средний возраст составил 8,9 лет ± 5,2). Все пациенты имели неблагоприятный прогноз и нуждались в дальнейшей трансплантации ГСК. В зависимости от иммунологического варианта дети, больные ОЛЛ, были разделены на три группы: 1 группа В-ОЛЛ (98 пациентов); 2 группа Т-ОЛЛ (37 пациентов); 3-ю группу составляли дети, с неустановленным иммунологическим вариантом (52 пациента). Дети, больные ОМЛ, были разделены в зависимости от цитоморфологической характеристики заболевания в соответствии с FAB классификацией на группы: М2 - 28 больных, М4 – 26 больных, М5 - 28 больных и М7 - 18 больных. Группы больных вариантами ОМЛ М0 (5 детей), ОМЛ М1 (5 детей) и М6 (4 ребенка), были малочисленными и потому не были включены в исследование. Помимо этого, была выделена группа с неустановленным морфологическим вариантом (32 ребенка).
3. Образцы периферической крови 46 пациентов с диагнозом ГЦ, разделенные на 2 группы: 1 основная группа 28 детей в возрасте от 1 года до 17 лет (средний возраст – 7,53 + 4,9, медиана составила – 6,0) и 18 взрослых от 19 лет до 81 года (медиана – 51,0, средний возраст – 48,4 + 17,3) с установленным диагнозом ГЦ (всего 45 пациентов). Диагноз ГЦ был установлен в соответствии с критериями ESPGHAN. 2 группа сравнения была представлена образцами ПК условно здоровых детей.
Статистическую обработку результатов исследования осуществляли с использованием критерия Стьюдента с поправкой Бонферрони и тесту Ньюмена-Кейлса; для вариационных рядов с непараметрическим распределением с помощью критерия Крускалла-Уоллеса и критерия Манна-Уитни. Статистический анализ исследования ассоциаций проводился с использованием двупольной таблицы при помощи программы «Open Epi» (Open Source Epidemiologic Statistics for Public Health), версия 2.3 (2009/20/05). Полученные результаты обработаны методами вариационной статистики пакета Excel Microsoft и программы «Biostat», «SISA» и «EpiMax Table Calculator». При расчетах использовали программы Excel 2002 Pro, STATISTIKA for Windows 8.0, Biostat for Windows.
Результаты исследования
В развитии клеточного направления восстановительной медицины чрезвычайно актуален вопрос подготовки достаточного количества эффективного и безопасного клеточного материала, применение которого при различных заболеваниях повысит регуляторные, компенсаторные и адаптивные механизмы возможности организма.
Особенности клеточного состава ПК новорожденных
Результаты исследования количества клеток и их основных параметров были проанализированы и представлены в таблице 2.
Таблица 2.
Референтные значения клеточного состава ПК (n=3964)
| Лейкоцитарная формула | (M+m) |
| WBC/(109/л) | 17,24 + 0,16 |
| NEU/(109/л) | 8,41 + 0,10 |
| LYM/(109/л) | 5,54 + 0,06 |
| MON/(109/л) | 2,42 + 0,033 |
| EOS/(109/л) | 0,64 + 0,01 |
| BAS/(109/л) | 0,23 + 0,01 |
| RBC /(1012/л) | 4,40 + 0,01 |
| HGB/(г/л) | 157,4 + 0,46 |
| HCT (%) | 32,29 + 0,14 |
| MCV/(фл) | 105,81 + 0,12 |
| MCH/(пг) | 35,83 + 0,04 |
| MCHС/(пг) | 338,6 + 0,24 |
| RDW (%) | 12.71 + 0,02 |
| MCH/(пг) | 35,83 + 0,04 |
| PLT / /(109/л) | 307,54 + 1,97 |
| MPV / (фл) | 7,18 + 0,02 |
ПК характеризуется тем, что наряду со зрелыми элементами нейтрофильного ряда, содержит повышенное количество палочкоядерных нейтрофилов и более молодые формы - метамиелоциты и миелоциты, поэтому скрининг состава и характеристик клеток ПК, проводимый при помощи автоматических счетчиков клеток крови в работе банков ПК не вполне удовлетворителен. При исследовании ПК окрашенные мазки оценивали с помощью световой микроскопии. Полученные результаты (средние величины по группе) затем сравнивались с величинами, полученными при исследовании тех же образцов пуповинной крови при помощи автоматического анализатора клеток крови. Отмечено, что при автоматическом анализе занижается процентное соотношение нейтрофилов, а лимфоцитов, моноцитов, эозинофилов и базофилов увеличивается. Все изменения были статистически достоверны (табл. 3.).
Таблица 3.
Различия клеточного состава ПК при подсчете клеток при помощи автоматического анализатора и светооптической микроскопии, в % (n=3964)
| Лейкоцитарная формула | Автоматический анализ (M+m) | Ручной подсчет (M+m) |
| NEU | 47,48+ 0,44 | 57,48+ 0,47 |
| LYM | 32,76+ 0,36 | 28,66+ 0,43 |
| MON | 14,64 +0,124 | 9,95+ 0,19 |
| EOS | 3,86+ 0,10 | 3,28+ 0,13 |
| BAS | 3,41+ 0,04 | 0,61+ 0,03 |
Примечание. p<0,0001
Установлено, что при большом содержании в ПК лейкоцитов и нормобластов увеличивается степень различий в определении базофилов (r=-0,44, p<0,0001), лимфоцитов (r=-0,25, p<0,0001), нейтрофилов (r=-0,22, p<0,0005). Полученные закономерности не зависят от сроков гестации, степени разведения образца ПК антикоагулянтом, времени, прошедшего после родов до начала сбора и обработки ПК.
Иммунологическую характеристику клеточного состава ПК (количество CD34+ клеток в ПК) определяли с помощью проточной цитометрии и оценивали как два параметра: процент от общего количества лейкоцитов - 0,827+ 0,023 и абсолютное количество CD клеток - 0,100+0,003 в 1мл ПК. Оценивали количество CD34+CD133+ клеток, как наиболее ранние предшественники гемопоэза, CD133+CD31+ - эндотелиальные предшественники, CD133+CD106+ - мезенхимальные стволовые клетки; количество пролиферирующих гемопоэтических предшественников определяли по уровню экспрессии трансферринового рецептора (CD71) в ПК и концентрате - достоверных различий не было выявлено, что свидетельствует о качестве полученного концетрата стволовых клеток.
Количество колоний оценивалось на 105 MNC и на 1 мл ПК. Также подсчитывался процент колоний каждого вида от их общего количества. Выявили преобладание ранних ГСК - КОЕ-ГЕММ-35,3 % (рисунок 1.).
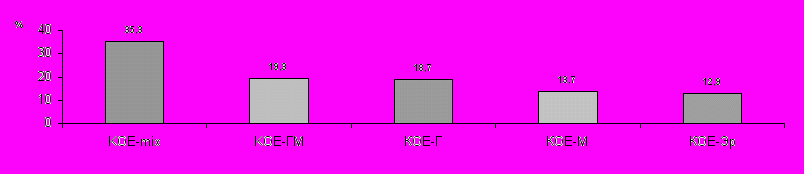
Рисунок 1. Распределение колониеобразующих единиц пуповинной крови
Была установлена статистически значимая положительная корреляционная взаимосвязь между процентом CD34+ клеток в ПК и количеством КОЕ-mix в 1 мл образца (r=0,231; р=0,013), и между абсолютным количеством CD34+ клеток в ПК и КОЕ-mix в 1 мл образца (r=0,3888; р=0,001), КОЕ-ГМ (r=0,4285; р=0,001), КОЕ-Г (r=0,2887; р=0,0018), КОЕ-М (r=0,3197; р=0,0005) и общим количеством КОЕ в мл образца (r=0,4187; р=0,001). Прямых корреляционных взаимосвязей между сроком гестации и количеством КОЕ не было выявлено. Уровень некроза лейкоцитов ПК составил 3,49 ± 0,28 %, при этом, уровень некроза лимфоцитов был ниже значений всех лейкоцитов (2,99 ± 0,34 %) и статистически значимо отличался от уровня некроза моноцитов и гранулоцитов, составлявшего 5,59 ± 0,72 % и 6,12 ± 0,65 % соответственно (р < 0,0001) (рис. 2.).
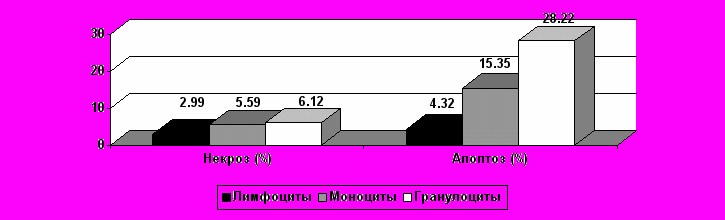
Рисунок 2. Уровень некроза и спонтанного апоптоза лейкоцитов ПК
Уровень спонтанного апоптоза лейкоцитов составил 9,18 ± 1,19 %. Уровень спонтанного апоптоза лимфоцитов был ниже значений в общей группе (4,32 ± 0,7 %), и статистически отличался от уровня спонтанного апоптоза моноцитов и гранулоцитов (15,35 ± 2,02 % и 28,22 ± 2,51 % соответственно, р < 0,0001).
Такое соотношение показателей позволяет предположить большую жизнеспособность лимфоцитов, что представляется позитивным результатом, учитывая тот факт, что популяция ГСК находится в пуле лимфоцитов. Это предположение подтверждается положительной корреляционной взаимосвязью количества лимфоцитов и колониеобразующей активностью ПК (табл. 4.).
Таблица 4.
Взаимосвязь количества лимфоцитов и колониеобразующей активности ПК
| | Лимфоциты | |
| r | р | |
| KOE-mix | 0,399 | < 0,001 |
| КОЕ-ГМ | 0,4993 | < 0,001 |
| КОЕ-Г | 0,4467 | < 0,001 |
| КОЕ-М | 0,4995 | < 0,001 |
| КОЕ-Эр | 0,2068 | 0,0018 |
| КОЕ-сумма | 0,5634 | < 0,001 |
При изучении взаимосвязи уровня спонтанного апоптоза лимфоцитов и колониеобразующей активности клеток ПК оказалось, что отмечается положительная корреляционная взаимосвязь между уровнем спонтанного апоптоза лимфоцитов и колониеобразующей активностью пуповинной крови, что доказывает однонаправленность процессов апоптоза и пролиферации (табл. 5.).
Таблица 5.
Взаимосвязь уровня апоптоза лимфоцитов и колониеобразующей активности ПК
| | Доля лимфоцитов на разных стадиях апоптоза | |
| r | р | |
| KOE-mix | 0,4427 | 0,0208 |
| КОЕ-ГМ | 0,2948 | 0,1525 |
| КОЕ-Г | 0,3537 | 0,0828 |
| КОЕ-М | 0,3003 | 0,1447 |
| КОЕ-Эр | 0,1221 | 0,544 |
| КОЕ-сумма | 0,3677 | 0,0706 |
Примечание: r – коэффициент корреляции; р - достоверность
При исследовании клеточного состава ПК в зависимости от пола было выявлено, что у девочек уровень лейкоцитов выше (17,74±0,24 х109/л; М±m), чем у мальчиков (16,8±0,23 х109/л; М±m). В абсолютных количествах у девочек также больше нейтрофилов, но меньше эозинофилов (табл. 6.).
Было установлено, что количество эритроцитов (4,33±0,02 х1012/л) и содержание гемоглобина (155,1±0,7 г/л) у девочек меньше, чем у мальчиков (4,46±0,02 х1012/л; 159,5±0,6 г/л; р<0,0001).
Таблица 6.
Зависимость лейкоцитарной формулы от пола новорожденного (M+m)
| Пол | | WBC(109/л) | Лейкоцитарная формула (%) | ||||
| NEU | LYM | MON | EOS | BAS | |||
| Девочки | n | 1920 | 1920 | 1920 | 1920 | 1920 | 1920 |
| M+m | 17,74+0,24 | 49,97+0,35 | 31,57+0,15 | 13,75 | 3,48+0,07 | 1,26+0,03 | |
| Мальчики | n | 2044 | 2044 | 2044 | 2044 | 2044 | 2044 |
| M+m | 16,80+0.23 | 47,10+0.34 | 33,23+0.30 | 14,29+0.17 | 4,16+0.09 | 1,18+0.03 |
Примечание. p<0,001
Гематокрит у девочек (31,79±0,2 %) также меньше. (32,76±0,19 %; р=0). Различий в эритроцитарных индексах (MСV, MCH, MCHC, RDW) в зависимости от пола новорожденного не обнаружено. Количество тромбоцитов у девочек (314,87±2,98 х109/л) больше, чем у мальчиков (300,72±2,62 х109/л; р<0,0001). CD34+ клеток больше в процентном (0,88±0,03 – мальчики; 0,77±0,03 – девочки; р=0,01) и в абсолютном количестве (0,106±0,005 – мальчики; 0,095±0,005 – девочки; р=0,002) (табл. 7.).
Таблица 7.
Количество CD34+ клеток в ПК доношенных новорожденных.
| Пол ребенка | Параметры | CD34 (%) | CD34 (10³/mm³) |
| Девочки | n | 1920 | 1920 |
| M+m | 0,769+0,032 | 0,095 +0,005 | |
| Мальчики | n | 2044 | 2044 |
| M+m | 0,883 +0,032 | 0,106+ 0,005 |
Примечание. p<0,001
При изучении колониеобразующей активности ПК установлено, что у мальчиков больше количество КОЕ-ГМ в 1 мл ПК (745,71±65,11 – девочки; 1216,7±185,45 – мальчики; р=0,022), имеется тенденция к увеличению количества КОЕ-М (691,64±78,6 – девочки; 1052,1±252,09 – мальчики; р=0,19) и общего количества колоний (4883,13±455 – девочки; 6070,8±691 – мальчики; р=0,16) в 1 мл образца ПК. При анализе эффективности клонирования (на 105 MNC) у мальчиков также больше КОЕ-Г (18,44±1,31 – девочки; 22,42±1,6 – мальчики; р=0,058). В процентном соотношении имеется тенденция к увеличению количества КОЕ-mix (р=0,11) у девочек, и уменьшению у них КОЕ-ГМ (р=0,13) и КОЕ-Эр (р=0,14).
Связь клеточного состава с массой тела новорожденного очень слабая: достоверная положительная корреляция с массой тела ребенка обнаружена для нейтрофилов (r=0,12; р=0,0002), эозинофилов (r=0,14; р=0,0001), базофилов (r=0,12; р=0,0002) и гематокрита (r=0,2; р<0,0001). Все новорожденные были разделены на группы согласно массе тела при рождении: ≤2500 г; 2500-3000 г; 3000-4000 г и >4000 г. При сравнении полученных данных отмечено, что с увеличением массы тела ребенка при рождении увеличивается количество лейкоцитов – от 15,52±0,59 х109/л до 17,51±0,44 х109/л (р=0,01). Увеличивается абсолютное количество нейтрофилов и эозинофилов (р<0,0001 и р=0,004, соответственно), а количество моноцитов уменьшается (р<0,0001). В процентном соотношении у детей с большей массой тела нейтрофилов и эозинофилов больше, а лимфоцитов и моноцитов меньше. Концентрация гемоглобина и количество эритроцитов не зависят от массы тела ребенка. Отмечено увеличение гематокрита с увеличением массы тела ребенка (от 28,48±2,47% до 33,86±0,39 %; р<0,0001). Отмечено также уменьшение MCHC (р<0,0001) и увеличение MPV (р=0,025) с увеличением веса ребенка. При проведении регрессионного анализа достоверных корреляционных взаимосвязей количества CD34+клеток и колониеобразующей активностью ПК и массы ребенка не получено. Наиболее статистически значимо увеличение среди KOE-mix (р=0,096).
