Львова Елена Михайловна к Х. н., доцент учебно-методический комплекс
| Вид материала | Учебно-методический комплекс |
- Феоктистова Елена Михайловна к э. н., доцент должность профессор Киреева Инна Михайловна, 1783.66kb.
- Середина Елена Владимировна, кандидат географических наук, доцент, доцент кафедры учебно-методический, 653.52kb.
- Карпенко Елена Зугумовна к э. н., доцент должность профессор учебно-методический комплекс, 976.86kb.
- Миронова Елена Анатольевна к ю. н., доцент учебно-методический комплекс, 440.82kb.
- Карпенко Елена Зугумовна к э. н., доцент должность профессор учебно-методический комплекс, 548.9kb.
- Феоктистова Елена Михайловна кандидат экономических наук, доцент, профессор Киреева, 825.83kb.
- Бородина Елена Алексеевна кандидат юридических наук, доцент кафедры Гражданского права, 779.8kb.
- Романова Елена Витальевна, кандидат экономических наук, доцент, доцент кафедры информатики, 254.32kb.
- Парамонова Татьяна Николаевна д э. н., профессор Красюк Ирина Николаевна к э. н., доцент,, 1704.02kb.
- Учебно-методический комплекс подготовлен Юдиной А. С. Учебно-методический комплекс, 1284.72kb.
- Справочные величины приведены в таблице 2
Таблица 2. Давление насыщенного водяного пара в равновесии с водой
| Температура, С | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | |
Давле-ние пара | Па 103 | 1,81 | 1,93 | 2,06 | 2,19 | 2,33 | 2,48 | 2,64 | 2,81 | 2,98 |
| мм рт.ст. | 13,6 | 14,5 | 15,4 | 16,4 | 17,5 | 18,6 | 19,8 | 21,0 | 22,3 | |
1 атм. = 101325 Па = 760 мм рт. ст. = 1,013 106 дн /см 3
Теоретическое значение молярной массы эквивалента цинка (Мэ) в проводимой реакции составляет 32,69 г/ моль.
Таблица 3. Значения Универсальной газовой постоянной
| Единицы измерения | 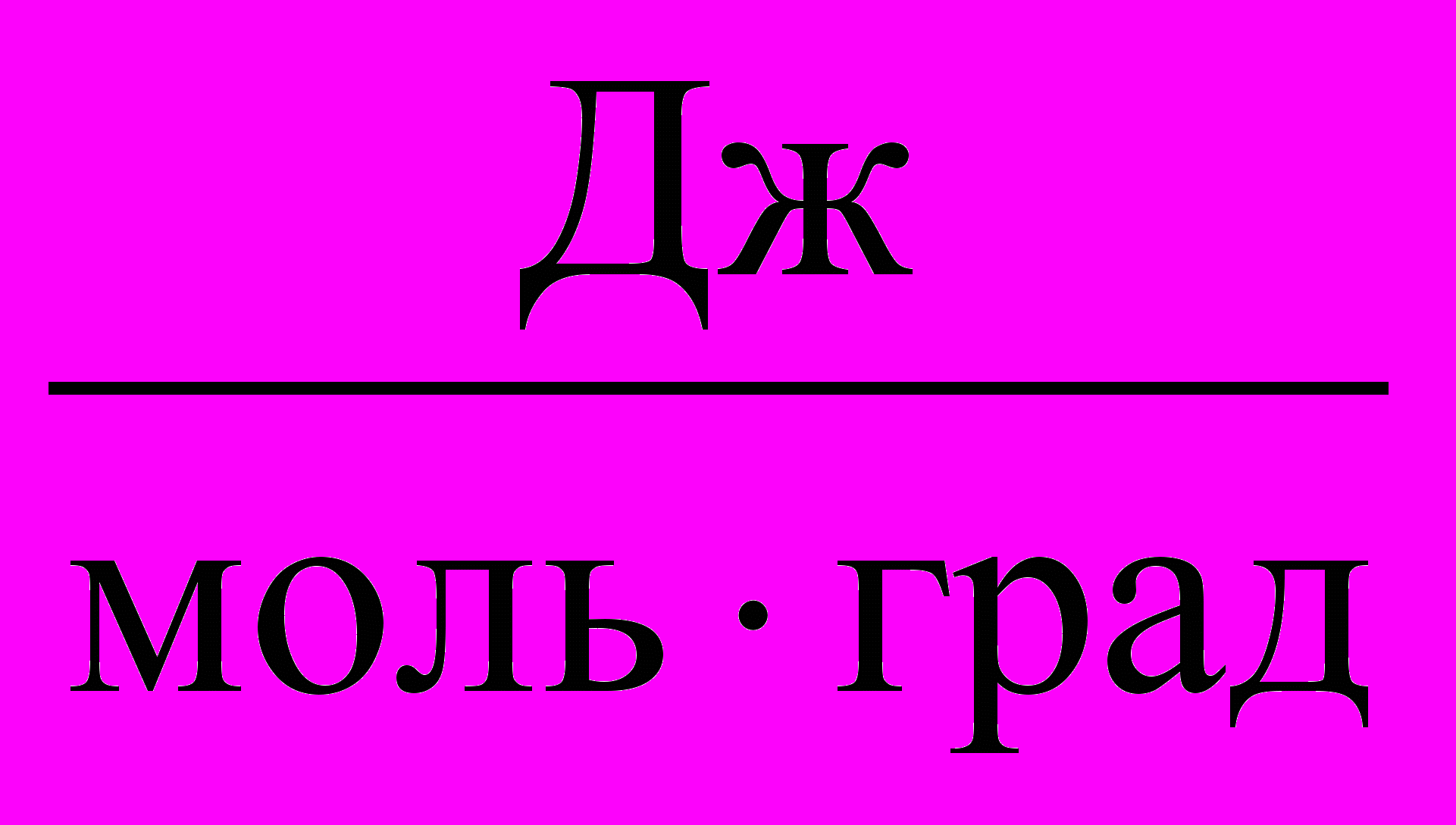 | 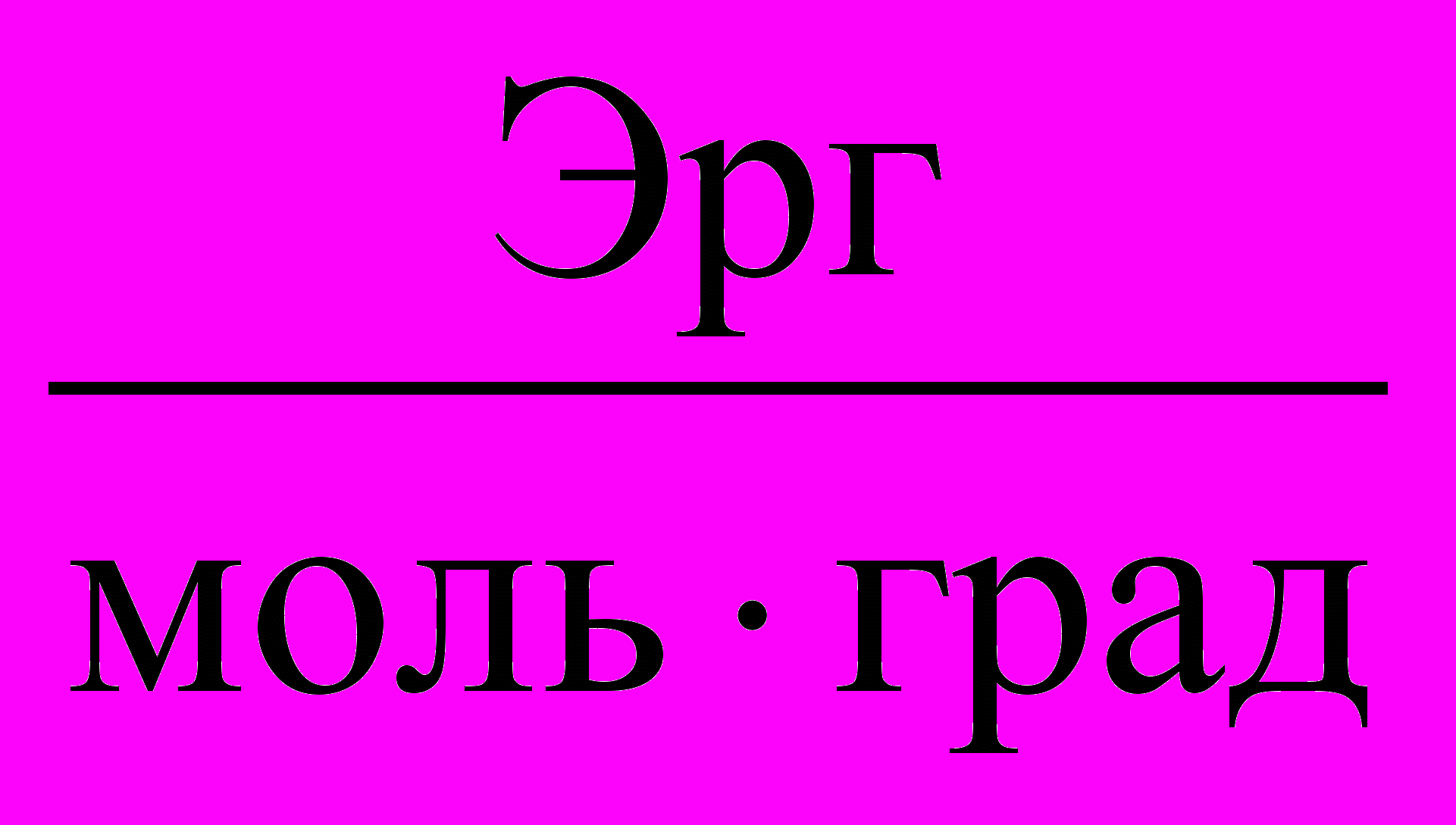 | 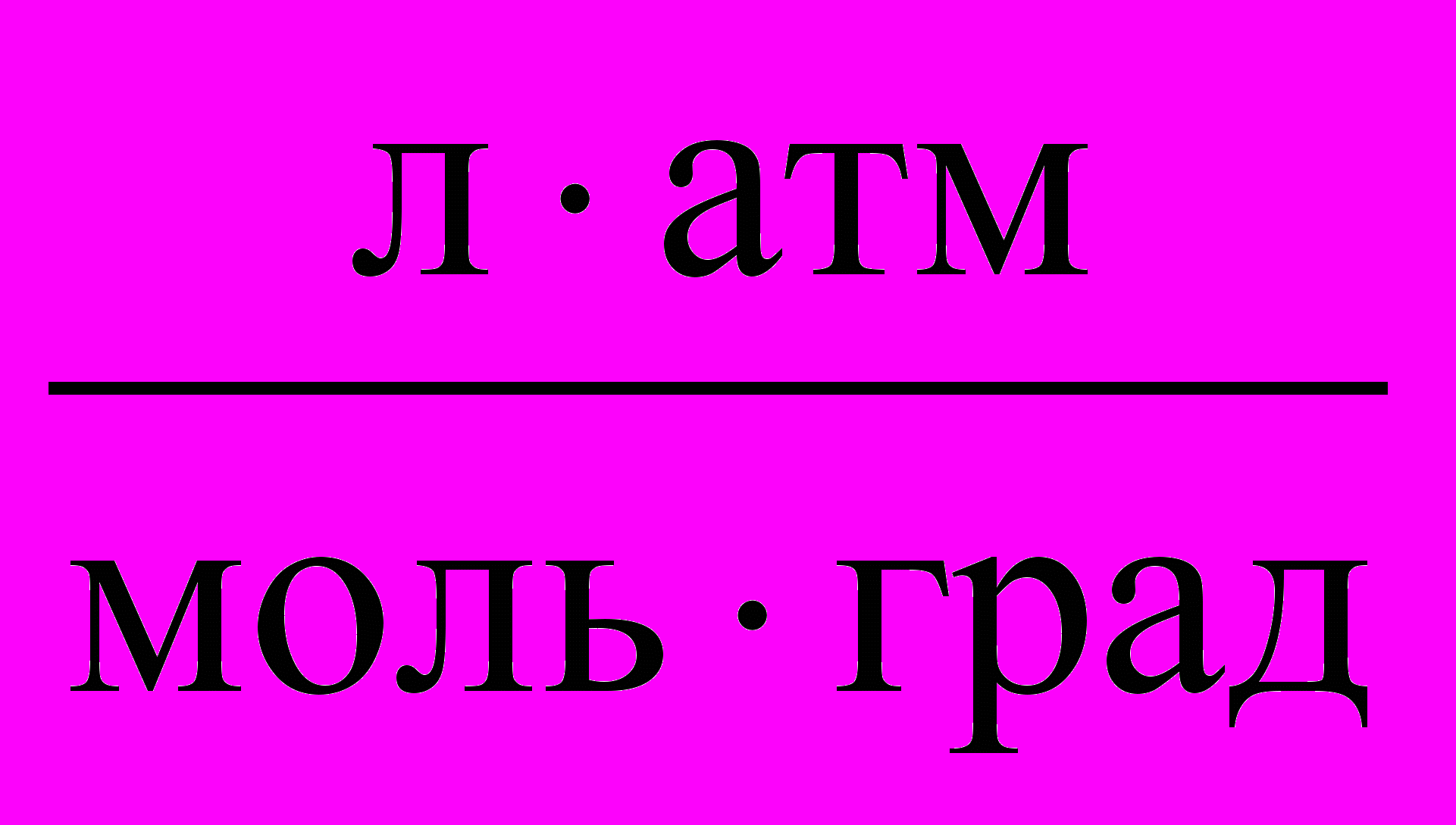 | 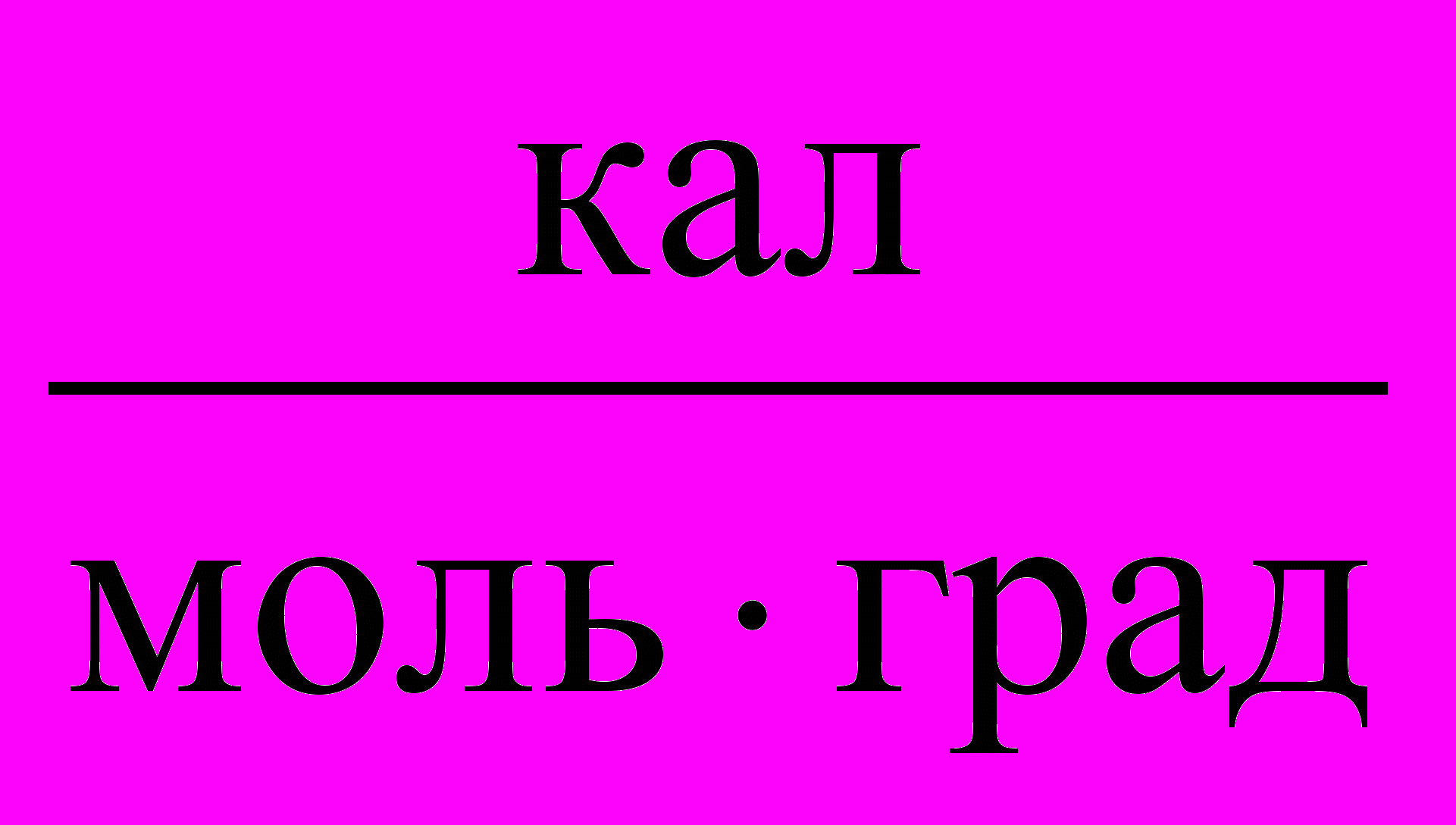 | 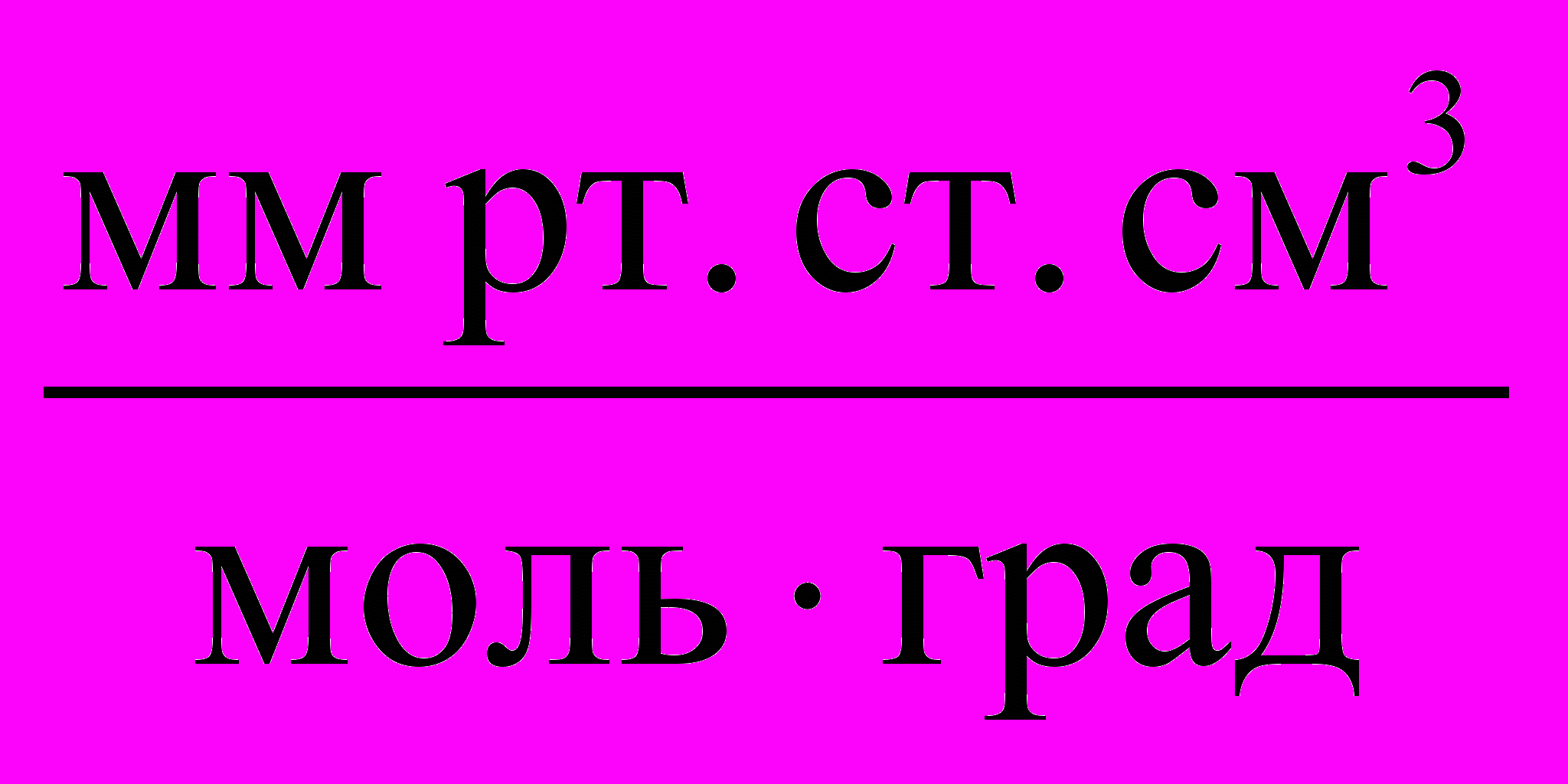 |
| значения | 8,3145 | 8,3145107 | 0,082057 | 1,9858 | 62360 |
5. На основании полученных результатов проведите следующие расчеты
5.1. Расчет молярной массы эквивалента цинка по массе выделившегося водорода в соответствии с законом эквивалентов.
Массу водорода рассчитайте по уравнению Клапейрона-Менделеева с
использованием данных из таблиц 1 и 3:
2
2
P( H ) V(H ) =
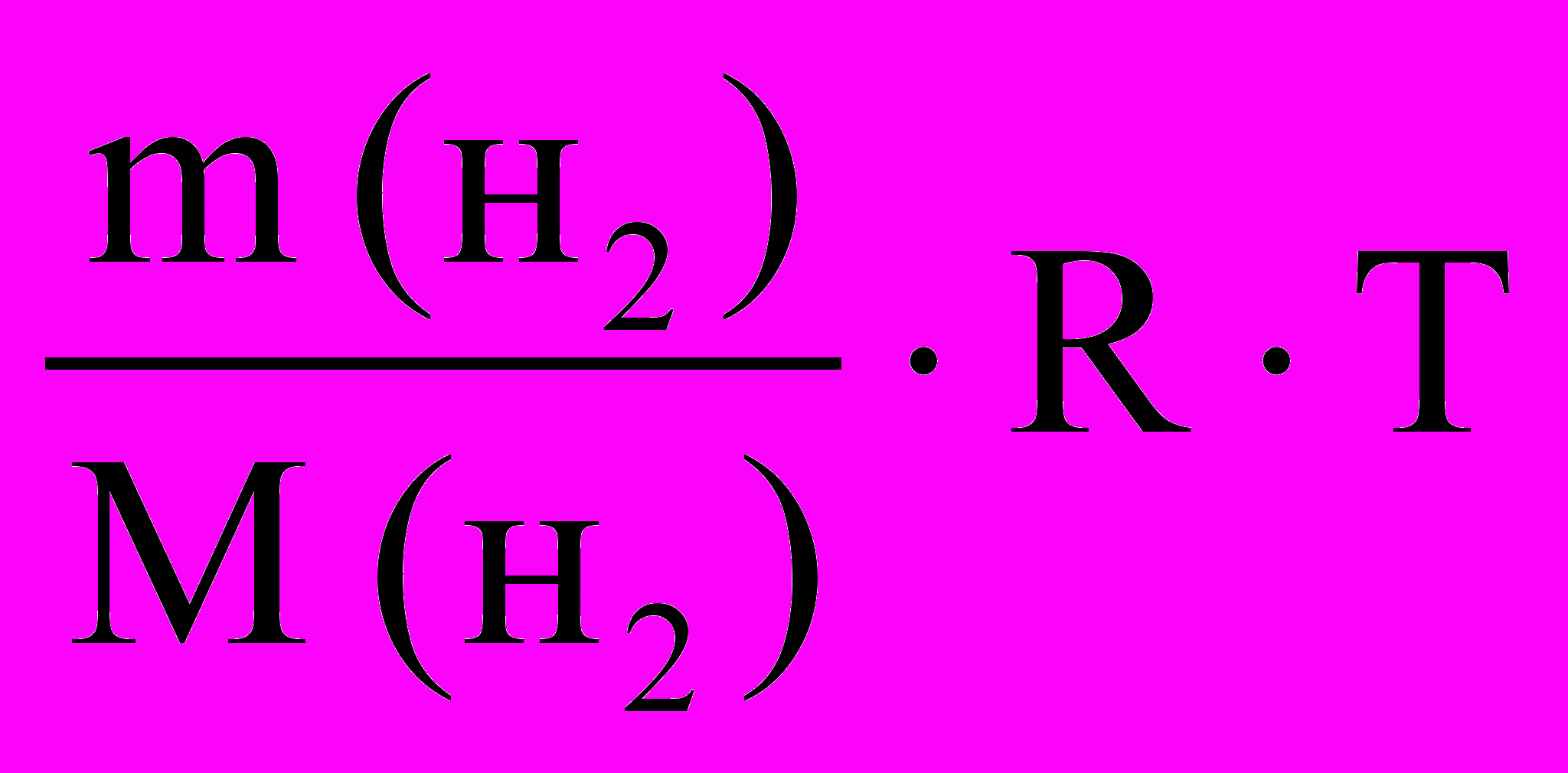
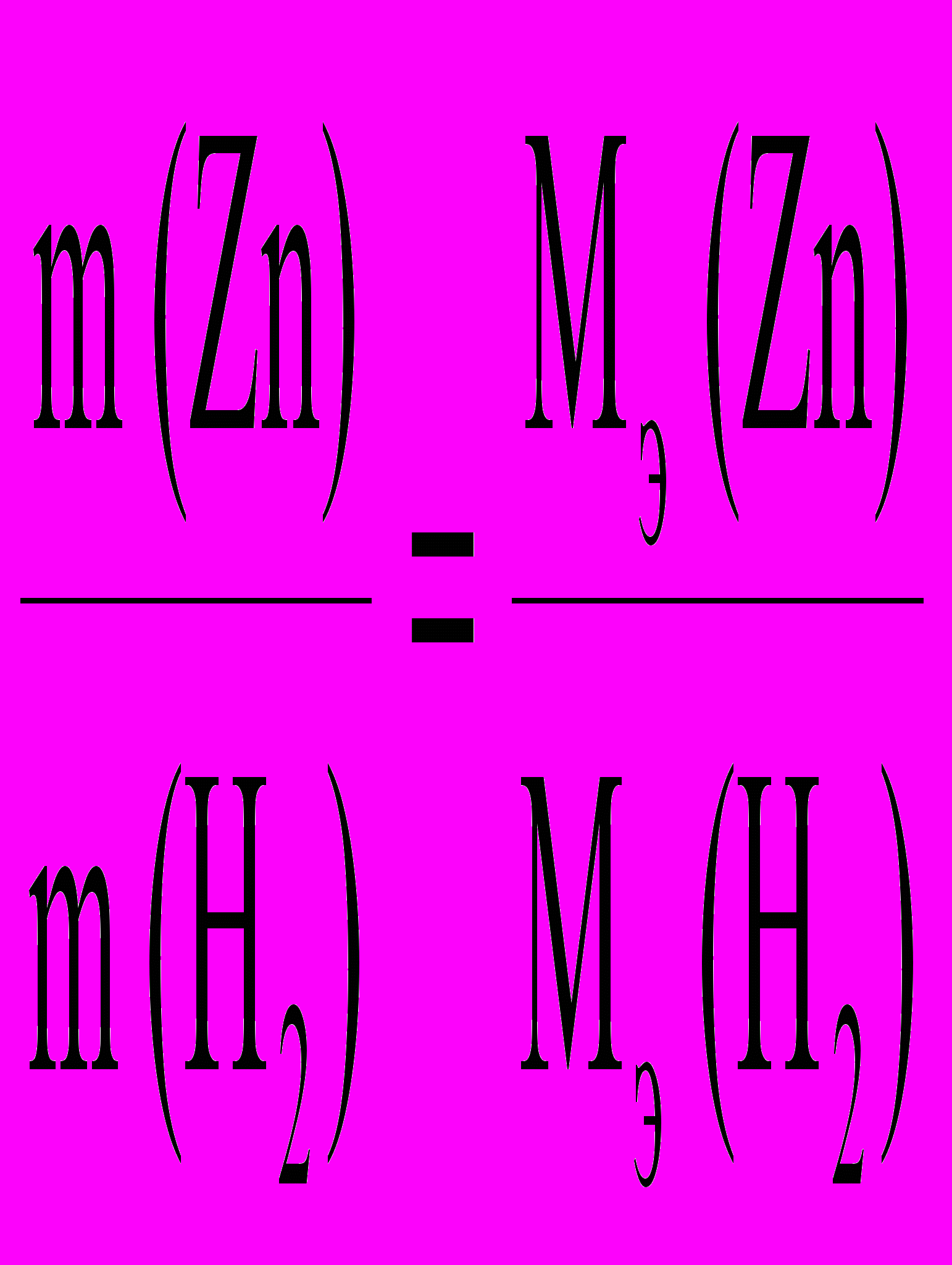 , Mэ (H2) = 1,008 г/ моль, Мэ (Zn)1 = …
, Mэ (H2) = 1,008 г/ моль, Мэ (Zn)1 = …5.2. Расчет молярной массы эквивалента цинка по объему выделившегося
водорода.
По закону эквивалентов :
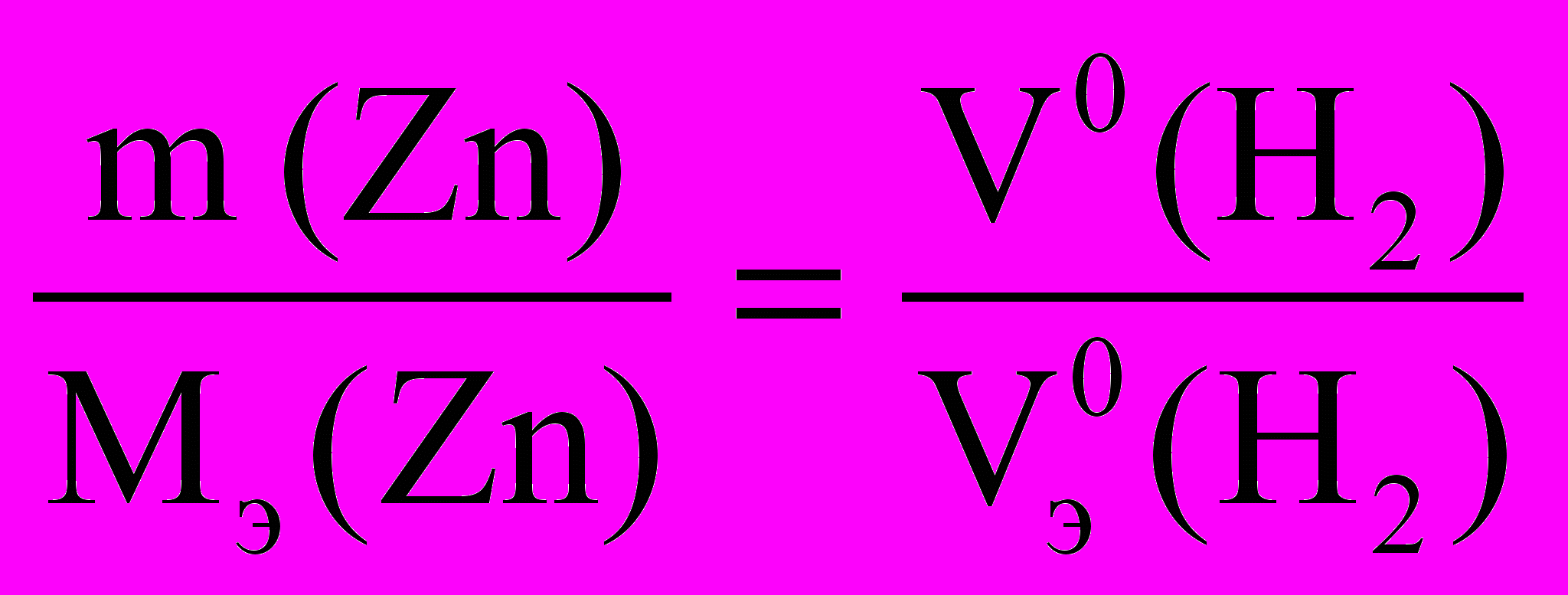
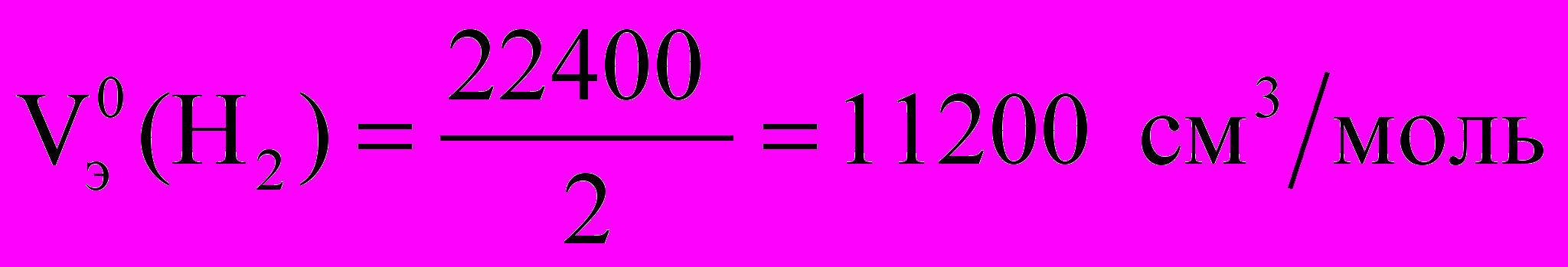 Мэ (Zn)2 =
Мэ (Zn)2 = Расчет объема водорода при нормальных условиях выполняют по уравнению Объединенного газового закона:
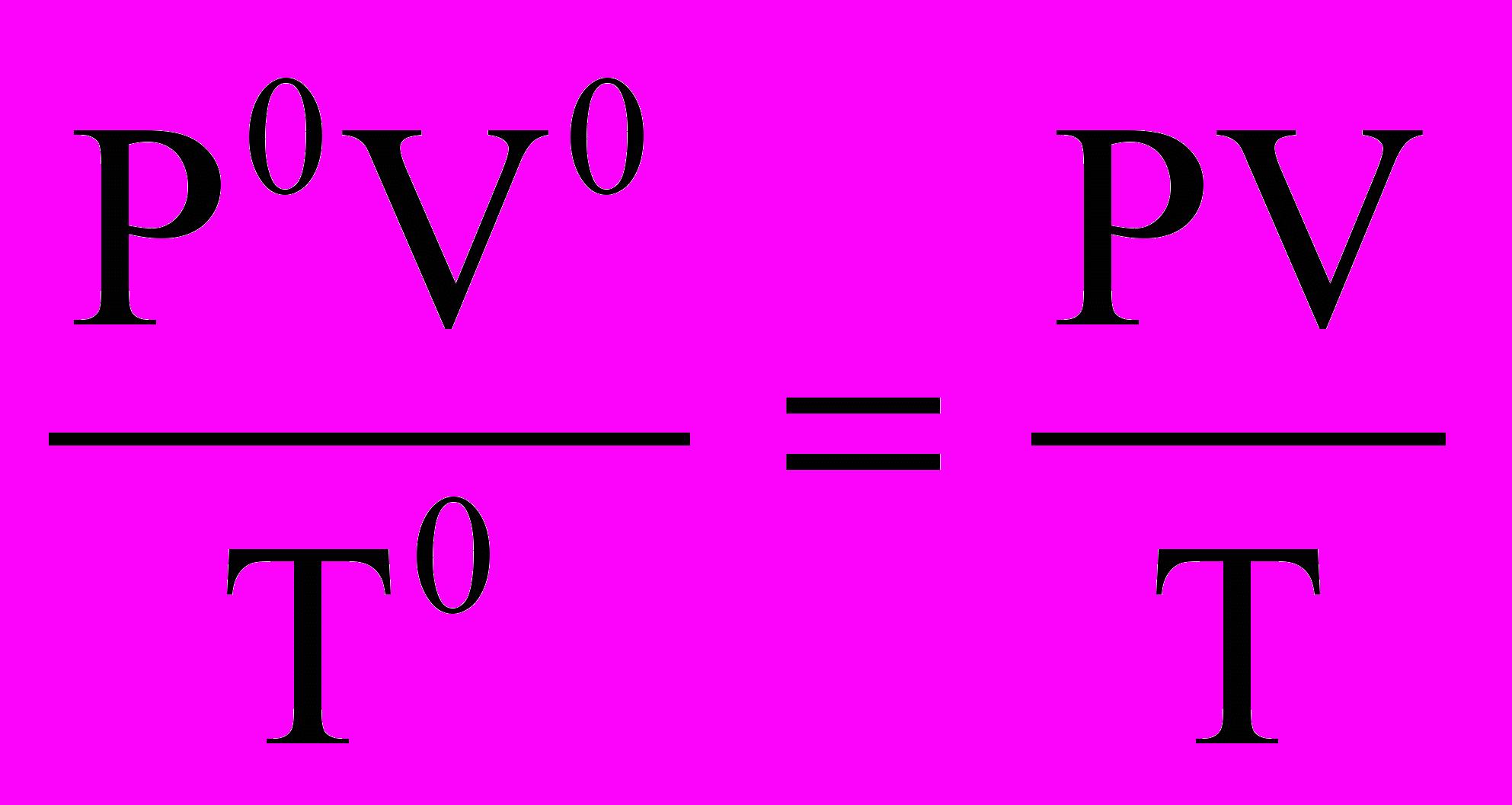 , V0 (H2) =
, V0 (H2) = 6. Проводят расчет погрешности эксперимента
6.1. Абсолютная погрешность
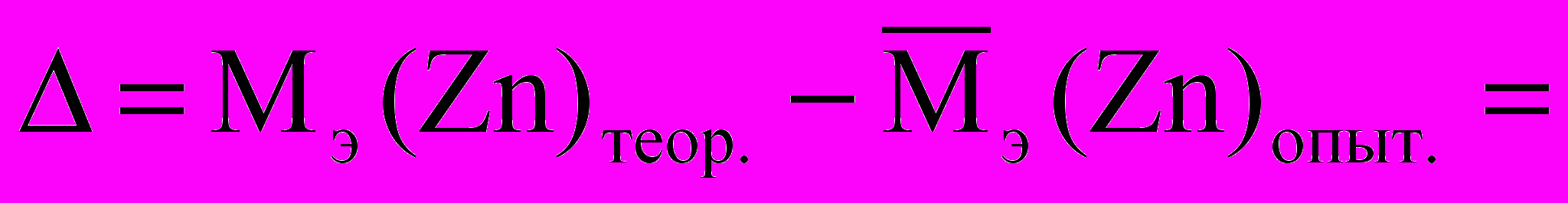
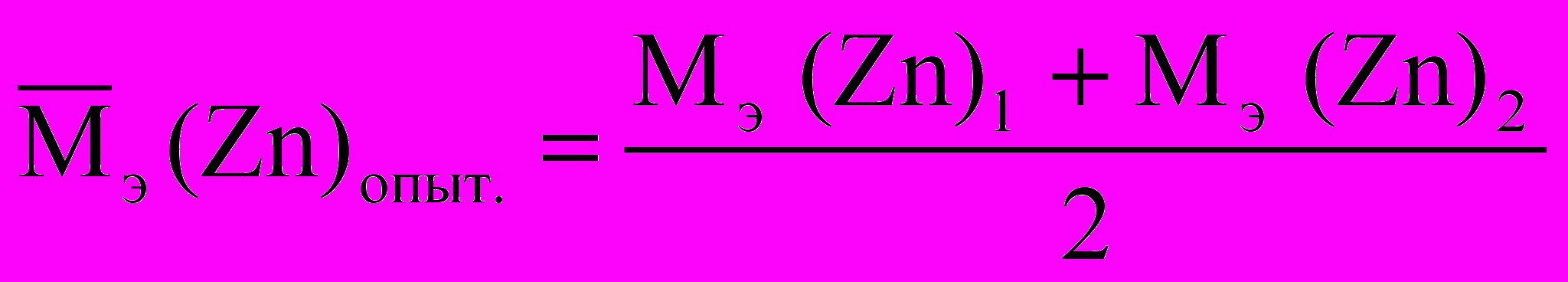
6.2. Относительная погрешность :
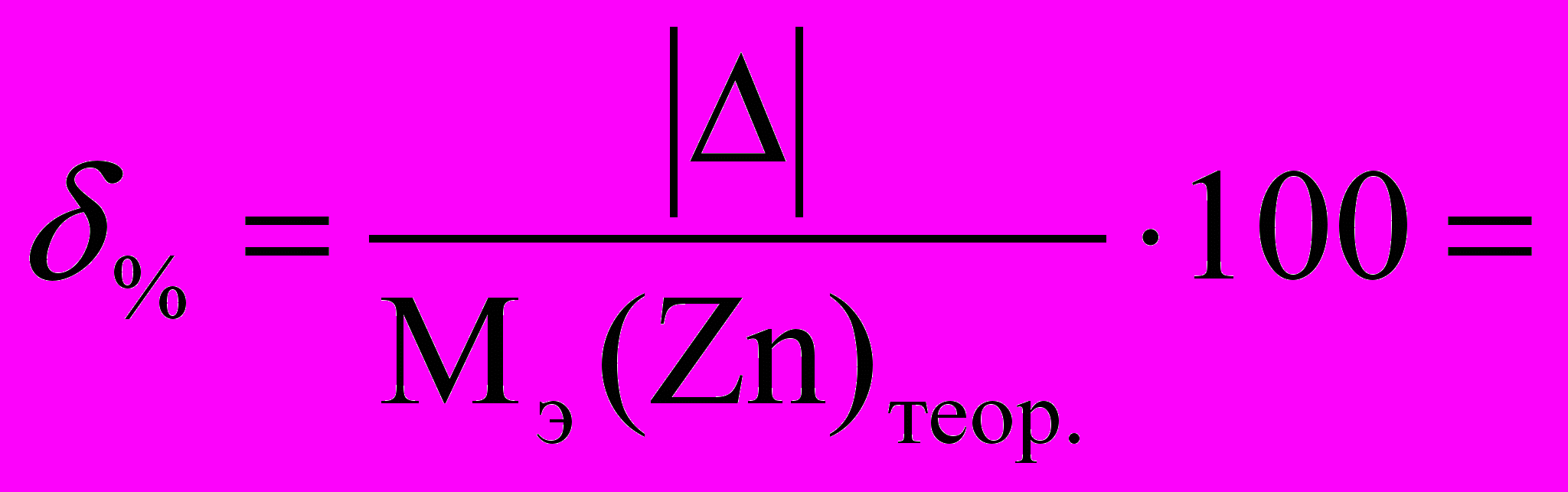
8. Примеры типовых расчетных задач для самостоятельной работы студентов
Тема 1.
Задача 1. При взаимодействии 0,91 г двухвалентного металла с соляной кислотой выделилось 0,314 л водорода (при нормальных условиях). Определите молярную массу эквивалента этого металла и назовите металл. (Ответ: Мэ=32,5; металл Zn)
Задача 2. Массовая доля серы в оксиде равна 40%. Определите формулу оксида. (Ответ: SO3)
Задача 3. В колбе емкостью 500 мл при 25°С находится 0,615 г оксида азота (II). Вычислите давление газа. ( Ответ: 1 атм)
Задача 4. При 20°С объем газа равен 20,4 мл. Какой объем займет газ при его охлаждении до 0°С, если давление остается постоянным? (Ответ:19 мл)
Тема 6.
Задача 1. Рассчитайте теплоту сгорания метана и количество теплоты, которое выделится при сгорании 100 л метана. ( Ответ: 802,2 кДж/моль; 3577,8 кДж)
Задача 2. Рассчитайте ∆Ho298 химической реакции Na2O(т) + H2O(ж) NaOH(т)
по значениям стандартных энтальпий образования веществ.
( Ответ: –153,6кДж).
Задача 3. Определите, прямая или обратная реакция будет протекать при стандартных условиях в системе 2NO(г) + О2(г) ↔ 2NO2(г) . Ответ мотивируйте, вычислив Go298 прямой реакции. (Ответ: -69,70 кДж)
Тема 7.
Задача 1. Во сколько раз возрастет скорость реакции при повышении температуры от 50°С до 100°С, если температурный коэффициент равен 2,9?
( Ответ: в 595 раз)
Задача 2. Как повлияет увеличение давления в 2 раза на химическое равновесие в системе: Fe3O4(т) + СО(г) ↔ 3FeO(т) + СО2(г)
Ответ: (равновесие не сместится)
Тема 9.
Задача 1. Приготовьте 25,0 см3 раствора хлорида цинка молярной концентрации 0,10 моль/дм3. Чему равна нормальная концентрация этого раствора?
Задача 2. Сколько граммов хлорида натрия потребуется взять для приготовления 4,50 дм3 10,0%-ного раствора плотностью 1,07 г/см3?
Задача 3. Определите массы исходных растворов с массовыми долями гидроксида натрия 5% и 40%, если при их смешивании образовался раствор массой 210 г с массовой долей гидроксида натрия 10%. (Ответ: 180 г и 30 г)
Тема 10.
Задача 1. Рассчитайте рН 0,003Н раствора соляной кислоты. (Ответ: 2,52)
Задача 2. ПР хлорида серебра равно 1, 56∙10-10. Рассчитать, сколько граммов этой соли содержится в 100 мл насыщенного раствора. (Ответ: 1.79∙10-4 г.)
Тема 11.
Задача 1. При электролизе водного раствора Cr2(SO4) током силой 2А масса катода увеличилась на 8 г. В течение какого времени проводили электролиз ?
(Ответ: 6,19 ч.)
Задача 2. Рассчитайте потенциал цинкового электрода, опущенного в раствор с концентрацией ZnSO4 , равной 0,001 М, Т=298 К. . (Ответ: 0,852 В.)
Тема 13.
Задача 1. Сколько калия получится в результате реакции обмена между КСl массой 9,8 г и металлическим натрием? (Ответ: 15,6 г.)
Задача 2. При взаимодействии с водой 15,7 г сплава кальция и бария выделилось 3,36 л газа (н.у.). Определите массовую долю (%) металлов в сплаве. (Ответ: 87,3% Ва; 12,7% Са)
Задача 3. При прокаливании 1,8 г смеси ZnCO3 и ZnO получено 1,4 г оксида цинка. Какова массовая доля (%) компонентов смеси? (Ответ: 63% ZnCO3 37% ZnO)
Задача 4. Через 70 мл 20%-го раствора KJ (плотность 1,186 г/мл) пропустили хлор. Сколько граммов осадка образовалось? (Ответ: 12,7 г)
Тема 14.
Задача 1. Рассчитать концентрацию насыщенного раствора иодида серебра при 25 °С, если произведение растворимости этой соли составляет 8,31∙ 10–17. Ответ: 9,1∙10–9 моль/л.
Задача 2. Чему равен титр раствора НСl, если при прибавлении к 20,00 мл этого раствора избытка раствора AgNO3 получено 0,2868 г AgCl?
(Ответ: THCl = 0,003646 г/мл.)
Тема 16.
Задача 1. Смесь этана и этилена объемом 200 мл (н.у.) обесцветила бромную воду массой 25 г. Рассчитать объемную долю этилена в смеси, если массовая доля брома в бромной воде равна 3,2%. (Ответ: 56%)
Задача 2. . Какую массу углекислого газа можно получить, если сжечь 3,2 г метана? Определите объем, который займет углекислый газ, образовавшийся в этой реакции при нормальных условиях. (Ответ: 8,8 г.)
Задача 3. Вычислите объем воздуха, измеренный при н.у., который потребуется для полного сгорания бензола массой 5,3 г. Объемная доля кислорода в воздухе составляет 21%.(Ответ: 56 л.)
Тема 17
Задача 1. Из 18,4 г этанола было получено 6,0 г простого эфира по реакции межмолекулярной дегидратации. Определить выход продукта в % от теоретического. (Ответ: 40,5 %)
Задача 2. Вычислите массу простого эфира, полученного из 25 г метанола по реакции межмолекулярной дегидратации, если реакция протекает с 80% выходом. . (Ответ: 14,4 г)
Задача 3. Вычислите массу фенола, которую можно получить из 1500 г 25%-го раствора фенолята натрия при взаимодействии его с угольной кислотой (Н2СО3). (Ответ: 303,9 г)
Тема 19.
Задача 1. Массовая доля крахмала в картофеле составляет 20%. Рассчитайте массу глюкозы, которая может быть получена из картофеля массой 405 кг. Выход продукта равен 70%. (Ответ: 63 кг)
Задача 2. При полном гидролизе сахарозы образовалось 270 г смеси глюкозы и фруктозы. Определите массы сахарозы и воды, которые вступили в реакцию. (Ответ: 256,5 г сахарозы, 13,5 г воды)
