Учебное пособие для модульно-рейтинговой технологии обучения Бийск
| Вид материала | Учебное пособие |
- Методические рекомендации по организации учебного процесса с использованием модульно-рейтинговой, 554.48kb.
- Я. В. Вакула Нефтегазовые технологии Учебное пособие, 2652.31kb.
- Учебное пособие «управление персоналом» для студентов заочного обучения специальности, 1516.37kb.
- М. Н. Машкин Информационные технологии Учебное пособие, 2701.91kb.
- Учебное пособие Уфа 2005 удк 338 (075. 8) Ббк, 1087.66kb.
- Учебный план как средство реализации принципов модульно-рейтинговой технологии обучения, 68.67kb.
- О. Д. Картавцева интенсивный курс обучения изобразительной грамоте учебное пособие, 780.71kb.
- Менеджмента качества положение о модульно-рейтинговой системе квалиметрии учебной деятельности, 1381.23kb.
- Учебное пособие 28365942 Москва 2008 ббк 66., 2986.28kb.
- Формирование профессиональной компетентности будущих специалистов в области вычислительной, 372.85kb.
Теория электролитической диссоциации С. Аррениуса содержит следующие положения:
1) при растворении в воде (или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы (подвергаются электролитической диссоциации);
2) под действием электрического тока катионы (+) двигаются к катоду (-), а анионы (-) – к аноду (+);
3) электролитическая диссоциация – процесс обратимый (обратная реакция называется моляризацией);
4) степень электролитической диссоциации α (Приложение Г) зависит от природы электролита и растворителя, температуры и концентрации. Она показывает отношение числа молекул, распавшихся на ионы (n), к общему числу молекул, введенных в раствор (N):
 . (2.37)
. (2.37)Степень диссоциации слабого электролита можно связать с изотоническим коэффициентом. Будем считать, что из N молекул электролита продиссоциировало n молекул, образовав νn ионов (ν – число ионов, на которое диссоциирует молекула). Поскольку изотонический коэффициент показывает, во сколько раз общее число молекул и ионов в растворе больше числа молекул до диссоциации, получаем:
 , (2.38)
, (2.38) . (2.39)
. (2.39)Соотношение (2.39) дает возможность, экспериментально определив изотонический коэффициент раствора, рассчитать степень диссоциации слабого электролита.
Однако теория С. Аррениуса не учитывала всей сложности явлений в растворах. В частности, она рассматривала ионы как свободные, независимые от молекул растворителя частицы. Теории С. Аррениуса противостояла химическая, или гидратная, теория растворов Д.И. Менделеева, в основе которой лежало представление о взаимодействии растворенного вещества с растворителем. Кажущееся противоречие обеих теорий было устранено предположением о гидратации ионов (И.А. Каблуков).
Сольватация – взаимодействие между молекулами и ионами растворяемого вещества и молекулами растворителя, состоит из нескольких стадий:
а) Молекулярная диссоциация и образование сольватов (рисунок 2.5).
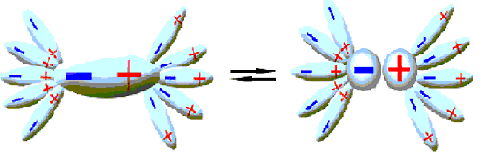
Рисунок 2.5 – Процесс образования сольватов
 ,
,где АВ – молекулы растворяемого вещества;
S – молекулы растворителя.
б) Ионизация и электролитическая диссоциация (рисунок 2.6).
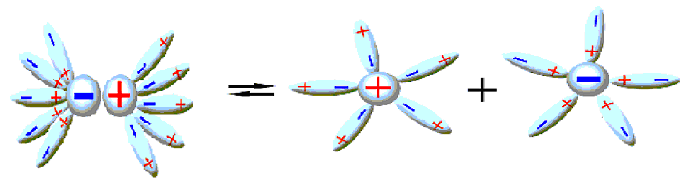
Рисунок 2.6 – Электролитическая диссоциация
 .
.Электролитическая диссоциация − это процесс распада молекул веществ на ионы под действием полярных молекул растворителя, а также при их плавлении.
Если процесс сольватации останавливается на стадии (a), то образуется раствор неэлектролита (подчиняется законам Рауля, принципу Вант-Гоффа) – раствор сахара в воде.
Если процесс протекает до стадии (б), то система является раствором электролита: растворы щелочей, солей, неорганических кислот в воде.
Механизм электролитической диссоциации ионных веществ можно представить следующим образом.
При растворении соединений с ионными связями (например, NaCl) процесс гидратации начинается с ориентации диполей воды вокруг всех выступов и граней кристаллов соли.
Ориентируясь вокруг ионов кристаллической решетки, молекулы воды образуют с ними либо водородные, либо донорно-акцепторные связи. При этом процессе выделяется большое количество энергии, которая называется энергией гидратации.
Энергия гидратации, величина которой сравнима с энергией кристаллической решетки, идет на разрушение кристаллической решетки. При этом гидратированные ионы слой за слоем переходят в растворитель и, перемешиваясь с его молекулами, образуют раствор.
Механизм электролитической диссоциации полярных веществ можно представить следующим образом.
Аналогично диссоциируют и вещества, молекулы которых образованы по типу полярной ковалентной связи. Вокруг каждой полярной молекулы вещества (например, HCl) определенным образом ориентируются диполи воды. В результате взаимодействия с диполями воды полярная молекула еще больше поляризуется и превращается в ионную, далее уже легко образуются свободные гидратированные ионы.
2.7.2 Вопросы для самоконтроля
- Что такое сольваты?
- Что называется электролитической диссоциацией, или ионизацией?
- Кто и когда предложил теорию электролитической диссоциации?
- Сформулируйте основные положения теории электролитической диссоциации.
- Какая химическая связь существует в молекулах электролитов?
- Как происходит диссоциация электролитов с ионной связью? Покажите схематически на примере.
- Как происходит диссоциация электролитов с полярной связью? Покажите на примере.
- Что называется степенью диссоциации?
- Каким соотношением связаны между собой изотонический коэффициент и степень электролитической диссоциации?
2.8 Теории кислот и оснований
2.8.1 История развития представлений о кислотах
и основаниях
Множество химических реакций может быть рассмотрено с позиций кислотно-основных взаимодействий. Такие вопросы, как трактовка механизмов реакций, кислотный и основной катализ, влияние различных факторов на ход процесса, в основном базируются на учете кислотно-основных взаимодействий. Овладеть оценкой кислотно-основных взаимодействий − это значит понять сущность химической реакции и иметь возможность управлять ею.
Представления о кислотах и основаниях существуют более трех столетий, но до сих пор нет единого определения этих понятий. Рассмотрим кратко эволюцию взглядов на природу кислот и оснований. Термины «кислоты» и «основания» сформировались еще в XVII веке, однако их содержание неоднократно пересматривалось и уточнялось. Лишь в конце прошлого века после появления теории электролитической диссоциации (С. Аррениус, 1887 г.) сформировалась первая научная ионная теория кислот и оснований (Д. Оствальд, С. Аррениус).
Важной вехой в развитии взглядов на кислоты и основания явилось сформулированное А. Ганчем в 1917–1927 годах понятие об амфотерности − способности некоторых соединений проявлять как кислотные, так и основные свойства в зависимости от условий и природы реагентов, участвующих в кислотно-основном взаимодействии. И, как оказалось позже, таких соединений (проявляющих амфотерность) − подавляющее большинство. В зависимости от природы партнера по взаимодействию явная кислота может выступать в роли основания и наоборот.
Доминирующие в настоящее время протонная (И. Бренстед и Т. Лаури) и электронная (Г. Льюис) теории кислот и оснований были предложены одновременно в 1923 году.
Академиком АН Казахской ССР физиком-химиком М.И. Усановичем была предпринята попытка объединить электронную и протонную теории. В 1938 г. М.И. Усанович разработал оригинальную теорию кислот и оснований, положив в основу представление, что водород не является универсальным носителем кислотных свойств. Он отнес к кислотам все вещества, образующие соли при взаимодействии с основаниями. Все окислительно-восстановительные и протолитические реакции оказывались частным случаем кислотно-основных взаимодействий. Кроме того, М.И. Усанович считал, что амфотерность присуща всем полярным соединениям.
В современной химии используются две теории кислот и оснований: теория Бренстеда − Лаури и теория Льюиса − Усановича. Более общие определения кислот и оснований предложены в теории Льюиса – Усановича.
2.8.2 Кислоты и основания в теории С. Аррениуса
С. Аррениус объяснял появление ионов в водном растворе (или расплаве) распадом растворенных веществ − электролитов.
Аррениус из всех ионов выделил ионы H+ и OH- как продукты автодиссоциации воды:
 .
.Затем он высказал утверждение, что кислотой называют электролит, диссоциирующий в растворах с образованием ионов Н+; основанием называют электролит, диссоциирующий в воде с образованием гидроксид-ионов ОН
 :
:кислоты:
 ;
;основания:
 .
.Кислоты и основания, для которых степень распада на ионы (степень электролитической диссоциации) имеет значение, близкое к единице, были названы С. Аррениусом сильными (HNO3, NaOH), а все остальные – слабыми (HNO2, NH3 . H2O).
Слабые кислоты можно было сравнить по силе, используя значения констант диссоциации кислот KДК, а слабые основания − по значениям констант диссоциации оснований KДО. Чем выше значение констант диссоциации KД, тем более сильным считался слабый электролит-кислота или слабый электролит-основание.
 ,
, .
. ,
, .
.Сильные же кислоты и основания с точки зрения теории кислот и оснований, предложенной С. Аррениусом, никак не характеризовались количественно, их сила просто считалась наибольшей.
2.8.3 Протонная теория кислот и оснований
