Учебное пособие для модульно-рейтинговой технологии обучения Бийск
| Вид материала | Учебное пособие |
- Методические рекомендации по организации учебного процесса с использованием модульно-рейтинговой, 554.48kb.
- Я. В. Вакула Нефтегазовые технологии Учебное пособие, 2652.31kb.
- Учебное пособие «управление персоналом» для студентов заочного обучения специальности, 1516.37kb.
- М. Н. Машкин Информационные технологии Учебное пособие, 2701.91kb.
- Учебное пособие Уфа 2005 удк 338 (075. 8) Ббк, 1087.66kb.
- Учебный план как средство реализации принципов модульно-рейтинговой технологии обучения, 68.67kb.
- О. Д. Картавцева интенсивный курс обучения изобразительной грамоте учебное пособие, 780.71kb.
- Менеджмента качества положение о модульно-рейтинговой системе квалиметрии учебной деятельности, 1381.23kb.
- Учебное пособие 28365942 Москва 2008 ббк 66., 2986.28kb.
- Формирование профессиональной компетентности будущих специалистов в области вычислительной, 372.85kb.
б) высокая растворимость может быть следствием образования водородных связей (спирт – вода).
в) если растворение вещества является экзотермическим процессом, то с повышением температуры его растворимость уменьшается (например, Ca(OH)2 в воде) и наоборот.
2.5.1.3 Растворимость газов в жидкостях
Растворение газа в жидкости, как правило, является процессом экзотермическим, поэтому с ростом температуры растворимость газов в жидкости уменьшается (принцип Ле Шателье).
Однако растворение газов в органических жидкостях нередко сопровождается поглощением теплоты, в подобных случаях с ростом температуры растворимость газов увеличивается. Такие процессы возможны между веществами, резко отличающимися по своей природе: неполярным газом и полярной жидкостью.
Так как при растворении газообразных веществ в жидкости объем уменьшается, то давление способствует росту растворимости газов.
С повышением давления растворимость газов в жидкостях увеличивается, а с понижением уменьшается.
Эта зависимость выражается законом Генри − Дальтона: растворимость газа в жидкости при постоянной температуре прямо пропорциональна его давлению над жидкостью:
 , (2.21)
, (2.21)где k − коэффициент пропорциональности, зависящий от природы газа;
С − концентрация растворенного газа в жидкости.
Закон Генри – Дальтона справедлив только для разбавленных растворов при малых давлениях, когда газы можно считать идеальными. Газы, способные к специфическому взаимодействию с растворителем, данному закону не подчиняются.
Растворимость газов в жидкости сильно зависит от концентрации других растворенных веществ.
2.5.1.4 Растворимость жидкостей в жидкостях
Она может быть полной (спирт – вода), ограниченной (вода – анилин), и жидкости могут быть практически нерастворимыми друг в друге. Как правило, растворимость жидкости в жидкости растет с температурой, и при некоторой критической температуре наблюдается полная взаимная растворимость.

Рисунок 2.2 − Диаграмма растворимости системы «анилин – вода»
Зависимость концентрации растворов от температуры принято изображать графически с помощью диаграммы взаимной растворимости. Эта диаграмма для системы «анилин − вода» приведена на рисунке 2.2. Область под кривой – это область расслаивания жидкостей. Повышение температуры приводит к увеличению концентрации каждого из растворов (увеличению взаимной растворимости), и при некоторой температуре, называемой критической температурой расслоения (Ткр), взаимная растворимость воды и анилина становится неограниченной. Система «анилин – вода» относится к системам с верхней критической температурой расслоения; существуют также и системы, для которых повышение температуры приводит к уменьшению взаимной растворимости компонентов.
Взаимное растворение жидкостей обычно не сопровождается значительным изменением объема. Поэтому взаимная растворимость жидкостей мало зависит от давления и заметно возрастает лишь при высоких давлениях.
2.5.1.5 Растворимость твердых веществ в жидкостях
Растворимость твердых веществ в жидкостях для большинства веществ увеличивается с увеличением температуры, а давление практически не влияет на растворимость. Добавки посторонних веществ снижают растворимость данного вещества − меньше свободных молекул растворителя (эффект высаливания).
Высаливание – выделение растворенного вещества из раствора прибавлением другого вещества (чаще всего соли), обладающего большей растворимостью. Например, при добавлении Na2СО3 в раствор СаСО3 повысится концентрация иона СО32- и поэтому уменьшится концентрация иона Са2+ и соответственно снизится растворимость СаСО3. Таким методом можно осаждать из раствора малорастворимые электролиты.
Скорость растворения твердых веществ зависит от их дисперсности – измельченный порошок растворяется быстрее первоначального продукта.
На кафедре неорганической химии Санкт-Петербургского университета, которую возглавлял с 1934 по 1977 гг. С.А. Щукарев, проводились термохимические исследования растворов электролитов и твердых фаз. В соответствии с законом С.А. Щукарева, скорость процесса кристаллизации и обратного процесса растворения определяется скоростью подвода или отвода вещества к поверхности кристалла и описывается уравнением:
 , (2.22)
, (2.22)где − коэффициент массоотдачи;
Cp − концентрация насыщения;
C − концентрация пересыщения;
S – площадь поверхности кристалла.
Закон распределения Нернста – Шилова: вещество, способное растворяться в двух несмешивающихся растворителях, распределяется между ними так, что отношение его концентраций в этих растворителях при постоянной температуре остается постоянным, независимо от общего количества растворенного вещества:
 , (2.23)
, (2.23)где Крас – коэффициент распределения;
Са и Сb – молярные концентрации веществ в растворах А и В, моль/л.
2.5.2 Примеры решения задач
Задача 1
Растворимость хлорида натрия (поваренная соль) NaCl в воде при обычной температуре (20 °С) составляет 31,6 г в 100 г воды. Рассчитать содержание соли в 10 г насыщенного раствора хлорида натрия.
| Дано: m(NaCl) = 31,6 г; m(H20) = 100 г; m(р-ра) = 10 г; раствор насыщенный | Решение: Определим массу воды в 10 г насыщенного раствора NaCl. Примем массу хлорида натрия в этом растворе за х г, тогда масса воды будет равна (10 – х) г. |
| Найти: m(NaCl)в р-ре |
Составим соотношение:
100 г воды (раствор насыщенный) − 31,6 г NaCl
(10 – х) воды (раствор насыщенный) − х г NaCl.
Отсюда 100/(10 – х) = 31,6/х, и х = 2,4 г хлорида натрия. Масса воды в этом растворе: 10 – 2,4 = 7,6.
Ответ: 2,4 г хлорида натрия.
Задача 2
Рассчитать растворимость нитрата калия в воде при обычной температуре (20 °С), если при выпаривании 50 г насыщенного раствора масса сухой соли оказалась равной 13,02 г.
| Дано: m(р-ра)насыщенный = 50 г; m(KNO3) = 13,02 г | Решение: Масса нитрата калия в 100 г раствора равна 13,02∙100/50 = 26,04. Эта масса нитрата калия приходится на 100 – 26,04 = 73,96 воды в насыщенном растворе. Составляем соотношение: |
| Найти: растворимость KNO3 |
26,04 г KNO3 – 73,96 г воды
х г KNO3 – 100 г воды.
Откуда х = 26,04∙100/73,96 = 35,2.
Ответ: растворимость нитрата калия, т. е. масса растворенного вещества в насыщенном растворе, приходящаяся на 100 г воды, равна 35,2 г.
2.5.3 Вопросы для самоконтроля
1. Что такое насыщенные, пересыщенные и ненасыщенные растворы?
2. Что называют коэффициентом растворимости?
3. Как делятся вещества по растворимости? Приведите примеры.
4. От каких факторов зависит растворимость веществ?
5. Что такое разбавленный и концентрированный растворы?
6. Посмотрите на рисунок 2.1. Какие вещества можно очищать перекристаллизацией? Можно ли этим приемом очистить хлорид натрия?
7. Сформулируйте закон распределения Щукарева и Нернста − Шилова.
2.6 Общие свойства растворов
Свойства разбавленных растворов, зависящие только от количества нелетучего растворенного вещества, называются коллигативными (общими) свойствами. К ним относятся понижение давление пара растворителя над раствором, повышение температуры кипения и понижение температуры замерзания раствора, а также осмотическое давление.
2.6.1 Закон Рауля
Любая жидкость испаряется. Давление пара в состоянии равновесия называется давлением насыщенного пара. При данной температуре давление насыщенного пара над каждой жидкостью есть величина постоянная.
Давление пара над раствором отличается от давления пара над чистым веществом. Почему? При растворении вещества В в веществе А число молекул А в единице объема жидкости уменьшается, а значит, снижается и их число, приходящееся на единицу поверхности испаряющейся жидкости. Из-за этого уменьшается скорость испарения растворителя (воды) и снижается давление (парциальное) насыщенного пара растворителя над раствором.
Парциальное давление – давление, которое имел бы газ, входящий в состав газовой смеси, если бы он один занимал объем, равный объему смеси при той же температуре.
Для некоторых растворов выполняется следующая закономерность, которую называют первым законом Рауля (1887 г.). Парциальное давление насыщенного пара компонента раствора (Pi) прямо пропорционально его мольной доле в растворе (хi), причем коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом (
 ):
):  . (2.24)
. (2.24)Поскольку сумма мольных долей всех компонентов раствора равна единице, для бинарного раствора, состоящего из компонентов А и В, легко получить следующее соотношение, также являющееся формулировкой первого закона Рауля. Относительное понижение давления пара растворителя над раствором равно мольной доле растворенного вещества и не зависит от природы растворенного вещества:
 , (2.25)
, (2.25)где
 и
и  – давление насыщенного пара растворителя над чистым растворителем и над раствором, Па;
– давление насыщенного пара растворителя над чистым растворителем и над раствором, Па;хВ – мольная доля растворенного вещества.
Если оба компонента А и В раствора летучи, то закон Рауля выполняется для каждого из компонентов:
 , (2.26)
, (2.26) , (2.27)
, (2.27)где PА и PВ − парциальные давления легколетучих компонентов.
Общее давление пара над раствором равно сумме парциальных давлений PА и PВ.
 (2.28)
(2.28)то есть давление пара линейно зависит от состава раствора.
В идеальных растворах закон Рауля выполняется для обоих компонентов во всем интервале составов. К таким системам относятся, например, системы «бензол – толуол», «гексан – гептан», смеси изомерных углеводородов (рисунок 2.3).

Рисунок 2.3 − Зависимость парциальных и общего давлений пара
идеального раствора от концентрации
В реальных предельно разбавленных растворах для растворителя выполняется закон Рауля, а для растворенного вещества выполняется закон Генри − Дальтона. В идеальных растворах закон Генри совпадает с законом Рауля.
Если измерить давление пара чистой воды при температуре 20 °С, то оно окажется равным 2333 Па. Если приготовить раствор сахарозы С12Н22О11 (сахар) с мольной долей сахарозы 0,1, в котором мольная доля воды будет составлять (1 – 0,1) = 0,9, то давление пара воды должно понизиться до 2333·0,9 = 2100 Па. Это значение верно только для идеального раствора. У реального раствора с высокой концентрацией растворенного вещества давление пара воды будет несколько иным, но будем полагать, что имеем дело с идеальными растворами.
Самое удивительное обнаружится, если вместо сахарозы возьмем хлорид натрия NaCl и приготовим раствор с той же мольной долей растворенного вещества – 0,1. У этого раствора давление пара воды будет составлять около 1866 Па. Постарайтесь объяснить этот очень важный факт.
Возьмем теперь раствор хлорида кальция CaCl2 с той же мольной долей (0,1) этого вещества. Давление пара воды этого раствора равно приблизительно 1633 Па. Объясните причину столь значительного понижения давления пара воды.
Продолжим эксперимент теперь с раствором хлорида алюминия с той же мольной долей. Окажется, что давление насыщенного пара воды над этим раствором будет составлять около 1400 Па.
Если вы обнаружили некоторую зависимость в изменении
давления насыщенного пара воды над раствором от природы растворенного вещества, то предскажите давление пара воды над раствором сульфата алюминия Al2(SО4)3 с его мольной долей, равной 0,1.
Первое следствие из закона Рауля: повышение температуры кипения Ткип пропорционально моляльной концентрации раствора:

 , (2.29)
, (2.29)где Кэ – эбулиоскопическая постоянная растворителя;
Сm – моляльная концентрация, моль/1000 г .
Второе следствие из закона Рауля: понижение температуры замерзания Тзам пропорционально моляльной концентрации раствора:
 , (2.30)
, (2.30)где Кк – криоскопическая постоянная.
Эбулиоскопические и криоскопические постоянные Кк и Кэ зависят от природы растворителя и могут быть определены по уравнениям:
 , (2.31)
, (2.31)где Нкип. – удельная теплота испарения, Дж/г;
Ткип. – температура кипения чистого растворителя, K;
R – универсальная газовая постоянная, 8,31 Дж/моль∙K.
 , (2.32)
, (2.32)где Нкриcт. – удельная теплота кристаллизации, Дж/г;
Ткрист. – температура кристаллизации чистого растворителя, К.
Криоскопический и эбулиоскопический методы изучения веществ в растворенном состоянии позволяют определять мольные массы растворенных веществ. Суть определения чрезвычайно проста: необходимо найти такую концентрацию растворенного вещества, выраженную в [г/л] раствора, при которой понижение температуры замерзания или повышение температуры кипения равнялись соответственно криоскопической или эбулиоскопической постоянным.
В этом случае в 1 л раствора будет содержаться 1 моль растворенного вещества и число граммов этого вещества будет равно его мольной массе. Это относится к неэлектролитам. В случае раствора электролита криоскопический и эбулиоскопический методы позволяют определить степень его диссоциации.
Обычно размерность при эбулиоскопической и криоскопической постоянных не указывают. Какова их размерность?
Эбулиоскопическая постоянная есть повышение температуры кипения одномоляльного водного раствора неэлектролита. Криоскопическая постоянная есть понижение температуры замерзания одномольного водного раствора неэлектролита. Этот вывод правилен только в том случае, если раствор идеальный. Однако раствор с концентрацией растворенного вещества 1 моль/л не является идеальным раствором, и эбулиоскопический и криоскопический методы исследования растворов применяют при концентрациях растворенного вещества не выше 0,01 моль/л (правильнее: 0,01 моль/1000 г растворителя).
Еще раз повторяем, что сказанное верно лишь для разбавленных растворов и при использовании моляльной концентрации (моль/1000 г растворителя).
2.6.2 Осмотическое давление
Явление, связанное со способностью проходить через мембрану молекул растворителя из менее концентрированного раствора в более концентрированный раствор, называется осмосом, а вызываемое им изменение давления по обе стороны мембраны – осмотическим давлением. Явление осмоса чрезвычайно разнообразно и во многом определяется природой мембраны и компонентов раствора.
Представим, что сосуд с двумя горлами для добавления раствора разделен мембраной (рисунок 2.4). В каждую часть сосуда зальем растворы, отличающиеся только концентрацией. Поскольку молярные концентрации растворителя по обе стороны мембраны не совпадают, то стремление их к выравниванию приведет к переходу части растворителя в ту часть сосуда, где концентрация растворенного вещества больше. Увеличение количества растворителя эквивалентно возрастанию давления, и если мембрана способна к деформации, она изогнется в сторону с меньшей концентрацией растворенного вещества (рисунок 2.4а). Если мембрана жесткая, то в отсеке с большей концентрацией количество растворителя будет возрастать до тех пор, пока гидростатическое давление h (рисунок 2.4б) не станет равным осмотическому давлению и не прекратит осмос.
Если внешнее давление больше атмосферного и приложено к более концентрированному раствору, то растворитель будет переходить в разбавленный раствор – явление обратного осмоса.
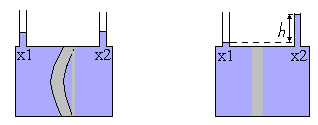
а б
Рисунок 2.4 − Схема разности осмотических давлений для
концентрации x1
Осмотическое давление, π – внутреннее давление растворенного вещества, численно равное тому внешнему давлению, которое нужно приложить, чтобы прекратить осмос; оно зависит от температуры и концентрации.
Согласно Вант-Гоффу осмотическое давление раствора численно равно тому газовому давлению, которое имело бы растворенное вещество, будучи переведенным в газообразное состояние в том же объеме и при той же температуре. Для растворов неэлектролитов невысоких концентраций зависимость осмотического давления от концентрации и температуры раствора выражается принципом Вант-Гоффа:
 , (2.33)
, (2.33)где СМ – молярная концентрация, моль/л;
R – универсальная газовая постоянная, 8,31 Дж/моль;
T– температура раствора, K.
Если растворы характеризуются одинаковыми осмотическими давлениями, то по Я.Х. Вант-Гоффу такие растворы называются изотоническими. Независимо от природы растворенного вещества, изотоничность является следствием одинакового числа частиц в растворе.
Законы Рауля и принцип Вант-Гоффа не выполняются для растворов (даже бесконечно разбавленных), которые проводят электрический ток – растворов электролитов. Обобщая экспериментальные данные, Вант-Гофф пришел к выводу, что растворы электролитов всегда ведут себя так, будто они содержат больше частиц растворенного вещества, чем следует из аналитической концентрации: повышение температуры кипения, понижение температуры замерзания, осмотическое давление для них всегда больше, чем вычисленные. Для учета этих отклонений Вант-Гофф внес в уравнение (2.22) для растворов электролитов поправку – изотонический коэффициент i:
 . (2.34)
. (2.34)Аналогичная поправка вносится в законы Рауля, и изотонический коэффициент определяется из экспериментальных данных следующим образом:
 . (2.35)
. (2.35)Изотонический коэффициент для растворов электролитов всегда больше единицы, причем с разбавлением раствора значение i возрастает до некоторого целочисленного значения. Для растворов электролитов принцип Вант-Гоффа не выполняется, так как при растворении реальное число частиц может отличаться от числа растворенных молекул. По определению изотонический коэффициент − это отношение всех частиц к числу растворенных:
 , (2.36)
, (2.36)где N1 − число всех частиц, находящихся в растворе;
N2 − число растворенных молекул.
В бензольном растворе уксусной кислоты изотонический коэффициент i меньше 1, так как в этом растворе число частиц меньше числа растворенных молекул в результате реакции ассоциации в соответствии с уравнением:
 .
.Если же в растворе преобладает не ассоциативный, а диссоциативный или ионизационный механизмы взаимодействия, то изотонический коэффициент i больше 1. Так, в водном растворе уксусная кислота диссоциирует:
 ,
,и число частиц становится больше числа растворенных молекул.
Осмос и осмотическое давление имеют огромное значение в биологических явлениях, т. к. оболочки клеток биологических тканей являются полупроницаемыми перегородками. Вследствие осмоса вода и питательные растворы поднимаются из почвы по корням и далее по стволу растения на значительную высоту.
Осмотическое давление внутри живых клеток обусловливает прочность и упругость тканей, и благодаря ему осуществляется солевой обмен живой ткани с окружающей средой.
К коллигативным свойствам растворов относятся понижение давления пара растворителя над раствором, повышение температуры кипения, понижение температуры замерзания. Все эти свойства пропорциональны числу растворенных частиц.
2.6.3 Примеры решения задач
Задача 1
Вычислить температуры кристаллизации и кипения 2%-ного водного раствора глюкозы С6Н12О6.
| Дано: ω,% = 2 %; глюкоза С6Н12О6 | Решение: Для воды криоскопическая и эбулиоскопическая постоянные соответственно равны 1,86 кг∙K /моль и 0,52 кг∙K /моль. Понижение температуры кристаллизации 2%- ного раствора: Δtзам = 1,86 ∙ 2 1000/(180 ∙ 98) = 0,21 (0С). |
| Найти: tкип., tзам |
Вода кристаллизуется при температуре 0 0С, следовательно, температура кристаллизации раствора tзам = -0,21 (0С).
Повышения температуры кипения 2%-ного раствора С6Н12О6:
Δtкип = 0,52 ∙ 2 ∙ 1000/(180 ∙ 98) = 0,06 (0С).
Вода кипит при температуре 100 0С, следовательно, температура кипения этого раствора tкип = 100+ 0,06 = 100,06 (0С).
Ответ: tкип. = 100,06 0С, tзам = - 0,21 0С.
Задача 2
Раствор, содержащий 1,22 г бензойной кислоты С6Н5СООН в 100 г сероуглерода, кипит при температуре 46,529 0С. Температура кипения сероуглерода 46,3 0С. Вычислить эбулиоскопическую константу сероуглерода.
| Дано: m = 1,22 г; m1= 100 г; tкип.=46,529 0С; tкип.1 = 46,3 0С | Решение: Повышение температуры кипения: Δtкип = 46,529- 46,3 = 0,229 (0С). Один моль бензойной кислоты 122 г/моль. Из формулы находим эбулиоскопическую константу: Кэ = Δtкип Сm = 0.229 ∙ 122∙100/1,22∙1000 = = 2,29 (кг∙K /моль) . |
| Найти: Кэ |
Ответ: Кэ = 2,29 кг∙K /моль.
Задача 3
Раствор, содержащий 11,04 г глицерина в 800 г воды, кристаллизуется при температуре минус 0,279 0С. Вычислить молекулярную массу глицерина.
| Дано: m = 11,04 г; m1 = 800 г; tзам = - 0,279 0С | Решение: Температура кристаллизации чистой воды 0 0С, следовательно, понижение температуры кристаллизации: Δtзам = 0 - (- 0,279) = 0,279 (0С). Масса глицерина m (г), приходящаяся на 1000 г воды, |
| Найти: М |
m/m1 = 11,04 ∙ 1000/800 = 13,8.
Подставляем в уравнение данные:

 .
.Вычисляем молекулярную массу глицерина:М = 1,86 ∙ 13,8/0,279= = 92 (г/моль).
Ответ: М = 92 г/моль.
Задача 4
Вычислить массовую долю в процентах водного раствора мочевины (NH2)2CO, зная, что температура кристаллизации этого раствора равна минус 0,465 0С.
| Дано: tк(NH2)2CO) = - 0,465 0C | Решение: Температура кристаллизации чистой воды 0 0С, следовательно, Δt = = (-0,465) = 0,465 (0C). Зная, что молярная масса мочевины 60 г/моль, находим массу m (г) растворенного вещества, приходящуюся на 1000 г воды: |
| Найти: ω,% |
 .
.Общая масса раствора, содержащего 15 г мочевины, составляет 1000+15=1015 г. Массовая доля в процентах мочевины в данном растворе находится из соотношения:
В 1015 г раствора – 15 г вещества ;
В100 г раствора – х г вещества ;
х =1,48 (%) .
Ответ: ω,% = 1,48 % .
2.6.4 Вопросы для самоконтроля
1. Сформулируйте законы Рауля и принцип Вант-Гоффа для растворов.
2. Что такое осмотическое давление?
3. От чего зависят эбулиоскопическая и криоскопическая постоянные?
4. Что означает выражение насыщенный пар?
5. Приведите определение парциального давления.
6. Что означает изотонический коэффициент?
7. Когда следует солить воду при варке картофеля − в начале или в конце?
8. Почему через полупроницаемую перегородку проходят молекулы воды и не проходят ионы поваренной соли?
9. Над океаном или морем давление паров воды ниже, чем над озером или рекой с пресной водой. Почему влажность воздуха на берегу океана или моря выше по сравнению с влажностью воздуха около озера или реки? На берегу моря даже выстиранное белье высыхает очень долго.
10. В 1 л воды растворено 54 г глюкозы С6Н1206. Рассчитайте:
а) изменение давления насыщенного пара над раствором Δр;
б) изменение температуры кипения ΔТкип;
в) изменение температуры замерзания ΔТзам;
г) осмотическое давление раствора при 298 К.
11. Если измерять температуры замерзания 0,01 М растворов сахарозы, глюкозы, глицерина, то они окажутся равными минус 0,0186 °С, т. е. температуры замерзания понизятся на 0,0186 °С. Но понижение температуры замерзания раствора хлорида натрия NaCl той же концентрации окажется в два раза больше, раствора хлорида кальция CaCl2 – в три раза, а раствора хлорида алюминия AlCl3 – в четыре раза. Почему?
12. Почему при приготовлении варенья из слив, крыжовника или вишни плоды рекомендуют прокалывать?
2.7 Теория электролитической диссоциации
2.7.1 Общие положения
С. Аррениус обратил внимание на тесную связь между способностью растворов кислот, солей и оснований проводить электрический ток и отклонениями растворов этих веществ от законов Вант-Гоффа и Рауля.
