Методичні вказівки та контрольні завдання з біологічної хімії для студентів факультету заочного навчання
| Вид материала | Документы |
СодержаниеТема для самостійної підготовки студентів Заняття №2 Актуальність теми Зміст заняття Блок інформації Хід виконання практичного заняття Хід роботи. |
- Львівський національний медичний університет імені данила галицького кафедра біологічної, 1655.89kb.
- Програма, методичні вказівки та контрольні завдання з дисципліни «екологія» для студентів, 566.78kb.
- Робоча програма, методичні вказівки до вивчення дисципліни та контрольні завдання для, 393.01kb.
- Програма, методичні вказівки І контрольні завдання з дисципліни "основи екології" для, 325.1kb.
- Програма, методичні вказівки та контрольні завдання з дисципліни " виробництво виливків, 797.9kb.
- Типова програма, методичні вказівки та контрольні завдання для студентів навчального, 708.32kb.
- Програма, методичні вказівки та контрольні завдання з дисципліни «охорона праці в галузі», 339.25kb.
- Львівський національний медичний університет імені Данила Галицького кафедра біологічної, 1954.66kb.
- Робоча програма, методичні вказівки та індивідуальні завдання до вивчення дисципліни, 165.04kb.
- Програма, методичні вказівки та контрольні завдання з дисципліни " виробництво виливків, 864.84kb.
Тема для самостійної підготовки студентів
Біохімічні процеси при апоптозі.
Науково-дослідна робода студентів
Теми реферативних доповідей:
- Біологічна роль ДНК.
- Транспортні рибонуклеїнові кислоти, їх значення.
- Генетичний код, його роль.
Література
ОСНОВНА:
- Вороніна Л.Н., Десенко В.Ф., Мадієвська Н.Н. та інші. Біологічна хімія.- Харків: Основа, 2000.-С.62-65,72-73,81-108.
- Гонський Я.І., Максимчук Т.П. Біохімія людини. Київ-Тернопіль: Укрмедкнига, 2001.-С.54-56,61,435-447.
- Губський Ю.І. Біологічна хімія. Київ-Тернопіль:Укрмедкнига, 2000.-С.41-56, 68.
- Березов Т.Т., Коровкин Б.Ф. Биологическая химия. М.:Медицина,1990. – С.71-91.
- Біологічна хімія. Тести та ситуаційні задачі / За ред.О. Я.Склярова. – Львів.:Світ.2006. –С. 27-31.
- Савицкий И.В.Биологическая химия.К.:Вища школа, 1982. – С.162-174.
- Николаев А.Я. Биологическая химия. М.: Высшая школа, 1989.-С.92-100.
- Строев Е.А. Биологическая химия. М.: Высшая школа, 1986. – С. 69-84.
ДОДАТКОВА:
- Ленинджер А. Биохимия. М.: Мир, 1974. –С.284-310.
- Страйхер Л. Биохимия М.: мир, 1984.-т.1.-232 с.
- Бышевский А.Ш., Терсенов О.А. Биохимия для врача. Екатеринбург: Уральский рабочий, 1994.- С. 56 – 64.
- Ангельські С., Якубовські З., Домінічак М.Г. Клінічна біохімія. Сопот, 1998.-451с.
НАУКОВА:
- Семенов И.А., Вольбух Т.В. Гидратация и структурное состояниє ДНК из печени крыс в зоне Чернобыльской АЭС. Радиоционная биология, Реднобиология, 1994,34,№3, 328 – 335.
- Караулов А.В., Москалева Е.Ю. Структура ДНК лимфоцитов переферической крови человека и их способность к репарации. Вопросы медицинской химии, 994, т.40, №2,73 –79.
ЗАНЯТТЯ №2
Тема заняття. ЗАГАЛЬНІ ВЛАСТИВОСТІ ФЕРМЕНТІВ
Мета заняття: Засвоїти принципи організації та загальні властивості ферментів. Оволодіти методом визначення активності амілази слини і на її прикладі вивчити вплив температури та рН середовища на активність ферментів.
Актуальність теми: У зв'язку з тим, що завдяки ферментам забезпечується протікання та регуляція різних метаболічних реакцій, знання будови, ролі та функціонування ферментів, а також факторів, що впливають на їх активність, є необхідним для розуміння життєдіяльності клітини в цілому та перебігу чисельних біохімічних реакцій в організмі. Характерним прикладом для вивчення загальних властивостей ферментів є амілаза слини.
Конкретна мета: Вміти:1.Вміти виділяти окремі ферменти та розуміти принципи їх організації. 2.Оцінити вплив температури та рН середовища на активність ферментів. 3.Оволодіти методом визначення активності амілази слини. 4.Оцінити клініко-діагностичне значення зміни активності амілази в сироватці крові.
Міжкафедральна інтеграція: Знати:1.Будову білкових молекул (каф. біоорганічної хімії). 2.Основні ознаки каталітичних процесів (каф. біонеорганічної хімії). 3.Будову слинних залоз (каф. гістології). 4.Механізм секреції слини (каф. нормальної фізіології).
ЗМІСТ ЗАНЯТТЯ
Питання для самопідготовки :
Поняття про ферменти. Спільні та відмінні властивості між ферментами та неорганічними каталізаторами. Термолабільність ферментів. Специфічність дії ферментів.
- Будова простих ферментів. Функціонально активні ділянки ферментативної молекули. Загальна характеристика коферментів. Їх природа, зв’язок з апоферментом та значення для ферментативного перетворення.
- Сучасні уявлення про механізм дії ферментів та кінетику ферментативних реакцій.
- Залежність швидкості ферментативної реакції від температури, рН середовища, концентрації субстрату і ферменту. Константа Міхаеліса.
- Множинні форми ферментів (ізоферменти). Їх структурні і функціональні особливості. Клінічне значення визначення ізоферментів лактатдегідрогенази.
- Рівні структурної організації ферментів. Мультиферментні комплекси, ферментативні ансамблі, поліфункціональні ферменти, їх переваги.
- Вплив іонізуючого випромінювання і різних екологічних факторів на будову і функціонування ферментів.
- Клініко-діагностичне значення визначення активності ферментів.
- Препарати ферментів як лікарські засоби.
Блок інформації
Ферменти – це біологічні каталізатори білкової природи, які забезпечують прискорення і координацію численних метаболічних процесів в живих організмах. Між ферментами і каталізаторами неорганічної природи існують певні спільні та відмінні ознаки. Спільним для них є те, що ферменти, як і неорганнічні каталізатори, не можуть прискорювати термодинамічно неможливі реакції, а лише каталізують ті реакції, які можуть відбуватись і без них, однак із значно меншою швидкістю. Ферменти і неорганічні каталізатори не використовуються під час реакції і не входять до складу кінцевих продуктів, не зміщують хімічної рівноваги, а тільки прискорюють її встановлення.
Ферменти за хімічною структурою є простими і складними білками. Їх каталітична активність залежить від ступеня збереження нативної білкової структури. Під впливом денатуруючих агентів втрачається каталітична активність ферментів. Отже, для ферментативної активності білків важливе значення має збереження їх первинної, вторинної та третинної структур.
Останнім часом у науковій літературі з'явилася інформація про те, що біокаталітичну активність можуть мати певні молекули РНК, так мала ядерна РНК каталізує відщеплення інтронних послідовностей.
Прості ферменти складаються тільки із залишків амінокислот, тому вони ще називаються однокомпонентними. Складні ферменти складаються з білка та небілкової частини і називаються двокомпонентними. Білкова частина двокомпонентних ферментів називається апоферментом, а молекула в цілому – холоферментом, небілковий компонент прийнято називати кофактором. Сполучення білкової частини ферменту з небілковою здійснюється за рахунок іонних, водневих і рідше ковалентних зв'язків, а також гідрофобних взаємодій.
Зв'язок між білковою і небілковою частинами фермента може бути різної міцності. Небілкові компоненти, які слабо пов'язані з білком і легко дисоціюють, прийнято називати коферментами. Коферменти знаходяться у вільному стані та сполучаються з білковою частиною тільки в момент каталітичної реакції. Їх можна розділити шляхом діалізу.
Один і той же кофермент може сполучатися з різними білками. Саме білкова частина визначає специфічність дії складного ферменту. Коферменти діють як акцептори або донори атомів і функціональних груп, що відокремлюють їх від субстрату або приєднують до нього. У зв'язку з цим вважають, що більш правильно розглядати коферменти як косубстрати.
Якщо небілкова частина ферменту міцно пов'язана з білком і в циклі біохімічних реакцій не відділяється від нього, її прийнято називати простетичною групою. Однак різкої відмінності між коферментами і простетичними групами не існує. Ступінь міцності зв'язку білкової частини з небілковими компонентами може змінюватися в широких межах.
Кофактори. Для біологічної дії більшості ферментів необхідна наявність певних низькомолекулярних небілкових сполук – кофакторів. Роль кофакторів можуть грати органічні сполуки різної хімічної природи або іони металів (Mg2+, Ca2+, Fe3+, Fe2+, Cu2+, Cu+ тощо).
Іони металів пов’язані з апоферментом або входять до складу небілкової простетичної групи – найчастіше порфіринового кільця гемінових ферментів (цитохромів, пероксидаз, каталази). Ферменти, які міцно пов’язані з іонами металів і не втрачають цього зв’язку за умов виділення та фракціонування ферменту, називаються металоферментами.
У деяких випадках іони металів не входять до складу ферментів як інтегральні структурні компоненти, а виконують лише функцію їх активаторів.
Коферменти (коензими) – біоорганічні сполуки небілкової природи, які є необхідними для дії ферменту, тобто перетворення субстрату в каталітичному акті.
Ферменти забезпечують прискорення перебігу хімічних перетворень внаслідок зниження енергії активації та енергетичного бар’єру прямої реакції. У процесі каталізу фермент утворює з субстратом комплекс. Утворення комплексу поділяють на три стадії. На першій відбувається сполучення субстрату з активним центром фермента. Ця стадія є швидкою і залежить від концентрації компонентів і активності їх дифузії. На другому етапі відбувається перетворення комплексу в активну форму. При цьому субстрат змінює свою структуру і стає доступним для наступних перетворень. Часто тут відбувається розрив одних зв’язків і утворення інших. Другий етап найбільш довготривалий і лімітує загальну швидкість реакції каталізу. На третьому етапі завершується ферментативне перетворення субстрату, утворення продуктів реакції та їх вивільнення з активного центру. Зниження енергії активації при ферментативному каталізі обумовлене кількома ефектами: ефектом зближення і оріентації, який забезпечує упорядковане розміщення активованих груп і сприяє зниженню ентропії; ефектом деформації субстрату, ефектом електро- та нуклеофільної взаємодії, що призводить до перерозподілу густини заряду та поляризації зв’язків.
На активність ферментів значний вплив мають іонізуюче випромінювання та різні екологічні фактори. Їх дія може бути як прямою, через повну або часткову денатурацію ферментативного білка та негативний вплив на простетичну групу, так і опосередкованою, через механізм генетичного кодування та синтезу нових молекул ензимів.
-
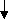 Основні властивості ферментів
Основні властивості ферментів

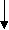
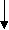
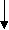




Вплив співвід-ношення концентрацій ферменту і суб-
страту




Ізоферменти – це ферменти, що каталізують однакові реакції, але мають генетично зумовлені відмінності первинної структури, відрізняються набором і співвідношенням субодиниць та різною каталітичною активністю в різних середовищах. Множинні форми характерні для більшості ферментів рідин та тканин організму і змінюються при різних станах та патологічних процесах. Ізоферментні форми відрізняються за властивостями, амінокислотним складом, імунобіологічними характеристиками, електрофоретичною рухливістю. Сьогодні виявлено і виділено ізоферменти у більшості ферментів людського організму. Детально вивчено ізоферменти лактатдегідрогенази. Цей фермент складається з чотирьох субодиниць двох типів: Н і М. В залежності від їх співвідношення розрізняють п’ять ізоферментів лактатдегідрогенази, які позначають від ЛДГ1 до ЛДГ5. Для кожного органу властиві свої ізоферменти. Так ЛДГ1 переважає в серці, ЛДГ5 - в м’язах. При інфаркті міокарду суттєво зростає активність ЛДГ1, при захворюваннях печінки, м’язів та злоякісних новоутвореннях – ЛДГ4 та ЛДГ5.
Ферменти, які виконують різні реакції одного метаболічного шляху, можуть об’єднуватись в просторі і часі і утворювати мультиферментні комплекси. Розділення таких комплексів є досить важким завданням, а отримані поодинокі ферменти частково втрачають свою активність. Утворення надмолекулярних ферментативних комплексів дає можливість прискорювати загальну швидкість перетворення речовин по певному метаболічному шляху, оскільки скорочується час дифузії проміжних метаболітів та збільшується ймовірність їх наступного перетворення. Мультиферментні комплекси найчастіше локалізовані на поверхні окремих клітинних структур. Прикладом таких комплексів можуть служити ферменти дихального ланцюга на внутрішній мембрані мітохондрій, АТФ-синтетазний комплекс, піруватдегідрогеназний комплекс.
Основною метою ензимологічних досліджень у клініці є встановлення джерела походження ензиму та його активності. Більшість клітинних ферментів, визначення яких має клініко-діагностичне значення, – це ензими, що містяться у багатьох клітинах і органах. Прикладом використання ферментів в клініко-діагностичній практиці є визначення кількісного та якісного складу ферментів в плазмі крові при інфаркті міокарду, вірусному гепатиті, гострому панкреатиті. При цьому найчастіше визначають активність таких ферментів, як лактатдегідрогенази та її фракції, аспартат- та аланінамінотрансферази, альдолаза, пептидази.
Ферменти як фармакологічні засоби:
а) препарати, які використовуються переважно при гнійно-некротичних процеса – трипсин, хімотрипсин кристалічний, хімопсин, рибонуклеаза, дезоксирибонуклеаза, колагеназа, елластолітин, іруксол;
б) фібринолітичні препарати – фібринолізин, стрептоліаза (містить фермент стрептокіназу).
в) препарати, які покращують процеси травлення – пепсин, сік шлунковий натуральний, панкреатин (містить трипсин і амілазу), трифермент (містить трипсин, ліпазу, амілазу).
г) різні препарати ферментів – лідаза, ронідаза, цитохром С, лекозім (містить папаїн, хімопапаїн, лізозим), пеніциліназа.
ХІД ВИКОНАННЯ ПРАКТИЧНОГО ЗАНЯТТЯ
Д о с л і д 1. Дослідження гідролізу крохмалю амілазою слини.
Принцип методу: . Метод засновано на здатності амілази каталізувати гідроліз крохмалю через стадії утворення декстринів та мальтози. Крохмал у разі взаємодії з йодом утворює синє забарвлення. Декстрин при взаємодії з йодом утворює фіолетове, червоно-буре або оранжеве забарвлення. Мальтоза з йодом забарвлення не дає і її можна визначити за допомогою проби Троммера.
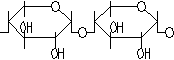


 СН2ОН СН2ОН СН2ОН СН2ОН
СН2ОН СН2ОН СН2ОН СН2ОН амілаза
амілаза2
2n n
Матеріальне забезпечення: 0,5 % розчин крохмалю, 0,1% розчин йоду в калію йодиді, 10% розчин натрію гідроксиду, 5% розчин купруму сульфату, дистильована вода, газовий пальник, пробірки, піпетки, штатив.
Хід роботи. Для одержання розведеної слини ротову порожнину злегка прополіскують водою, набирають нову порцію дистильованої води і прополіскують нею рот протягом 1–2 хв. Зібрану в пробірку рідину використовують для аналізу.
Щоб переконатись у тому, що крохмаль з йодом дає синє забарвлення, в пробірку вливають 10 крапель розчину крохмалю, додають 2 краплі розчину йоду в калію йодиді. За наявності крохмалю спостерігають утворення синього забарвлення.
В штатив ставлять 10 пробірок і наливають у кожну по 2 мл дистильованої води та додають по одній краплі розчину йоду в калію йодиді.
В окрему пробірку наливають 5 мл 0,5% розчину крохмалю, додають 1 мл розведеної слини, вміст пробірки перемішують і спостерігають опалесценцію. З цієї пробірки кожні 60 с відбирають по 0,5 мл рідини і вливають по черзі в пробірки №1, 2, 3 і так далі, що були заготовлені з розчином йоду в калію йодиді. Якщо розчин, перенесений у першу пробірку, змінив колір на фіолетовий або червоний, то інтервал між перенесеннями скорочують до 30 с.
Якщо чергова проба не змінить жовтого кольору розчину йоду, гідроліз крохмалю вважають закінченим і відмічають час. Спостерігають зникнення опалесценції розчину в процесі гідролізу. Через 10 хв проводять пробу Троммера.
Для проведення проби Троммера до вмісту останньої пробірки додають однаковий об’єм 10 % розчину натрію гідроксиду 5-7 крапель 5% розчину купруму сульфату. Вміст пробірки перемішують до зникнення помутніння. Верхню частину пробірки обережно нагрівають на відкритому вогні до кипіння. Реакція Троммера повинна бути позитивною. Спостерігають за появою жовтого або червоного осаду.
Пояснити отриманий результат. Зробити висновок.
