Методичні вказівки та контрольні завдання з біологічної хімії для студентів факультету заочного навчання
| Вид материала | Документы |
- Львівський національний медичний університет імені данила галицького кафедра біологічної, 1655.89kb.
- Програма, методичні вказівки та контрольні завдання з дисципліни «екологія» для студентів, 566.78kb.
- Робоча програма, методичні вказівки до вивчення дисципліни та контрольні завдання для, 393.01kb.
- Програма, методичні вказівки І контрольні завдання з дисципліни "основи екології" для, 325.1kb.
- Програма, методичні вказівки та контрольні завдання з дисципліни " виробництво виливків, 797.9kb.
- Типова програма, методичні вказівки та контрольні завдання для студентів навчального, 708.32kb.
- Програма, методичні вказівки та контрольні завдання з дисципліни «охорона праці в галузі», 339.25kb.
- Львівський національний медичний університет імені Данила Галицького кафедра біологічної, 1954.66kb.
- Робоча програма, методичні вказівки та індивідуальні завдання до вивчення дисципліни, 165.04kb.
- Програма, методичні вказівки та контрольні завдання з дисципліни " виробництво виливків, 864.84kb.
Дослідження шлункового соку включає в себе:
- визначення його об'єму;
- загальної кислотності;
- базальної секреції;
- концентрації гідрохлоридної кислоти;
- дебіту і дефіциту гідрохлоридної кислоти;
- наявності молочної кислоти;
- концентрації пепсину і виділення уропепсиногену з сечею.
При необхідності досліджують:
- вміст сіалових кислот;
- уреазу;
- електроліти (Ма, К, Са, СІ).
Шлунок натще при нормальній секреції стерильний. Безмікробний стан шлунка пов'язують з бактерицидною дією гідрохлоридної кислоти, Не дивлячись на її присутність у ньому в невеликій кількості присутні ентерококи, молочнокислі бактерії, стрептококи, стафілококи, гриби, а число мікроорганізмів не перевищує 1000 мікробних тіл в 1 мл шлункового соку. Посилене розмноження мікрофлори проходить у хворих з анацидним і гіпоанацидним гастритами, вживанні препаратів, що гальмують виділення гідрохлоридної кислоти (блокатори Н2-гістамінових рецепторів). Зменшення або повне зникнення бактерій спостерігається при гіперацидному гастриті. Мікробна флора шлунка змінюється при дуодено-гастральному рефлюксі та зниженні моторики тонкої кишки. Найбільший інтерес викликає спіралеподібний грамнегативний мікроорганізм Неlicobacter руlогі (Н. руlогі), який є пусковим механізмом у порушенні балансу між факторами агресії та цитопротекції на користь факторів агресії. Запальний процес, викликаний Н. руlогі, призводить до пошкодження і проліферації слизової та появи вільних кисневих радикалів. Серед існуючих методів діагностики Н. руlогі поширені методи, які базуються на виявленні в біоптаті ферменту уреази.
Гідроліз білків відбувається в порожнині кишок (порожнинне травлення) і на поверхні слизової оболонки (пристінкове травлення). Деякі білки не перетравлюються (не розщеплюються), не всі амінокислоти встигають всмоктатися в тонкій кишці й використовуються кишковою мікрофлорою для забезпечення своєї життєдіяльності. Ці процеси називаються гниттям білків. Так, амінокислоти зазнають ферментативного мікробного розкладу з утворенням аміаку, метану, сірководню, вуглекислого газу і інших розчинних інертних і токсичних речовин. Разом з тим, утворюються такі токсичні речовини, як, зокрема, путресцин із орнітину, кадаверин із лізину, фенол та крезол утворюються під час гниття фенілаланіну і тирозину, індол та скатол - продукти гниття триптофану. Неперетравлені в травному тракті білки виділяються з калом.
ХІД ВИКОНАННЯ ПРАКТИЧНОГО ЗАНЯТТЯ
Д о с л і д 1. Визначення загальної кислотності, вільної гідрохлоридної кислоти, зв’язаної гідрохлоридної кислоти в одній порції шлункового соку.
При визначенні кислотності шлункового соку розрізняють такі її форми: 1) загальну кислотність, 2) вільну гідрохлоридну кислоту, 3) зв’язану гідрохлоридну кислоту.
Загальна кислотність (титраційні одиниці, титр. од.) вимірюють в мілілітрах 0,1 н. розчину NаОН, затраченого на нейтралізацію 100 мл шлункового соку в присутності індикатору фенолфталеїну (інтервал переходу рН 8,2 - 10,0; при рН нижче 8,2 – безбарвний, вище 10,0 – рожевий). Вільну гідрохлоридну кислоту в шлунковому соці вимірюють в мілілітрах 0,1 н. NаОН, витраченого на нейтралізацію шлункового соку в присутності індикатора 2,4-диметиламіноазобензолу (рН переходу 2,9-4,0; при нижче 2,9 – рожево-червоний, вище 4,0 – жовтий). Зв’язана кислота знаходиться в солеподібному стані з білками і продуктами їх перетворення, а загальна складається з суми вільної і зв’язаної гідрохлоридної кислоти. Визначення загальної кислотності, загальної та вільної кислоти, зв’язаної кислоти в одній порції шлункового соку проводять титруванням з використанням двох індикаторів: 2,4-диметиламіноазобензолу і фенолфталеїну.
Принцип методу:
Шлунковий сік титрують 0,1 н. розчином NаОН в присутності змішаних індикаторів за принципом суміші сильної та слабкої кислот. Сильною кислотою в шлунковому соці є гідрохлоридна кислота, точка еквівалентності якої при титруванні лежить в нейтральному середовищі. Слабкою кислотою є зв’язана гідрохлоридна кислота, групи-СООН білків, органічні кислоти, кислі фосфати, точка еквівалентності яких при титруванні з сильною основою лежить в слаболужному середовищі.
загальна кислотність

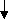
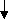

 А В С Д
А В С Д




 рН 1 2 3 4 5 6 7 8 9 10 11
рН 1 2 3 4 5 6 7 8 9 10 11 вільна НСІ

 зв’язана НСІ
зв’язана НСІ індикатор: 2,4-диме- фенолфталеїн
тиламіно-
зобензол
забарвлення: рожево- жовто- жовте рожеве
червоне рожеве
Матеріальне забезпечення: Шлунковий сік, 0,1 н. розчин NаОН, 0,5 % спиртовий розчин 2,4-диметиламіноазобензолу, 0,5% спиртовий розчин фенолфталеїну, піпетки, бюретки, штатив.
Хід роботи:
У колбу для титрування вносять мірною піпеткою 10 мл шлункового, соку (роботу виконують у вигляді експериментальних задач із різним шлунковим соком), додають 2 краплі 0,5%-ного спиртового розчину 2,4-диметиламіноазобензолу, 2 краплі 0,5%-ного спиртового розчину фенолфталеїну і титрують із бюретки 0,1 н. розчином NаОН. Спостерігають зміну забарвлення: рожево-червоне жовто-рожеве жовте (лимонне) рожеве. У точках зміни забарвлення визначають кількість мілілітрів 0,1 н. NаОН, що пішло на титрування. При наявності в шлунковому соці вільної гідрохлоридної кислоти, при додаванні змішаних індикаторів шлунковий сік забарвлюється в червоний колір з рожевим відтінком, а при відсутності вільної кислоти - відразу з'являється жовте забарвлення.
РОЗРАХУНОК:
1. Вільна гідрохлоридна кислота:(В - А) мл х 10;
2. Загальна кислотність :(Д - А) мл х 10;
3. Зв'язана гідрохлоридна кислота: [(С - В) + (Д - С)/ 2] х 10
Зробити висновок про відповідність отриманих даних показникам норми.
Д о с л і д 2. Реакція на молочну кислоту (реакція Уффельмана)
Принцип методу:
Молочна кислота в присутності феруму феноляту (реактив Уффельмана), забарвленого у фіолетовий колір, утворює феруму лактат жовто-зеленого кольору:

Феруму фенолят
б
 )
)Феруму фенолят молочна кислота Феруму лактат
Матеріальне забезпечення:
Патологічний шлунковий сік, 1%-ний розчин фенолу, 3%-ний розчин FeCl3, піпетки, пробірки, штатив.
Хід роботи:
До 5 мл 1%-ного розчину фенолу додають 2-3 краплі 3%-ного розчину хлорного заліза. Утворюється феруму фенолят фіолетового кольору, до якого додають по краплях патологічний шлунковий сік, в якому відсутня вільна гідрохлоридна кислота. При наявності в шлунковому соці молочної кислоти утворюється жовто-зелене забарвлення в результаті утворення феруму лактату .
Зробити висновок про наявність чи відсутність у шлунковому соці молочної кислоти, вказати на патологічні стани, при яких вона з'являється.
Д о с л і д 3. Бензидинова проба на кров.
Принцип методу: Реакція базується на окисленні бензидину киснем, який утворюється при розкладі пероксиду водню під дією гемоглобіну крові.
Матеріальне забезпечення: Патологічний шлунковий сік, 10%-ний розчин бензидину в оцтовій кислоті, 3%-ий Н2О2, піпетки, пробірки, штатив.
Хід роботи: До 1-2 мл патологічного шлункового соку з підвищеною кислотністю додають 4-5 крапель 10%-ного розчину бензидину в оцтовій кислоті та 2-3 краплі 3%-ого розчину пероксиду водню. У присутності крові утворюється синє або зелене забарвлення внаслідок окиснення бензидину.
Зробити висновок про наявність крові у шлунковому соці та вказати патологічні стани, при яких вона з'являється.
Д о с л і д 4. Уреазний метод виявлення в шлунковому соці Неlісоbасteг руlогі.
Принцип методу: В гастробіоптаті виявляють фермент уреазу, яка каталізує гідроліз сечовини. Аміак, що утворюється, зміщує рН розчину в лужну сторону і в присутності фенолфталеїну утворюється рожеве забарвлення.
Матеріальне забезпечення: Патологічний шлунковий сік, 0,5%-ний спиртовий розчин фенолфталеїну, 1%-ий розчин сечовини, піпетки, пробірки, штатив.
Хід роботи: До 1-2 мл патологічного шлункового соку додають 1-2 мл сечовини і 2-3 краплі фенолфталеїну. Вміст пробірок перемішують, залишають на декілька хвилин при кімнатній температурі і спостерігають за появою рожевого забарвлення в пробірці.
Зробити висновок про наявність у шлунковому соці Н. руlогі.
ЗНАЧЕННЯ ДЛЯ ФАРМАЦІЇ ТА КЛІНІКИ
При захворюваннях шлунка кислотність може залишатися нормальною або бути підвищеною чи зниженою. При виразковій хворобі шлунка або гіперацидному гастриті збільшується вміст вільної гідрохлоридної кислоти, загальна кислотність (гіперхлоргідрія) та вміст пепсиногену. Для її нормалізації використовують блокатори Н2-гістамінових рецепторів (циметидин, ранітидин, фамотидин) та М- холінорецепторів (гастроцепін). При гіпоацидному гастриті або при раку шлунка спостерігається зменшення кількості вільної гідрохлоридної кислоти і загальної кислотності (гіпохлоргідрія). У таких випадках застосовується сік шлунковий натуральний або кислота гідрохлоридна розведена, а також пепсин, ацидин-пепсин. Ці препарати сприяють нормалізації перетравлюючої функції шлунка. При гіпоацидних та анацидних гастритах, пов'язаних з екскреторною недостатністю підшлункової залози, застосовують панкреатин, що містить ферменти підшлункової залози, головним чином трипсин та амілазу, а також оразу та панзинорм-форте – комбінований ферментний препарат, що містить амілазу, ліпазу, трипсин, хімотрипсин та екстракт жовчі. Н. руlогі знаходять при виразках 12-палої кишки у 92-100%, гастритах – близько 90%, виразці шлунка 70-80%, у хворих із раком шлунка – до 80%, диспепсії без виразок 40-70%.
Визначення кінцевого рівня знань
Приклад тестового контролю кінцевого рівня знань
Тест 1
| Умова | Варіанти відповідей |
| Добрати найінформативніше дослідження ферментів при обстеженні хворих із захворюваннями:
|
|
Тест 2
| Умова | Варіанти відповідей |
| Вибрати речовини, які утворюються в кишках за участю мікроорганізмів при гнитті таких амінокислот:
|
|
Тест 3
При хронічному панкреатиті спостерігається зменшення синтезу та секреції трипсину. Травлення та всмоктування яких речовин порушено?
- Білків
- Ліпідів
- Полісахаридів
- Нуклеїнових кислот
- Дисахаридів
Тест 4
У пацієнта М. вміст вільної гідрохлоридної кислоти в шлунковому соці знаходиться в межах норми. Які серед наведених показників є вірогідні для такого випадку?
- 50-60 мМ/л.
- 30-40 мМ/л.
- 20-40 мМ/л.
- 10-20 мМ/л.
- 35-50 мМ/л.
Ситуаційні задачі
1. З їжею в організм людини надійшло 80 г повноцінного білка. З сечею виділилось 16 г азоту. Який азотний баланс у людини і про що він свідчить?
2. Хворий 50 років. Поступив у клініку зі скаргами на поганий апетит, слабість, болі в ділянці шлунка. Загальна кислотність шлункового соку 10 ммоль/л. Як називається такий стан? Про що це свідчить ?
Питання до контролю виконання практичної роботи
- Чим обумовлена зміна фіолетового забарвлення на жовто-зелене при дослідженні шлункового соку на вміст молочної кислоти?
- Про що свідчить поява синього забарвлення при додаванні у шлунковий сік бензидину та пеоксиду водню?
- Як вираховується показник загальної гідрохлоридної кислоти?
- Наявність якого фермента у шлунковому соці є діагностичною ознакою для виявлення Н.pylori?
Науково-дослідна робота студентів
Теми реферативних доповідей:
1. Стимулятори і блокатори Н2-гістамінових рецепторів як лікарські препарати (бетазол, циметидин, ранітидин, фамотидин, нізатидин).
2. Антагоністи серотонінових 5НТз рецепторів як лікарські препарати (ондасетрон, тропісетрон, гранісетрон, метоклопрамід).
Література
ОСНОВНА:
- Вороніна Л.М., Десенко В.Ф., Мадієвська Н.М. та ін. Біологічна хімія. – X.: Основа, 2000. – С. 321 -331.
- Губський Ю.І. Біологічна хімія. – К.: Укрмедкнига, 2000. – С.386 - 395.
- Гонський Я.І., Максимчук Т.П. Біохімія людини. – Тернопіль: Укрмедкнига, 2001. – С. 400-406.
- Березов Т.Т, Коровкин Б.Ф. Биологическая химия. – М.: Медицина, 1990. –С.318-332.
- Біологічна хімія. Тести та ситуаційні задачі / За ред.О. Я.Склярова. – Львів.:Світ.2006. –С. 119-129.
- Савицкий И.В. Биологическая химия. – К.: Вища школа, 1982. – С. 126-131.
- Строев Е.В. Биологическая химия. – М.: Высшая школа, 1986. – С. 172-173, 176, 178-181, 184-185, 188-189,274-277.
ДОДАТКОВА:
1. Бышевский А.Ш., Терсенов О.А. Биохимия для врача. – Екатеринбург: Уральский рабочий, 1994. – С. 107-110, 214-217, 247-251.
2. Ленинджер А. Основы биохимии. – М.: Мир, 1985. Т. 3. – С. 747-750.
3. Скляров О.Я., Косий Є.Р., Скляров Є.Я. Фізіологічні та клінічні основи гастроентерології. – Львів, 1997. – С. 5-11, 15-16, 25-28, 58-70, 261-263.
4. Скляров О.Я., Косий Є.Р., Андріюк Л.В. Фізіологічні та клінічні основи регуляції вегетативних функцій. – Львів, 1995. – С. 46-55.
НАУКОВА:
1. Машковский М.Д. Лекарственные средства. – Харьков: Торсинг, 1997. Т. 1. – С.182-183, 186-189, 215, 220-221, 273-276, 284-287.
2. Микрофлора желудка при язвенной болезни и хроническом гастрите / В.А. Грушка, С.Н. Гулевский, С.С. Лазня, М.В. Васильєва // Лікарська справа. – 1998. – №1. – С.52 - 58.
3.Ломов С.Ю. Современные представлення о гастрите, вызванном Неlісоbасtег руlогі // Лікарська справа. – 1997. – № 5. – С. 3-8.
4. Самусева Е.А., Терещенко В.П. Морфологическая диагностика Неlісоbасtег руlогі в слизистой желудка при хроническом гастрите // Лікарська справа. –1998. – № 2. – С. 45-48.
5. Lewis J. Н. Виразкова хвороба: сучасне лікування в еру Неliсоbасtег руlогі // Медицина світу. – 1996. – № 1. – С. 17-24.
ЗАНЯТТЯ № 9
Тема заняття: РОЛЬ ПЕЧІНКИ В МЕТАБОЛІЧНИХ ПРОЦЕСАХ ОРГАНІЗМУ
Мета заняття: Знати шляхи утворення, транспортування та знешкодження аміаку в організмі. Вміти кількісно визначати сечовину в сечі. Вміти визначати кількість сечової кислоти в сироватці крові та сечі, загального та зв'язаного білірубіну в крові та грамотно інтерпретувати отримані результати.
Актуальність теми: В процесі обміну амінокислот та інших азотовмісних сполук утворюється аміак, знешкодження якого є однією з головних детоксикаційних функцій організму. Більшість реакцій перетворення амінокислот, в тому числі синтез і розпад білків, відбувається в печінці. В ній утворюються та знешкоджуються численні метаболіти білкового обміну, в тому числі сечовина, сечова кислота, білірубін, різноманітні продукти кон’югаційних реакцій. Деякі з цих перетворень є незворотніми, і метаболіти, утворені в них, транспортуються з печінки та виводяться з організму з сечею.
Студентам необхідно оволодіти методами кількісного та якісного визначення метаболітів детоксикаційних процесів печінки у біологічних рідинах з метою оцінки функціональної активності цих систем.
Конкретна мета: Вміти: 1. Кількісно визначити сечовину у біологічних рідинах. 2. Кількісно визначити сечову кислоту у біологічних рідинах. 3. Визначити білірубін у сироватці крові. 4. Дати оцінку проведеним дослідженням і зробити висновок.
Міжкафедральна інтеграція: Знати: 1. Хімічну будову та властивості білків (кафедра біоорганічної хімії). 2. Загальні шляхи катаболізму білків (кафедра біохімії). 3. Будову гему та нуклеотидів (кафедра біоорганічної хімії).
ЗМІСТ ЗАНЯТТЯ
Питання для самопідготовки :
1. Шляхи знешкодження аміаку в організмі.
2. Орнітиновий цикл синтезу сечовини, його зв'язок з іншими метаболічними шляхами. Діагностичне значення визначення вмісту сечовини в крові і сечі.
3. Специфічні шляхи обміну амінокислот та їх порушення.
4. Розпад пуринових нуклеотидів до кінцевих продуктів. Утворення сечової кислоти.
5. Утворення кінцевих продуктів розпаду піримідинових нуклеотидів.
6. Характеристика захворювання подагра. Механізм дії алопуринолу.
7. Обмін гемпротеїнів. Схема розпаду гемоглобіну до кінцевих продуктів.
8. Обмін гемпротеїнів. Синтез гему.
9. Характеристика непрямого і прямого білірубіну. Будова УДФГК, її значення в утворенні прямого білірубіну.
10. Утворення жовчних пігментів. Нормальний вміст і діагностичне значення визначення жовчних пігментів у крові та сечі.
11. Порушення пігментного обміну – жовтяниці. Види жовтяниць. Діагностика жовтяниць.
12. Хімічний склад та роль жовчі, механізми регуляції її утворення та виділення. Фармпрепарати, які стимулюють утворення і жовчовиділення.
Блок інформації
Вміст вільних іонів амонію в крові в нормі дорівнює 0,05 мг/100 мл, в еритроцитах – 0,15 мг/100 мл. Знешкодження аміаку, що утворюється при дезамінуванні амінокислот (головним чином глутамінової) і, в меншій мірі, при дезамінуванні пуринових основ, біогенних амінів, амідів амінокислот і розпаді піримідинових основ, здійснюється декількома шляхами :
1) Відновне амінування відбувається в незначній мірі і несуттєве у знешкодженні аміаку, хоч і забезпечує утворення деяких амінокислот, насамперед глутамінової;
2) Утворення амідів аспарагінової та глутамінової кислот - аспарагіну і глутаміну. Цей процес відбувається переважно в нервовій тканині, особливо чутливій до токсичної дії аміаку, потім в м'язовій і в нирковій тканинах під дією аспарагін- та глутамінсинтетаз. Аміди амінокислот є основною транспортною формою аміаку.
3) Утворення амонійних солей відбувається в нирках, внаслідок гідролізу амідів амінокислот під дією глутамінази та аспарагінази.В результаті реакції утворюється глутамат, аспартат і вільний аміак. Аміак нейтралізується шляхом утворення солей амонію, які виділяються з сечею. Інтенсивність їх утворення залежить від кислотності сечі.
4) Синтез сечовини (уреогенез) – основний шлях знешкодження аміаку- здійснюється в печінці. Це циклічний ендергонічний процес (орнітиновий цикл), перші реакції якого відбуваються в мітохондріях, а останні – в цитоплазмі гепатоцитів. В цикл включається по одній молекулі аміаку, орнітину і аспаргінової кислоти, вивільняється також по одній молекулі сечовини, фумарату і орнітину. В нормі вміст сечовини в крові становить 3,3-8,3 ммоль/л. Порушення функцій печінки внаслідок різноманітних захворювань призводить до зниження синтезу сечовини, зниження вмісту сечовини в крові та зменшення виведення її з сечею. В нормі за добу з сечею виділяється близько 333-583 ммоль сечовини. Підвищення вмісту сечовини в крові – уремія – спостерігається при захворюваннях нирок. При цьому вміст сечовини в сечі зменшується. Уремія спостерігається при патологіях і станах, що супроводжуються інтенсивним розпадом білків, тобто гіперпродукцією аміаку – гарячкових станах, сепсисі, туберкульозі, опіках, перитонітах. Нерідко буває при гіперпротеїновій дієті.
Підвищення вмісту вільних іонів амонію в крові – гіперамоніємія – може спостерігатися при еклампсії, при декомпенсації серцевої діяльності, при спадкових порушеннях синтезу сечовини, при захворюваннях печінки.
Основним органом детоксикації продуктів білкового обміну є печінка. Це єдиний орган, який містить всі ферменти циклу утворення сечовини з аміаку. Аміак, що утворюється в інших тканинах, в печінці перетворюється на індиферентний продукт – сечовину, яка виділяється в кров. При інтенсивному катаболізмі білків та небілкових азотистих сполук (амінокислот, пуринів, піримідинів, біогенних амінів) посилюється утворення сечовини в печінці, її вміст в крові і сечі.
Важливою функцією печінки є знешкодження продукту розпаду гемпротеїнів – білірубіну, що здійснюється шляхом утворення білірубінглюкуронідів, подальший метаболізм яких відбувається в кишці. Білірубін утворюється в організмі в результаті фізіологічного розпаду гемоглобіну еритроцитів у клітинах ретикуло-ендотеліальної системи (печінка, селезінка). Транспортується білірубін до печінки в комплексі з білком. Білірубін відноситься до групи жовчних пігментів і є токсичною речовиною; він знешкоджується в клітинах печінки шляхом кон’югації з УДФ-глюкуроновою кислотою за схемою:
глюкуронілтрансфераза
Б
 ілірубін + УДФ-глюкуронова кислота
ілірубін + УДФ-глюкуронова кислота білірубінмоно- (ди-) глюкуронід
Кон’югати - глюкуроніди білірубіну - добре розчинні у воді і виводяться з печінки жовчовивідними шляхами.
У сироватці крові є два види білірубіну: вільний і зв’язаний. Вільний (непрямий, некон’югований) білірубін нерозчинний у воді, токсичний, не проходить через нирковий фільтр, розчиняється в органічних розчинниках, після обробки акселераторами (кофеїновий реактив) дає реакцію з діазореактивом. Зв’язаний (прямий, кон’югований) білірубін менш токсичний, проходить через нирковий фільтр, переноситься через клітинну мембрану в жовчні канали, а потім у 12-палу кишку, з подальшим відновленням до мезобілірубіну, мезобіліногену, стеркобіліногену. Останній, окислюючись, перетворюється в стеркобілін. Зв’язаний білірубін реагує з діазореактивом без попередньої обробки.
В печінці відбувається розпад уробіліногену (мезобіліногену) до ди- і трипіролів.
При порушенні процесу кон’югації білірубіну (віковому – у випадку жовтяниці новонароджених або природженому – жовтяниці при хворобі Жільбера, синдромі Криглера-Найяра, синдромі Ротора) для лікування жовтяниць використовують фармпрепарати – індуктори глюкуронілтрансферази (УДФГК-трансферази).
Порушення пігментного обміну спостерігається також при дисбактеріозі кишечника, який виникає як результат пригнічення його нормальної мікрофлори (наприклад, при тривалому лікуванні антибіотиками).
В печінці інтенсивно окислюються пуринові основи до сечової кислоти, яка є кінцевим продуктом цього обміну та виводиться з сечею. Сечова кислота погано розчиняється у воді, нормальні концентрації її в рідинах організму наближені до межі розчинності. Гіперурикемія – підвищений вміст сечової кислоти в крові - викликає відкладення уратів натрію в тканинах, особливо при ацидозі. Це захворювання називається подагрою. Для його лікування використовують препарати, що гальмують утворення сечової кислоти (алопуринол), або стимулюють виведення її нирками (антуран, цинхофен). Перетворення піримідинових основ іде до -аланіну, СО2 і аміаку. -Аланін використовується для синтезу дипептидів м'язевої системи – карнозину та ансерину – або виділяється з сечею. Аміак знешкоджується в орнітиновому циклі.
При порушенні екскреторної функції печінки відбувається затримка у внутрішньому середовищі організму речовин, що повинні виводитися з жовччю. Це жовчні кислоти, білірубінглюкуроніди, лужна фосфатаза та інші екскреторні ферменти тощо. За зростанням їх вмісту в крові і виведенням з сечею можна виявити зміни екскреторної функції печінки. За показами призначають фармпрепарати, які стимулюють утворення і виведення жовчі (жовчні кислоти та їх солі, препарати жовчі – “Холензим”, препарати рослинного походження – “Фламін”, синтетичні препарати “Оксафенамід”).
Крім неспецифічних спільних шляхів обміну, притаманних всім амінокислотам, існують специфічні, властиві окремим амінокислотам або групам амінокислот. Продукти таких реакцій незначні за кількістю, проте можуть відігравати важливу роль в метаболічних процесах.
Вроджені ензимні порушення обміну амінокислот мають важливі наслідки для організму, обумовлені токсичною дією надлишкової кількості амінокислот або їх метаболітів і, перш за все, дисбалансом обмінних процесів. Недоумство часто супроводжує ці захворювання внаслідок високої чутливості нервової тканини до дисбалансу амінокислот. Розрізняють гіпераміноацидемії, обумовлені ензимодефектами в ланцюзі метаболічних перетворень (фенілкетонурія, цитрулінемія, гістидинемія, лізинемія та інші, супроводжуються аміноацидурією), та ниркові гіпераміноацидемії, викликані спадковим порушенням канальцевої транспортної системи.
ХІД ВИКОНАННЯ ПРАКТИЧНОГО ЗАНЯТТЯ
Д о с л і д 1. Визначення вмісту сечовини в сечі.
Принцип методу. Метод базується на здатності сечовини, що містить аміногрупи, утворювати з парадиметиламінобензальдегідом в кислому середовищі комплексну сполуку, забарвлену в жовтий колір. Інтенсивність забарвлення прямо пропорційна концентрації сечовини в досліджуваній сечі і визначається фотоколориметрично.
Матеріальне забезпечення: сеча; 2% розчин парадиметил-амінобензальдегіду (ПДМАБА); стандартний розчин сечовини (2,5%); ФЕК, піпетки, мікропіпетки, сухі пробірки.
Хід роботи. У пробірку наливають 0,2 мл сечі, додають 1,2 мл розчину ПДМАБА і ретельно перемішують. Через 15 хв. пробу фотометрують в сухих кюветах шириною 3 мм (синій світлофільтр, λ= 450-480 нм) проти води. Показник Е для контролю – 0,08. Для визначення вмісту сечовини в сечі користуються готовим калібрувальним графіком (0,5; 1,0; 1,5; 2,0; 2,5 г сечовини в 100 мл) і розраховують кількість сечовини в г/добу. При побудові калібрувального графіку використовують стандартні розчини сечовини (замість сечі беруть 0,2 мл кожного стандарту, обробляють так само, як і сечу, і аналогічно фотометрують). Коефіцієнт перерахунку в одиниці СІ (ммоль/добу) дорівнює 16,65.
Пояснити отримані результати. Зробити висновок.
Д о с л і д 2. Визначення вмісту сечовини в сироватці крові та сечі за реакцією з діацетилмонооксимом.
Принцип методу. Сечовина в кислому середовищі при наявності тіосемикарбазиду і солей заліза утворює з діацетилмонооксимом комплексну сполуку червоного кольору, оптична густина якої при зеленому світлофільтрі (500-560 нм) пропорційна концентрації сечовини.
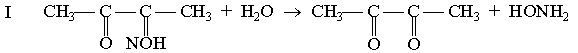
діацетилмонооксим діацетил гідроксиламін
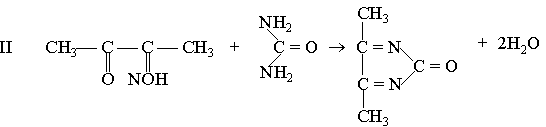
діацетил сечовина діазинове похідне
Матеріальне забезпечення: розчин трихлорацетатної кислоти (ТХАК) (100 г/л), діацетилмонооксим (25 г/л, водний стабільний розчин), тіосемикарбазид (2,5г/л водний розчин стабільний при зберіганні у темному посуді за кімнатної температури), кислота сульфатна, конц.(96%), кислота ортофосфорна (85%), заліза хлорне (основний розчин – 5 г феруму хлориду доводять до 100 мл водою і підкислюють додаванням 1 мл сульфатної кислоти конц. З основного розчина готують робочий: 1 мл основного розчину феруму хлориду доводять до 100 мл водою, додають 8 мл конц. сульфатної кислоти і 1 мл 85% ортофосфатної кислоти. Зберігають 2 тижні у темному посуді.), розчин бензойної кислоти (2 г/л), розчин сечовини (7 ммоль/л – 42г/100 мл), кольоровий реактив ( до 30 мл робочого розчину феруму хлориду додають 20 мл води, 1 мл розчину діацетилмонооксиму і 0,25 мл розчину тіосемикарбазиду. Кольоровий розчин готують кожен раз перед використанням.), спектрофотометр, водяна баня з температурою 100 С, сироватка крові, добова сеча профільтрована, розведена ізотонічним розчином натрію хлориду або дистильованою водою 1:50 або 1:100.
Хід роботи. Визначення з депротеїнуванням
Зразки: сироватка (плазма) крові ліпемічна або гемолізована цільна кров.
Хід визначення проводять за наступною схемою:
| | Контрольна проба, Мл | Стандартна проба, мл ( Dс ) | Дослідна проба мл ( Dд ) |
| Н2О | 1,0 | 0,8 | 0,8 |
| Розчин ТХАК | 1,0 | 1,0 | 1,0 |
| Досліджуваний зразок | - | - | 0,2 |
| Стандартний розчин сечовини | - | 0,2 | - |
| Перемішати і центрифугувати 10 хвилин при 3000 об/хв | |||
| Надосадова рідина | 0,5 | 0,5 | 0,5 |
| Кольоровий розчин | 5,0 | 5,0 | 5,0 |
Вміст пробірок ретельно перемішують, отвір закривають алюмінієвою фольгою і пробірки ставлять у киплячу водяну баню точно на 20 хвилин. Потім пробірки швидко охолоджують холодною водою і вимірюють оптичну густину стандартної та дослідної проб при зеленому світлофільтрі (500-560 нм) проти контрольної проби в кюветі товщиною 1,0 см. Забарвлення є стійким протягом 15 хвилин.
Розрахунок вмісту сечовини проводять за формулою
Dд
С
 = 7,0
= 7,0Dс
де: С – вміст сечовини в дослідній пробі, ммоль/л;
Dд – оптична густина дослідної проби;
Dс – оптична густина стандартної проби;
7,0 – вміст сечовини у стандартному розчині, ммоль/л
Пояснити отриманий результат. Зробити висновок. Звернути увагу на наступне, якщо вміст сечовини в пробі перевищує 17 ммоль/л, пробу необхідно розвести дистильованою водою і аналіз провести повторно. Результат необхідно перемножити на розведення.
ЗНАЧЕННЯ ДЛЯ ФАРМАЦІЇ ТА КЛІНІКИ
Синтез сечовини відбувається в печінці (цитозоль і мітохондрії) головним чином з аміаку, який утворюється при дезамінуванні амінокислот, розпаді пуринових і піримідинових нуклеотидів. За добу з сечею здорової людини виділяється 20-35 г або 333-583 ммоль сечовини. В нормі вміст сечовини в сироватці крові становить 3,3- 8,3 ммоль/л.
Відхилення від нормального вмісту залежать від інтенсивності процесів синтезу сечовини та її виведення.
У сироватці крові
Збільшення вмісту сечовини є однією з головних ознак порушення видільної функції нирок. Крім цього, зростання рівня сечовини сироватки крові може бути позаниркового походження:
- при втраті організмом рідини (блювота, понос, зневоднення),
- при посиленому розпаді білків (гостра жирова дистрофія печінки).
Зменшення вмісту сечовини може спостерігатися при захворюваннях печінки (паренхіматозна жовтяниця, цироз печінки) внаслідок порушення синтезу сечовини в печінці.
У сечі
Підвищений вміст сечовини спостерігається при дефіциті білка в їжі, при злоякісній анемії, гарячці, інтенсивному розпаді білків в організмі, після прийому саліцилатів, при отруєнні фосфором.
Знижений вміст сечовини спостерігається при цирозі печінки, паренхіматозній жовтяниці, нефриті, ацидозі, уремії.
Д о с л і д 3. Кількісне визначення сечової кислоти в сироватці крові.
Принцип методу. Сечова кислота відновлює фосфатвольфраматний реактив з утворенням сполуки блакитного кольору, оптична густина якої за довжини хвилі 640 нм є пропорційною концентрації сечової кислоти у сироватці крові.
Матеріальне забезпечення: сироватка або плазма крові, 10% розчин натрію дигідрогенвольфрамат дигідрату, розчин натрію карбонату (10,3г /100 мл), 0,35 М розчин сульфатної кислоти, фосфатвольфраматний реактив (реактив Фоліна), 30 мкМ калібрувальний розчин сечової кислоти, піпетки, пробірки, центрифуга.
Хід роботи. У центрифугову пробірку вміщують 0,5 мл сироватки крові та 4 мл дистильованої води. Вміст пробірки перемішують і додають 0,25 мл 0,35 М розчину сульфатної кислоти та 0,25 мл 10% розчину натрію вольфрамату. Вміст пробірки перемішують і через 5 хв центрифугують протягом 10 хв за швидкості 3000 об/хв. Проводять визначення сечової кислоти за наступною схемою.
Визначення сечової кислоти в сироватці крові.
| | Контрольна проба, мл | Стандартна проба, мл | Дослідна проба, мл |
| Надосадова рідина | - | - | 2 |
| Стандартний розчин сечової кислоти | - | 2 | - |
| Вода дистильована | 2 | - | - |
| Розчин натрію карбонату | 1 | 1 | 1 |
| Фосфатвольфраматний реактив | 0,5 | 0,5 | 0,5 |
Вміст пробірок перемішують. Через 30 хв визначають оптичну густину стандартної та дослідних проб за довжини хвилі 640 нм (590-700 нм, червоний світлофільтр) проти контрольної проби у кюветі затовшки 10 мм. Забарвлення є стабільним протягом 30 хв.
Розрахунок вмісту сечової кислоти проводять за формулою:
Dо
С
 = × 30 × 10,
= × 30 × 10, Dс
де: С – вміст сечової кислоти у дослідній пробі, мкмоль/л; Dо – оптична густина дослідної проби; Dс - оптична густина контрольної проби; 30 – вміст сечової кислоти у стандартному розчині, мкмоль/л; 10 – величина розведення сироватки.
У чоловіків вміст сечової кислоти у сироватці крові за цим методом становить 240-500 мкмоль/л, у жінок – 160-400 мкмоль/л.
Пояснити отримані результати. Зробити висновок. Звернути увагу на те, що наведеним методом можна визначати кількість сечової кислоти у сечі, однак її попередньо необхідно розвести у 10 разів дистильованою водою.
